猪链球菌II型五种感染途径感染猪模型的比较
2016-12-01李宗明李江华郭利伟田永祥陈焕春刘国平
周 康,李宗明,李江华,董 俊,郭利伟,田永祥,陈焕春,刘国平,
(1.长江大学动物科学学院,荆州434025;2.生猪健康养殖协同创新中心,武汉430070;3.湖北省农业科学院畜牧兽医研究所,武汉430070)
·研究论文·
猪链球菌II型五种感染途径感染猪模型的比较
周 康1,李宗明1,李江华2,董 俊1,郭利伟1,田永祥3,陈焕春2,刘国平1,2
(1.长江大学动物科学学院,荆州434025;2.生猪健康养殖协同创新中心,武汉430070;3.湖北省农业科学院畜牧兽医研究所,武汉430070)
为研究猪链球菌2型感染猪的发病进程,选择24 头28日龄杜长大败血波氏杆菌阳性猪,分别采用皮下、肌肉、静脉、鼻腔、胸腔5种途径感染实验猪,猪链球菌2型山东株剂量为60亿CFU,同时设立生理盐水对照组,试验期为30 d。观察感染猪的临床症状和病理变化,并对各脏器进行细菌记数。结果表明,除鼻腔外的4种感染模式均复制出了猪链球菌2型的感染症状,细菌计数结果印证了感染模型。细菌计数结果提示血液、肺脏组织及脑是猪链球菌2型易增殖部位,肺脏可能是呼吸道传播模式致全身性感染的中转站(上呼吸道-肺脏-全身性感染),所有致死猪均出现菌血症。
猪链球菌2型;感染模式;比较
猪链球菌2型(Swine Streptococcus suis typeⅡ,Ss2)可引起猪和人的脑膜炎、败血症、肺炎、多发性关节炎、多发性浆膜炎和突发性死亡[1],是一种重要的人畜共患病病原菌[2]。Ss2可以产生多种毒力因子,也是链球菌中毒力最强、危害最深、流行最广泛的一种血清型。Ss2感染在世界各地均有发生,已成为严重影响各国养猪业发展的一种重要疫病[3]。2005年7月中国四川省爆发了Ss2感染,造成了200余人感染、38人死亡,此次疫病的爆发不仅给我国养猪业造成了巨大的经济损失,也给人类健康带来了巨大的威胁,引起了国内外的高度重视。Ss2通常从口腔或鼻腔侵入机体,而后在扁桃体定居[4],突破扁桃体及上呼吸道黏膜屏障后进入血液循环[5]。通过游离状态、黏附于吞噬细胞表面和吞噬于胞内等方式和作用进入中枢神经系统,从而引起脑膜炎及一系列炎症反应[6-8]。
动物模型的建立对于研究病原微生物的致病机制等有着非常重要的意义。猪链球菌2型动物致病性研究是个难题,现有的模型很多,但结果却并不一致[7-9]。病理学研究发现感染Ss2后,猪肺脏组织表现为间质性肺炎,肺炎是Ss2感染后的一个非常重要的临床症状。虽然呼吸道是猪Ss2传播的主要传播方式之一,但是Ss2感染导致肺炎的致病机理并不清晰。因此以本课题组采用成熟的猪链球菌2型山东株为致病菌株,对5种不同感染途径的模型进行了对比。猪败血波氏杆菌是一种鼻腔常在菌,定居于鼻粘膜、呼吸道,与链球菌有协同作用。单一使用链球菌不易突破鼻粘膜上皮细胞,因此选择猪败血波氏杆菌阳性猪作为研究对象。同时,本研究对感染猪的主要靶器官的感染菌数量进行量化,为猪链球菌2型致病机制的进一步探索提供线索与工具。
1 材料与方法
1.1 菌株 猪链球菌2型山东株(SD)[10]及对照菌株:大肠杆菌、肺炎链球菌、支气管败血波氏杆菌[11]由本实验室分离、保存。
1.2 酶及主要试剂 Taq DNA聚合酶购于大连TaKaRa公司;细菌微量生化反应管购于杭州天和微生物试剂有限公司;TSA、TSB、NAD 购自上海生物工程公司;Ss2标准阴、阳性血清、致敏红细胞、DNA裂解液均由本实验室自行制备。
1.3 实验动物 分别采用间接血凝抑制试验和鼻拭子对山东省济南市某种猪场的28日龄杜长大猪进行Ss2的抗体和病原学检测,挑选此2项指标均为阴性的猪进行试验。28日龄杜长大败血波氏杆菌阳性猪,购自山东省济南市某种猪场,由鼻拭子分离鉴定确定阳性。
1.4 菌株的增菌 TSA及TSB培养基按操作说明进行制备。在无菌条件下,向含100 mL已灭菌的TSB的细菌瓶中按体积比加入5%的小牛血清。无菌挑取少许经纯化的链球菌在瓶内壁靠近底部轻轻左右划动数下,使细菌附着在瓶壁上,再把接种环浸在液体内轻微振荡几次,洗掉环上的细菌,灼烧瓶口并封住。将细菌瓶放在磁力搅拌器上低速搅动2 min,使菌体均匀分布在液体中。然后将细菌瓶竖直固定于摇床中,200 r/min、37℃恒温培养8 h。取上述重制备菌液采用活菌计数将原菌液稀释至108CFU/mL。
1.5 DNA提取 将采集的猪鼻拭子样品于含5%牛犊血清的TSB培养液中培养8 h,取100 μL菌液500×g离心5 min,收集菌体,加100 μL裂解液A(主要含pH 8.0的10 mmol/L Tris-Hcl、5 mmol/L MgCl2;1% TritionX-100、0.32 mmol/L 蔗糖),振荡均匀后,静置10 min;10 800×g离心5 min,弃上清,向沉淀中加入50 μL DNA提取液B(主要含50 mmol/ L KCl、pH 8.0的10 mmol/L Tris-Hcl、100 μg/mL 蛋白酶 K),振荡均匀,56℃ 温育30 min使DNA尽量释放;沸水浴10 min,立即置冰水混合物中冷却,10 800×g离心2 min,取上清用无水乙醇抽提1次后,10 800×g离心10 min,上清作模板。
1.6 PCR检测 检测Ss2引物及扩增条件参照文献[11]进行;检测支气管败血波氏杆菌引物及扩增条件参照文献[12]进行。引物由上海生工生物工程技术服务有限公司合成。
1.7 猪感染性试验 感染前观察实验猪5 d,然后分别按皮下注射、肌肉注射、静脉注射、鼻腔接种和胸腔穿刺肺部注射5种模式进行感染试验,接种剂量均为6 mL。作好标记,记录接种时间。感染后每日观察1次,根据实验要求作出详细记录:注意猪的食欲、精神状态以及接种部位的变化,同时注意体温、呼吸、血压等生理体征的变化。若发现濒死的猪可前腔静脉采血分离细菌。
1.8 感染猪的病理学 对感染猪进行剖杀,观察其病理变化。分离出脑、肝脏、脾脏、肺脏、肾脏后依次称重,分别各取1 g组织加灭菌生理盐水10 mL进行充分研磨,分别按倍比稀释法依次稀释至10-9、10-10、10-11、10-12、10-13浓度梯度,每个浓度梯度接种3个TSA平板,每个平板的接种量为100 μL,37℃恒温培养24 h后活菌计数。同时选取菌落生长均匀平板,随机挑选20个菌落进行PCR鉴定,对阳性菌落挑选2个进行生化鉴定验证。计算感染菌占总菌量的百分比,从而得出感染菌的绝对数。
2 结果
2.1 临床观察和生命体征的测定 实验猪接种菌液后,每天仔细记录猪的临床表现(表1)和体温变化(表2)。在观察期间死亡者,立即进行解剖。在观察时间到达后未死亡者,放血迫杀致死。

表1 感染猪的临床症状Table1 The clinical symptoms of infected pigs

表2 感染期间各猪的体温变化(℃)Table2 The temperature of each pigs during the infecting periods(℃)
从表中可以看出,Ss2很容易通过皮下、肌肉、静脉注射3种模式引起实验猪发病。鼻腔接种则无明显的变化,胸腔接种到后期时,实验猪才表现出明显的临床症状。这说明Ss2的感染与接种途径之间有密切的关系。在d5各组猪的感染情况如下:皮下注射、肌肉注射、静脉注射感染组全身呈现败血症症状,关节炎、神经症状和共济失调等;静脉注射组的猪开始出现死亡;鼻腔注射组的猪无明显变化。
2.2 病理变化 预定观察时间结束,对现有的感染猪进行剖杀,未感染组各脏器未见明显异常。各感染组猪的病理变化如表3、图1所示。通过静脉注射感染组的实验猪最先表现出典型的临床症状,如败血症、关节炎、神经症状等,然后所有感染猪很快死亡。皮下注射、肌肉注射、静脉注射感染组病理组织学表现大致相同,鼻腔感染组虽然未见全身性病变,但出现明显的间质性肺炎。具体的病理表现以静脉注射组加以展示,详见图1。从图中可以看出,静脉注射组感染猪皮下出血,肌肉组织出血,各内脏器官的主要病变是出血性变化,间质性肺炎,弥漫性出血;心外膜条状出血,内膜有散在出血点;肝表面出血坏死、胆囊内壁出血器官表面有大小不等的出血点,出血斑以及白色坏死灶;肾表面出血,脾边缘梗死等。其他组别病理学表现见表3。

图1 以静脉注射来描述各脏器感染的病理变化Fig.1 The typical pathological changes of pigs infected with Ss2 by intravenous injection
2.3 各脏器中细菌数量的测定 各脏器的细菌数量测定结果详见表4。在这5种感染模式中,除鼻腔接种外,其余4种感染模式均可对实验猪产生较强的致病力,原因在于Ss2可直接由感染部位进入血液系统到达全身各处进行增殖。可能由于受肝脏、脾脏、肾脏的生理功能和其所处的生理环境的影响,在这些器官中,Ss2数量明显很低,同时从细菌繁殖的数量看血液及脑更容易被Ss2攻击。
3 讨论
通过感染后猪的临床症状、病理剖检和细菌回收结果来看,本研究成功地从皮下注射、肌肉注射、静脉注射、胸腔穿刺等4个模式建立了Ss2对猪的感染模型。

表3 各组感染猪的病变情况Table3 The pathological changes of infected pigs
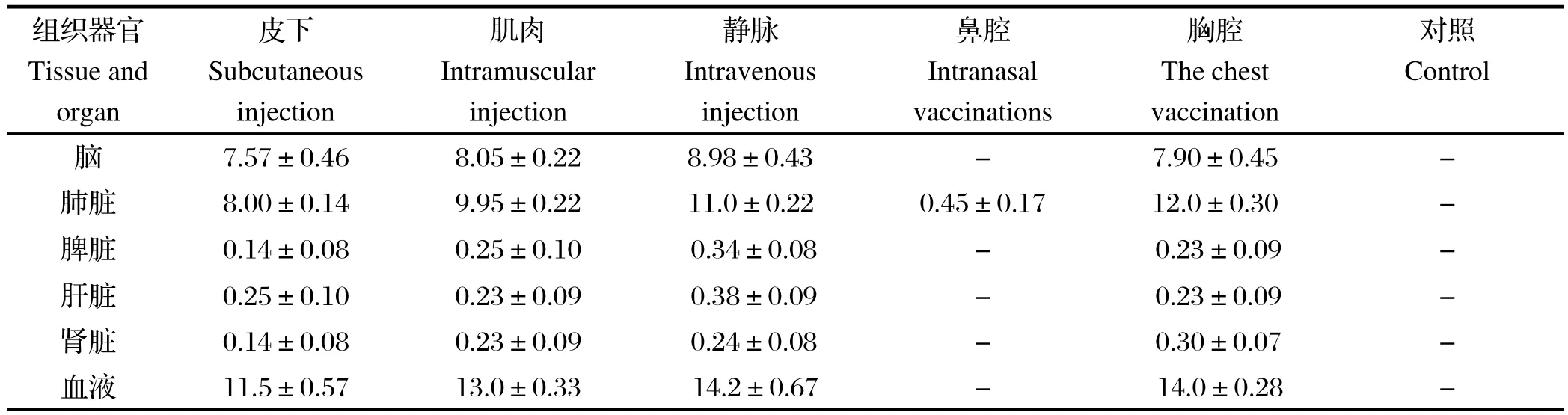
表4 各脏器中细菌数量(×109CFU/g)Table4 The numbers of bacteria in each organs
肺炎是Ss2感染中的一个非常重要的临床症状,病理学研究发现感染Ss2后猪肺脏组织表现为间质性肺炎[13],本研究证实了这一点。通过胸腔注射肺部造模取得了成功,结合细菌计数和病理学表现。肺脏、血液及脑感染菌数量明显高于其他脏器,这可能是因为病原菌在肺脏组织中大量增殖,分泌毒力因子,当具备足够的侵袭力后进入血液循环,从而导致脑膜炎症状及全身性感染。有研究提示Ss2的荚膜多糖和溶血素能帮助细菌体逃避巨噬细胞的吞噬作用和天然免疫反应[14,15]。肺脏中巨噬细胞与上皮细胞组成的屏障是Ss2的定植的场所,也是Ss2侵入血液的关键。
虽然鼻腔感染未造成全身性感染,但仍可导致典型的间质性肺炎,病原分离证实肺炎由Ss2引起,结合肺部感染试验的结果,我们分析,鼻腔的局部感染可能并不导致全身性的感染,即便是和支气管败血波氏杆菌共同作用。当鼻腔感染足够量的Ss2时,病原菌通过上呼吸道感染至肺部,在肺部定居,增殖,进入血液循环而导致全身性的感染。因此,在针对Ss2的防御体系中,包括鼻腔的上呼吸道的固有免疫力非常关键,这为我们进一步研究Ss2的感染机制奠定基础。可以推测当鼻腔感染剂量足够大时,可以建立全身性的感染模型。
通过细菌回收来描述各个脏器的感染程度,比较精确、客观。有研究证明Ss2能大量定植在健康猪的扁桃体而不引起感染[16],为本次研究提供了理论基础,也为研究Ss2对猪的感染提供了一个优良的量化模型。
本研究之所以采用波氏杆菌阳性猪为试验对象,是因为Ss2在没有穿过黏膜上皮细胞毛细血管之前,一般不会引起感染。由于波氏杆菌首先在鼻腔粘膜上皮感染繁殖,波氏杆菌产生的毒素对上皮细胞具有损伤作用,可破坏鼻腔粘膜,导致黏膜屏障易被各种病原性因子突破等[17]、从而增加感染机会,与Ss2对猪的感染构成了协同作用。
静脉注射感染组的猪死亡最快,肌肉注射感染组的猪从d7开始出现死亡,皮下感染组从d11开始出现死亡。静脉注射接种,Ss2直接进入血液循环进行繁殖,迅速到达全身各处引起菌血症[18];肌肉注射接种,Ss2首先进入接种部位的毛细血管,这显然比静脉注射接种的死亡速度慢,但又由于肌肉的毛细血管比皮下组织中的毛细血管丰富,所以死亡进度又比皮下接种快。在临床中我们也观察到,这3个感染模式中,每头猪到后期均出现了不同程度的神经症状如打转、死亡前四肢划水样运动,而且这些猪,大多数都有关节疼痛(触之尖叫),结果在剖检时都采集到大量的脑积液和关节液。而其他两组的感染猪中这些现象不明显。由此可作推断,Ss2更容易通过血液传播对猪的中枢神经系统造成伤害。
通过皮下、肌肉、静脉注射感染的猪很快表现出典型的临床症状和病变特征并很快出现死亡现象。通过胸腔接种的猪在d17时才出现典型的临床症状和死亡情况。根据各脏器的细菌回收结果可以推断,无论哪种感染模式,实验猪到后期都表现出严重的菌血症变化。同时,根据从血液中回收细菌结果来看,除鼻腔感染外的4种感染模式组的猪到濒死期都产生了严重的菌血症。由此可以推断,最终导致实验猪死亡的直接原因是菌血症,即感染猪的死亡与菌血症相关,而与Ss2的毒力因子没有相关性,这也与Rougier等[19]、Tsai等[20]、Segura等[21]阐述的相互一致。然而,造成不同组织中病原菌的数量差异的精细化机制需进一步研究。
[1] 蔡宝祥.家畜传染病学 [M].4版.北京: 中国农业出版社, 1996.
[2] 陆安法, 姚振华, 陆艳, 等.猪链球菌病[J].动物医学进展, 2003, 24(5): 123-126.
[3] Lun S, Willson P J.Expression of green fluorescent protein and its application in pathogenesis studies of serotype 2 Streptococcus suis[J].J Microbiol Methods, 2004, 56(3): 401-412.
[4] Yoshimi Benno, DVN.Bifidobacterium as a microecological preparation[J].5th CJICM, 2003.8
[5] Charland N, Nizet V, Rubens C E, et al.Streptococcus suis serotype 2 interactions with human brain microvascular endothelial cells[J].Infect Immun, 2000, 68(2): 637- 643.
[6] Berthelot-Herault F, Marois C, Gottschalk M, et al.Genetic diversity of Streptococcus suis strains isolated from pigs and humans as revealed by pulsed field gelelectrophoresis[J].J Clin Microbiol, 2002, 40(2): 615-619.
[7] Okwum abua O, O'Connor M, Shull E.A polymerase chain reaction (PCR) assay specific for streptococcus suis based on the gene encoding the glutamate dehydrogenase[J].FEMS Microbiol Lett, 2003, 218(1): 79-84.
[8] Li Y, Martinez G, Gottschalk M, et al.Identification of a surface protein of Streptococcus suis and evaluation of its immunogenic and protective capacity in pigs[J].Infect Immun, 2006, 74(1): 305-312.
[9] Enright, Fortin J, Willson P J, et al.Acquisition of plasmin human brain microvascular endothelial cells[J].FEMS Microbiol Lett, 2005, 252(1): 105-111
[10] 倪艳秀, 何孔旺, 王继春, 等.猪链球菌2型的PCR快速检测[J].中国兽医学报, 2002, 22(5): 474-476.
[11] 刘国平, 梁雄燕, 李江华, 等.猪链球菌2型昆明鼠动物病理模型的建立[J].中国兽医学报, 2008, 28(7): 795-797.
[12] 汤细彪, 吴斌, 刘国平, 等.应用巢氏PCR方法快速检测猪鼻拭子样品中产毒素多杀性巴氏杆菌[J].畜牧兽医学报, 2007, 38(10): 1083-1087.
[13] 郭培元.猪链球菌2型的分离鉴定以及实验性感染猪链球菌2型的病理学研究[D].扬州: 扬州大学, 2008.
[14] Smith H E, Damman M, van der Velde J, et al.Identification and characterization of the cps locus of Streptococcus suis serotype 2: the capsule protects against phagocytosis and is an important virulence factor[J].Infect Immun, 1999, 67(4): 1750-1756.
[15] Chabot-Roy G, Willson P, Segura M, et al.Phagocytosis and killing of Streptococcus suis by porcine neutrophils[J].Microb Pathog, 2006, 41(1): 21-32.
[16] Helbok R, Pongpakdee S, Yenjun S, et al.Chronic meningitis in Thailand.Clinical characteristics, laboratory data and outcome in patients with specific reference to tuberculosis and cryptococcosis[J].Neuroepidemiology, 2006, 26(1): 37-44.
[17] Chabot-Roy G, Willson P, Segura M, et al.Phagocytosis and killing of Streptococcus suis by porcine neutrophils[J].Microb Pathog, 2006, 41(1): 21-32.
[18] Tenenbaum T, Adam R, Eggelnpohler I, et al.Straindependent disruption of blood-cerebrospinal fluid barrier by Streptoccocus suis in vitro[J].FEMS Immunol Med Microbiol, 2005, 44(1): 25-34.
[19] Rougier S, Galland D, Boucher S, et al.Epidemiology and susceptibility of pathogenic bacteria responsible for upper respiratory tract infections in pet rabbits[J].Vet Microbiol, 2006, 115(1-3): 192-198.
[20] Tsai H C, Lee S S, Wann S R, et al.Streptococcus suis meningitis with ventriculoperitoneal shunt infection and spondylodiscitis[J].J Formos Med Assoc, 2005, 104(12): 948-950.
[21] Segura M, Vanier G, Al-Numani D, et al.Proinflammatory cytokine and chemokine modulation by Streptococcus suis in a whole-blood culture system[J].FEMS Immunol Med Microbiol, 2006, 47(1): 92-106.
COMPARISON OF FIVE INFECTION ROUTES OF STREPTOCOCUS SUIS TYPE 2 IN PIGS
ZHOU Kang1, LI Zong-ming1, LI Jiang-hua2, DONG Jun1, GUO Li-wei1, TIAN Yong-xiang3, CHEN Huan-chun2, LIU Guo-ping1,2
(1.College of Animal Science, Yangtze University, Jingzhou 434025, China; 2.The Collaborative Innovation Center for Sustainable Pig Production, Wuhan 430070, China; 3.Institute of Animal Husbandry and Veterinary, Hubei Academy of Agricultural Science, Wuhan 430070, China)
In order to investigate into the pathogenesis of Streptococcus suis typeⅡ(SS2), 24 pigs were inoculated with the bacteriaat 6×109CFU or physiological saline (control) via subcutaneous, intramuscular, intravenous, intranasal and pleural routes.The pigs were terminated in 30 days.The typical clinical signs were observed in four infection routes except intranasal route.More bacteria were found in blood, lungs and brains than other organs.Bacteremia was detected in all dead pigs.
Swine Streptococcus suis type2; infection routes; comparison
S852.61
A
1674-6422(2016)02-0035-07
2015-12-03
湖北省教育厅重点项目资助(D20121205)
周康,男,硕士研究生,预防兽医学专业;李宗明,男,硕士研究生,预防兽医学专业
刘国平,E-mail:hhaaiieerr@163.com
