微RNA-129表达对食管鳞癌细胞增殖、凋亡和细胞周期的影响及其分子机制
2016-12-01李青峰高燕萍吴勉华
李青峰,高燕萍,吴勉华
(1.南京中医药大学江苏省中医药防治肿瘤协同创新中心,江苏南京210023;2.南京军区总医院肿瘤内科,江苏南京210002)
微RNA-129表达对食管鳞癌细胞增殖、凋亡和细胞周期的影响及其分子机制
李青峰1,高燕萍2,吴勉华1
(1.南京中医药大学江苏省中医药防治肿瘤协同创新中心,江苏南京210023;2.南京军区总医院肿瘤内科,江苏南京210002)
目的分析微RNA-129(miR-129)表达对食管鳞癌(ESCC)细胞增殖、凋亡和细胞周期的影响及可能的分子机制。方法构建miR-129过表达载体(pGCMV/EGFP/miR-129)和对照载体(pGCMV/EGFP/ miR-NC),分别稳定转染ESCC细胞Eca109和EC9706,实时定量PCR检测miR-129表达水平;MTT法、克隆形成实验和流式细胞术分别检测miR-129表达对食管癌细胞体外增殖活性、细胞凋亡率和细胞周期的影响;构建含有Bcl-2基因3′-UTR野生和突变序列的荧光素酶报告基因载体,分别与pGCMV/EGFP/miR-129共转染人ESCC细胞Eca109,双重荧光素酶报告基因实验分析荧光素酶活性变化;Western蛋白质印迹法检测Bcl-2、激活型胱天蛋白酶3及总胱天蛋白酶3蛋白表达水平。结果miR-129过表达可显著抑制食管癌细胞增殖(P<0.01),增加细胞凋亡率(P<0.05),并诱导细胞G0/G1期比例增加和S期比例降低(P<0.05),G2/M期比例则无显著变化。荧光素酶报告基因实验分析结果表明,miR-129可显著降低含有Bcl-2基因3′-UTR野生序列的荧光素酶活性,而不降低含有Bcl-2基因3′-UTR突变序列的荧光素酶活性。Western蛋白质印迹法检测结果提示,miR-129过表达可显著降低ESCC细胞中Bcl-2蛋白表达,增加激活型胱天蛋白酶3蛋白水平(P<0.05),总胱天蛋白酶3蛋白表达水平无明显变化。结论miR-129可能通过靶向调控Bcl-2表达而影响ESCC细胞增殖活性、凋亡和细胞周期的变化,为miR-129成为ESCC临床治疗的分子靶标提供了实验依据。
miR-129;食管鳞癌;细胞增殖;细胞凋亡;Bcl-2
微RNA(microRNA,miRNA)是一类长度约为22 nt大小在生物进化过程中高度保守的非编码小分子RNA,可通过识别和特异性结合靶基因mRNA分子3′端翻译区域,从而负性调控靶mRNA翻译,已成为基因表达调控领域中一类非常重要的转录后调控因子[1]。大量研究表明,miRNA参与调控人类多种生理学及病理学过程,包括细胞增殖、分化和凋亡,同时在肿瘤发生,发展过程中也发挥着非常重要的调控作用[2-4]。近来,miRNA-129(miR-129)在结肠癌、胃癌、宫颈癌和肝癌中的作用已有相关报道[5-8],但其在食管鳞癌(esophageal squamous cellcarcinoma,ESCC)发生过程中的作用并不清楚。本研究检测ESCC细胞中miR-129的表达,分析miR-129对ESCC细胞增殖、凋亡和细胞周期的影响及其可能的分子机制。
1 材料与方法
1.1 细胞、试剂和主要仪器
人ESCC细胞(Eca109和EC9706)、人正常食管上皮细胞(HEEC)、AnnexinⅤ/PI细胞凋亡检测试剂盒、流式细胞周期检测试剂盒和细胞培养基DMEM均购自南京凯基生物科技发展有限公司;胎牛血清(fetalbovine serum,FBS)购自杭州四季青生物工程材料所;Trizol试剂、MMLV-RT逆转录试剂盒购自美国Invitrogen公司;RealMasterMix(SYBR Green)荧光定量PCR试剂盒购自中国Tiangen公司;鼠抗人Bcl-2、激活型胱天蛋白酶3、总胱天蛋白酶3和GAPDH单克隆抗体购自美国Santa Cruz公司;辣根过氧化物酶标记的羊抗鼠IgG二抗购自美国Biosharp公司;LipofectAMINE2000转染试剂购自美国Ambion公司;miR-129过表达载体(pGCMV/ EGFP/miR-129)及对照载体(pGCMV/EGFP/miRNC)均由上海吉玛公司构建;含野生型Bcl-2基因3′-非翻译区(3′-untranslated region,3′-UTR)的荧光素酶报告载体(pLUC/Bcl-2-3′-UTR-wt)和含突变型Bcl-2基因3′-UTR的荧光素酶报告载体(pLUC/Bcl-2-3′-UTR-mut)购自广州复能基因有限公司;双荧光素酶活性检测试剂盒购自美国Promega公司。Partec流式细胞仪,德国PARTEC公司。
1.2 细胞培养和稳定转染
ESCC细胞Eca109和EC9706采用含10% FBS、100 kU·L-1青霉素和100 mg·L-1链霉素的DMEM培养液,在37℃,5%CO2条件下培养。分别将Eca109和EC9706细胞传入6孔板,待细胞密度达到80%时运用脂质体法分别将pGCMV/EGFP/ miR-129和pGCMV/EGFP/miR-NC转染细胞内,方法参照LipofectAMINE2000转染试剂盒的说明书进行。培养48 h后,加入含有氨基糖苷类抗生素G418 600 mg·L-1进行筛选,每2 d更换筛选培养液,14 d后,挑选6孔板中形成的单细胞克隆至24孔板中进行扩大培养,直到获得稳定的具有G418抗性的细胞克隆。稳定阳性细胞克隆分别命名为Eca109/miR-129,Eca109/miR-NC,EC9706/ miR-129和EC9706/miR-NC。
1.3 实时定量逆转录PCR检测miR-129表达
参照Trizol试剂说明书提取细胞总RNA,参照MMLV-RT逆转录试剂盒操作步骤进行逆转录得到cDNA。按照ABI 7500 Real-time仪器说明书,并根据RealMasterMix(SYBR Green)荧光定量PCR试剂盒进行miR-129扩增,操作步骤均严格按照说明书,以U6作内参。每一样本同时做3复孔,输出数据为复孔Ct值的平均值,待测基因相对表达水平用2-ΔΔCt表示。
1.4 MTT法检测细胞存活
将上述稳定转染细胞以每孔1.0×104细胞密度接种于96孔板,每组设5复孔,并设调零孔。分别在转染后第20,44,68,92和116小时,每孔加入MTT 10μL(5.0 g·L-1),继续培养4 h后弃上清,每孔加150μL DMSO溶解紫色颗粒,振荡混匀,酶标仪测定490 nm处吸光度值(A490nm)。实验重复3次。
1.5 流式细胞术检测细胞凋亡
收集上述稳定转染细胞,用预冷1.0×PBS(4℃)洗涤细胞3次,377.3×g离心5 min,将上清弃净,加入100μL的1.0×Annexin缓冲液悬浮细胞,加入5μL AnnexinⅤ和1μL PI染色、混匀后,避光,室温孵育约15 min;测试前补加400μL的1.0×缓冲液,于流式细胞仪上测细胞凋亡情况。每组均设2复孔,实验重复3次。
1.6 流式细胞仪检测细胞周期
收集上述稳定转染细胞,用预冷1×PBS(4℃)洗涤细胞2次,调整细胞密度约为1.0×108L-1,以-20℃预冷的75%冰乙醇1 mL固定细胞,置于4℃冰箱过夜;以167.7×g离心5 min后弃上清,染色前用PBS洗去固定液,洗涤2次,每次重悬5 min,167.7×g离心5 min;弃上清后加100μL RNA酶A,37℃水浴30 min;再加入400μL PI染色并混匀,4℃避光30 min后,激发光波长在488 nm处,流式细胞仪记录红色荧光检测细胞周期,实验重复3次。
1.7 Western蛋白质印迹法检测蛋白表达
收集上述稳定转染细胞,冰上裂解液处理后,保留上清,采用二喹啉甲酸法检测裂解液的蛋白浓度后,每组取等量蛋白,与上样缓冲液混合后行常规SDS-PAGE凝胶电泳,取目的条带行转膜处理后,根据条带大小加入适量鼠抗人Bcl-2,激活型胱天蛋白酶3、总胱天蛋白酶3和GAPDH一抗(稀释度为1∶150),4℃孵育过夜,TBST洗涤3次,每次5 min。加入山羊抗鼠IgG二抗(1∶2000稀释),室温40 min,TBST洗涤4次,每次5 min,辣根过氧化酶底物显色后用Gel-Pro analyzer软件分析各条带积分吸光度(integrated absorbance,IA)值,目的蛋白相对表达水平用目的条带与内参GAPDH条带IA比值表示。
1.8 生物信息学在线分析软件分析miR-129可能调控的靶mRNA
运用3种miRNA/靶mRNA在线生物信息学分析软件:miRanda(http://www.microrna.org),TargetScan(http://www.targetscan.org)和PicTar(http://pictar.bio.nyu.edu/)预测miR-129可能调控的下游靶基因。
1.9 荧光素酶活性分析miR-129是否与Bcl-2基因3′-UTR结合
收集对数生长期ESCC细胞Eca109并接种于6孔板中,当细胞融合度达60%~70%时,按LipofectAMINE 2000说明书分别将pGCMV/ EGFP/miR-129+pLUC/Bcl-2-3′-UTR-wt,pGCMV/ EGFP/miR-129+pLUC/Bcl-2-3′-UTR-mut,pGCMV/ EGFP/miR-NC+pLUC/Bcl-2-3′-UTR-wt和pGCMV/ EGFP/miR-NC+pLUC/Bcl-2-3′-UTR-mut共转染至Eca109细胞。转染48 h后,收集各组细胞,按双荧光素酶活性检测试剂盒说明书进行检测,计算相对荧光素酶活性。样品荧光素酶活性=(海肾荧光素酶活性值-本底值)/(萤火虫荧光素酶活性值-本底值)。实验重复3次。
1.10 统计学分析
2 结果
2.1 人食管鳞癌细胞Eca109和EC9706 miR-129表达水平
如图1所示,与HEEC比较,ESCC细胞Eca109和EC9706中miR-129相对表达水平显著降低(P<0.05)。以HEEC细胞中miR-129相对表达量为1.0,ESCC细胞Eca109和EC9706中相对表达量分别为0.45±0.08和0.58±0.11。

Fig.1 MicroRNA-129(miR-129)expression in esopha⁃geal squamous cell cancer(ESCC)cells(Eca109 and EC9706)detected by quantitative real-time reverse transcription(qRT-PCR).U6 was used as an internal control.*P<0.05,compared with normalcontrol HEEC.
2.2 转染miR-129对Eca109和EC9706细胞增殖活性的影响
qRT-PCR检测结果发现,相对于Eca109/miRNC和EC9706/miR-NC细胞,转染细胞Eca109/ miR-129和EC9706/miR-129细胞中miR-129表达水平分别升高304.8%和416.3%(P<0.01)(图2A)。MTT法检测结果表明,相对于Eca109/miR-NC和EC9706/miR-NC细胞,转染细胞Eca109/miR-129和EC9706/miR-129细胞增殖活性均显著降低(P<0.05,P<0.01)(图2B)。表明miR-129表达水平升高可显著降低ESCC细胞增殖活性。
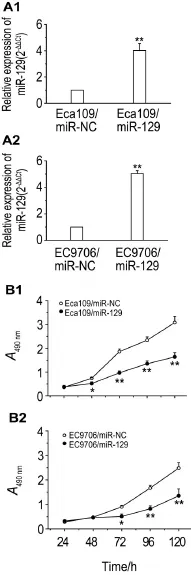
Fig.2 Transfection of miR-129 on proliferation of ESCC cells.A:miR-129 expression in the stably transfected ESCC cells was detected by qRT-PCR;B:proliferation of stably transfected ESCC cells was detected by MTT assay.A1 and B1:Eca109 cells;A2 and B2:EC9706 cells.n=3.*P<0.05,**P<0.01,compared with corresponding contro(l miR-NC)group.
2.3 转染miR-129对Eca109和Ec9706细胞周期、凋亡和胱天蛋白酶3蛋白表达的影响
细胞周期检测结果表明,相对于对照组细胞,Eca109/miR-129和EC9706/miR-129细胞G0/G1比例显著增加(P<0.05),S期比例显著降低(P<0.05)而G2/M期比例无明显变化(图3A)。细胞凋亡检测结果表明,相对于对照组细胞,Eca109/miR-129和EC9706/miR-129细胞凋亡率分别增加了14.5%和18.4%(P<0.05)(图3B)。Western蛋白质印迹法结果发现,相对于对照组细胞,Eca109/miR-129和EC9706/miR-129细胞中激活型胱天蛋白酶3蛋白表达水平显著升高(P<0.05),而总胱天蛋白酶3蛋白表达水平无显著变化(图3C)。因此推测,miR-129表达水平升高可诱导ESCC细胞周期阻滞于G0/G1期,且细胞凋亡率升高。

Fig.3 Transfection of miR-129 on cell cycle(A),apoptosis(B)and caspase 3 protein expression(C)of Eca109 and EC9706 cells detected by FCM or Western blotting.C1:Eca109 cells;C2:EC9706 cells;IA:integrated absorbance.n=3.*P<0.05,**P<0.01,compared with corresponding control(miR-NC)group.
2.4 miR-129对Bcl-2的调控作用
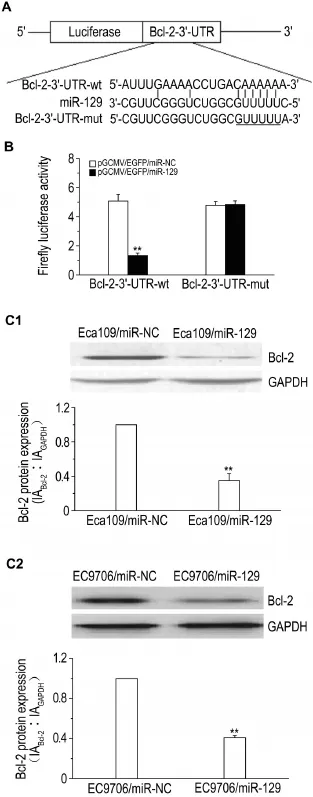
Fig.4 Identification of Bcl-2 gene as target gene down⁃stream regulated by miR-129.A:schematic graph of putative one binding site of miR-129 in Bcl-2/3′-UTR.The human Bcl-2/3′-UTR fragment containing wild-type or mutant miR-129-binding sequence was subcloned into downstream of the luciferase reporter gene in pLUC/luc vector;B:transfection of pGCMV/ EGFP/miR-129 inhibited firefly luciferase activity of pLUC/Bcl-2-3′-UTR-wt.Such inhibition was not observed with mutations in the miR-129-binding site(pLUC/Bcl-2-3′-UTR-mut);C:Bcl-2 protein expression in stably transfected ESCC cells was detected by Western blotting.C1:Eca109 cells;C2:EC9706 cells;n=3.*P<0.05,**P<0.01,compared with corresponding control(miR-NC)group.
为了进一步分析miR-129作用分子机制,运用3个miRNA/靶基因在线分析软件(TargetScan,miRanda和PicTar)分析miR-129下游可能调控的靶基因。图4结果显示,在Bcl-2基因mRNA/3′-UTR(1525~1531碱基:CAAAAA)含有一个潜在的miR-129结合位点。依托广州复能基因有限公司,分别构建含野生型Bcl-2基因3′-UTR的荧光素酶报告载体(pLUC/Bcl-2-3′-UTR-wt)和含突变型Bcl-2基因3′-UTR的荧光素酶报告载体(pLUC/ Bcl-2-3′-UTR-mut)(图4A),分别与pGCMV/ EGFP/miR-NC或pGCMV/EGFP/miR-129共转染Eca109细胞,48 h后收集细胞测定荧光素酶活性。结果发现,相比对照组,miR-129能靶向野生型Bcl-2基因的3′-UTR,使荧光素酶表达水平降低,抑制效率为(67.5±3.8)%,显著低于对照组(P<0.05)(图4B)。进一步用Western蛋白印迹法分析上述稳定转染细胞(Eca109/miR-129,Eca109/miR-NC,EC9706/miR-129和EC9706/miR-NC)中Bcl-2蛋白表达水平。结果提示,相对于对照组细胞,Eca109/ miR-129和EC9706/miR-129细胞中Bcl-2蛋白表达水平显著降低(P<0.01)(图4C)。上述结果表明,miR-129能与靶基因Bcl-2基因3′-UTR序列结合,提示Bcl-2是miR-129下游的一个靶基因。
3 讨论
食管癌是世界上最常见的消化道恶性肿瘤之一,其发病率居恶性肿瘤的第7位,死亡率居世界癌症死因的第6位。中国是食管癌最高发的地区之一,其中ESCC是主要的组织学类型。由于食管鳞癌具有较强的侵袭转移活性,在早期即可局部和远处转移,通常大多数ESCC患者确诊时已为晚期,错过了手术的最佳时期,再加上放化疗一般不敏感,因此食管癌患者的预后较差[9]。探索ESCC的分子病因学将有助于寻找ESCC新的肿瘤分子标志物,从而进一步提高其临床诊治水平。
miRNA是一类平均长度约为18~24个核苷酸的内源性的非编码小分子RNA,在表观遗传学和翻译后修饰调控过程中发挥着重要的作用[10]。miRNA能通过识别并结合到靶基因的3′-UTR区的结合位点,通过诱导mRNA的降解或抑制其翻译从而降低靶基因的表达,因此在肿瘤中发挥着癌基因或者抑癌基因的功能参与肿瘤的发生发展等各个阶段[11-12]。近年来,miRNA与ESCC之间的相关文献报道逐渐增加。研究发现,miRNA可用作食管癌早期诊断和预后评估的分子标志物。Zhang等[13]研究发现,miR-335在ESCC中表达水平上调与患者较差的生存预后密切相关。另外,Zhou等[14]研究表明,miR-100表达水平降低不仅与ESCC预后相关,同时通过检测其表达水平还有助于鉴别哪些临床患者对放疗敏感。另外,miRNA表达紊乱被证明在ESCC细胞的增殖、侵袭转移及放、化疗耐药等多种恶性表型形成过程中还发挥着重要作用。Li等[15]研究发现,miR-338-3p可通过调控细胞周期和凋亡而影响ESCC体内外增殖活性。Nie等[16]研究发现,miR-34a可通过调控转录因子Yin Yang-1(YY1)表达从而调控ESCC细胞的侵袭转移能力。Imanaka等[17]研究报道,miR-141可通过转录后水平调控YAP1表达从而增加ESCC细胞抵抗顺铂诱导的凋亡并最终产生顺铂化疗抵抗。肿瘤的发生发展过程是一个多因素及多基因参与的复杂过程,探索新miRNA在ESCC发展过程中的作用,有助于进一步深入阐明ESCC发生及发展过程中的转录后分子调控机制并构建新的miRNA调控网络。miR-129是新近发现的一个抑癌基因性质的miRNA,在多种肿瘤细胞和组织中呈低表达状态,包括结肠癌、胃癌、乳腺癌和肝癌等[5-8,18],然而miR-129与食管癌之间的关系并未见相关的国内外文献报道。因此,本研究探索miR-129在ESCC恶性表型中的作用及可能的下游分子调控机制。
本研究首先运用qRT-PCR检测ESCC细胞和HEEC中miR-129表达水平。结果发现,ESCC细胞中miR-129表达水平显著降低,提示miR-129表达水平下调可能在ESCC发生过程中起重要作用。MTT法检测miR-129表达对ESCC细胞体外增殖活性的影响。结果发现,miR-129过表达显著降低ESCC细胞的体外增殖能力。进一步用流式细胞术分析miR-129表达对细胞周期和凋亡的影响。结果发现,miR-129过表达组ESCC细胞G0/G1期细胞比例显著升高,S期细胞比例显著降低,G2/M期细胞比例无显著变化。同时,miR-129过表达组ESCC细胞凋亡率显著升高,且激活型胱天蛋白酶3蛋白表达水平显著升高。已有研究表明,miRNA的生物学功能发挥依赖下游靶基因的调控,探索并阐明miR-129下游调控的靶基因有助于阐明miR-129调控ESCC功能的分子机制。运用3个miRNA/靶基因在线分析软件分析miR-129下游可能调控的靶mRNA。结果发现,在Bcl-2基因mRNA/3′-UTR(1525~1531碱基:CAAAAA)含有一个潜在的miR-129结合位点。在前期结肠癌的研究中,Karaayvaz等[5]已证明,miR-129可通过负向调控癌基因Bcl-2表达而影响结肠癌细胞的凋亡水平,并最终调节结肠癌细胞对化疗药5-氟尿嘧啶的化疗敏感性。为了进一步验证Bcl-2是否有miR-129参与调控ESCC细胞恶性表型形成的一个下游功能靶基因,本研究依托广州复能基因有限公司分别构建含野生型Bcl-2基因3′-UTR和含突变型Bcl-2基因3′-UTR的荧光素酶报告载体。通过荧光素酶报告基因实验证明了miR-129可直接结合Bcl-2基因mRNA 3′-UTR区。进一步用Western蛋白质印检测结果提示,miR-129表达升高可以显著降低ESCC细胞中Bcl-2蛋白表达水平。上述结果均提示,Bcl-2是miR-129在ESCC中的一个下游功能靶基因。
综上所述,miR-129表达水平下调诱导Bcl-2蛋白表达水平上调,在ESCC发生发展过程中起重要作用,上调miR-129表达可显著抑制ESCC细胞增殖,并诱导其细胞周期阻滞和细胞凋亡增加。因此,miR-129有望成为ESCC治疗的一个新分子靶标。当然,这一论点还有待进一步验证,仍有许多问题需要进一步研究。如①通过临床的组织标本了解miR-129在ESCC的临床病理及预后价值;②miR-129是否参与调控ESCC的其他恶性生物学表型形成,包括侵袭转移、放化疗耐药等;③由于一个miRNA可调控多个靶基因,因此除了Bcl-2之外,miR-129是否还通过调控其他靶基因从而影响ESCC恶性表型形成等。
[1]Ke XS,Liu CM,Liu DP,Liang CC.MicroRNAs:key participants in gene regulatory networks[J]. Curr Opin Chem Biol,2003,7(4):516-523.
[2]Pasquinelli AE,Ruvkun G.Control of developmental timing by microRNAs and their targets[J]. Annu Rev Cell Dev Biol,2002,18:495-513.
[3]Jovanovic M,Hengartner MO.miRNAs and apop⁃tosis:RNAs to die for[J].Oncogene,2006,25(46):6176-6187.
[4]Dalmay T,Edwards DR.MicroRNAs and the hall⁃marks of cancer[J].Oncogene,2006,25(46):6170-6175.
[5]Karaayvaz M,Zhai H,Ju J.miR-129 promotes apoptosis and enhances chemosensitivity to 5-fluo⁃rouracil in colorectal cancer[J].Cell Death Dis,2013,4:e659.
[6]Yu X,Song H,Xia T,Han S,Xiao B,Luo L,et al. Growth inhibitory effects of three miR-129 family members on gastric cancer[J].Gene,2013,532(1):87-93.
[7]Zhang J,Li S,Yan Q,Chen X,Yang Y,Liu X,et al.Interferon-βinduced microRNA-129-5p down-regulates HPV-18 E6 and E7 viral gene expression by targeting SP1 in cervical cancer cells[J].PLoS One,2013,8(12):e81366.
[8]Lu CY,Lin KY,Tien MT,Wu CT,Uen YH,Tseng TL.Frequent DNA methylation of MiR-129-2 and its potential clinical implication in hepatocellular carcinoma[J].Genes Chromosomes Cancer,2013,52(7):636-643.
[9]D′journo XB,Thomas PA.Current management of esophageal cancer[J].J Thorac Dis,2014,6(Suppl2):S253-S264.
[10]Carthew RW.Gene regulation by microRNAs[J]. Curr Opin Genet Dev,2006,16(2):203-208.
[11]Adams BD,Kasinski AL,Slack FJ.Aberrant regu⁃lation and function of microRNAs in cancer[J]. Curr Biol,2014,24(16):R762-R776.
[12]Han C,Yu Z,Duan Z,Kan Q.Role of microRNA-1 in human cancer and its therapeutic potentials[J]. Biomed Res Int,2014,2014:428371.
[13]Zhang BJ,Gong HY,Zheng F,Liu DJ,Liu HX. Up-regulation of miR-335 predicts a favorable prognosis in esophageal squamous cellcarcinoma[J].Int J Clin Exp Pathol,2014,7(9):6213-6218.
[14]Zhou S,Yang B,Zhao Y,Xu S,Zhang H,Li Z. Prognostic value of microRNA-100 in esophageal squamous cell carcinoma[J].J Surg Res,2014,192(2):515-520.
[15]Li X,Li Z,Yang G,Pan Z.MicroRNA-338-3p suppresses tumor growth of esophageal squamous cell carcinoma in vitro and in vivo[J].Mol Med Rep,2015,12(3):3951-3957.
[16]Nie J,Ge X,Geng Y,Cao H,Zhu W,Jiao Y,et al. miR-34a inhibits the migration and invasion of esophageal squamous cell carcinoma by targeting Yin Yang-1[J].Oncol Rep,2015,34(1):311-317.
[17]Imanaka Y,Tsuchiya S,Sato F,Shimada Y,Shimizu K,Tsujimoto G.MicroRNA-141 confers resistance to cisplatin-induced apoptosis by targeting YAP1 in human esophageal squamous cell carcinoma[J].J Hum Genet,2011,56(4):270-276.
[18]Wang QY,Tang J,Zhou CX,Zhao Q.The downregulation of miR-129 in breast cancer and its effect on breast cancer migration and motility[J]. Acta Physiol Sin(生理学报),2012,64(4):403-411.
EffectofmicroRNA-129 expression on proliferation,apoptosis and cellcycle of esophagealsquamous cell cancer and its possible molecular mechanism
LIQing-feng1,GAO Yan-ping2,WU Mian-hua1
(1.Jiangsu Collaborative Innovation Center of TraditionalChinese Medicine for Prevention and Treatment of Tumor,Nanjing University of Chinese Medicine,Nanjing 210023,China;2.Department of Oncology,GeneralHospitalof Nanjing Military Command,PLA,Nanjing 210002,China)
OBJECTIVE To investigate the effect of microRNA-129(miR-129)expression on malignant phenotypes of esophageal squamous cell cancer(ESCC)cells and its possible molecular mechanisms. METHODS The constructed miR-129-overexpressed vector(pGCMV/EGFP/miR-129)and negative control vector(pGCMV/EGFP/miR-NC)were stably transfected into ESCC cell lines(Eca109 and EC9706),respectively.Quantitative real-time PCR(qRT-PCR)was performed to detect the expression of miR-129.MTT and flow cytometry(FCM)assays were performed to analyze the effects of miR-129 on proliferation,cell cycle and apoptosis of ESCC cells.Furthermore,a luciferase reporter vector with the putative B-celllymphoma-2(Bcl-2)3′-untranslated region(pLUC/Bcl-2-3′-UTR-wtand pLUC/ Bcl-2-3′-UTR-mut)was constructed to explore whether Bcl-2 was a direct target gene of miR-129 by detecting luciferase activity.Next,Western blotting was performed to detect the expression of Bcl-2,cleaved caspase 3 and totalcaspase 3 proteins.RESULTS Overexpression of miR-129 significantly inhibited proliferation(P<0.01),induced cellarrest in G0/G1phase(P<0.05)and enhanced apoptosis(P<0.05)in ESCC cells.Luciferase reporter assay indicated that Bcl-2 was identified as a direct target gene ofmiR-129.Results of Western blotting showed thatoverexpression of miR-129 significantly reduced the expression of Bcl-2 protein and increased the expression ofcleaved caspase 3 protein,butinduced no changes in total caspase 3 protein in ESCC cells.CONCLUSION miR-129 functions as a tumor suppressor in ESCC cells by targeting Bcl-2 gene.Therefore,miR-129 will be a potential molecular targetfor the treatmentofhuman ESCC.
miR-129;esophagealsquamous cellcancer;proliferation;apoptosis;Bcl-2
The projectsupported by NationalNaturalScience Foundation of China(81273717)
WU Mian-hua,E-mail:wmh7001@163.com
Q522
A
1000-3002-(2016)05-0532-07
10.3867/j.issn.1000-3002.2016.05.008
2015-12-08接受日期:2016-03-18)
(本文编辑:齐春会)
国家自然科学基金(81273717)
李青峰,硕士研究生,主要从事肿瘤内科学研究。
吴勉华,E-mail:wmh7001@163.com
