猪甲状腺球蛋白诱导小鼠毒性弥漫性甲状腺肿模型的建立
2016-12-01玄振玉邹珊珊刘丹凤
周 驰,玄振玉,邹珊珊,刘丹凤,雷 瑜
(1.上海中医药大学药理学教研室,上海201203;2.上海玉森新药开发有限公司,上海201203)
猪甲状腺球蛋白诱导小鼠毒性弥漫性甲状腺肿模型的建立
周 驰1,玄振玉2,邹珊珊2,刘丹凤1,雷 瑜1
(1.上海中医药大学药理学教研室,上海201203;2.上海玉森新药开发有限公司,上海201203)
目的通过注射猪甲状腺球蛋白(PTG)制备小鼠毒性弥漫性甲状腺肿(GD)模型,探索其模型发病率及稳定性。方法模型组C57BL6/N小鼠每只每周皮下多点注射PTG 25μg,共计6次。免疫攻击完成后测量心率和耗氧量;之后每2周进行血清三碘甲腺原氨酸(T3)水平的测定,以模型组小鼠血清T3水平高于正常对照组小鼠T3的x+3s为造模成功,共计12周。第12周实验结束时处死小鼠测定脾和胸腺指数、血清甲状腺球蛋白抗体和甲状腺过氧化物酶抗体,并对甲状腺组织进行病理观察。结果PTG免疫6次后,与正常对照组小鼠相比,模型组小鼠心率加快(P<0.01),耗氧量增多(P<0.01),血清T3水平升高(P<0.01),其雄鼠发病率约为77.7%,雌鼠发病率约为88.8%。在免疫结束后的12周内,模型组血清T3水平始终高于正常对照组,雄性模型组T3水平有下降趋势,而雌性模型组血清T3始终保持相对稳定的高水平状态。结论本法制备小鼠GD模型造模时间短,发病率高,持续时间长,是较为理想的GD造模方法。
猪甲状腺球蛋白;毒性弥漫性甲状腺肿;动物模型
一般认为毒性弥漫性甲状腺肿(Graves病,Graves disease,GD)是一种甲状腺自身免疫性疾病,以基础代谢率增高、自主神经系统功能失常为特征[1]。随着现代社会生活压力加大,GD的发病率呈上升趋势,严重危害人类的身体健康。但GD的发病机制迄今尚不明确。实验动物模型对于发病机制的剖析和治疗方案的研究有着极其重要的意义,尤其对于自身免疫性疾病,动物模型对耐受机制及免疫干预疗法等的研究有着不可估量的作用。1996年Shimojo等[2]用编码人类促甲状腺激素受体的cDNA免疫攻击AKR/N小鼠,得到第一个真正意义上的GD动物模型。近10余年来,人们通过不同方法免疫小鼠[3],建立了不同的GD小鼠模型,但这些模型的发病率较低且稳定性差。因此,建立发病率高、稳定性好的GD动物模型非常必要。
甲状腺球蛋白(thyroglobulin,TG)是甲状腺滤泡上皮细胞分泌的一种蛋白质,是滤泡腔内胶质的主要组成部分[4],本身就是甲状腺的一种自身抗原,其产生的TG抗体(TG antibody,TGAB)是自身免疫性疾病一个重要指标。近几年,Endo和Kobayashi[5]通过注射猪TG(porcine TG,PTG)建立了新的GD模型,但其成功率仅为30%,且未进行雌雄发病率差异和稳定性考察。本研究在此基础上缩短抗原攻击时间,提高免疫频率,增加注射部位,并进行模型稳定性的探讨,以期建立发病率高且稳定性好的GD模型。
1 材料与方法
1.1 试剂和仪器
PTG(批号018K7012V)和完全弗氏佐剂(批号SLBJ2846V),美国Sigma公司;乌来糖(批号30191228),国药集团化学试剂有限公司;[125I]三碘甲腺原氨酸(triiodothyronine,T3)放射免疫分析药盒、[125I]TGAB放射免疫分析药盒和[125I]甲状腺过氧化物酶抗体(thyroid peroxidase antibody,TPOAB)放射免疫分析试剂盒,北京北方生物技术研究所有限公司;磷酸盐缓冲液(PBS,批号15052601),上海西唐生物科技有限公司。JA5003A电子天平,上海精天电子仪器有限公司;RM6240型多道生理信号采集仪,成都仪器厂;CY-12C型便携式数字测氧仪,北京天创尚邦仪器设备有限公司;SN-697放射免疫γ计数器,中国科学院上海原子核研究所日环仪器厂;Scanspeed mini离心机,丹麦Labogene公司。
1.2 PTG抗原乳剂及免疫动物模型的制备
取PTG溶解于PBS中与完全弗氏佐剂按照1∶1比例混匀,配置成PTG浓度为0.5 g·L-1的乳剂。C57BL6/N小鼠,体质量约20 g,雌雄各半,购买并饲养于上海中医药大学动物实验中心〔SPF级饲养室,许可证号SCXK(沪):2007-0005〕。饲养环境为温度20~24℃,湿度50%~70%,小鼠自由进食、饮水,自然昼夜节律光照。动物福利及实验均符合上海中医药大学动物实验中心相关实验动物管理条例。
60只C57BL6/N小鼠分为正常对照组24只和模型组36只,每组雌雄各半。模型组小鼠每只每次皮下多点注射PTG抗原乳剂共计50μL,正常对照组小鼠以PBS代替,每周1次,共计6次。免疫攻击完成后进行心率、耗氧量和T3水平观察,并开始每2周1次眼内眦取血,分离血清测定T3,以模型组小鼠T3水平高于正常对照组T3的x+3s为造模成功,持续观察12周,于最后1周腹腔注射乌拉坦0.75 g·kg-1麻醉小鼠,下腔静脉取血。处死小鼠,测定脾和胸腺指数,并定性判断血清中TGAB和TPOAB的阳性率。
1.3 小鼠外观和体质量变化的观察
实验期间密切观察小鼠的一般活动及行为状态。在6次免疫攻击过程中,每周免疫注射后第7天记录1次小鼠体质量的变化。在免疫造模完成后,每周记录1次小鼠的平均进食情况,连续12周。
1.4 心率检测
免疫6次后,腹腔注射乌拉坦0.75 g·kg-1麻醉小鼠,RM6240多道生理信号仪记录心率。
1.5 耗氧量检测
免疫6次后,将每只小鼠分别放入500 mL的密闭抽滤瓶中,将抽滤瓶外通玻璃管与50 mL注射器用胶皮套与三通阀相连。10 min后用注射器通过三通阀吸取瓶内空气30 mL,注入CY-12C测氧仪,测氧仪显示为抽滤瓶中气体的氧含量,氧含量消耗值(%)=21%-剩余氧含量,小鼠的耗氧量=氧含量消耗值(%)/体质量(g)。
1.6 放射免疫法测定血清T3,TPOAB和TGAB水平
免疫攻击完成后每2周1次眼内眦取血,800×g离心15 min,吸取血清,采用放射免疫法定量测定血清中的T3;定性测定TPOAB和TGAB,以P/N<2.1定义为阴性,2.1≤P/N≤4.0定义为弱阳性,P/N>4.0定义为强阳性,操作均按放免试剂盒说明书进行。
1.7 免疫脏器指数测定
在免疫攻击完成后的第12周麻醉处死小鼠,迅速解剖取出脾和胸腺并称重,计算脾和胸腺质量(mg)与体质量(g)的比值,即为脾和胸腺的脏器指数。
1.8 甲状腺组织病理观察
实验结束后取出甲状腺,置于10%甲醛固定,切片,HE染色,光镜下观察病理改变。
1.9 统计学分析
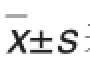
2 结果
2.1 GD模型小鼠一般行为状态变化
实验过程中,正常对照组小鼠始终未见活动、行为及毛色的异常。模型组小鼠在免疫攻击5周后开始出现多动不安和互相攻击的情况,并伴有一定的脱毛现象,粪便也较多,但随着时间延长其多动不安的行为有所改善。
2.2 GD模型小鼠体质量和进食量变化
图1结果显示,在免疫攻击6次期间,模型组小鼠的体质量较正常对照组略轻,其中在第4次免疫后雄性模型组体质量明显减轻(P<0.01)。图2结果显示,在免疫造模完成后的12周内,模型组小鼠的平均进食量较正常对照组增多(P<0.01)。提示该模型可使小鼠的体质量增加减缓和进食量增多。
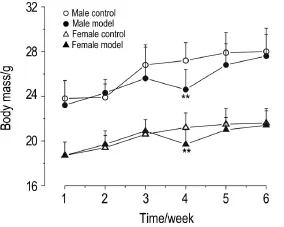
Fig.1 Effect of immunization with porcine thyroid globulin(PTG)on body mass of Graves disease(GD)mice.The mice in modelgroup received multi-point subcutaneous injection of PTG 25μg once a week for 6 weeks,meanwhile the mice in control groups were given PBS 50μL.Body mass was measured at the 7th day after each PTG injection.n=12(control),18(model).**P<0.01,compared with corre⁃sponding controlgroup.
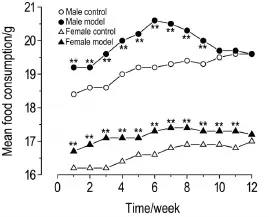
Fig.2 Effect of immunization with PTG on food con⁃sumption of GD model mice. See Fig.1 for the mouse treat⁃ment. Food consumption was measured after the end of immunization,once a week for 12 weeks.Mean food consumption= mass of consumptive food(g)/number of mice.(control),18(model). **P<0.01,compared with corresponding control group.
2.3 GD模型小鼠心率变化
表1结果显示,在免疫攻击6次后,模型组小鼠心率与正常对照组小鼠比较明显加快(P<0.01),提示PTG免疫可使小鼠心率加快。

Tab.1 Heart rate of GD model mice after immunization with PTG for 6 times
2.4 GD模型小鼠耗氧量变化
表2结果显示,在免疫攻击6次后,模型组小鼠耗氧量与正常对照组小鼠比较明显增多(P<0.01),提示PTG免疫可使小鼠耗氧量增多。

Tab.2 Oxygen consumption of GD model mice after immunization with PTG for 6 times
2.5 GD模型小鼠免疫脏器指数变化
表3结果显示,在免疫攻击完成12周后,模型组小鼠脾系数与正常对照组小鼠相比无明显差异,但胸腺系数明显下降(P<0.01)。
2.6 GD模型小鼠发病率的性别差异
表4结果显示,在免疫攻击6次后,雌雄模型组小鼠与正常对照组小鼠比较血清T3水平明显增加,(P<0.01)。以模型组小鼠血清T3水平高于正常对照组血清T3的x+3s为造模成功,雄性小鼠发病率为77.7%,雌性小鼠发病率为88.8%(表5),提示该模型的发病率有性别差异。
2.7 GD模型小鼠稳定性观察
图3结果显示,不同性别模型组小鼠在免疫攻击完成后12周内,与同性别正常对照组小鼠相比,血清T3浓度始终保持在高水平。表5结果表明,雄性小鼠的发病高峰较雌性小鼠早2周出现,雄性模型小鼠的血清T3水平下降速度较雌性快,而雌性模型小鼠在12周内始终保持相对较高的血清T3水平。
2.8 GD模型小鼠血清TPOAB和TGAB水平的性别差异
在免疫攻击完成12周后,雌雄正常对照组小鼠无1例出现TGAB和TPOAB阳性。从表6中可以看出,雌雄模型小鼠的不同抗体水平变化不一,雄性模型小鼠较雌性模型小鼠出现多例强阳性TGAB(P<0.05),还出现2例强阳性TPOAB,但雌性模型小鼠未出现强阳性,两者比较无显著性差异。
2.9 GD模型小鼠甲状腺组织病理变化
正常对照组雌性小鼠甲状腺滤泡大小大致相同,多呈椭圆形,边界清晰;滤泡内胶质较均匀,滤泡上皮细胞多呈低柱状,核圆形(图4A)。模型组雌性小鼠甲状腺滤泡肿大明显且滤泡大小不一,呈不规则变化;滤泡胶质内有众多小空泡产生,少数滤泡胶质稀薄甚至缺失,滤泡间隙变宽;滤泡上皮细胞明显受压,变成低立方形,核稍大且多位于基底部(图4B)。
Tab.3 Effect of immunization with PTG on organ index of GD model mice
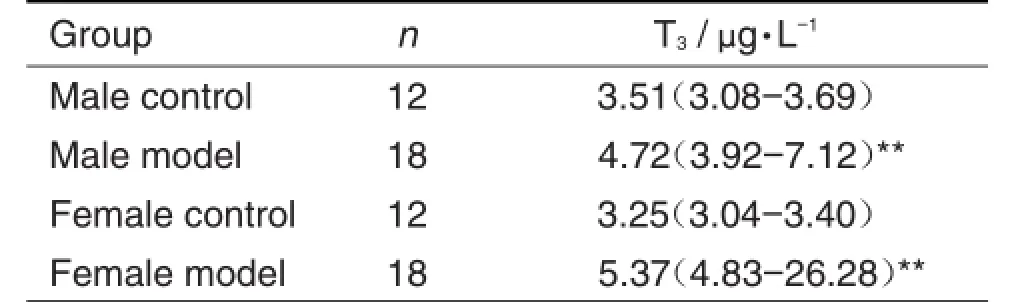
Tab.4 Serum T3level of mice after immunization with PTG for 6 times
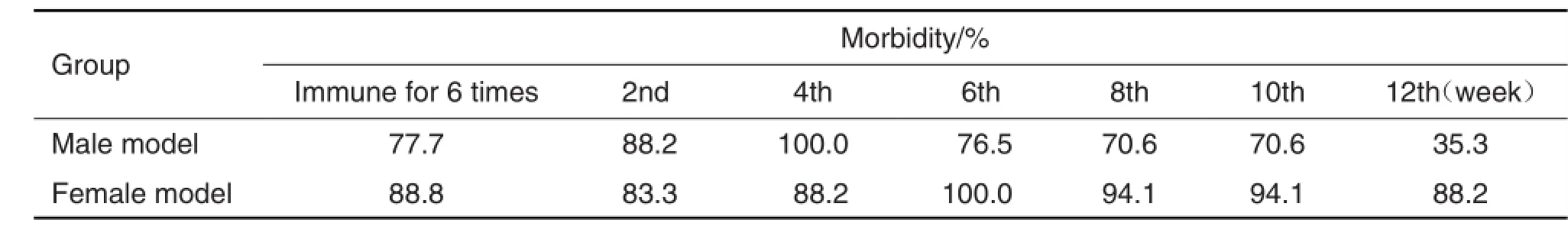
Tab.5 Morbidity ofmice in different genders during 12 weeks after 6 times PTG injection
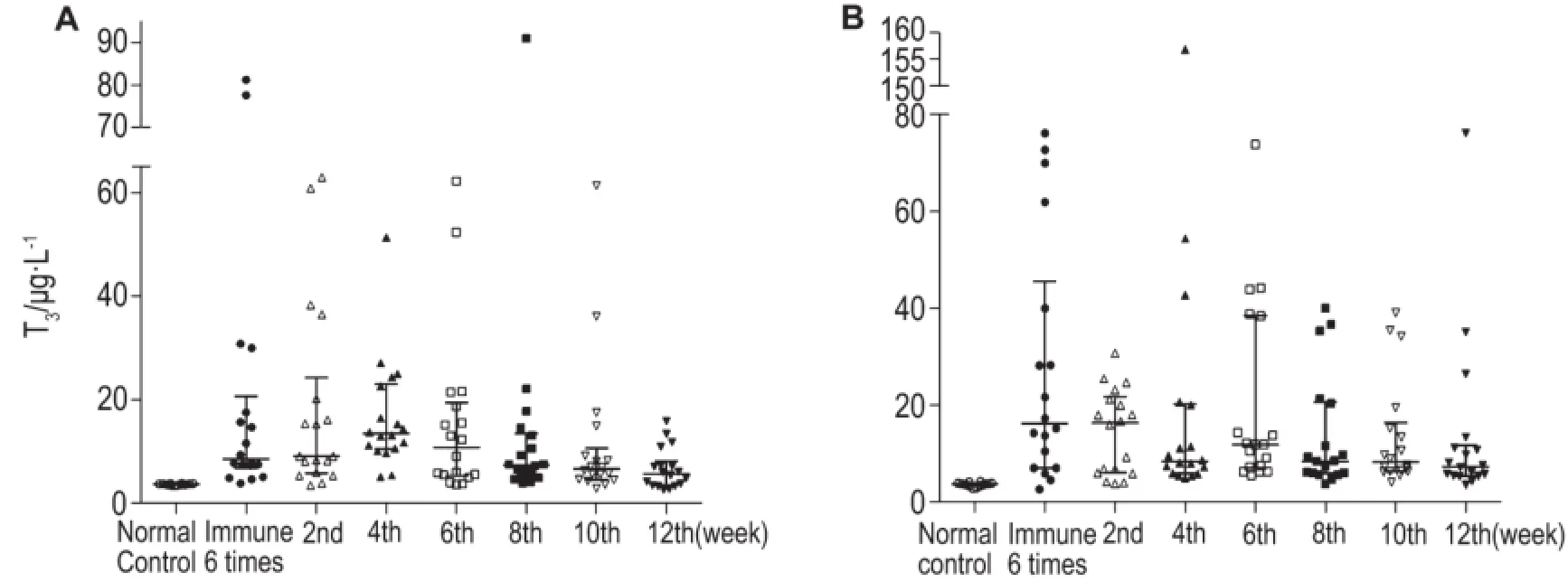
Fig.3 Variation of serum T3level in GD model mice after 6 times of PTG injection.See Fig.1 for the mouse treatment. The serum T3of mice was measured every two weeks for 12 weeks after the end of PTG injection.A:male group;B:female group.
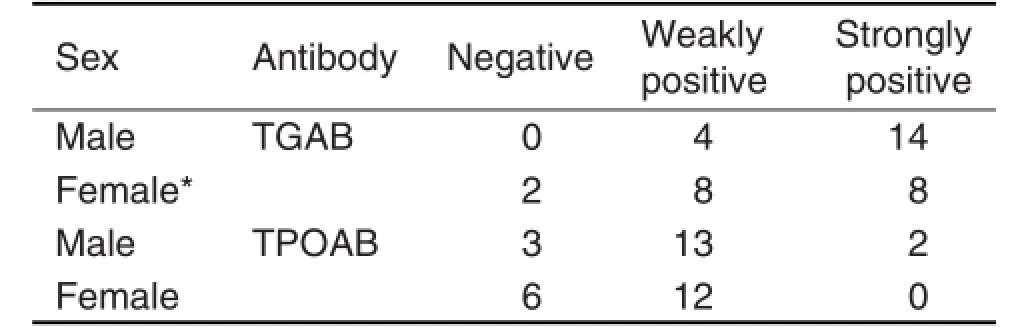
Tab.6 Effect of immunization with PTG on serum TG antibody(TGAB)and thyroid peroxidase antibody(TPOAB)levels of GD modelmice
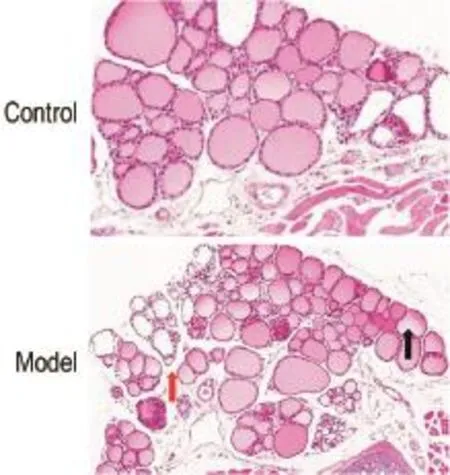
Fig.4 Histopathological changes of thyroid glands of GD modelfemale mice immunized with PTG(HE staining×400). See Fig.1 for the mouse treatment.Histopathologicalchanges were observed atthe 12th week after the end of PTG injection.The red arrow showed folliclar space wide.The black arrow showed acinarcolloid thin.
3 讨论
本研究结果表明,模型组小鼠在PTG免疫攻击6次后,血清T3水平升高,造成交感神经兴奋,出现了以心率加快、耗氧量增多、体质量减轻和进食量增多为特征的基础代谢率加快现象,这与GD患者在临床上的表现一致[6],但免疫结束后,其体质量与正常对照组相比无显著差异。
脾作为免疫器官是产生B淋巴细胞的主要场所,主要参与体液免疫;而胸腺是产生T淋巴细胞的主要场所,主要参与细胞免疫。胸腺和脾系数是反映其各自功能的重要指征,系数的增减变化在一定程度上反映了机体的免疫功能状况[7]。本课题组曾发现在6次免疫结束后,模型组小鼠的脾系数较对照组明显增大,而胸腺系数只略减小。在本研究中,PTG作为外来抗原攻击机体时,脾分泌大量B淋巴细胞产生相应抗体进行机体防御,很可能导致脾系数增大;而在免疫完成后12周内,由于未继续给予小鼠外来抗原,脾不再大量分泌B淋巴细胞,模型组小鼠的脾系数与正常对照组相比已无显著性差异。但模型组小鼠的胸腺系数较正常对照组显著变小。此结果再次证实,GD的产生可能与细胞免疫或体液免疫的失衡有关[8]。对于本模型而言,无论是在免疫结束之时还是在免疫结束后12周,其细胞免疫/体液免疫始终处于减弱状态。
本研究采用了与Endo等[5]实验相同的C57BL6/N品系小鼠,一方面提高免疫攻击的频率,即将原来每2周免疫攻击1次缩短为每周免疫攻击1次,总的免疫攻击次数不变;另一方面采用皮下多点注射[9]替代原来单一注射比目鱼肌,使模型的发病率由Endo方法的30%提高至约80%。
此外,现有GD免疫模型研究对象多为雌性动物,其原因是GD多发于女性,与雌激素水平有密切联系[10],可得到发病率较高的模型。但仅用雌性动物作为研究GD发病机制和药效学研究的对象不合理且不全面,毕竟GD在男性也有一定发病率,故在免疫模型上比较发病率性别的差异是有意义的。本研究发现,通过PTG诱导的GD模型,其雄性小鼠在免疫完成后的发病率为77.7%,而雌性小鼠为88.8%。雌、雄小鼠在免疫造模完成后的12周内血清T3水平均出现先升高后下降的现象,但雄性小鼠的血清T3水平下降趋势明显,而雌性小鼠始终保持相对较高的稳定状态。
分析雌、雄小鼠发病率和稳定性差异的原因,一方面可能是雄鼠比雌鼠易产生具有水解TG作用的TGAB,而TG作为甲状腺中的一种碘化糖蛋白既是合成T3的原料也是储存T3的场所,TG经水解后可生成T3[11]。因此,在免疫完成后,雄鼠比雌鼠先达到T3水平高峰,而后又因后期雄鼠TG含量的减少导致T3分泌的减少,出现了后期雄鼠T3水平比雌鼠下降快的现象;另一方面可能是雄鼠也易产生TPOAB,而过氧化物酶是催化碘的氧化和酪氨酸碘化过程中不可缺少的物质[12],故由于雄鼠甲状腺过氧化物酶含量减少,导致了碘的氧化和酪氨酸碘化过程的受阻,使得T3合成和分泌通路被阻断,进一步加快了雄鼠在后期T3水平的下降。
GD作为一种与情志等多种因素有关的自身免疫性疾病,发病机制尚不十分明确,对于该病的治疗原则也很难确立。而对于用免疫方法建立GD动物模型,一直认为难度较大,可复制性亦较低,在国内成功开展的报道较少,更鲜见相关模型应用于药效学研究。本研究通过改良后的造模方法使得GD小鼠的发病率增高,并且模型小鼠在免疫结束后12周内始终保持较高的血清T3水平,持续时间长。本法制备的模型小鼠呈现的症状与GD临床症状相似且稳定,造模时间缩短,可作为较理想的药效研究的造模方法之一。
[1]Zhang MX.Thyroid Disease Diagnosis and Treatment(甲状腺疾病诊断学)[M].Beijing:China MedicalScience Press,2005:96-105.
[2]Shimojo N,Kohno Y,Yamaguchi K,Kikuoka S,Hoshioka A,NiimiH,et al.Induction of Graves-like disease in mice by immunization with fibroblasts transfected with the thyrotropin receptor and a classⅡmolecule[J].Proc NatlAcad SciUSA,1996,93(20):11074-11079.
[3]Li QM,Wei JP.Research overview of Graves disease animal model building methods[J].J Med Res(医学研究杂志),2013,42(8):18-22.
[4]Torréns JI,Burch HB.Serum thyroglobulin measure⁃ment:utility in clinical practice[J].Endocrinol Metab Clin North Am,2001,30(2):429-467.
[5]Endo T,KobayashiT.Immunization with thyroglobulin in⁃duces Graves′-like disease in mice[J].J Endocrinol,2009,202(2):217-222.
[6]Qiao J,LiJT,Qu GY.Electrocardiogram analysis of 133hyperthyroidism patients[J].China PracticalMed(中国实用医药),2015,10(5):38-39.
[7]Liu Q,Liu XG,Wu S.Experimental study of the change on thymus index and spleen index in rats with insufficiency of the lung-qi of pulmonary emphysema[J].J Gansu College TraditChin Med(甘肃中医学院学报),2006,23(1):20-23.
[8]Liu M,Pan JF.The study ofthe effectofthyroxine on T,B cells abnormalities in Graves′disease patients[J]. Chin J Immunol(中国免疫学杂志),1999,15(7):321-323.
[9]Ye DM,Wang P,Chen J.Development of murine model of experimental autoimmune thyroiditis[J]. Acta Acad Med Wannan(皖南医学院学报),2015,34(1):10-12.
[10]Wang S,Mao S,Zhao G,Wu H.Relationship between estrogen receptor and Graves′disease[J]. Chin J Surg(中华外科杂志),2000,38(8):619-621.
[11]CuiSL,Yu J,Shoujun L.Iodine intake increases IP-10 expression in the serum and thyroids of rats with experimentalautoimmune thyroiditis[J].IntJ Endocri⁃nol,2014,2014:581069.
[12]Andrade VA,Gross JL,Maia AL.The effect of methimazole pretreatmenton the efficacy ofradioactive iodine therapy in Graves'hyperthyroidism:one-year follow-up ofa prospective,randomized study[J].J Clin Endocrinol Metab,2001,86(8):3488-3493.
Preparation ofmouse modelof Graves disease using porcine thyroid globulin
ZHOUChi1,XUANZhen-yu2,ZOUShan-shan2,LIUDan-feng1,LEIYu1
(1.Department of Pharmacology,Shanghai University of Traditional Chinese Medicine,Shanghai 201203,China;2.ShanghaiYouseen Drug Development Corporation,Shanghai 201203,China)
OBJECTIVE To prepare the Graves disease(GD)mouse model through porcine thyroid globulin(PTG)injection and investigate the morbidity and stability of the model.METHODS C57BL6/N mice in modelgroup received multi-pointsubcutaneous injection of PTG 25μg each week,six times in all.Afterthe end ofimmunization,theirheartrate and oxygen consumption were measured and serum triiodothyronine(T3)levelwas determined every two weeks.A modelwas considered successfulif serum T3levelwas higherthan x+3s ofthe controlgroup.Observation ofthe modellasted 12 weeks.Atthe 12th week,spleen and thymus gland indices,serum thyroid globulin antibodies and thyroid peroxidase antibodies were measured,and the thyroid glands were taken for pathologicalobservation.RESULTS After six times of immunization,mice in modelgroup showed increased heart rate(P<0.01),oxygen consumption(P<0.01)and T3level(P<0.01)compared with controlgroup.The morbidity was 77.7%for male mice and 88.8%forfemales.In addition,T3levelin modelgroup remained higherthan thatin control group within 12 weeks afterimmunization.The T3leveltended to decrease in male mice,butremained ata relatively stable higherlevelin females.CONCLUSION This method is suitable for GDmodeling due to its shortmodel-making time,high morbidity and long durability.
porcine thyroid globulin;Graves disease;animalmodel
XUAN Zhen-yu,E-mail:xuanzhenyu@163.com
R965.1
A
1000-3002-(2016)05-0582-06
10.3867/j.issn.1000-3002.2016.05.016
2015-08-03接受日期:2016-02-18)
(本文编辑:齐春会)
周驰(1990-),男,硕士研究生,主要从事中药药理学研究。
玄振玉,E-mail:xuanzhenyu@163.com
