邻苯二甲酸单乙基己基酯对神经干细胞增殖和迁移的作用
2016-12-01黄意湘马晓晓郝欣蕊廖双菊梅虹霞郑丽丹
黄意湘,马晓晓,郝欣蕊,刘 劲,廖双菊,梅虹霞,苏 颖,郑丽丹,林 函,
(1.温州医科大学附属第二医院麻醉科,浙江温州325000;2.浙江省麻醉学重点实验室,浙江温州325000)
邻苯二甲酸单乙基己基酯对神经干细胞增殖和迁移的作用
黄意湘1,马晓晓1,郝欣蕊1,刘 劲1,廖双菊1,梅虹霞2,苏 颖2,郑丽丹2,林 函1,2
(1.温州医科大学附属第二医院麻醉科,浙江温州325000;2.浙江省麻醉学重点实验室,浙江温州325000)
目的探讨邻苯二甲酸单乙基己基酯(MEHP)对原代神经干细胞(NSC)和NE-4C小鼠细胞增殖和迁移的影响。方法原代NSC来源于孕15 d(E15)远交群SD胎大鼠脑皮质;NE-4C细胞为小鼠NSC。MEHP 0,1,10,100和1000μmol·L-1处理72 h后,CCK-8法检测细胞活力;5-乙炔基-2′脱氧尿嘧啶核苷(EdU)法检测细胞增殖能力;Transwell小室检测细胞迁移;Western蛋白印迹法检测糖皮质激素受体(GR)、Y性别决定区框2(Sox2)、信号传导与转录激活因子3(Stat3)等基因及蛋白的表达。结果CCK-8结果显示,与正常对照组相比,MEHP1000μmol·L-1作用72 h后,NE-4C和NSC细胞活力明显减弱,分别为正常对照组的70.3%和40.0%。EdU结果显示,与正常对照组相比,MEHP 100μmol·L-1组细胞增殖率降低,分别为正常对照组的74.8%和12.0%(P<0.05)。Transwell实验发现,MEHP 100μmol·L-1处理72 h后,NE-4C细胞的迁移率降低至(63.4±2.0)%(P<0.05)。MEHP 100μmol·L-1组NE-4C中与增殖和迁移相关的基因GR,Stat3和Sox2的表达下调,分别为正常对照组的49.8%,26.0%和14.0%(P<0.05);在NSC中的相应基因也下调,分别为正常对照组的10.0%,14.0%和15.3%;在NE-4C中与增殖及迁移相关的蛋白GR,GRβ,p-S tat3和Sox2的表达下调,相对表达量分别为0.92±0.17,0.87±0.35,0.62±0.24和0.81±0.22(P<0.05);在NSC中相应蛋白表达也下调,相对表达量分别为0.82±0.20,0.56±0.12,0.53±0.20和0.84±0.36(P<0.05)。结论大剂量MEHP可抑制NSC的增殖和迁移能力,其机制可能是通过GR介导的Stat3及Sox2的作用实现。
邻苯二甲酸单乙基己基酯;神经干细胞;NE-4C;细胞增殖;细胞迁移;糖皮质激素受体
塑化剂在20世纪30年代开始使用,主要用于提高产品的可塑性和增强产品的强度。邻苯二甲酸酯类化合物是应用较为广泛的塑化剂,许多研究表明,在大气、水体、土壤、生物体,乃至人体中普遍发现邻苯二甲酸酯类的存在,这类物质可通过多种途径进入人体,已成为一种全球性的重要环境有机污染物[1]。邻苯二甲酸酯类对人类的危害主要表现在致癌、致畸性以及免疫抑制性[2],目前以致人体生殖功能损害的研究最多[3]。其中,邻苯二甲酸二(2-乙基)己酯(dethylhexylphthalate,DEHP)被认为是最广泛应用的塑化剂,邻苯二甲酸单乙基己基酯(mono-2-ethylhexylphthalate,MEHP)则为DEHP在哺乳动物肠道内的主要活性代谢产物[4],其毒性是DEHP的10倍。
神经干细胞(neuralstem cells,NSC)是一类具有分化潜能的祖细胞。在胚胎发育过程中,脑内存在大量NSC;成年后主要分布在脑室下区和侧脑室参与神经的再生。NSC的增殖、分化及迁移是神经系统发育的基础。在NSC分化和神经损伤后的修复中,细胞迁移起到基础性的支持作用。
目前已发现,MEHP可抑制类神经的PC12细胞G2/M细胞周期及DNA合成,从而抑制该细胞的增殖,促进分化[5]。动物实验同样发现,出生后早期DEHP的暴露可对神经系统的发育造成不利效应,从而影响仔小鼠成年后的运动协调功能[6]。当前大量研究证实,MEHP可与雄激素受体(androgen receptor,AR)相互作用以调节雄性生殖系统的功能[7]。糖皮质激素受体(glucocorticoid receptor,GR)可促进NSC凋亡、抑制其增殖[8]。而研究已证实,GR与AR具有结构上的相似性。因而本研究旨在探究MEHP是否可通过GR引起NSC的增殖和迁移改变,并拟从信号传导与转录激活因子3(signal transducerand activatoroftranscription 3,Stat3)和Y性别决定区框2〔sex determining region Y(SRY)-box 2,Sox2〕角度探讨其机制。
1 材料与方法
1.1 细胞和试剂
NE-4C细胞,中国科学院上海分院生命科学研究院生物化学与细胞生物学研究所,型号(ATCC,CRL-2925™)。
原代NSC的制备:体质量250~350 g雌雄SD大鼠(温州医科大学实验动物中心,动物许可证编号:SCXK浙20100044),置于定制的铁笼里进行交配,室温21.5~22.5℃,12 h昼夜交替饲养,观察到阴栓日计为孕第0天(E0)。取E15的SD大鼠,5%水合氯醛按照0.7 mg·kg-1腹腔注射,麻醉后无菌操作下取出胚胎置于预冷的D-Hanks平衡盐液中。解剖分离取出胚胎大脑皮层,剥离脑膜,剪碎组织移到15 mL离心管中,室温200×g离心5 min,去除培养液,加入1~2 mL Accutase消化酶于37℃消化5 min,反复吹打约30次,加入适量完全培养液后过滤。锥虫蓝(台盼蓝)染色以计数活细胞,细胞悬液以(1~2)×109L-1移至25 cm3培养瓶,置于5% CO237℃孵箱中培养,48 h后换液传代。细胞稳定传代至第2代时,进行MEHP暴露处理。
1.2 试剂和仪器
MEHP购于百灵威试剂公司,B27 supplement以及DMEM/F12购于美国Gibco公司,表皮生长因子(epidermalgrowth factor,EGF)及碱性成纤维细胞因子(basic fibroblastgrowth factor,bFGF)购于美国Cali-Bio公司,Click-iT™EdUAlexa Fluor高通道显像试剂盒购于美国Invitrogen公司,逆转录试剂盒购于美国Promega公司,SoFastEvaGreen⁃Supermix购于美国Bio-Rad公司,GR抗体、Stat3抗体、p-Stat3抗体以及Sox2抗体均购于美国Abcam公司(ab3579,ab109085,ab30647,ab97959),GRβ抗体购于英国Biorbyt公司(Orb157177),山羊抗兔和山羊抗小鼠二抗购于上海碧云天生物技术有限公司。SZ61解剖显微镜购于日本Olympus,Olympus Cx21倒置相差显微镜购于日本Nikon公司,TS100荧光显微镜购于日本Nikon公司,PVDF膜购于美国Millipore公司(0.45μm),Multiskan MK3全自动酶标分析仪购于美国Fisher公司,CFX96荧光定量PCR仪购于美国Bio-Rad公司,LAS4000mini凝胶成像分析系统购于美国GE公司。
1.3 细胞分组处理
原代NSC和细胞株NE-4C随机分为正常对照组、DMSO组、MEHP 1,10,100和1000μmol·L-1组,其中接种原代NSC的培养板预先用5%P-L-O溶液铺板,然后加入相应药物处理。每组设6个复孔,于37℃5%CO2孵育箱培养72 h后检测处理。
1.4 CCK-8实验检测细胞存活
NE-4C细胞株及原代NSC分别以每孔3×103和8×103的密度接种于96孔板内,体系为100μL。接种原代NSC的培养板预先用5%P-L-O溶液铺板。按1.3进行分组处理,每组设6个复孔,于37℃5%CO2孵育箱培养72 h。暴露结束前4 h移除原培养液,PBS漂洗后每孔加入10μL CCK-8溶液。孵育4 h后用酶标仪检测490 nm吸光度值(absor⁃bance,A)。细胞存活率(%)=(药物组A值-调零孔A值)/(正常对照孔A值-调零孔A值)×100%。
1.5 5-乙炔基-2′脱氧尿嘧啶核苷(EdU)法检测细胞增殖
取对数期生长的NE-4C细胞及原代NSC分别以每孔2×104和5×104接种于24孔板内,体系为0.5 mL。按1.3进行分组处理,每组设3个复孔,细胞置于37℃5%CO2孵育箱培养72 h。于终止培养前4 h,加入EdU 50μmol·L-1至培养液中。培养结束后去除上清,3.7%甲醛固定15 min后,用0.5% Triton X-100透膜,加入染色反应液Click-iT™,室温下避光于脱色摇床孵育30 min。最后采用Hoechst33342染核,荧光显微镜下拍照计数,200倍显微镜下每孔计数5个视野取平均值。
1.6 Transwell细胞迁移实验
将NE-4C细胞于无血清培养液中孵育12 h后,以每孔3×104密度加入Transwell上室,体系为500μL,并以1%的BSA维持渗透压,按1.3进行分组处理,每组3个复孔,Transwell下室加入含10% FBS的完全培养液,体系为600μL,于孵育箱培养72 h。孵育结束后去除Transwell上下室的培养液,PBS漂洗1~2次,4%多聚甲醛固定10 min后结晶紫染色15 min,PBS漂洗2~3次后在倒置显微镜下观察黏附在小室下层细胞的数量,200倍显微镜下计数10个视野取平均值。
1.7 实时荧光定量聚合酶链反应(qRT-PCR)检测基因表达水平
神经干细胞NE-4C和原代细胞分别以每孔3×105和5×105的密度接种于6孔板,体系为1 mL。按1.3进行分组处理,每组设6个复孔,细胞于37℃,5%CO2孵育箱培养72 h。药物作用终止后按Trizol试剂说明书提取各组NE-4C及NSC的总RNA,测定总RNA浓度与A260nm/A280nm比值,将RNA逆转为cDNA,采用相对稀释标准曲线法进行qRT-PCR测定目的基因GR,Stat3,Sox2 mRNA的相对表达水平,反应程序为:95℃×30 s,95℃×5 s,60℃×5 s;循环39次。针对NE-4C的引物序列如下,内参基因RS16:上游引物(F)CGTGCTTGTGCTCGGAGCTA;下游引物(R)GCTCCTTGCCCAGAAGCAAA;目的基因GR:(F)TACAGTCAAGGTTTCT⁃GCGTCT;(R)CCCCATCACTTTTGTTTCG;Stat3:(F)GCTCCTTGCCCAGAAGCAAA;(R)CGGT⁃GCTGCACGATAGG;Sox2:(F)CCCCATCACTTTTGTTTCG;(R)CTCGGTCTCGGACAAAA;针对NSC的引物序列如下,内参基因RS16:上游引物(F)AAGTCTTCGGACGCAAGAAA;下游引物(R)TTGCCCAGAAGCAGAACAG;目的基因GR:(F)ATACAGCATCCCTTTCTCAGCA;(R)CTTGGCACTATTCCAGTTTTC;Stat3:(F)TACCACAAAAGTCAGGTTGCTG;(R)ACATCCCCAGTCAG⁃GTTGCTG;Sox2:(F)TACCTCTTCCTCCCACTCCAG;(R)AATCTCTCCCCTTCTCCAGTTC;根据标准曲线法从各自标准曲线上计算待测样本初始表达量,将目的基因表达量归一处理,按照公式基因相对表达量(%)=(待测样本目的基因初始浓度/待测样本内参初始浓度)/(对照样本目的基因初始浓度/对照样本内参基因初始浓度)×100%,得出样本目的基因的表达。
1.8 Western蛋白印迹法检测蛋白表达
取1.3分组处理的细胞,MEHP作用终止后收集各组细胞离心沉淀,依蛋白裂解试剂说明书加入适量的RIPA裂解液和PMSF磷酸酶抑制剂。置于冰上静置30 min后移入EP管,超声(300 W、5 s× 3次,间隔5 s)破碎细胞。低温离心12 000 g× 10 min,收取上清液。用BCA工作试剂盒测定蛋白浓度,每条泳道蛋白上样30μg后电泳,转膜后用5%脱脂奶粉封闭2 h,加入内参蛋白β肌动蛋白和目的蛋白GR,Stat3,p-Stat3和Sox2一抗,按1∶1000的滴度稀释,4℃摇床孵育过夜后以TBST洗膜,加入稀释比例为1∶5000的山羊抗兔或山羊抗小鼠二抗,室温孵育2 h,TBST充分洗膜,通过曝光后显示条带。用Quantity One4.62软件分析目标蛋白条带和内参蛋白条带的积分吸光度(integrated absorbance,IA),以两者的IA比值表示目标蛋白的相对表达水平。
1.9 统计学分析
2 结果
2.1 MEHP对神经干细胞细胞活力的影响
CCK-8实验结果显示,NE-4C细胞(表1)和NSC(表2)在MEHP 1000μmol·L-1处理后,细胞存活率降低(P<0.05);分别降低了70.3%和40.0%(P<0.05)。其他浓度MEHP对细胞存活率无影响。
2.2 MEHP对神经干细胞增殖能力的影响
如图1和表3所示,MEHP 1和10μmol·L-1处理对2种细胞增殖能力的影响不明显;当浓度增加到100μmol·L-1,细胞增殖能力则被抑制,MEHP 100μmol·L-1组NE-4C和NSC的增殖能力分别被抑制74.8%和12.0%(P<0.05)。该结果提示,MEHP对细胞增殖的效应与浓度相关,低浓度时对增殖无影响,高浓度时则对细胞增殖产生抑制效应。

Tab.1 Effect of mono-2-ethylhexyl phthalate(MEHP)on cell viability of NE-4C cells by CCK-8 assay
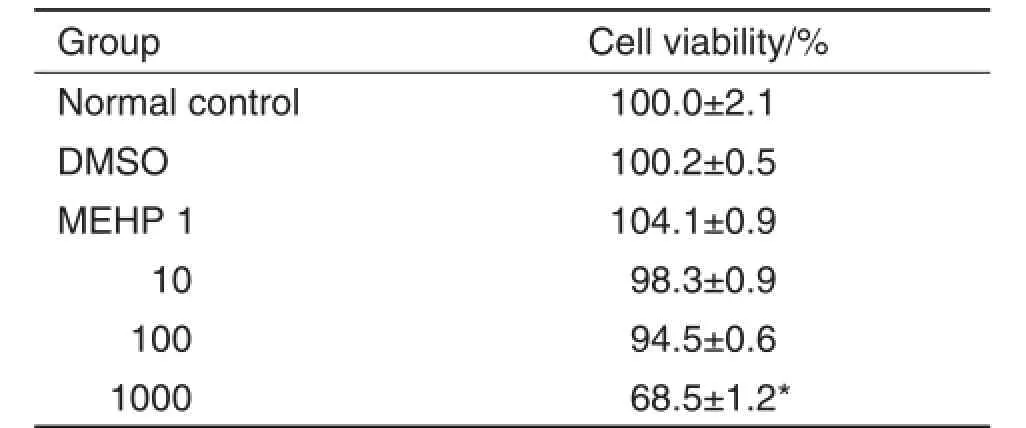
Tab.2 Effect of MEHP on cell viability of neural stem cells(NSCs)by CCK-8 assay
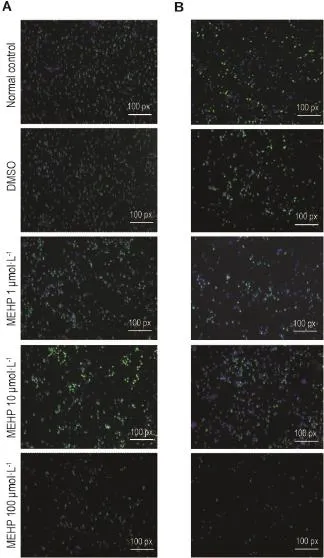
Fig.1 Effect of MEHP on NE-4C cells(A)and NSCs(B)proliferation detected by cell fluorescence images of EdU assay.See Tab.1 for the treatment.Green fluorescence refers to cells dyed by Hoechst33342,while blue fluorescence refers to cells dyed by EdU.

Tab.3 Effect of MEHP on cell proliferation of NE-4C and NSCs by EdU assay
2.3 MEHP对神经干细胞迁移能力的影响
图2显示了NE-4C细胞在MEHP作用下迁移能力的变化。如表4的结果,与正常对照组相比,MEHP 100μmol·L-1处理时,NE-4C的迁移能力显著下降(P<0.05),表现为穿过Transwell的细胞数量减少。其他浓度组的MEHP则不影响NE-4C细胞的迁移能力。
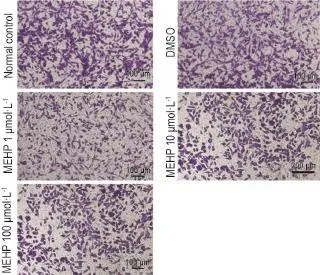
Fig.2 Effect of MEHP on migration of NE-4C detected by images of Transwell test.See Tab.1 for the treatment. Purple cells stained by crystalviolet refer to cells that migrate to the lower chamber ofthe transwell.
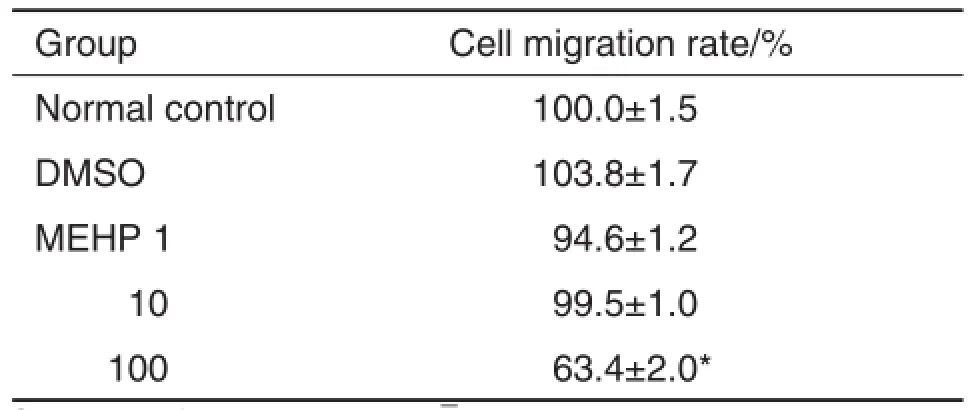
Tab.4 Effect of MEHP on cell migration of NE-4C by Transwellmigration assay
2.4 MEHP对与神经干细胞增殖和迁移相关的基因表达的影响
NE-4C和NSC的qRT-PCR结果(表5)显示,MEHP 100μmol·L-1处理后,增殖相关的基因(GR,Stat3和Sox2)的表达均表现为下调。与正常对照组相比,MEHP 100μmol·L-1处理使NE-4C中3种基因分别减少了49.8%,26.0%和14.0%;NSC中则分别减少了10.0%,14.0%和15.3%。
2.5 MEHP对与神经干细胞增殖和迁移相关的蛋白表达的影响
图3A和表6结果显示,与正常对照组比,MEHP 100μmol·L-1处理NE-4C细胞后,细胞的GR,p-Stat3,GRβ及Sox2蛋白表达显著降低(P<0.05),而Stat3的表达水平变化不显著。
图3B和表6结果显示,与正常对照组比,MEHP 100μmol·L-1处理NSC细胞后,细胞中的Stat3,GRβ及Sox2蛋白表达显著减少(P<0.05),而GR表达的改变无统计学差异。

Tab.5 Effect of MEHP on mRNA expression of GR,Stat3 and Sox2 of NE-4C and NSCs by qRT-PCR

Fig.3 Effect of MEHP on expression of GR,Sox2,Stat3 and p-stat3 in NE-4C cells(A)and NSCs(B)by Western blotting.See Tab.1 for the treatment.

Tab.6 Effect of MEHP on protein expression of GR,GRβ,Stat3,p-Stat3 and Sox2 in NE-4C cells and NSCs
3 讨论
本研究结果显示EHP的耐受能力可能存在差异,低浓度MEHP对细胞活力无影响,但当浓度达到1000μmol·L-1持续作用72 h时,对NE-4C和NSC则可致细胞存活率降低。因此,本研究在后续实验中取消1000μmol·L-1MEHP剂量组。
MEHP 100μmol·L-1可抑制NE-4C和NSC的增殖,使细胞的迁移能力减弱,而MEHP 1和10μmol·L-1则对NE-4C增殖和迁移无影响。在高浓度MEHP作用下,与NSC增殖相关的GR,Stat3及Sox2的表达均表现为不同程度的降低;与细胞迁移相关的Stat3和Sox2表达也受到抑制。
目前的研究认为,MEHP等邻苯二甲酸类物质是一类内分泌干预剂,通过模拟雌激素效应发挥类似拮抗雄激素的效应。GR在胚胎中期大量表达[11];与此同时,脑内也存在AR的表达[12],而GR与AR结构上具有相似性[13]。因此,MEHP很可能通过GR通路影响NSC的增殖。而本研究结果表明,当MEHP的浓度达到100μmol·L-1时,NE-4C细胞及NSC的增殖都受到不同程度的抑制。目前多数研究认为GR与细胞增殖呈负相关[14],而本研究发现GR表达下调时,细胞增殖作用减弱,似乎与上述观点不一致。可能的原因为GR存在2种亚型:GRα及GRβ,前者发挥经典的GR的作用,而GRβ的作用与GRα相反,随着GRβ表达下调,细胞增殖能力减弱。Heine等[14]研究GR功能时没有区分GRα和GRβ亚型,而本研究检测的是GRβ。因此,推测NSC增殖能力的减弱是通过抑制GRβ的表达实现的。而对于NE-4C细胞和原代NSC,MEHP 100μmol·L-1处理的NE-4C细胞GR表达下调,而NSC的GR蛋白表达改变则没有统计学意义,推测可能是NE-4C细胞和NSC的种类不同所致。本研究认为,NSC的结果更贴近真实的实验研究背景。
Stat3是Stat家族的成员之一,主要参与细胞因子和生长因子相关的信号通路介导的包括细胞增殖、分化、凋亡、迁移及自我更新等多种生理过程[15-16]。目前认为,在胚胎7.5 d,胎小鼠脑内即可检测到Stat3的存在[17],表明Stat3在胚胎早期发育中有重要作用。Li等[18]在Stat3与NSC的增殖与迁移的研究也证实了这两者的相关性。Debidda等[19]发现,应用慢病毒转染使Stat3失活时,细胞的增殖能力也被抑制。本研究中MEHP 100μmol·L-1处理可致NE-4C细胞和NSC的增殖能力受损,同时Stat3的表达降低。
在不同的组织和细胞系,Stat家族成员与GR无论在生理上还是功能上都存在相互作用,已有研究报道了Stat3与GR之间的交互联系,这种相互关系可表现为作用的一致性,或相反。通过对GR的激素应答元件的计算机分析发现,GR的应答元件与Stat3有重叠,提示激活的GR可与Stat3直接相互作用从而共同调节下游的基因,即GR与Stat3的作用表现一致,这种作用的一致性在肝细胞及B细胞的相关研究中也被证实[20]。与之相反,一项乳腺癌细胞的研究则发现,Stat3与GR的作用是相互拮抗的[21]。而本研究的结果,NE-4C细胞和NSC都表现为GR与Stat3作用的一致性。
在成髓细胞瘤等肿瘤细胞中发现,Stat3可增强它们的迁移[22],本研究也证实了Stat3与细胞迁移的这一相关调节作用。
Sox2是NSC的标志物之一。作为一种转录因子,Sox2可调节细胞的增殖、迁移、分化及细胞的自我更新。在Sox2与细胞的增殖的研究中,Chu等[23]发现,MEHP处理下,Sox2的表达降低时,细胞增殖的能力也减弱。本研究可发现,NE-4C的增殖能力在该浓度下受到抑制。
低浓度MEHP不影响细胞的迁移,当浓度达到100μmol·L-1NE-4C细胞的迁移能力受到抑制,此时Sox2的表达降低。在某些肿瘤细胞的研究中,Sox2的表达与细胞迁移能力成负相关[24]。
Stat3与Sox2之间同样存在相互作用。在食管鳞状细胞的研究中发现,Stat3可通过slug与Sox2产生相互作用,即Stat3/低氧诱导因子-1α激活可促进Sox2上调slug的表达[25]。Zhao等[26]发现,激活的Stat3可结合Myc和Sox2的启动子从而诱导后者的表达。在这些研究中,Stat3可调节Sox2的表达,这种调节表现为正向的作用,这与本研究的结果一致。
综上所述,当MEHP的浓度达到100μmol·L-1时,细胞的增殖和迁移能力及与之相关的GR,Stat3及Sox2的表达都表现为下调。而MEHP 1000μmol·L-1对细胞具有毒性作用,致细胞活力降低。因此可推测,MEHP对NSC的增殖作用是通过GR介导的Stat3及Sox2的作用机制实现的,而MEHP对NSC迁移的影响则与Stat3及Sox2相关。
[1]Valvi D,Monfort N,Ventura R,Casas M,Casas L,Sunyer J,et al.Variability and predictors of urinary phthalate metabolites in Spanish pregnant women[J].IntJ Hyg Environ Health,2015,218(2):220-231.
[2]Shi C,Chen X,Cai XH,Yu WD,Liang R,Lu Q,et al.Cytotoxic effects of mono-(2-ethylhexyl)phthalate on human embryonic stem cells[J].Chin Med J(中华医学杂志),2013,126(9):1714-1719.
[3]Murphy CJ,Stermer AR,Richburg JH.Age-and species-dependent infiltration of macrophages into the testis of rats and mice exposed to mono-(2-e thylhexyl)phthalate(MEHP)[J].Biol Reprod,2014,91(1):18.
[4]Ye T,Kang M,Huang Q,Fang C,Chen Y,Shen H,et al.Exposure to DEHP and MEHP from hatching to adulthood causes reproductive dysfunction and endocrine disruption in marine medaka(Oryzias melastigma)[J].Aquat Toxicol,2014,146(1):115-126.
[5]Chen T,Yang W,Li Y,Chen X,Xu S.Mono-(2-ethylhexyl)phthalate impairs neurodevelopment:inhibition of proliferation and promotion of differenti⁃ation in PC12 cells[J].Toxicol Lett,2011,201(1):34-41.
[6]Tanaka T.Reproductive and neurobehavioural toxicity study of Ponceau 4R administered to mice in the diet[J].Food Chem Toxicol,2006,44(10):1651-1658.
[7]LaguëE,Tremblay JJ.Antagonistic effects of testosterone and the endocrine disruptor mono-(2-ethylhexyl)phthalate on INSL3 transcription in Leydig cells[J].Endocrinology,2008,149(9):4688-4694.
[8]Noguchi KK,Lau K,Smith DJ,Swiney BS,Farber NB.Glucocorticoid receptor stimulation and the regulation of neonatalcerebellar neuralprogenitor cell apoptosis[J].Neurobiol Dis,2011,43(2):356-363.
[9]Lim CK,Kim SK,Ko DS,Cho JW,Jun JH,An SY,et al.Differentialcytotoxic effects of mono-(2-ethyl⁃hexyl)phthalate on blastomere-derived embryonic stem cells and differentiating neurons[J].Toxicology,2009,264(3):145-154.
[10]Manz P,Cadeddu RP,Wilk M,Fritz B,Haas R,Wenzel F.Impact of di(2-ethylhexyl)phthalate on migration rate of human promyelocytic leukemia cells(HL-60)[J].Clin Hemorheol Microcirc,2014,58(1):241-246.
[11]Yi SJ,Masters JN,Baram TZ.Glucocorticoid receptor mRNA ontogeny in the fetaland postnatal rat forebrain[J].Mol Cell Neurosci,1994,5(5):385-393.
[12]Young WJ,Chang C.Ontogeny and autoregulation of androgen receptor mRNA expression in the nervous system[J].Endocrine,1998,9(1):79-88.
[13]Xie N,Cheng H,Lin D,Liu L,Yang O,Jia L,et al.The expression of glucocorticoid receptor is negatively regulated by active androgen receptor signaling in prostate tumors[J].Int J Cancer,2015,136(4):E27-E38.
[14]Heine VM,Rowitch DH.Hedgehog signaling has a protective effect in glucocorticoid-induced mouse neonatalbrain injury through an 11βHSD2-dependent mechanism[J].J Clin Invest,2009,119(2):267-277.
[15]Arulanandam R,Geletu M,Feracci H,Raptis L. Activated Rac1 requires gp130 for Stat3 activation,cell proliferation and migration[J].Exp Cell Res,2010,316(5):875-886.
[16]Cheng X,Jin G,Zhang X,Tian M,Zou L.Stagedependent STAT3 activation is involved in the differentiation of rat hippocampus neuralstem cells[J].NeurosciLett,2011,493(1-2):18-23.
[17]Foshay KM,Gallicano GI.Regulation of Sox2 by STAT3 initiates commitment to the neural precursor cellfate[J].Stem Cells Dev,2008,17(2):269-278.
[18]Li Y,Zhuang P,Shen B,Zhang Y,Shen J. Baicalin promotes neuronal differentiation of neural stem/progenitor cells through modulating p-stat3 and bHLH family protein expression[J].Brain Res,2012,1429(1):36-42.
[19]Debidda M,Wang L,Zang H,Poli V,Zheng Y.A role of STAT3 in Rho GTPase-regulated cellmigration and proliferation[J].J Biol Chem,2005,280(17):17275-17285.
[20]Arambasic′J,Poznanovic′G,Ivanovic′MS, Bogojevic′D,Mihailovic′M,Uskokovic′A,et al. Association of the glucocorticoid receptor with STAT3,C/EBPbeta,and the hormone-responsive element within the rat haptoglobin gene promoter during the acute phase response[J].IUBMB Life,2010,62(3):227-236.
[21]Bertucci PY,Quaglino A,Pozzi AG,Kordon EC,Pecci A.Glucocorticoid-induced impairment of mammary gland involution is associated with STAT5 and STAT3 signaling modulation[J].Endocrinology,2010,151(12):5730-5740.
[22]Xiao H,Bid HK,Jou D,Wu X,Yu W,Li C,et al. A novel small molecular STAT3 inhibitor,LY5,inhibits cell viability,cell migration,and angiogenesis in medulloblastoma cells[J].J Biol Chem,2015,290(6):3418-3429.
[23]Chu DP,Tian S,Qi L,Hao CJ,Xia HF,Ma X. Abnormality of maternal-to-embryonic transition contributes to MEHP-induced mouse 2-cell block[J].J Cell Physiol,2013,228(4):753-763.
[24]Bayo P,Jou A,Stenzinger A,Shao C,Gross M,Jensen A,et al.Loss of SOX2 expression induces cell motility via vimentin up-regulation and is an unfavorable risk factor for survival of head and neck squamous cellcarcinoma[J].Mol Oncol,2015,9(8):1704-1719.
[25]Gao H,Teng C,Huang W,Peng J,Wang C.SOX2 Promotes the epithelial to mesenchymal transition ofesophagealsquamous cells by modu⁃lating slug expression through the activation of STAT3/HIF-αsignaling[J].Int J Mol Sci,2015,16(9):21643-21657.[26]Zhao D,Pan C,Sun J,Gilbert C,Drews-Elger K,Azzam DJ,et al.VEGF Drives cancer-initiating stem cells through VEGFR-2/Stat3 signaling to upregulate Myc and Sox2[J].Oncogene,2015,34(24):3107-3119.
Effect of mono-2-ethylhexylphthalate on proliferation and migration ofneuralstem cells
HUANG Yi-xiang1,MA Xiao-xiao1,HAO Xin-rui1,LIU Jin1,LIAO Shuang-ju1,MEIHong-xia2,SU Ying2,ZHENG Li-dan2,LIN Han2
(1.Department of Anesthesiology,the Second Affiliated Hospitalof Wenzhou MedicalUniversity,Wenzhou 325000,China;2.Anesthesiology Key Laboratory of Zhejiang Province,Wenzhou 325000,China)
OBJECTIVE To investigate the effect of mono-2-ethylhexyl phthalate(MEHP)on proliferation of primary neuralstem cells(NSCs)ofrats and NE-4C cells ofmice and on the migration of NE-4C cells and the mechanism.METHODS NE-4C or NSCs were treated with MEHP 1,10,100 and 1000μmol·L-1for 72 h,respectively.The cytotoxicity was estimated with the cell counting kit-8(CCK-8).Cellproliferation was analyzed by EdU assay.The mRNA expression levels of the glucocorticoid receptor(GR),signaltransducer and activator of transcription 3(Stat3)and sex determining region Y(SRY)-box 2(Sox2)were detected by qRT-PCR.The protein expression levels of total GR,GRβ,Sox2,Stat3 and p-S tat3 were measured by Western blotting.RESULTS Cellviability of NE-4C cells and NSCs at MEHP 1000μmol·L-1was significantly decreased,which was 70.3%and 40.0%ofthe control group,respectively.EdU assay showed that MEHP 100μmol·L-1decreased NE-4C cells and NSCs by 74.8%and 12.0%(P<0.05)compared with control.The effectof MEHP on the cellmigration of NE-4C was evidenced by the factthatthe migration was obviously reduced to(63.4±2.0)%(P<0.05)after treatment with MEHP 100μmol·L-1for 72 h.The mRNA expression levels associated with proliferation and migration in NE-4C of GR,Stat3 and Sox2 in MEHP 100μmol·L-1group were down-regulated to 49.8%,26.0%and 14.0%of control(P<0.05).At MEHP 100μmol·L-1,mRNA of GR,Stat3 and Sox2 in NSCs declined to 10.0%,14.0%and 15.3%of normalcontrol.Western blotting results revealed that protein expressions of GR,GRβ,Sox2 and p-S tat3 were remarkably inhibited by MEHP 100μmol·L-1in that the relative expression of NE-4C was 0.92±0.17,0.87±0.35,0.81±0.22 and 0.62±0.24(P<0.05).The corresponding protein expression in NSCs was 0.82±0.20,0.56±0.12,0.84±0.36 and 0.53±0.20(P<0.05)when the cells were treated with MEHP 100μmol·L-1for 72 h.CONCLUSION MEHP can inhibit the proliferation and migration of NE-4C cells and NSCs possibly by decreasing Stat3 and Sox2 thatare mediated by GRβ.
mono-2-ethylhexylphthalate;neuralstem cells;NE-4C;cellproliferation;cellmigration;glucocorticoid receptor
The project supported by National Natural Science Foundation of China(81471448);National Natural Science Foundation of China for the Youth(30800323);Natural Science Foundation of Zhejiang Province(LY14H090015);Technology Bureau of Wenzhou City(Y20150230);and Technology Bureau of Wenzhou City(Y20150061)
LIN Han,E-mail:nanlinhannansh@qq.com
R114
A
1000-3002-(2016)05-0545-08
10.3867/j.issn.1000-3002.2016.05.010
2016-01-29接受日期:2016-04-07)
(本文编辑:乔 虹)
国家自然科学基金(81471448);国家自然青年科学基金(30800323);浙江省自然科学基金(LY14H090015);温州市科学技术局(Y20150230);温州市科学技术局(Y20150061)
黄意湘,女,硕士研究生,主要从事麻醉药神经发育毒性研究;林函,男,博士,副教授,主要从事麻醉药神经发育毒性研究。
林函,E-mail:nanlinhannansh@qq.com
