鱼腥藻PCC7120染色体基因对asr0757/alr0758的表达优化及其鉴定
2016-11-29陈思礼吴汇兰
陈 洁, 陈思礼, 吴汇兰
(中南民族大学 生命科学学院, 武汉 430074)
鱼腥藻PCC7120染色体基因对asr0757/alr0758的表达优化及其鉴定
陈 洁, 陈思礼*, 吴汇兰
(中南民族大学 生命科学学院, 武汉 430074)
NCBI预测鱼腥藻PCC7120染色体上的基因对asr0757/alr0758可能构成一个毒素-抗毒素系统.为研究其是否属于毒素-抗毒素系统家族,分别构建这两个基因的表达载体.用1.0 mM IPTG诱导重组菌表达,优化表达条件,并对表达出的蛋白进行纯化与western blot检测.SDS-PAGE结果显示:asr0757与alr0758在37℃下诱导6 h后,均成功诱导表达出目的蛋白asr0757(13.5 KD)和alr0758(17.9 KD).抗毒素表达量较好,毒素alr0758表达量较少.通过设置诱导时间梯度和IPTG浓度梯度优化毒素基因表达条件,优化结果显示:毒素基因alr0758在28℃,IPTG浓度为0.4 mM,诱导10 h时有最大表达量.蛋白纯化与western blot结果证实诱导表达的蛋白为目的蛋白.
鱼腥藻PCC7120;asr0757/alr0758; 表达; 优化; 鉴定
蓝藻是一种存在于不同的环境中的古老而又多变的原核生物[1],这种能存在于不同环境中的特性反映了其对多变与极端环境的强大适应能力[2].鱼腥藻PCC7120作为蓝藻中的模式生物,其基因组测序工作于2001年由日本Kazusa研究所最早完成[3].当前,对于蓝藻的分子生物学研究主要集中在基因克隆,表达及功能鉴定与表达调控分析等方面[4].
有研究表明鱼腥藻染色体上存在大量毒素-抗毒素系统(TAS,toxin-antitoxin system)[5],TAS的存在有利于鱼腥藻更好地适应环境胁迫.TAS由位于同一个操纵子下的具有多个碱基重叠的两个基因组成,一个编码稳定的毒素蛋白,另一个编码不稳定的抗毒素蛋白[6].当前对毒素-抗毒素系统的功能的看法各异,Engelberg-Kulka等[7]通过实验证明TAS在外界压力条件下介导细胞程序性死亡,Gerdes等[8]通过对TAS系统在环境胁迫下抑制细胞生长的研究,提出了“生长调节模型”.
目前绝大多数细菌染色体上预测出的TAS基因对尚未经过实验验证,asr0757/alr0758是其中之一.本实验是首次对其进行系统的表达,并对其表达条件进行优化,通过蛋白纯化与western blot鉴定表达产物.具体而言,首先通过分子生物学方法成功地分别构建基因对asr0757与alr0758的表达载体,其后使用IPTG的诱导表达出带有组氨酸标签的目的蛋白,最后优化诱导表达条件,并对蛋白进行纯化以及western blot鉴定.本实验所构建的生物化学与分子生物学实验方法,为鱼腥藻染色体上潜在TAS基因的研究提供参考,创造较好的研究条件,同时对于完善 TAS系统理论,补充发展其分子机制具有一定的意义.
1 材料与方法
1.1 材料与试剂
本实验所用藻种,鱼腥藻PCC7120(Anabaenasp. PCC7120)购自中国科学院水生物研究所淡水藻种库(FACHB).宿主菌E.coilDH5α 和E.coilBL21(DE3)为本实验是保存的菌种.克隆载体pMD18-T购自Takara公司.表达载体pET30a(+)为本实验室保存.PCR引物合成及测序由南京金斯瑞生物科技有限公司负责.一抗TubaiB Rabbit ployAb(兔源抗His-Tag抗体);二抗,Goat anti-Rabbit IgG(辣根过氧化物酶标记山羊抗兔IgG)购自proteintech公司.
1.2 实验方法
1.2 .1PCC7120 基因组 DNA 提取 本实验蓝藻PCC7120基因组的提取方法请参照文献[9].
1.2 .2克隆载体pMD18-T-asr0757 和 pMD18-T-alr0758构建 基因的克隆按照分子生物学操作标准方法进行[10],设计引物并在引物中添加酶切位点,以鱼腥藻PCC7120的DNA为模板,运用Touch-Down PCR扩增得到asr0757目的基因片段和alr0758目的基因片段,PCR引物见表1.PCR反应程序如下:94℃预变性4 min;94℃变性1 min,退火温度由74℃开始每循环降低0.5℃,退火反应40 s后于72℃延伸40 s,15个循环;94℃变性1 min,退火温度由74℃开始每循环降低1.0℃,退火反应40 s后于72℃延伸40 s,20 个循环;72℃保持7 min.PCR产物纯化后与pMD18-T连接并导入E.coilDH5α中,涂平板蓝白斑筛选,阳性克隆经过菌落PCR以及双酶切鉴定后送测序.测序正确后保存质粒,分别命名为 pMD18-T-asr0757和pMD18-T-alr0758.

表1 PCR引物及序列
注:下划线为括号内对应限制性内切酶识别的酶切位点序列.
1.2 .3重组表达载体 pET-30a-asr0757,pET-30a-alr0758的构建BamH1和EcoR1双酶切测序正确的质粒pMD18-T-asr0757、pMD18-T-alr0758以及表达载体pET-30a(+),回收各自双酶切目的片段,回收的基因片段asr0757与alr0758分别与经过相同双酶切的pET-30a(+)连接,转化E.coilBL21(DE3),涂于含有50 μg/mL 硫酸卡纳霉素的LB 平板筛选阳性克隆,经菌落PCR、质粒双酶切及测序检测正确后分别命名为pET-30a-asr0757与pET-30a-alr0758.
1.2 .4目的基因asr0757,alr0758的诱导表达 重组质粒 pET-30a-asr0757与pET-30a-alr0758的BL21菌种分别接种于含50 μg/mL 硫酸卡纳霉素的LB 液体培养基中,在37℃摇床培养约3 h至 OD600=0.4~0.6后加入1 mM 的IPTG,于220 rpm转速下诱导6 h,收集菌体进行SDS-PAGE电泳检测重组蛋白的表达.
1.2 .5毒素基因alr0758诱导表达条件的优化
1)最佳诱导时间优化实验.含重组质粒pET-30a-alr0758的BL21菌37℃培养至OD600=0.4~0.6 时,加入 IPTG,使其终浓度为1.0 mmol/L,于28℃诱导表达,在24 h内每2 h收集一次菌体进行SDS-PAGE检测.2)最佳 IPTG 浓度优化实验.含重组质粒pET-30a-alr0758的BL21菌37℃培养至OD600=0.4~0.6时,加入IPTG 的终浓度梯度分别为0,0.2,0.4,0.6,0.8,1.0,1.2 mM,在28℃下诱导最佳时长收集菌体进行SDS-PAGE电泳检测蛋白表达情况.
1.2 .6目的蛋白纯化与western blot检测 诱导基因asr0757与alr0758表达,收集菌体进行超声波破碎处理,上清过Ni-NTA柱,洗脱后得到目标蛋白,将得到的蛋白进行SDS-PAGE电泳,待胶上蛋白电转至硝酸纤维素膜上用WB封闭液封闭,在摇床上缓慢摇动,室温封闭60 min,加入1∶5000稀释的兔抗6×His的多抗,4℃冰箱孵育过夜.次日取出继续摇动1~2 h.加入Western洗涤液,在摇床上缓慢摇动洗涤5~10 min.吸尽洗涤液后,再加入洗涤液,洗涤7~10 min.共洗涤3~4次. TBS洗涤后,加入1∶10000稀释的辣根过氧化物酶标记的山羊抗兔多克隆体,室温反应1.5 h,充分洗涤,加入新鲜配制的二氨基联苯胺(DAB)显色液,待显色条带清晰后立即用蒸馏水洗涤硝酸纤维素膜,同时设置对照组:BL21菌和含pET30a空载体的BL21转化菌.
2 结果与分析
2.1 鱼腥藻PCC7120总DNA的提取
本实验基因组DNA的提取主要是SDS裂解法,并对传统的酚-氯仿法作了改进,总共提取7管总DNA,为后续的PCR,以及菌落PCR检测提供需要,总DNA提取后琼脂糖凝胶电泳检测显示所有的条带在预计目的条带处均出现较亮的单一条带,如图1所示,表明鱼腥藻PCC7120总DNA提取成功.

M:DL5000标准marker;1~7:鱼腥藻PCC7120总DNA.图1 鱼腥藻PCC7120 DNA提取Fig.1 DNA extraction of Anabaena sp. PCC7120
2.2 克隆载体pMD18-T-asr0757 和 pMD18-T-alr0758构建
Touch-down PCR扩增的基因alr0758与asr0757的PCR产物经1.0%的琼脂糖凝胶电泳鉴定结果与预期大小相符:asr0757大小为210 bp和alr0758为342 bp(图2) .蓝白斑筛选阳性克隆双酶切检测(图3)结果显示在预测大小处有单一的目的条带,双酶切检测中有2条带,分别为目的条带与空T载体条带(2 692 bp).检测正确的克隆菌送往金斯瑞测序,测序结果与NCBI 所公布的asr0757 和alr0758 序列Blast 比对,结果显示碱基完全匹配,表明克隆载体pMD18-T-asr0757 和 pMD18-T-alr0758构建成功.
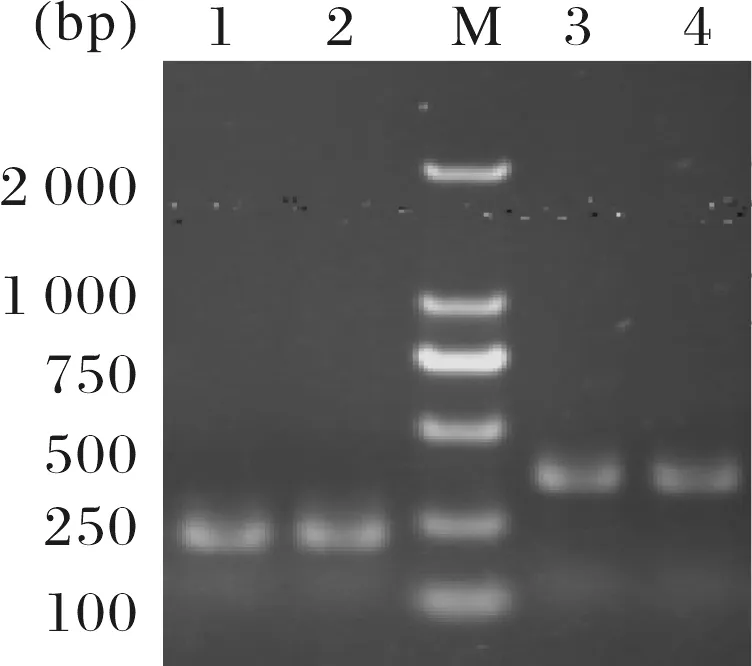
M:DL5000标准marker;1~2:asr0757 PCR 产物;3~4:alr0758 PCR 产物.图2 PCR电泳检测图Fig.2 Examination of PCR products by agar electrophoresis

M:DL5000标准marker;1~2:克隆质粒pMD18-T-asr0757双酶切产物;3~4:克隆质粒pMD18-T-alr0758双酶切产物.图3 pMD18-T-asr0757 和pMD18-T-alr0758双酶切电泳检测Fig.3 Examination of pMD18-T-asr0757 and pMD18-T-alr0758 with the double enzyme digestion
2.3 重组表达载体 pET-30a-asr0757,pET-30a-alr0758的构建
选用双酶切位点BamH1和EcoR1,对重组克隆载体pMD18-T-asr0757 和pMD18-T-alr0758 进行双酶切回收,连接经相同酶双酶切后的pET-30a转化BL21(DE3),挑取阳性克隆菌落进行PCR检测(见图4)以及双酶切检测(见图5),琼脂糖凝胶电泳结果显示在预测大小处出现目标条带(asr0757 为210 bp,alr0758为342 bp).双酶切检测图显示两条条带,一条为目的带另一条为pET-30a空载条带(5 422 bp),送金斯瑞公司测序,测序结果比对显示目的片段完全正确插入,重组表达载体 pET-30a-asr0757与pET-30a-alr0758构建成功.
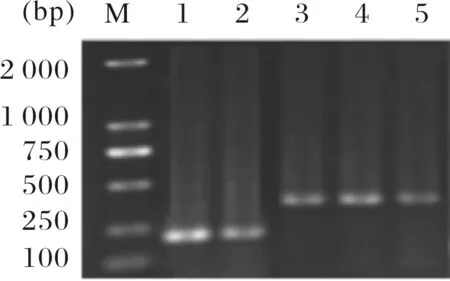
M:DL5000标准marker;1~2:表达重组菌pET-30a-asr0757菌落PCR产物;3~5:表达重组菌pET-30a-alr0758菌落PCR产物.图4 表达载体pET-30a-asr0757与pET-30a-alr0758菌落PCR检测Fig.4 Colony PCR detection of the expression vector pET-30a-asr0757 and pET-30a-alr0758

M:DL5000标准marker;1:重组表达质粒pET-30a-asr0757双酶切产物;2:重组表达质粒pET-30a-alr0758双酶切产物图5 重组表达质粒pET-30a-asr0757,pET-30a-alr0758双酶切检测Fig.5 Detection of expression vectors pET-30a-asr0757 and pET-30a-alr0758 with double enzyme digestion
2.4 目的基因asr0757,alr0758的诱导表达
表达菌pET-30a-asr0757与pET-30a-alr0758分别在37℃与28℃下,加入1.0 mM IPTG,220 rpm转速下诱导表达6 h后进行SDS-PAGE电泳检测.电泳结果显示,pET-30a-asr0757与pET-30a-alr0758分别在约13.5 kD(图6)和17.9 kD(图7)处有表达条带,抗毒素表达量较好,毒素表达量则较少.抗毒素基因asr0757与毒素基因alr0758表达的蛋白预测大小分别为8.068 kD,12.533 kD,加上空载体pET-30a自身带有的组氨酸标签与酶切位点,产生的融合蛋白大小分别为asr0757(13.5 kD)和alr0758(17.9 kD),SDS-PAGE胶上显示的诱导条带的大小与预测的目的基因诱导后表达的融合蛋白的大小相符合.

M:预染蛋白marker;1:pET-30a菌未诱导;2:pET-30a菌诱导表达; 3: 重组菌pET-30a-asr0757未诱导;4:重组菌pET-30a-asr0757诱导表达.图6 重组菌pET-30a-asr0757诱导表达产物SDS-PAGE检测Fig.6 Examination of recombinant protein pET-30a-asr0757 by SDS-PAGE
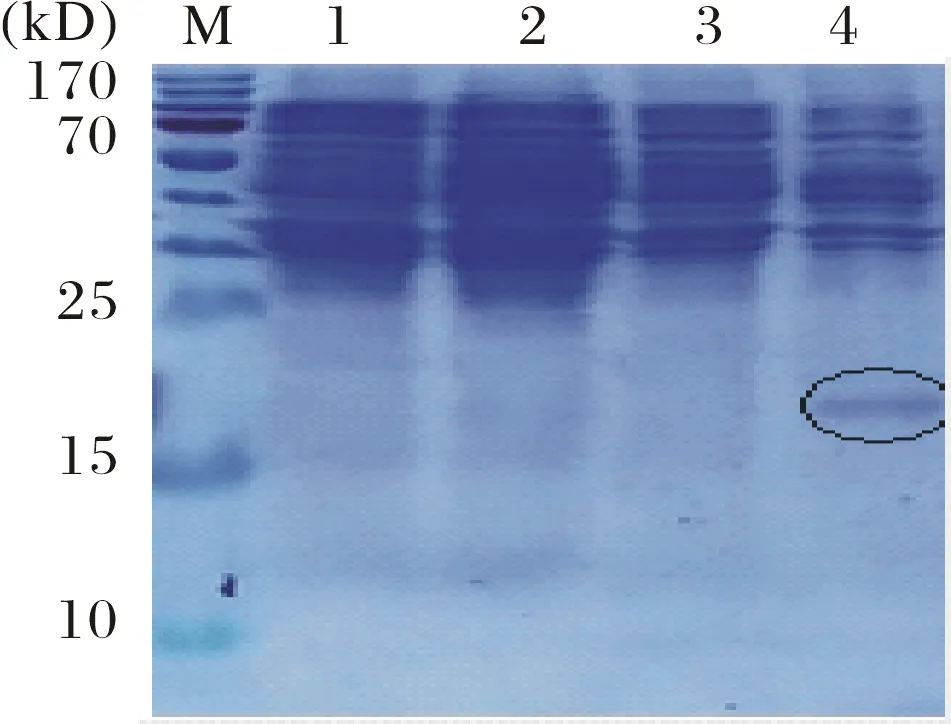
M:预染蛋白marker;1:pET-30a菌未诱导;2:pET-30a菌诱导表达;3:重组菌pET-30a-alr0758未诱导;4:重组菌pET-30a-alr0758诱导表达图7 重组菌pET-30a-alr0758诱导表达产物SDS-PAGE检测Fig.7 Examination of recombinant protein pET-30a-alr0758 by SDS-PAGE
2.5 毒素基因alr0758诱导表达条件的优化
由图7可知,毒素基因表达量较少,为后续蛋白纯化的需求,对毒素基因alr0758表达条件进行优化,主要从诱导时间梯度以及IPTG诱导浓度梯度这两个方面进行优化.
2.5 .1最佳诱导时间优化实验 图8为不同诱导时间对重组蛋白表达量的影响. 重组菌pET-30a-alr0758在诱导2 h时即有较明显的表达,在10 h时有最大表达量,之后延长诱导表达的时间蛋白的诱导表达量基本保持不变或呈减弱趋势,故重组蛋白pET-30a-alr0758的最佳诱导时间为10 h.
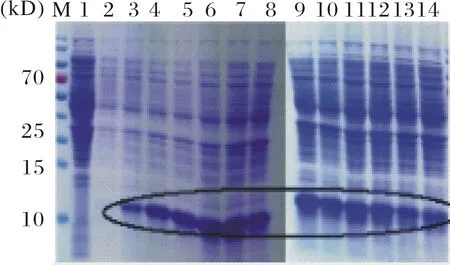
M:预染蛋白marker;1:空载体pET-30a诱导表达;2~14:诱导时间依次为0,2,4,6,8,10,12,14,16,18,20,22,24 h的pET-30a-alr0758重组菌图8 不同诱导时间对重组蛋白pET-30a-alr0758表达量的影响Fig.8 Influence of induction time on protein expression of pET-30a-alr0758
2.5.2最佳 IPTG 浓度优化实验 IPTG终浓度梯度诱导表达结果如图9所示,pET-30a-alr0758重组菌于28℃培养10 h,当IPTG诱导终浓度为0.4 mM时有最大的诱导表达量,故pET-30a-alr0758的IPTG最佳诱导浓度为0.4 mM.

M:预染蛋白marker;1:空载体pET-30a诱导表达;2~8:IPTG 诱导浓度依次为0,0.2,0.4,0.6,0.8,1.0,1.2 mM的pET-30a-alr0758重组菌.图9 不同IPTG 诱导浓度对重组蛋白pET-30a-alr0758表达量的影响Fig.9 Influence of IPTG concentration on protein expression of pET-30a-alr0758
2.6 目的蛋白纯化与western blot检测
重组表达菌在诱导表达过Ni-NTA柱后收集洗脱蛋白进行SDS-PAGE检验(设置对照组),结果显示在预测大小处出现单一的目标条带,如图10(A)所示,asr0757(13.5 kD)和alr0758(17.9 kD),大小与理论值相符,而实验对照组BL21和含pET-30a空载体的BL21转化菌则没有出现目标条带,表明纯化效果较好.western blot结果如图10(B)所示,重组菌pET30a-asr0757 与pET-30a-alr0758诱导纯化的蛋白分别在约13.5 kD和17.9 kD处出现明显的特异性条带而实验对照组同样在相同的位置没有出现特异性条带,说明纯化所得蛋白为目的蛋白.

A) M:预染蛋白marker;1:pET-30a-asr0757重组菌;2:pET-30a-alr0758重组菌;3:含空载pET-30a的BL21菌;4:BL21菌;B) 1:pET-30a-asr0757重组菌;2:pET-30a-alr0758重组菌;3:含空载pET-30a的BL21菌;4:BL21菌.图10 重组蛋白纯化(A)与western blot鉴定(B)Fig.10 Purification of the recombinant proteins(A) and identification by western blot(B)
3 讨论
尽管毒素-抗毒素系统广泛地存在于细菌中,且不同来源的毒素-抗毒素基因的同源性各不相同或者相差很大,但已有的生物学分析显示其遗传结构以及功能非常的相似[11].TAS根据毒素性质的不同,可以分为3种类型:Ⅰ型、Ⅱ型与Ⅲ型.Ⅱ型TAS分布最为广泛,研究较多,比较常见的Ⅱ型 TAS有MazF和RelE,本文研究的基因隶属MazEF家族,大肠杆菌染色体上的MazEF是研究最为清楚的II型TAS之一,其中的毒素蛋白MazF是具有序列特异性的核酸内切酶[12],当细胞遭遇外界环境胁迫时,不稳定的的抗毒素蛋白MazE被降解,稳定的毒素蛋白游离出来作用于细胞,使细胞生长抑制或死亡[13].
本文研究的基因对asr0757/alr0758通过前期NCBI Blast比对得知其与大肠杆菌中的TAS系统MazEF具有较高的同源性,且遗传结构相同,asr0757和alr0758具有14个碱基的重叠区域,通过这对基因诱导表达产物的研究以及在染色体上遗传结构特征,初步判定基因asr0757/alr0758也具有TAS基因功能构成TA系统.
成功构建的表达载体诱导表达后经SDS-PAGE检测,结果显示,基因对asr0757与alr0758均成功表达,但是毒素基因alr0758表达量较小,含有毒素基因alr0758的重组菌pET-30a-alr0758在37℃下,220 rpm时生长非常缓慢且诱导后几乎没有目的蛋白的产生,但是在28℃,160 rpm诱导条件下目的蛋白表达量明显增多,与含抗毒素基因的重组菌pET-30a-asr0757相比较,无论是活化阶段还是诱导阶段,pET-30a-alr0758明显比pET-30a-asr0757长势缓慢,这也在一定程度上显示了毒素基因alr0758的毒性作用,同时加入IPTG诱导的实验组菌株比未加入IPTG的对照组长势慢,说明IPTG对细胞生长也具有一定的毒性作用,pET-30a-alr0758在28℃,160 rpm,蛋白表达量较为可观,表明低温低速时诱导可以增加可溶性蛋白量[14],但是温度若过低时藻类生长速度缓慢,蛋白的诱导表达困难或不表达.由于蓝藻体内存在的大量TAS使其应对环境胁迫时更加有利,本实验的结果是对TAS家族基因的一个补充,具有一定的理论以及实际意义,期望能够为后续染色体上其它可能的TAS基因的探究提供一定的实验参考.
[1] WHITTON B. The ecology of cyanobacteria:Their success in time and space[M].Dordrecht:Kluwer Academic Publishers, 2000:12-35.
[2] TANDEAU N, HOUMARD J. Adaptation of cyanobacteria to environmental stimuli:New steps towards molecular mechanisms[J]. FEMS Microbiol Lett, 1993, 104(1-2): 119-189.
[3] KANEKO T, NAKAMURA Y, WOLK C P, et al. Complete genomic sequence of the filamentous nitrogen-fixing cyanobacterium Anabaena sp. strain PCC7120[J]. DNA Research, 2001, 8(5):205-213.
[4] 席 超,王春梅,施定基.蓝藻基因工程应用研究进展[J].中国生物工程杂志, 2010, 30(3):105-111.
[5] 常家宁,宁德刚.蓝细菌PCC6803染色体上的一对毒素-抗毒素基因的鉴定[J].微生物学通报, 2009, 36(1):2030-2035.
[6] GERDES K, CHRISTENSEN S K, LOBNER-OLESEN A. Prokaryotic toxin-antitoxin stress response loci[J]. Nat Rev Microbiol, 2005, 3(5): 371-382.
[7] ENGELBERG-KULKA H, AMITAI S, KOLODKIN-GAL I, et al. Bacterial programmed cell death and multicellular behavior in bacteria[J]. PLoS Genet, 2006, 2(5):1518-1526.
[8] CHRISTENSEN S K, MIKKELSEN M, PEDERSEN K, et al. RelE, a global inhibitor of translation, is activated during nutritional stress[J]. Proc Natl Acad Sci,2001, 98(25):14328-14333.
[9] 徐旭东,王业勤.鱼腥藻-大肠杆菌CAT启动子探测质粒的构建[J].中国科学院研究生院学报, 1993, 10(2):203-209.
[10] 萨姆布鲁克J,拉塞尔D W.分子克隆实验指南精编版[M].3版.黄培堂,王恒樑,周晓巍,等译.北京:科学出版社, 2002:518-522.
[11] PANDEY D P, GERDES K.Toxin-antitoxin loci are highly abundant in free-living but lost from host-associated pro-karyotes[J].Nucleic Acids Res, 2005, 33(3):966-976.
[12] CHRISTENSEN S K, PEDERSEN K, HANSEN F G, et al.Toxin-antitoxin loci as stress response elements:ChpAK/MazF and ChpBK cleave translated RNAs and are counteracted by tmRNA[J].J Mol Biol, 2003, 332(4):809-819.
[13] YAMAGUCHI Y, PARK J H, INOUYE M.Toxin-antitoxin systems in bacteria and archaea[J].Annu Rev Genet, 2011, 45:61-79.
[14] REN Z L, DU G C, CHEN J, et al. Strategies for high-level expression of recombinant protein inEschefichiacoil[J]. China Biotechnology, 2007, 27(9):103-109.
Optimized expression of chromosomal genepairasr0757/alr0758 inAnabaenasp. PCC 7120 and its identification
CHEN Jie, CHEN Sili, WU Huilan
(College of Life Science, South-Central University for Nationalities, Wuhan 430074)
Chromosomal gene pairasr0757/alr0758 inAnabaenasp. PCC 7120 was predicted to belong to the toxin-antitoxin system (TAS) with homology analysis by software NCBI. To verify this, expression vectors were constructed for the above two genes, respectively. The vectors were induced by 1.0 mM isopropyl β-D-1-thiogalactopyranoside(IPTG).Then, the inducing conditions were optimized, after which the proteins were purified and identified through western blot. Result of SDS-PAGE revealed that proteins of genesasr0757/alr0758 were expressed successfully after induced for 6 h at 37℃. The expression level ofasr0757(13.5 kD) appeared to be higher than that ofalr0758(17.9 kD). Therefore, induction time gradient and IPTG concentration were optimized to improve the expression level ofalr0758. Results showed that genealr0758 obtained relatively large expression quantity after 10 h induction at 37℃ with 0.4 mM IPTG. Protein purification and western blot results showed that the expression proteins were the target proteins.
Anabaenasp.PCC7120;asr0757/alr0758; expression; optimization; identification
2015-11-04.
国家自然科学基金项目(31001099/C190101);中央高校自然科学基金项目(CJSl3003,CJS13004);中南民族大学微生物与生物转化重点实验室项目(XJS09002);“十二五”国家级中南民族大学民族药学实验教学中心建设项目.
1000-1190(2016)02-0263-06
Q812
A
*通讯联系人. E-mail: sili.chen@163.com.
