天然甲壳素热裂解制备精细化学品的研究
2016-11-29胡新良
王 勤, 胡新良
(湖北工程学院 化学与材料科学学院, 湖北 孝感 432100)
天然甲壳素热裂解制备精细化学品的研究
王 勤, 胡新良*
(湖北工程学院 化学与材料科学学院, 湖北 孝感 432100)
为了充分利用甲壳素这种丰富的天然资源,将甲壳素进行了热解,用热重量分析仪和示差扫描热量计来观测此分解反应,所得的挥发产物用红外光谱进行即时表征.用气相色谱-质谱(GC-MS)对这些挥发性物质进行进一步的鉴定.可以确认在挥发性化合物产品中,有大量的呋喃和吡咯类物质,其中乙酰胺是最主要的成分,其总量超过了其他挥发性化合物的总和.因此,甲壳素具有大批量制备精细化学品如乙酰胺,呋喃和吡咯的潜在价值.推测了甲壳素热解生成挥发性产物的反应机理.在高温下,乙酰胺的生成是由于侧链的断开,裂解以及产品挥发导致的.
甲壳素; 热解; 挥发性化合物; 乙酰胺; 气相色谱-质谱联用; 热解机理
甲壳素是自然界中含量仅次于纤维素的一种天然多糖[1].它广泛存在于甲壳类动物如螃蟹与虾类的壳、昆虫类的角质层、以及真菌的细胞壁中.据统计,每年在自然界中天然合成的这种生物高分子高达1011吨[2].对于盛产甲壳类水产品的国家来说,甲壳的废弃处理是一个很大的难题.甲壳素由2-乙酰氨基-2-脱氧-D-葡萄糖(N-乙酰-D-葡萄糖胺)组成.因其特殊的生物化学特性,在过去的20年中甲壳素和它的脱乙酰产物壳聚糖已经在农业、医药、功能保健食品、环保、生物技术以及纺织业中得到了广泛的应用[3-6].
作为一种环保的可再生资源,甲壳素及其在某种环境中的降解行为已经得到了大量研究.甲壳素由于各种环境因素导致的降解引起了链的断裂,释放出挥发性产物[7-8].在高温下,甲壳素常常碳化,且产生挥发性化合物[9-10].虽然已有一些甲壳素的热降解动力学研究[11-12],但是有关甲壳素生产精细化学品的研究经验仍然十分有限.
本课题的主要目的就是探究甲壳素热裂解生成精细化学品的反应过程.用热重量分析法和差示扫描量热法监测了天然与合成化合物的热解现象.红外光谱法(FT-IR)是表征热解产物的一种重要方法[13-14].在本研究中采用热重法与差示扫描量热法联用研究甲壳素在氮气中的热解行为,所生成的挥发性产物用红外和热分析仪通过热线连接进行鉴定.为了进一步确认甲壳素的热解产物,采用气相色谱和质谱联用进行表征,发现主要的热解产物是乙酰胺,呋喃和吡咯.
1 实验部分
1.1 材料
甲壳素是由中国金贝生化股份有限公司提供,没有进行进一步纯化.其他化合物从Sigma化学公司购买.
1.2 甲壳素的非等温热解和气体产物的红外表征
TG-DSC与FT-IR(Thermo Nico-let 380)在热分析仪(SDT-Q600)上进行联用.
取5.0 mg甲壳素放在空的氧化铝坩埚内.TG表面的加热速率为10.0 ℃/min,氮气作为载气(纯度>99.999%),流速为200 mL/min.用于连接TG和FTIR的转移线是1.0 m长的不锈钢管,内径为2 mm,温度保持在200℃.红外分光光度计的光电池体积为45 mL,路径长度为200 mm,温度也保持在200℃.红外光谱的分辨率为8 cm-1,每光谱扫描32次,使时间分辨率达4.32 s.气体产物从炉内到达光电池的滞后时间为7 s.
1.3 甲壳素的热裂解曲线以及GC/MS分析
将0.5 g干燥的甲壳素放在100 mL的不锈钢烧瓶中,用油泵抽真空.将烧瓶密封好,在油浴中恒温1 h.冷却至室温后,加入10 mL甲醇,用高效液相色谱法将甲壳素分解产物进行分级分离.有机相放在无水硫酸钠中过滤,干燥.滤液保留,用于GC-MS分析.
气相色谱仪采用Varian Model 3400与FID联用,非极性石英玻璃毛细管柱(DB-1, 30 m × 0.25 mm (i. d.), 膜厚度0.25 μm: J&W Scientific, Folsom, CA).柱温设置为从80℃加热到270℃,加热速率为3 ℃/min.注射器和检测器的温度保持在279℃.氮气载气流速为1 mL/min.注射样品体积为1 μL, 分流比大小为25∶1. GC/MS分析仪由HP Model 5790 GC和HP 5970A质谱仪组合而成.毛细管柱和温度设置与气相色谱分析保持一致.质谱的电离电压为70 eV,质检范围是33到500.定量分析根据GC/FID检测结果所得到的数据进行,而定性分析根据GC/MS所得结果进行.化合物的图谱鉴定参考威利质谱库.
1.4 定量分析
挥发性化合物的流量由相应的色谱峰面积Av、内标物重量Wis和峰面积Ais,以及裂解产物的流量Q来计算,计算公式是:Y=fWisAv/AisQ,f是内标物影响因子.平均影响因子f由以下方法测定:取1.00 mL的挥发性化合物(500 mg/L甲醇溶液)和1 mL的4-氯苯甲醛(500 mg/L的甲醇溶液作内标物)混合,然后用GC/MS联用分析.影响因子的算法是:f=Ais/Av,其中Ais是内标物峰面积,Av是挥发物峰面积.在这项研究中,采用4-氯苯甲醛作为甲壳素热解产物的定量内标物,是因为它的结构与需要鉴定的挥发性化合物非常相似.每种样品至少检测3次,来证实测试的重现性良好.
2 结果与讨论
2.1 甲壳素的非等温热解
2.1 .1甲壳素的TG与DSC分析 为了研究甲壳素的热解行为,将它在氮气流中从50℃加热到500℃,所得相应的TG,DSC曲线如图1所示.甲壳素最主要的特征峰是254~380℃之间的一个较强的发热峰,伴随着70.12%的失重,这说明甲壳素在254℃开始热解并生成挥发性物质.这种放热效应可能是因为C—O—C主链的分解和一些挥发性化合物比如二氧化碳的挥发导致的.
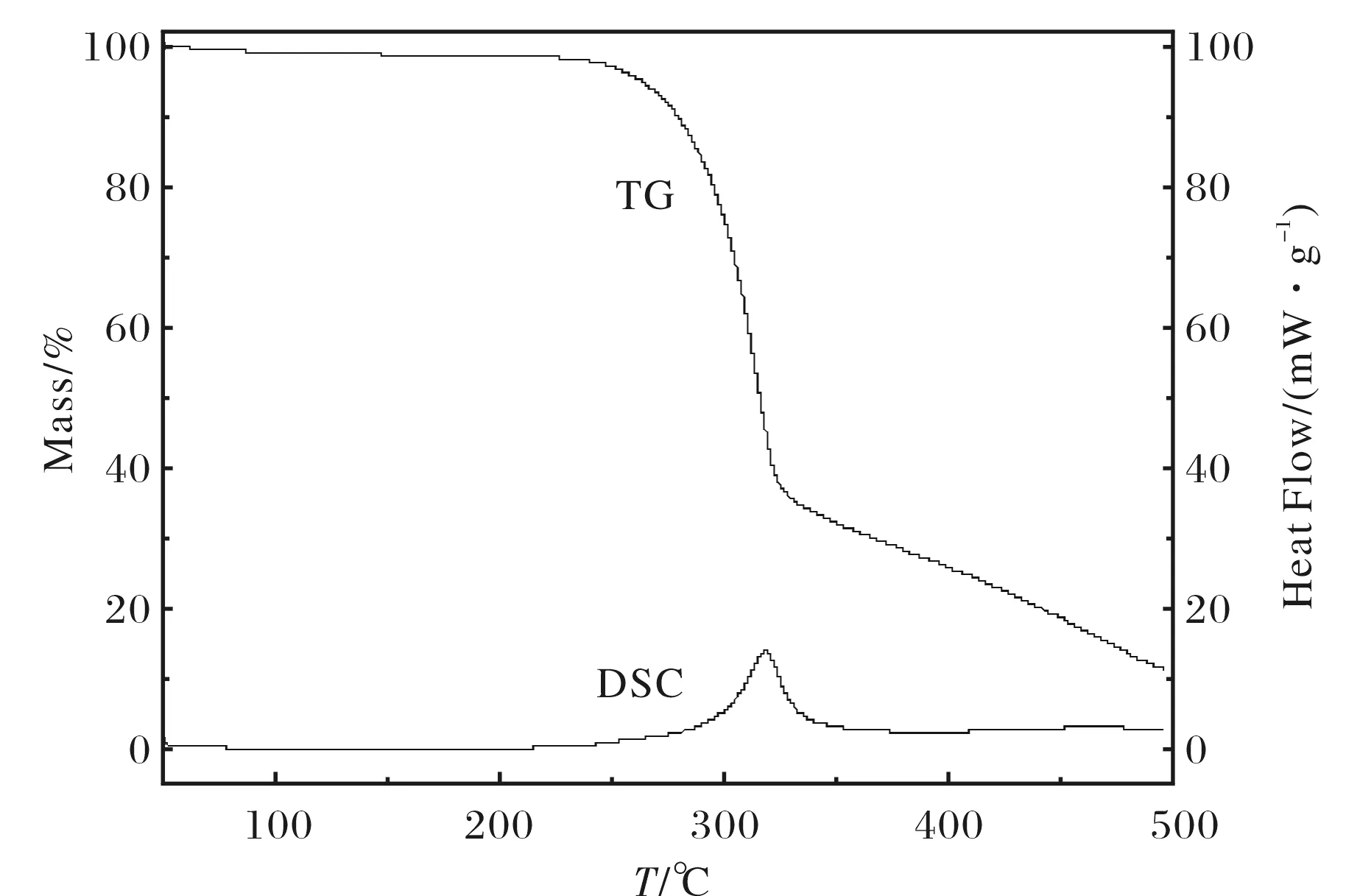
图1 甲壳素在氮气流中的TG-DSC曲线Fig.1 TG and DSC curves of chitin in dynamic nitrogen
2.1 .2气相产物的红外表征 甲壳素热降解所得到的气体产物用红外光谱进行在线分析.图2(a)记录了在不同加热时间气体产物的红外光谱.在所有图形中都可以看到在22.56~27.11 min这个时间段检测到了挥发性物质.红外光谱中尤其明显的特征带是1 797.5 cm-1, 1 773.6 cm-1和1 182.7 cm-1的3个强尖峰,分别代表伯胺,仲胺,季胺.在高温下,乙酰胺由甲壳素的2-乙酰胺-2-脱氧-D-吡喃葡萄糖单元裂解产生.如图2b所示,两个强尖峰出现在2357.3 cm-1和669.0 cm-1,分别是CO2的伸缩振动和弯曲振动带.由于C—O—C键能比C—C键能小,所以在氮气氛中,二氧化碳是甲壳素主链上的吡喃糖环被热破坏产生的[11].因此,最有可能的是甲壳素的分解是从甲壳素主链上一个薄弱环节上的C—O—C键断裂开而开始的,而单体的解聚合从末端自由基开始.
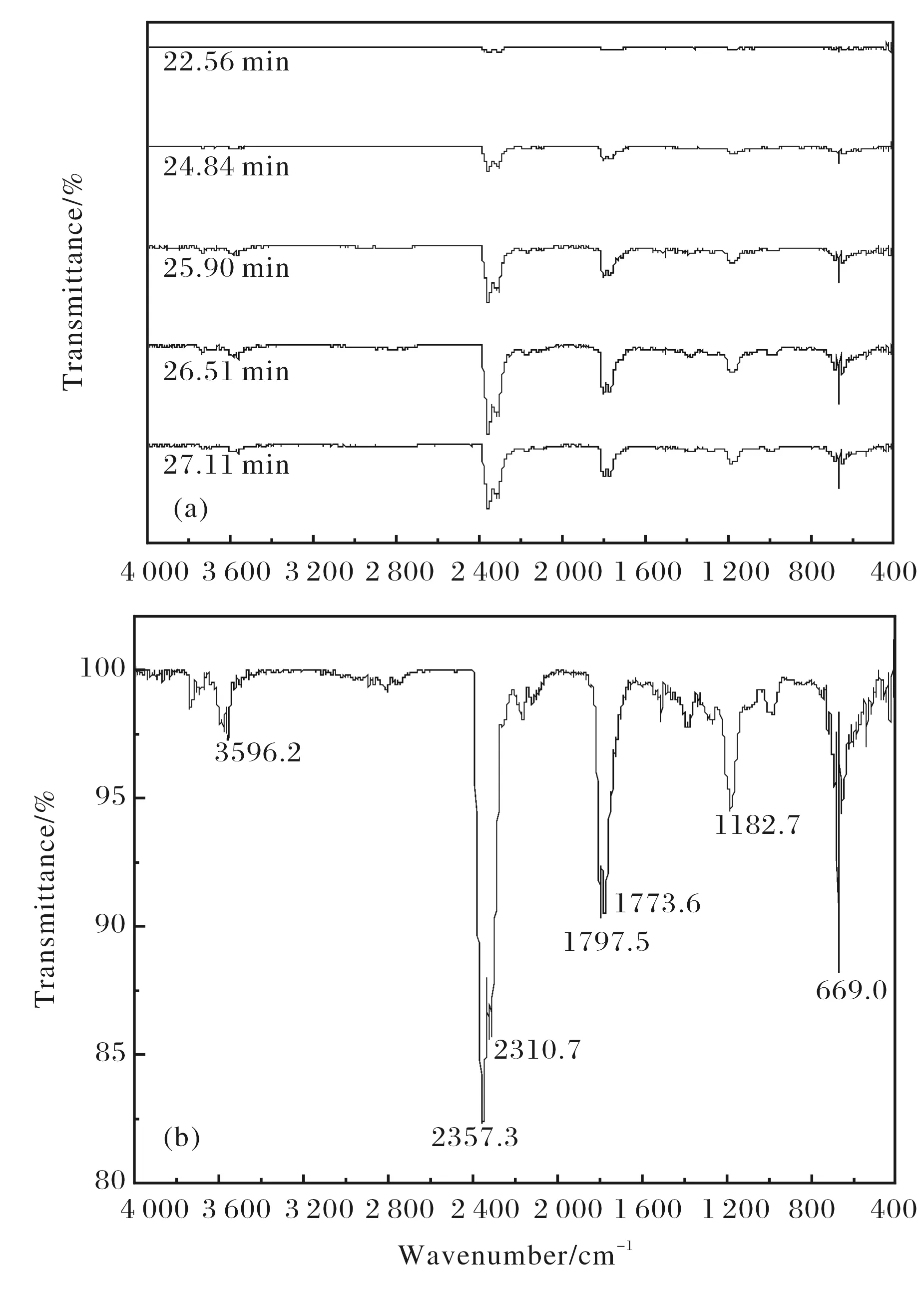
(a)甲壳素在不同加热时间的热解产物红外光谱图;(b)26.51 min时的红外光谱放大图图2 热裂解产物红外光谱图Fig.2 The IR spectrum of pyrolysis products
2.2 甲壳素的热裂解曲线以及挥发性化学物质的GC/MS分析
2.2.1热解温度对挥发性产物的浓度及分布的影响 一般而言,如果甲壳素在高温下完全分解,每一个N-乙酰-D-葡萄糖胺单元都能产生一个乙酰胺分子.图3显示了甲壳素热解产生挥发性物质的气相色谱图,其具体成分如表1,包括乙酰胺,呋喃和吡咯类.主要的产品是:乙酰胺、呋喃甲醛、2-羟甲基-4H-吡喃-4-酮、1H-吡咯-2-甲醛、呋喃甲醇按照降序排列.产品含量由每克甲壳素产生的挥发性产品毫克数表示.
为了探讨挥发性化合物浓度和加热温度之间的关系,将甲壳素加热到260℃到360℃之间不同的温度1 h,产品被收集后用来进行GC-MS分析.图4显示主要产物乙酰胺的浓度与温度的关系.260℃时每克甲壳素热解生成的乙酰胺浓度是43.8 mg/g,而360℃时每克甲壳素热解生成的乙酰胺浓度为48.1 mg/g. 总之,乙酰胺的浓度在260℃到360℃之间随着温度的增加增长比较缓慢,这说明了主要产物乙酰胺是在热解的初级阶段生成的.乙酰胺的收率达到16.2%.将热解之后所得到的炭灰收集起来用甲醇洗涤3次.碳化真空干燥12 h之后,炭灰质量变为208 mg,说明260℃时甲壳素热解失去了60%的重量.从表1可以看出300℃时甲壳素热解所生成的所有挥发性产物与260℃时所得的产品类型及洗脱顺序完全一致,只有浓度,保留时间稍有区别.根据这些结果,可以得出一个结论,就是甲壳素的热解温度对挥发性产物的浓度和分布没有太大影响.在甲壳素中,乙酰胺基团是侧链取代基,其热稳定性是由C—N键和氢键决定的.如果热解温度可以使C—N键和氢键断开的话,甲壳素中的乙酰胺基基团就可以被释放出来.因此,一旦甲壳素的分解反应已经发生,乙酰胺浓度就不再与热解温度的升高有太大关联了.
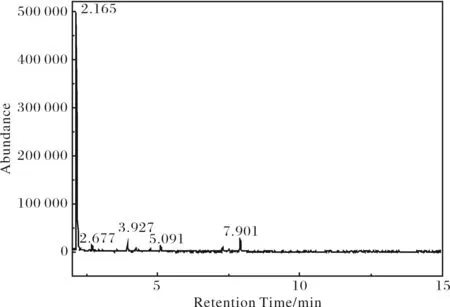
图3 甲壳素在300℃时热解产生的挥发性产物气相色谱图Fig.3 Gas Chromatography spectrum of volatile compounds generated from pyrolysis of chitin at 300,260℃.

表1 300℃,260℃时鉴别出来的甲壳素热解挥发性产物[15-17]

图4 在不同温度下甲壳素热解生成的乙酰胺浓度Fig.4 Concentrations of acetamide generated from the pyrolysis of chitin at different temperature
2.2 .2氧气对挥发性产物及其分布的影响 图5是氧气流中甲壳素热解挥发性产物的气象色谱图.在氧气流当中主要的挥发性产物仍然是乙酰胺.然而,挥发性产物的种类仍然很复杂,有一些很难鉴定出来.在氧气流中甲壳素的热解有些副反应和次级反应.因此,氧气显著影响了挥发性产品的分布和浓度.

图5 氧气流中260℃甲壳素的热解挥发性产物气相色谱图(氧气流速100 mL/min)Fig.5 Gas Chromatography spectrumof volatile compounds generated from pyrolysis of chitin at 260℃ in a stream of oxygen(The flow velocity of oxygen is 100 mL/min)
2.3 有关热解反应机理的讨论
甲壳素是一种由β-(1,4)-2-乙酰氨基-2-脱氧-D-葡萄糖组成的线性聚合物.甲壳素热解之后,生成的挥发性产物有乙酰胺,吡咯和呋喃等.其中乙酰胺是挥发成分的主要产品,它的总量超过了其他被鉴别出来的挥发性产品总量.在高温下,乙酰胺由侧链的断裂和挥发性物质的释放产生(如图6),这与文献的描述完全一致[18].总的来说,乙酰胺基团占了N-乙酰-D-氨基葡萄糖总质量的29%.每个N-乙酰-D-氨基葡萄糖单元能生产一个乙酰胺分子,因此其质量在挥发性产物当中占最大比例.
二氧化碳是另外一种主要的挥发性化合物,由图2中2 357.3 cm-1和669.0 cm-1处的两个强尖峰可以判断出来.甲壳素是一种β-(1, 4)连接多糖,所以含有大量的糖苷键.由于C—O—C键的键能比C—C键键能小,所以很可能甲壳素的分解是从甲壳素主链上的某个薄弱环节开始的.在高温下甲壳素中的糖苷键破裂,并因C—O—C键断裂而产生二氧化碳.同样的情况在纤维素热解过程中也有发生[19].
在热解发生的时候,一些单糖如葡萄糖,果糖,氨基葡萄糖和N-乙酰氨基葡萄糖可以产生呋喃衍生物[20-22].在糖类物质的热处理过程中,热解和重排反应在呋喃的产生过程中是很常见的. 在高温下,甲壳素分解为单体,然后脱水,产生呋喃衍生物和羟甲基-4H-吡喃-4-酮,如图7所示.

图6 甲壳素热解生成乙酰胺的机理推断Fig. 6 The proposed production mechanisms for acetamide from chitin pyrolysis
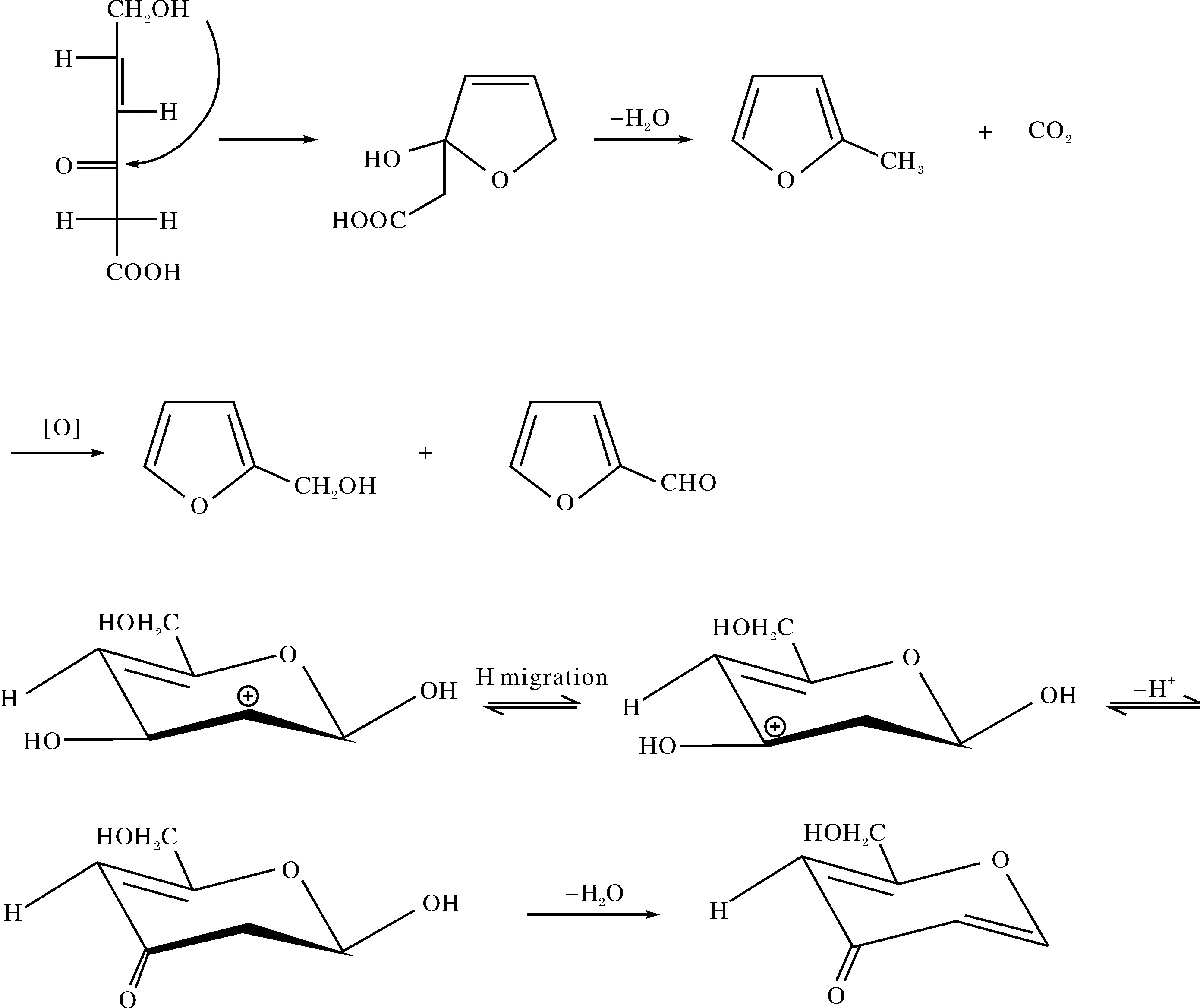
图7 甲壳素热解生成呋喃和羟甲基-4H-吡喃-4-酮的机理推测Fig.7 The proposed production mechanisms of furans and (hydroxymethyl)-4H-pyran-4-one from chitin pyrolysis
3 结论
本研究发现,甲壳素在温度达到254℃时分解并产生挥发性化合物.被识别出来的主要挥发性产品有乙酰胺,呋喃甲醇,呋喃-2-甲醛,1H-吡咯-2-甲醛,2-羟甲基-4H-吡喃-4-酮.乙酰胺是主要的挥发性产品,产物浓度为46.9 mg·g-1(产率为16.2%).当热解温度在260℃到360℃之间变动时,热解温度对挥发性产物的浓度和分布影响非常微弱,这说明乙酰胺是在热解的初级阶段由于侧链裂解生成的.在氧气流中甲壳素的热解主要挥发性产物仍然是乙酰胺,然而挥发性产物的种类非常复杂.
因此,甲壳素具有大量制备精细化学品如乙酰胺,呋喃和吡咯的潜在价值.该反应的催化剂,反应时间和所需氧气量等工艺条件需要进一步进行细化研究.
[1] KURITA K. Controlled functionalization of the polysaccharide chitin[J]. Progress of Polymer Science, 2001, 26: 1921-1971.
[2] KUMAR M N V R. A review of chitin and chitosan applications[J]. Reactive & Functional Polymers, 2000, 46: 1-27.
[3] QIN C Q, LI H R, XIAO Q, et al. Water-solubility of chitosan and its antimicrobial activity[J]. Carbohydrate Polymers, 2006, 63: 367-374.
[4] DODANE V, VILIVALAM V D. Pharmaceutical applications of chitosan[J]. Pharceutical Science and Technology Today, 1998, 1: 246-253.
[5] SHAHIDI F, ARACHCHI J KV, JEON Y J. Food applications of chitin and chitosan[J]. Trends in Food Science and Technology, 1999, 10: 37-51.
[6] KUMAR M N V R, MUZZARELLI R A A, MUZZARELLI C,et al. Chitosan chemistry and phar-maceutical perspectives[J]. Chemical Reviews, 2004, 104: 6017-6084.
[7] PONDER G R, RICHARDS G N. A review of some recent studies on me-chanisms of pyrolysis of polysaccharides[J]. Biomass and Bioenergy, 1994, 7: 1-24.
[8] QIN C Q, DU Y M, XIAO L. Effect of hydrogen peroxide treatment on the molecular weight and structure of chitosan[J]. Polymer Degradation and Stability, 2002, 76: 211-218.
[9] KNORR D, WAMPLER T P, TEUTONICO R A. Formation of pyrazines by chitin pyrolysis[J]. Journal of Food Science, 1985, 50: 1762-1763.
[10] SATO H, MIZUTANI S, OHTANI H, et al. Determination of degree of sub-stitution in N-carboxyethylated chitin derivatives by pyrolysis-gas chroma-tography in the presence of oxalic acid[J]. Journal of Analytical and Applied Pyrolysis, 2002, 64: 177-185.
[11] TANG W J, WANG C X, CHEN D H. Kinetic studies on the pyrolysis of chitin and chitosan[J]. Polymer Degradation and Stability, 2005, 87: 389-394.
[12] STOLAREK P, LEDAKOWICZ S. Pyrolysis kinetics of chitin by non-isothermal thermogravimetry[J]. Thermochimica Acta, 2005, 433: 200-208.
[13] MOLDOVEANU S C. Analytical Pyrolysis of Natural Organic Polymers[C]. Techniques and Instrumentation in Analytical Chemistry, Amsterdam: Elsevier, 1998.
[14] ZENG L T, QIN C Q, WANG L S,et al. Volatile compounds formed from the pyrolysis of chitosan[J]. Carbohydrate Polymers,2011, 83: 1553-1557.
[15] ADAMIANO A, GOFFREDO S, DUBINSKY Z,et al. Analytical pyrolysis-based study on intra-skeletal organic matrices from Mediter-rianean corals[J]. Anal Bioanal Chem, 2014, 406: 6021-6033.
[16] STANKIEWICZ B A, VAN BERGEN P F, DUNCAN I J, et al. Recognition of chitin and proteins in invertebrate cuticles using analytical pyrolysis/gas chromatography and pyrolysis/gas chromatography/Mass spectrometry[J]. Rapid Commun Mass Sp, 1996, 10: 1747-1757.
[17] CHEN J H, HO C T. Volatile com-pounds formed from thermal degradation of glucosamine in a dry system[J]. J Agric Food Chem, 1998, 46:1971-1974.
[18] KNORR D, WAMPLER T P, TEUTONICO R A. Formation of pyrazines by chitin pyrolysis[J]. Journal of Food Science, 1985, 50: 1762-1763.
[19] SOUDAIS Y, MOGA L, BLAZEK J, et al. Coupled DTA-TGA- FT-IR investigation of pyrolytic decom-posetion of EVA, PVC and cellulose[J]. Journal of Analytical and Applied Pyrolysis, 2007, 78: 46-57.
[20] SANDERSA E B, GOLDSMITHB A I, SEEMAN J I. A model that distingui-shes the pyrolysis of D-glucose, D-fruc-tose, and sucrose from that of cellulose. Application to the understanding of ci-garette smoke formation[J]. Journal of An alytical and Applied Pyrolysis, 2003, 66: 29-50.
[21] CHEN J H, HO C T. Volatile compounds formed from thermal degradation of glucosamine in a dry system[J]. Journal of Agricultural and Food Chemistry, 1998, 46: 1971-1974.
[22] CHEN J, WANG M, HO C T. Volatile Compounds Generated from Thermal Degradation of N -Acetylglucosamine[J]. Journal of Agricultural and Food Chemistry, 1998, 46: 3207-3209.
Production of fine chemicals from chitin by flash pyrolysis
WANG Qin, HU Xinliang
(College of Chemistry and Materials Science, Hubei Engineering University, Xiaogan, Hubei 432100)
Chitin is the second abundant natural polysaccharide in nature. This article is focused on investigation of volatile chemicals and their distributions from pyrolysis of chitin. Thermogravimetric analyzer (TG) equipped with differential scanning calorimeter (DSC) was used to investigate the pyrolysis behavior of chitin. The evolved volatiles were characterized by Fourier Transform Infrared Spectroscopy (FT-IR) in real time and further identified by Gas Chromatography/Mass Spectrometry (GC-MS). The main volatiles evolved from the pyrolysis of chitin in vacuum were furans and pyrroles. The majority of them was acetamide, the total amount which has exceeded the summary of the other volatile compounds. These suggested that chitin has potential value in large-scale preparation of fine chemicals such as acetamide, furan, and pyrrole. In addition, the reaction mechanism of chitin pyrolysis was also speculated. Under high temperature, the formation of acetamide is supposed to be due to the disconnection and cracking of the side chain as well as the volatilization of gaseous product.
chitin; pyrolysis; volatile compound; acetamide; GC-MS; pyrolysis mechanism
2015-09-24.
国家自然科学基金项目(21203138);湖北省教育厅基金项目(D20132702).
1000-1190(2016)02-0243-06
TS201.2
A
*通讯联系人. E-mail: hxl-7@163.com.
