糖基化影响真菌植酸酶的胰蛋白酶耐受性
2016-11-29朱庆锋王志林崔百元晏石娟贝锦龙
朱庆锋,王志林,崔百元,张 琪,陈 庄,晏石娟,贝锦龙*
(1.广东省农业科学院 农业基因中心,广州 510640; 2.广东省农业科学院 动物科学研究所,广州 510640)
糖基化影响真菌植酸酶的胰蛋白酶耐受性
朱庆锋1,王志林2,崔百元1,张 琪1,陈 庄1,晏石娟1,贝锦龙1*
(1.广东省农业科学院 农业基因中心,广州 510640; 2.广东省农业科学院 动物科学研究所,广州 510640)
通过重叠聚合酶链式反应,将黑曲霉植酸酶(AspergillusnigerNRRL 3135 phytase)第238~337位与第382~444位多肽片段的基因编码序列替换为烟曲霉植酸酶(AspergillusfumigatusATCC 13073 phytase)中的对应序列,构建片段置换植酸酶(Fragments-replaced phytase)基因.将插入该基因的pGAPZα A重组质粒转化入毕赤酵母.通过离子交换与凝胶过滤纯化,获得重组酵母分泌的活性片段置换植酸酶.与黑曲霉植酸酶相比,片段置换显著提高了片段置换植酸酶的胰蛋白酶耐受性.而通过脱糖基化酶PNGase彻底去除N-糖基化,可恢复片段置换植酸酶对胰蛋白酶的敏感性.上述结果表明烟曲霉植酸酶对应片段上的N-糖基化修饰可显著提高毕赤酵母表达的黑曲霉植酸酶的胰蛋白酶耐受性.
植酸酶; 黑曲霉; 烟曲霉; 糖基化; 蛋白酶水解
由于缺乏内源性植酸酶,单胃动物(如猪、鸡等)无法直接释放与利用植物籽实中与肌醇结合的磷酸.在饲料中添加微生物植酸酶,可促进动物利用植物性饲料中的植酸磷,降低植酸的抗营养作用与环境中的磷污染[1].目前饲料工业已广泛应用商品化外源性植酸酶替代部分无机磷,并取得显著的经济与环境效益[2].
动物胃肠道环境复杂多变,除pH从酸性陡变为中性外,还存在胃蛋白酶与胰蛋白酶等蛋白水解酶.而来源各异的植酸酶对不同蛋白酶的抗水解能力也不相同[3-4].为提升使用效率,理想的养殖业用植酸酶除高底物亲和力、宽最适pH范围、耐热性等[5]外,还应具有在动物消化道内抵抗消化酶水解的特性[4].
来自黑曲霉(Aspergillusniger)NRRL 3135菌株的植酸酶(Anp)是最早得到应用的一种商品植酸酶[6].2001年贝锦龙等[7]通过密码子优化等手段,在毕赤酵母中高效分泌表达该酶.但与曲霉表达的耐胰蛋白酶不耐胃蛋白酶的黑曲霉植酸酶[3]不同,酵母表达的Anp对胃蛋白酶表现出极强的抵抗力,而对胰蛋白酶十分敏感[8].但通过毕赤酵母表达的另一种来自无花果曲霉(Aspergillusfumigatus)ATCC 13073菌株的植酸酶(Afp),则完全不受胰蛋白酶的影响[8].陈庄等[9]发现在Afp中引入Anp片段可降低植酸酶对胰蛋白酶的耐受性.本研究则通过在Anp中引入Afp片段的策略,增加了Anp对胰蛋白酶的耐受性,并揭示了糖基化对真菌植酸酶胰蛋白酶耐受性的影响.
1 材料与方法
1.1 材料
毕赤酵母X-33和质粒pGAPZα A购自invitrogen公司(USA).PfuUltraTM高保真DNA聚合酶购自STRATAGENE公司(USA).所有限制性内切酶购自宝生物工程(大连)有限公司. Vivaspin超滤柱购自VIVASCIENCE公司(Germany).HiTrapTMSP柱、HiTrapTMQ柱和HiPrepTM26/60 Sephacryl S-200 HR柱购自Amersham Pharmacia Biotech公司 (Switzerland).Sequencing Grade Modified Trypsin 购自Promega公司(USA).PNGase F购自NEB(北京)有限公司.纯化试剂盒QIAEX II购自QIAGEN公司(Germany).凝胶电泳所用试剂:Tris、丙烯酰胺、SDS、过硫酸铵、TEMED、甘氨酸购自SIGMA-ALDRICH公司(USA).Quick Start Bradford蛋白测定试剂盒、样品缓冲液、蛋白质相对分子质量标记购自Bio-Rad公司(USA).其余试剂均为国产分析纯级.
Afp基因 (GenBank accession no. AY644455) 由中山大学王珣章教授惠赠,Anp基因 (GenBank accession no. AF295325) 由实验室所保存.分泌表达Anp的重组毕赤酵母X-33已构建好并于实验室保存.
1.2 片段置换植酸酶基因的构建
根据分别位于质粒pGAPZα A的单克隆位点两侧的659~679和838~824序列合成一对引物Pf1和Rf1 (表1).根据文献[5]选用3对引物(表1):Pf2和Rf2、Pf3 和Rf3、Pf4和Rf4.配对引物的5'末端彼此反向互补.

表1 引物名称和序列
片段置换植酸酶基因通过以下步骤构建: 分别从2个亲本基因中PCR扩增出需要的DNA片段; 将需要的DNA片段通过重叠PCR连接起来 (图1a~c).为确保连接顺序与方向的正确性需要相邻片段的末端序列高度一致.将植酸酶Anp中第238~337位与第382~444位多肽序列对应基因替换为植酸酶Afp的相应片段.
所涉及的PCR反应均使用PfuUltraTM高保真DNA聚合酶且PCR产物在进行下一步实验前均经过QIAEX II 胶纯化试剂盒纯化.
1.3 重组质粒构建与酵母转化
连接好的基因经XhoⅠ和KpnⅠ酶切后插入同样经XhoⅠ和KpnⅠ酶切的pGAPZα A质粒中,构建成含片段置换序列的重组质粒(图2).每个基因的N端均融合有受GAP启动子控制的酿酒酵母α分泌信号因子.按照invitrogen的手册将重组质粒转化入毕赤酵母X-33.在转化板上挑取单克隆,并提取酵母基因组DNA.以该DNA为模板及Pf1和Pr1为引物的PCR产物进行测序,筛选重组质粒插入成功的基因工程酵母菌株.
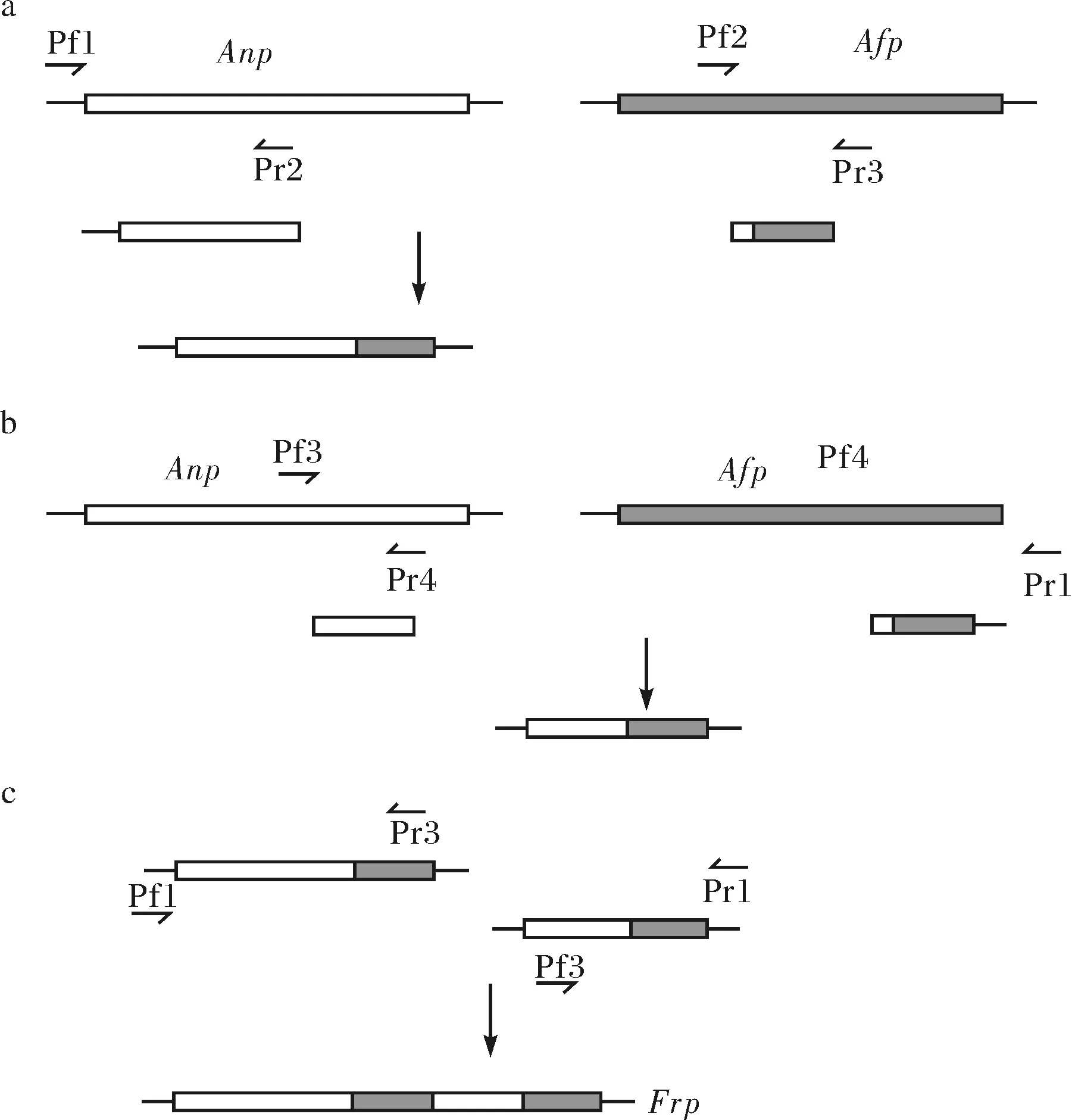
横向箭头表示相关引物;空白框表示Anp基因序列;灰色框表示Afp基因序列图1 片段置换植酸酶基因(Frp)构建Fig.1 Construction of the segment substitution phytase gene (Frp)
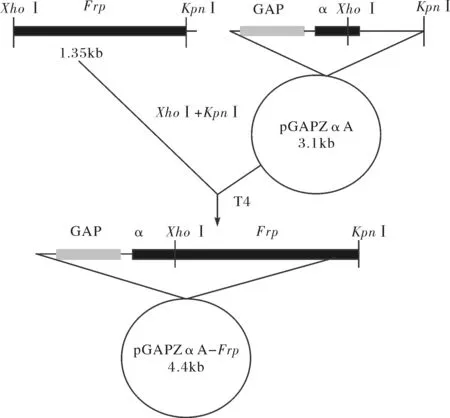
图2 含片段置换Frp基因的重组质粒构建Fig.2 Construction of the recombinant plasmid of the segment substitution Frp gene
1.4 片段置换植酸酶的表达与层析纯化
将重组酵母接入500 mLYPD培养基中,30℃、250 rpm振摇48 h后离心,弃上清;使用新鲜YPD加入到沉淀中,30℃、250 rpm继续振摇48 h后离心,弃沉淀;用Amicon 8400 cells磁力搅拌超滤器(PM30膜)将上清浓缩至4.5毫升左右.片段置换植酸酶用HiTrapTMSP柱(pH 5.0,A液为10 mmol/L乙酸钠;B液1 mol/L氯化钠+10 mmol/L乙酸钠)进行离子交换纯化;Anp用HiTrapTMQ柱(pH 5.5,A液10 mmol/L乙酸钠;B液1 mol/L氯化钠+10 mmol/L乙酸钠)进行离子交换纯化.收集目的蛋白峰后过凝胶过滤柱HiPrepTM26/60 Sephacryl S-200 HR(pH 5.0,150 mmol/L氯化钠,10 mmol/L乙酸钠)进行分子筛纯化.纯化后的蛋白质经Vivaspin超滤柱浓缩.纯化后的蛋白经Bradford法测定浓度后保存备用.
1.5 植酸酶活测定
植酸酶活力测定方法基本参照文献[7].由于原方法中植酸钠底物(Sigma,P3168)已停产,本研究参考文献报道[10],换用底物浓度为5 mmol/L的另一种进口植酸钠(Sigma,P8810).
1.6 胰蛋白酶与脱糖基化酶处理
将20 μg Trypsin溶解于40 μL pH7.5的25 mmol/L碳酸氢钠溶液中.取含50 μg纯化后的Anp和片段置换植酸酶蛋白溶液,并用水补足体积至220 μL;以Anp为例,从220 μL体系中各取100 μL分至a、b管.a管中加入10 μL空白1xBuffer,b管加入10 μL用1xBuffer稀释的脱糖基化酶PNGase F酶液(含1 000 U的脱糖基化酶活力);两管pH经精密pH试纸检测,均为7.5以上.将a、b管置于37℃水浴中过夜.
从a管分别取50 μL溶液至A、C管中,A管加入1 μL空白碳酸氢钠溶液(pH7.5),C管加入1 μL Trypsin碳酸氢钠溶液(0.5 μg/μL,pH7.5).从b管也分别取50 μL体积至B、D管中,B管加入1 μL同样的空白碳酸氢钠溶液,D管加入1 μL Trypsin(0.5 μg/ uL,pH7.5).将ABCD置于37℃水浴中2 h.
1.7 蛋白质电泳
按照《蛋白质与蛋白质组学实验指南》上聚丙烯酰氨凝胶电泳的方法配制4%的浓缩胶和15%的分离胶.电泳完成后将凝胶剥下,浸泡在染色液中进行常规的考马斯亮蓝染色.
1.8 统计分析
全部数据用SPSS软件( release 19.0版,SPSS Science,Chicago,IL )进行处理.使用Student非配对t检验检测数据.P<0.05为差异显著.
2 结果
2.1 片段置换植酸酶基因构建与表达
重组毕赤酵母基因组的PCR产物测序结果表明片段置换植酸酶基因已经转入毕赤酵母X-33细胞中,且重组毕赤酵母均能分泌有活性的植酸酶.根据测序结果进行blast比对,片段置换植酸酶与理论序列相似性达99%.
2.2 片段置换植酸酶纯化
片段置换植酸酶Frp和植酸酶Anp经过离子交换纯化及凝胶过滤柱纯化(图3).
2.3 片段置换提高植酸酶的胰蛋白酶耐受性
与此前报道相同,胰蛋白酶处理后,毕赤酵母分泌表达的Anp丧失所有植酸酶活力[8];而新片段置换植酸酶则仍能保留75%的酶活性(图4).蛋白电泳结果证明,胰蛋白酶可以将Anp彻底水解,而新片段置换植酸酶则对其有显著提升的耐受性(图5第3、7泳道).
2.4 脱糖基化处理削弱胰蛋白酶耐受性
由于酵母糖基化不均匀,导致2种植酸酶(尤其是Anp)分子量均一性差,在聚丙烯酰胺胶上条带呈弥散状(图5第1、5泳道).脱糖基化酶经过8 h水浴后,可以将植酸酶上的N-糖基彻底切除.在脱糖基化处理后,2种植酸酶均在50 kD左右形成一条锐带(图5第2、6泳道).但脱去糖基后,新片段置换植酸酶Frp的胰蛋白酶耐受性显著降低.无论是Anp还是新片段置换植酸酶Frp,脱糖基化后均可被胰蛋白酶彻底水解(图5第4、8泳道).此外,脱糖基化后两种酶均失去植酸酶活性(图4).
3 讨论
与毕赤酵母表达的烟曲霉植酸酶不同,烟曲霉本身表达的植酸酶对蛋白酶耐受性不如黑曲霉本身表达的植酸酶.而将前者一个暴露环状结构上的敏感酶切位点替换为黑曲霉植酸酶的对应位点后,对真菌自身蛋白酶的耐受性显著上升[11].由于黑曲霉植酸酶上的胰蛋白酶切位点多达数十个以上,且分布于整条多肽链,很难采用同样策略去提高其耐受性.本文在前期研究基础上[9],通过将黑曲霉植酸酶Anp中第238~337位与第382~444位替换为耐受胰蛋白酶的烟曲霉植酸酶Afp的相应片段,显著改善了Anp对胰蛋白酶的敏感性.证明可通过蛋白质工程技术改良黑曲霉植酸酶的蛋白酶耐受性.PNGase脱糖基化处理则恢复了胰蛋白酶对片段置换后的Anp的攻击性.由于该脱糖基化酶特异性水解多肽链上N-糖基化,因此上述结果表明Afp对应片段上的N-糖基化可显著影响毕赤酵母表达Anp的胰蛋白酶耐受性.
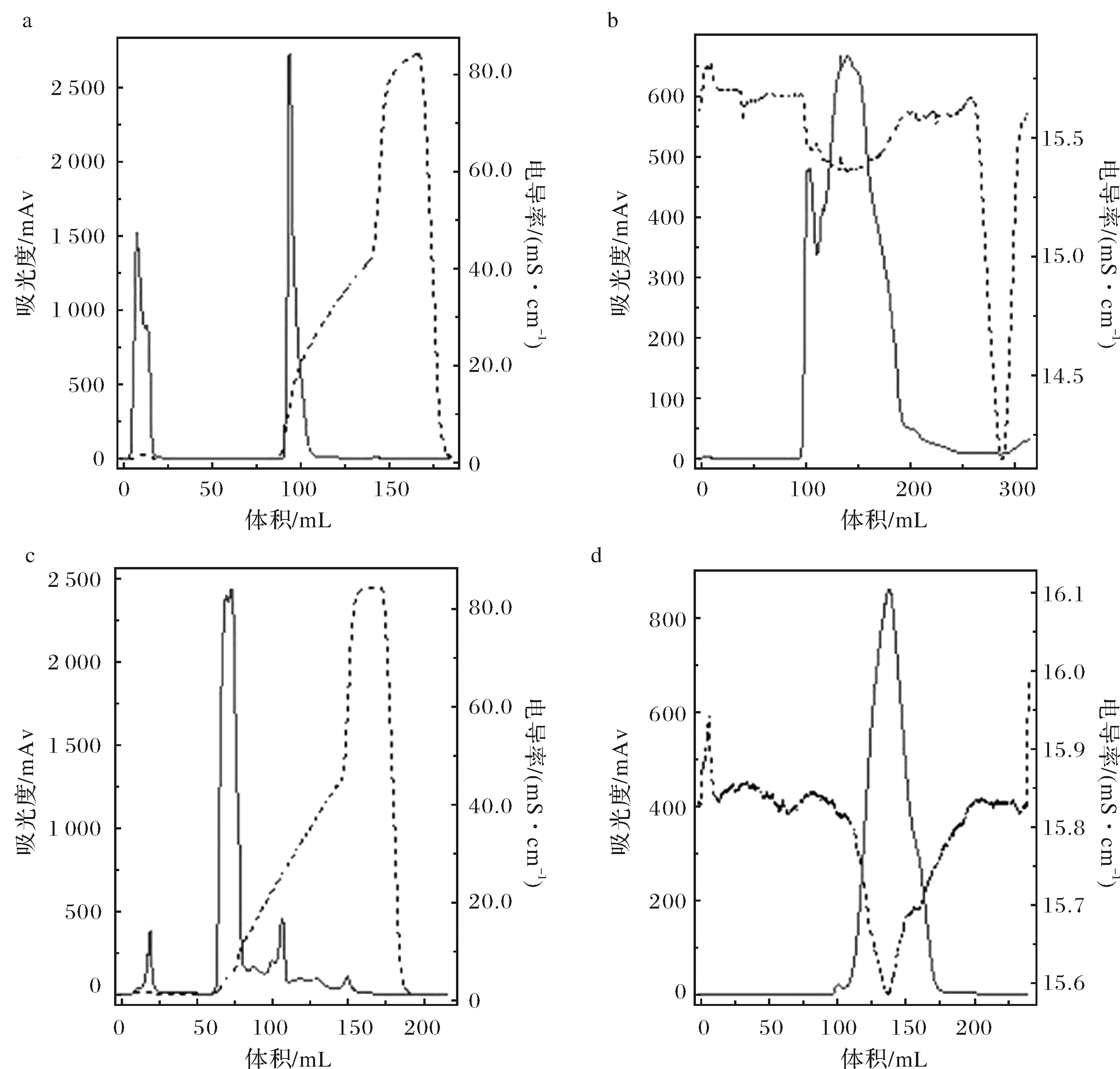
a. Frp离子交换纯化A280 nm图谱;b. Frp凝胶纯化A280 nm图谱;c. Anp植酸酶离子交换纯化A280 nm图谱;d. Anp植酸酶凝胶纯化A280 nm图谱;x轴表示体积(mL);左侧表示吸光度(mAU);右侧表示电导率(mS/cm)图3 Frp和Anp 280 nm吸收光谱图(实线)和电导率图(虚线)Fig.3 The A280 spectrum (solid line) and conductivity figure (dotted line) of Frp and Anp

T为胰蛋白酶;P为脱糖基化酶;-为未添加酶;+为添加酶;星号表示与Anp差异显著图4 Anp 和Frp经不同处理后的相对比活力Fig.4 The relative specific activity of Anp and Frp by different treatment
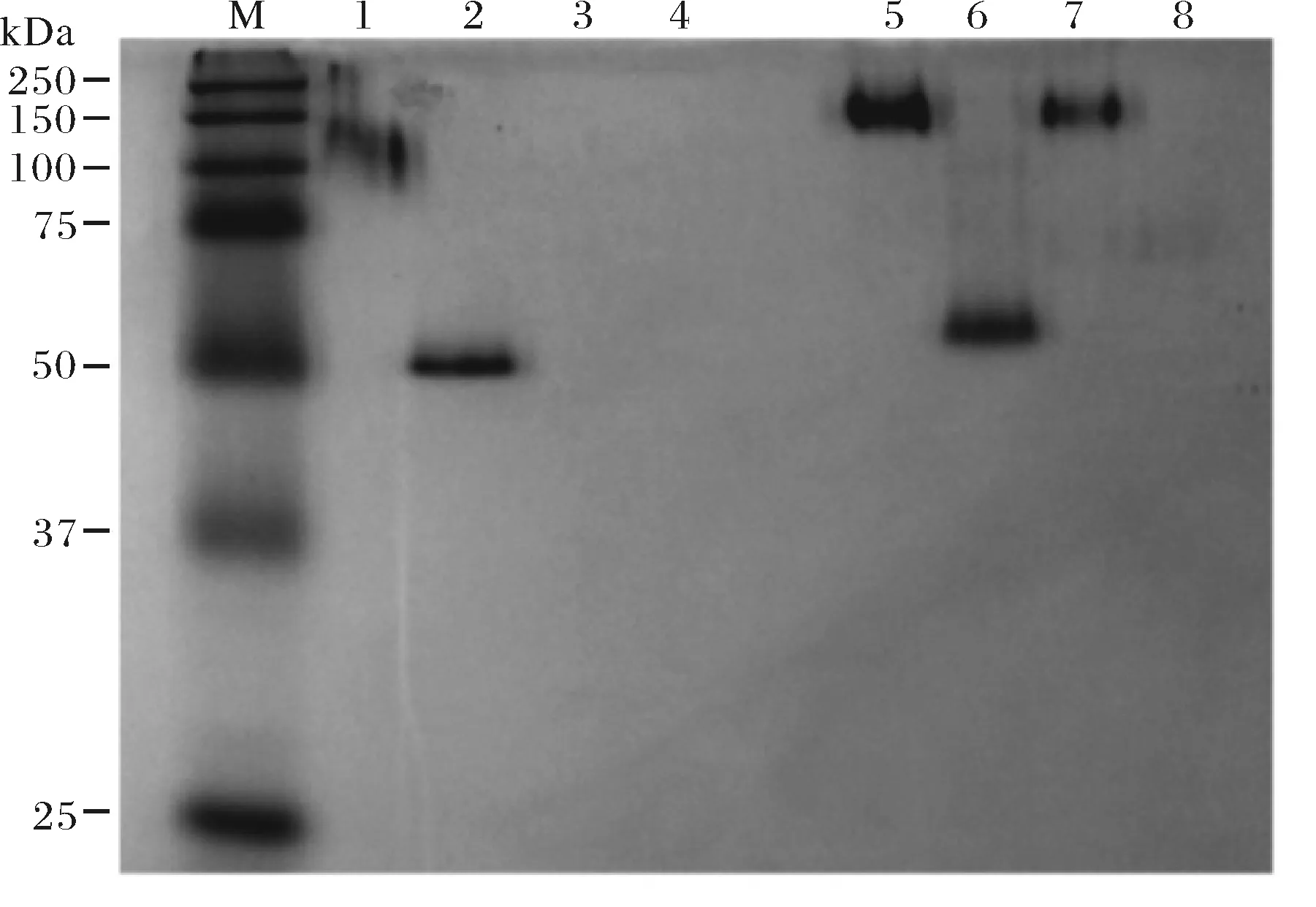
M. 分子质量标记;1.Anp T-P-;2.Anp T-P+;3.Anp T+P-;4.Anp T+P+;5.FrpT-P-;6.Frp T-P+; 7.Frp T+P-;8.Frp T+P+;T为胰蛋白酶;P为脱糖基化酶;-为未添加酶;+为添加酶图5 Anp和Frp在胰蛋白酶与脱糖基化酶消化后的非变性聚丙烯酰胺凝胶Fig.5 Non-denaturing polyacrylamide gel of Anp and Frp after trypsin and deglycosylation enzymes digestion
2种植酸酶的天然构型在实验过程中除酶处理效应外均未受破坏,从而能被观察到较真实的胰蛋白酶耐受性.无论是在脱糖基化、胰蛋白酶切或聚丙烯酰胺凝胶电泳实验中,本研究均未使用任何去垢剂(如可促进PNGase脱糖基化处理的NP-40等)、离液剂(尿素)与烷基化试剂等可能破坏蛋白构型的化学试剂.实验结果也表明脱糖基化与胰蛋白酶水解均能彻底完成,而除脱糖基化酶与胰蛋白酶外的其他溶液物质对植酸酶活无影响(图4、图5).但无论是Anp或片段置换植酸酶,均随着N-糖基化的去除而失去植酸酶活性.而当未对片段置换植酸酶添加足够PNGase,除导致脱糖基化不彻底外,也能保留部分酶活.这说明N-糖基化除与蛋白酶耐受性密切相关外,也在植酸酶水解植酸的过程中发挥重要作用.
本研究结果表明可能通过在Anp上添加Afp内第23~337位与第382~444位片段上的潜在N-糖基化位点(Asn-X-Ser/Thr),提升胰蛋白酶耐受性.N-糖基化修饰模式受多种因素影响.有报道在德国BASF商品黑曲霉植酸酶10个潜在的N-糖基化位点中,实际有2个位点完全未被糖基化,2个部分糖基化[11].Anp的一级序列与空间结构对糖基化效率及最终传导至对蛋白酶耐受性的影响,还需通过进一步研究来揭示.
致谢 感谢中山大学王珣章教授赠与基因以及蒋宗勇研究员、刘文华博士对项目的支持和指导.
[1] WODZINSKI R J,ULLAH A H. Phytase[J]. Adv Appl Microbiol,1996,42:263-302.
[2] 丁忠留,严建刚. 植酸酶应用与节磷减排[J]. 国外畜牧学(猪与禽),2011,1:87-88.
[3] RODRIGUEZ E,PRRESO J M,HAN Y,et al. Different sensitivity of recombinantAspergillusnigerphytase (r-PhyA) and Escherichia coli pH 2.5 acid phosphatase (r-AppA) to trypsin and pepsin in vitro [J]. Arch Biochem Biophys,1999,365(2): 262-267.
[4] 何 前,贝锦龙,容 庭,等. 市售商品植酸酶的作用效果评定[J]. 广东农业科学,2009(7): 170-172,195.
[5] BEI J,CHEN Z,FU J,et al. Structure-based fragment shuffling of two fungal phytases for combination of desirable properties[J]. J Biotechnol,2009,139(2): 186-193.
[6] ULLAH A H,MULLANEY E J. Aspergillus ficuum phytase: partial primary structure,substrate selectivity,and kinetic characterization[J]. Prep Biochem,1988,18(4): 459-471.
[7] 贝锦龙,王瑾雯,王珣章,等. 人工合成的黑曲霉NRRL3135菌株植酸酶基因在毕赤酵母系统中的高效表达[J]. 生物工程学报,2001(3): 254-258.
[8] 陈 庄,付 捷,贝锦龙,等. 两种重组真菌植酸酶的纯化及其酶学性质比较[J]. 四川大学学报(自然科学版),2007(5): 1141-1146.
[9] 陈 庄,贝锦龙,廖 玲,等. 真菌嵌合体植酸酶的构建及其抗蛋白酶水解特性研究[J]. 中山大学学报(自然科学版),2008(4): 72-76,87.
[10] 闵兆升,郭会明,洪厚胜. 饲用植酸酶酶活测定过程中底物的影响研究[J]. 中国饲料,2014(19): 30-32.
[11] WYSS M,PASAMONTES L,FRIEDLEIN A,et al. Biophysical characterization of fungal phytases (myo-inositol hexakisphosphate phosphohydrolases): molecular size,glycosylation pattern,and engineering of proteolytic resistance[J]. Appl Environ Microbiol,1999,65(2): 359-366.
Glycosylation of fungal phytase affects its resistance to trypsin
ZHU Qingfeng1,WANG Zhilin2,CUI Baiyuan1,ZHANG Qi1,CHEN Zhuang1,YAN Shijuan1,BEI Jinlong1
(1.Agro-biological Gene Research Center,Guangdong Academy of Agricultural Sciences,Guangzhou 510640;2.Institute of Animal Science,Guangdong Academy of Agricultural Sciences,Guangzhou 510640)
Using overlapping PCR technique,the DNA sequences encoding protein regions 238~337 and 382~444 fromAspergillusnigerNRRL 3135 phytase gene were replaced by correspondingAspergillusfumigatusATCC 13073 phytase sequences. The constructed Fragments-replaced phytase gene was inserted in pGAPZα A plasmid,and transformed into Pichia pastoris. Secreted Fragments-replaced phytase with phytase activity was purified through ion-exchange combined with gel filtration chromatography. While compared withAspergillusnigerNRRL 3135 phytase,Fragments-replaced phytase showed significantly improved resistance to tryptic digestion. However,after the N-glycosylation removed by PNGase thoroughly,the sensitivity of Fragments-replaced phytase to trypsin was recovered. These results indicated that the N-glycosylation modification of the replacing regions inAspergillusfumigatusATCC 13073 phytase enhanced the trypsin resistance ofAspergillusnigerNRRL 3135 phytase expressed in Pichia pastoris.
phytase;Aspergillusniger;Aspergillusfumigatus; glycosylation; proteolysis
2016-06-28.
广东省农业攻关引导项目(2012B020305011); 广东省科技计划项目(2016B070701013); 广东省自然科学基金博士启动项目(2014A030310489).
1000-1190(2016)05-0746-06
Q816
A
*通讯联系人. E-mail: jinlongbei@agrogene.ac.cn.
