不同温度水灌注肠镜的动物实验研究*
2016-11-29文黎明毛淑坤
文黎明,毛淑坤
(1.川北医学院附属第二医院消化中心,四川绵阳621000;2.重庆武警总医院,重庆400014)
论著
不同温度水灌注肠镜的动物实验研究*
文黎明1,毛淑坤2
(1.川北医学院附属第二医院消化中心,四川绵阳621000;2.重庆武警总医院,重庆400014)
目的观察不同温度水灌注对兔肠黏膜损伤和肠镜操作的影响。方法30只体重约1.6~2.5 kg的普通级、成年雄性家兔,随机分成3组:A组(35~36℃)、B组(37~38℃)和C组(39~41℃),行注水结肠镜检查,术中评估操作者满意度,术后光镜观察肠黏膜组织病理学改变。结果3组肠黏膜损伤情况比较差异无统计学意义(P>0.05),C组肠腔视野暴露评分最低,差异有统计学意义(P<0.05)。结论温水灌注肠镜是一种安全、有效的方法,其中39~41℃为最佳温度。
注水结肠镜;温度;Chiu评分;动物实验
注水结肠镜作为一种较新的进镜法,既可减轻腹痛,也能提高检查成功率,已逐步在临床实践中推广应用。但注水温度各家报道不一[1],为探讨不同温度对于肠黏膜的损伤情况,以选择合适的温度,本组进行了动物实验。现报道如下:
1 材料与方法
1.1实验动物及设备
1.1.1实验动物本次实验研究动物选取30只普通级、成年家兔,均为雄性,体重波动在1.6~2.5 kg,无相关消化系统疾病表现。
1.1.2动物分组所选动物通过数字表法分成3组,每组10只:A组用35~36℃温水保留灌肠及注水结肠镜;B组用37~38℃温水保留灌肠及注水结肠镜;C组用39~41℃温水保留灌肠及注水结肠镜。3组动物之间体重差异无统计学意义。
1.1.3设备结肠镜主机(PENTAX EPM-3500)、电子胃镜(PENTAX EG-2940),灌肠用20 ml一次性无菌注射器推注,灌肠管使用16 F硅胶导尿管。
1.2实验方法
1.2.1实验前准备所有动物均在内镜中心常规饲养。实验前严格禁食48 h,每日仅喂食少量糖盐水,禁饮8 h。术前称重,均用舒泰50麻醉,按照剂量5mg/kg,耳缘静脉推注。
1.2.2温水灌肠各组均用20ml一次性无菌注射器推注总量15 ml相对应温度的温水,5 min内完成,插管至距肛门约15.0 cm,灌肠后夹闭灌肠管,抬高臀部10min后拔管,全部动物均由同一实验员完成。见图1。
1.2.3结肠镜操作所有动物均采用同一主机、同一条胃镜、同一内镜医师行单人结肠镜检查(考虑家兔肠壁薄,管径细,故采用电子胃镜替代肠镜操作)。操作者具有从事消化内镜诊疗工作5年以上经验,术中用50ml无菌注射器通过活检孔道注水的方式获得视野,辨认肠腔走行而进镜,退镜则改为注气全面观察。见图2。
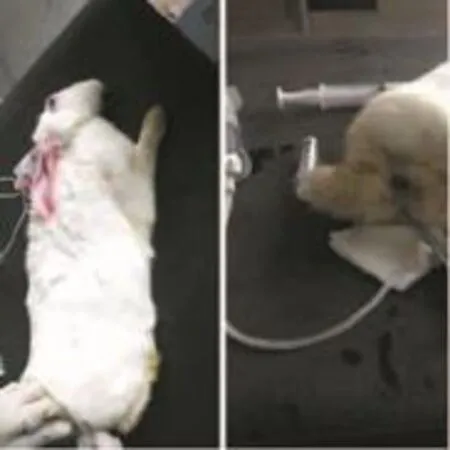
图1 动物麻醉及温水保留灌肠
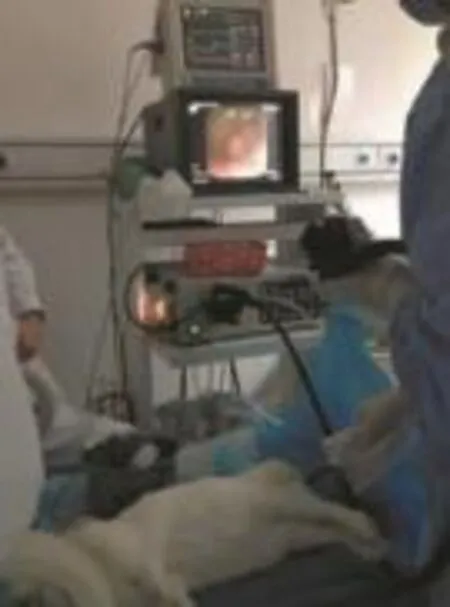
图2 动物结肠镜操作
1.3结果评定标准
1.3.1操作者满意度肉眼观察:每次检查力求到达兔圆小囊。术中操作者评估肠黏膜情况,每只动物观察3处肠段(分别距肛门约15.0、50.0和75.0 cm),取其平均值得分。标准如下:无改变,1分;黏膜仅轻度水肿,无明显改变,2分;黏膜中度水肿,散在点、斑片状充血,3分;黏膜弥漫性充血、水肿,血管网纹模糊,4分。
1.3.2肠腔视野暴露操作者评估进镜过程中肠腔视野显露情况。分为“满意-一般-差”3个等级,分别计为“1分-2分-3分”。
1.3.3肠黏膜组织病理学评分术后处死动物、剖腹,每只家兔距肛门15.0、50.0和75.0 cm处各取2.0 cm×3.0 cm肠组织,10%中性甲醛溶液固定,常规石蜡包埋,4μm切片,HE染色,光学显微镜观察组织学改变及拍照。组织学评分采用Chiu[2-3]肠黏膜损伤评分标准,各取上述3处不同部位平均值得分。标准如下:0分为正常,无损伤;1分为绒毛顶端上皮下的间隙增宽,毛细血管充血;2分为绒毛顶端上皮下间隙进一步扩大、抬高,与固有膜剥离;3分为绒毛上皮成块脱落;4分为上皮完全脱落,仅有固有膜,内皮下可见出血;5分为固有层崩解,出血,形成溃疡。
1.4统计学方法
实验结果均采用SPSS 18.0统计软件进行统计学分析。实验动物基本情况及操作者满意度均采用均数±标准差(±s)表示,实验动物一般情况采用完全随机方差分析,LSD法两两比较;肠黏膜组织Chiu评分采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1一般情况对比
所有实验动物均完成操作。3组肠腔视野显露得分比较,经完全随机的方差分析(Oneway Anova)检验,F=5.01,P<0.05,差异有统计学意义。两两比较:A组(35~36℃组)vs B组(37~38℃组):P= 0.363>0.05;A组(35~36℃组)vs C组(39~41℃组):P=0.005<0.05;B组(37~38℃组)vs C组(39~41℃组):P=0.040<0.05。结果C组得分最低(P<0.05),表明其肠管扩展、肠腔视野显露效果最好,A、B两组间差异无统计学意义(P>0.05)。见表1。
2.2肠黏膜组织病理学评分
2.2.13组肠黏膜组织病理学评分3组动物Chiu评分均波动在0~3分,经统计检验χ2值为4.35,P =0.930,差异无统计学意义。见表2和图3。
2.2.23组肠黏膜组织病理学表现A组肠黏膜表明上皮脱落,固有层充血、水肿、出血;B组肠黏膜表面上皮完整,局部与固有层解离,黏膜内血管充血水肿;而C组肠黏膜正常,仅见轻微小血管内充血。见图4。
表1 家兔一般情况比较(±s)

表1 家兔一般情况比较(±s)
注:1)代表A组与B组肠腔视野暴露情况比较,P>0.05;2)代表A组与C组肠腔视野暴露情况比较,P<0.05;3)代表B组与C组肠腔视野暴露情况比较,P<0.05

表2 3组Chiu评分比较例

图3 各组Chiu氏得分分布直方图

图4 3组肠黏膜组织病理学表现(HE×400)
3 讨论
目前诊断肠道器质性病变主要手段是结肠镜,肠镜是诊断结肠有无器质性病变的金标准,但对于肠易激综合征(irritable bowel syndrome,IBS)和有腹部手术史患者来说做结肠镜仍有一定操作难度。大多数慢性便秘、盆腹部手术史的患者肠管多冗长迂曲、肠粘连和肠系膜牵拉,肠管特别容易在盆腹腔中成角和折弯,行结肠镜检查会相对困难。而IBS患者多伴焦虑,检查过程中因肠道刺激、牵拉、反射性痉挛导致患者更加紧张,容易出现插管困难的情况。近年来无痛结肠镜在临床得到广泛应用,在严密监护下,经静脉给予适量速效镇静剂和麻醉剂,减少肠蠕动,不仅能方便观察及病变活检,患者在麻醉苏醒后也没有明显不适感,但其耗费高,特别对有心肺疾病者增加了麻醉风险,同时麻醉下可能无法准确掌握患者结肠镜检查耐受力,也不能提早预防并发症的发生[4]。怎样有效减轻患者痛苦已然成为内镜医师不断尝试的关注点。近年来,大量临床研究认为注水结肠镜能显著减轻患者腹痛[5-7],增加肠镜插镜到达回盲部的成功率,但报道注水温度差异较大,有常温水,也有温水,对于何种温度更适合用于困难插镜肠镜检查,不同温度对肠黏膜组织病理学的影响尚未见报道。因此,本组设计了家兔动物进行研究。
目前,注水结肠镜中水的最佳温度存在争论。因36℃更为接近人机体温度,被广泛应用[8]。保留灌肠则通常选择38℃[9]。Brocchi等[10]指出灌注42℃温水并未出现黏膜烫伤、腹痛或直肠刺激症状。家兔正常体温为38.5~39.5℃[11],临界温度为5~30℃。因此,本实验选用3种不同温度,即35~36℃、37~38℃和39~41℃,插管深度为距肛门约15.0 cm,以客观分析不同温度水对肠黏膜组织病理学和肠镜的影响,取得了一手实验资料。
本实验表明不同温度肠腔视野显露效果,39~41℃得分明显低于35~36℃和37~38℃[(1.300± 0.483)vs(2.300±0.823)vs(2.000±0.816)],均P<0.05,说明39~41℃家兔肠腔显露最佳。通过实验证明39~41℃对肠黏膜无明显损伤的同时,辨认肠管走行、肠腔视野暴露效果最好。这主要考虑与39~41℃接近家兔体温38.5~39.5℃相关。
正常肠道屏障,包括肠蠕动、肠黏膜机械、化学屏障、生物和免疫屏障,具有高选择性[12],可有效阻挡肠道内上百种肠道寄生菌及其毒素向肠腔外组织器官移位,防止机体免受内源性微生物及其毒素的侵害,为维持肠道内环境的稳定起着重要作用[13]。Wilmore[14]认为机体在应激状态下,肠黏膜微绒毛萎缩、绒毛上皮细胞脱落、渗透性增加,以及细菌和内毒素通过破坏的肠黏膜屏障形成细菌移位,导致肠管一过性或较长时间肠道屏障功能损伤。本研究采用不同温度水给家兔灌肠也会引起家兔肠黏膜应激反应,在不同温度应急状态下是否会导致家兔肠黏膜持续应急损伤?本研究通过3组肠黏膜组织病理学评分发现3组肠黏膜损伤评分差异无统计学意义(P>0.05),说明选择的3组温度对肠黏膜均无明显损伤。通过本实验证明39~41℃水灌注更有利于肠镜插管,同时对肠黏膜无明显损伤,39~41℃温水肠镜安全、有效,是最适合用于温水灌肠肠镜检查的温度,但临床实际应用有待大规模临床对照试验进一步证实。
[1]许丹,杨幼林.注水式结肠镜检查法的临床研究进展[J].医学综述,2015,21(7):1277-1279.
[2]Chiu CJ,Mcardle AH,Brown R,et al.Intestinal mucosa lesion in low flow states[J].Arch Surg,1970,101(4):478-483.
[3]徐旭娟,张凤,沈美云,等.不同pH值灌肠液对兔肠黏膜损伤的实验研究[J].护士进修杂志,2010,25(23):2120-2122.
[4]夏莉.结肠镜检查的护理体会[J].临床和实验医学杂志,2008,7(3): 193-194.
[5]Leung J,Mann S,Siao-Salera R,et al.A randomized,controlled trial to confirm the beneficial effects of the water method on U.S. veterans undergoing colonoscopy with the option of on-demand sedation[J].Gastrointest Endosc,2011,73(1):103-110.
[6]Leung FW,Leung JW,Mann SK,et al.DDW 2011 cutting edge colonoscopy techniques state of the art lecture master class-warm water infusion/CO(2)insufflation for colonoscopy[J].Interv Gastroenterol,2011,1(2):78-82.
[7]Radaelli F,Paggi S,Amato A,et al.Warm water infusion versus air insufflation for unsedated colonoscopy:a randomized,controlled trial[J].Gastrointest Endosc,2010,72(4):701-709.
[8]Leung FW,Aharonian HS,Leung JW,et al.Impact of a novelwater method on scheduled unsedated colonoscopy in US veterans[J]. Gastrointest Endosc,2009,69(3):546-550.
[9]郑伟琴,颜景颖,杨向东.中药保留灌肠治疗溃疡性结肠炎的进展[J].结直肠肛门外科,2008,14(4):291-294.
[10]Brocchi E,Pezzilli R,Tomassetti P,et al.Warm water or oilassisted colonoscopy:towards implerexam inations[J].Am J Gastroenterol,2008,103(3):581-587.
[11]韩崇选,杨学军,王明春,等.主要啮齿动物的特异性研究[J].西北林学院学报,2002,17(3):48-52.
[12]Kraehenbuhl JP,Pringault E,Neutra MR.Intestinal epithelia and barrier functions[J].Aliment Pharmacol Ther,1997,11(13): 3-8.
[13]Kiyono H,Weisborodt NW,Moody FG.Ileal mucosal response to bacterial toxin challenge[J].Trauma,2000,49(2):306-313.
[14]Wilmore DW.Catabolic illness.Strategies for enhancing recovery[J]. N Engl JMed,1991,325(10):695-702.
(吴静编辑)
Experimental animal colonoscopy with different temperatures of water infusion*
Li-mingWen1,Shu-kun Mao2
(1.Department of Digestion Diseases,the Second Affiliated Hospital of North Sichuan Medical College,Mianyang,Sichuan 621000,China;2.General Hospital of Chongqing Armed Corps Police,Chongqing 400014,China)
Objective To explore the impact on rabbit intestinal mucosa injury and the influence on endoscopic operation with different temperatures of water infusion.Methods 30 common adult male rabbit(weight 1.6~2.5 kg),were randomly divided into three groups with different temperatures of water infusion as follows:A group(35~36℃),B group(37~38℃),C group(39~41℃),then,perform water infusion colonoscopy,evaluating the operators satisfaction,then we observe the pathological changes of postoperative intestinal mucosal tissue.Results There was no statistically significant difference among the three groups of intestinal mucosa injury(P>0.05).The vision exposure score of Group C was lowest,compared with the other two groups,which has a statistically significant differences(P<0.05).Conclusions Warm water infusion colonoscopy is a safe and effective method,and the optimum temperature was about39~41℃.
water infusion colonoscopy;temperature;Chiu scores;animal experiment
R574
A
10.3969/j.issn.1007-1989.2016.02.006
1007-1989(2016)02-0026-04
2015-09-18
绵阳卫生计生委科研课题(No:绵卫201452)
