感染性主动脉瘤1例
2016-11-29靳丽妍朱光发
靳丽妍, 朱光发
·病例报告·
感染性主动脉瘤1例
靳丽妍, 朱光发
主动脉瘤,感染; 沙门菌; 治疗,抗感染
感染性主动脉瘤是一种罕见、治疗困难的动脉瘤类型[1],其发病率在主动脉瘤中占0.7 %~3 %[2],常于并发菌血症、败血症或动脉瘤破裂时才被发现,病死率达5 %~44 %[3]。
1 临床资料
患者男,59岁。因“间歇发热4个月”于2014年10月20日收入我科。患者4个月前无明显诱因出现发热,体温最高42 ℃,伴有畏寒、寒战,伴有肋下及后背部疼痛,为持续性撕裂样疼痛,深吸气或体位变动时加重,热退后缓解。无咳嗽、咯痰,无胸痛、咯血,无胸闷、憋气,无恶心、呕吐,无腹痛、腹泻,无尿频、尿急、尿痛,就诊于当地县医院,先后3次行血培养,1次血培养结果阳性,为“鸡沙门菌”,先后给予静脉滴注头孢哌酮 -他唑巴坦2 g 每8小时1次× 3 d, 哌拉西林-舒巴坦5 g 每8小时1次 × 8 d,左氧氟沙星0.5 g每日1次联合哌拉西林-舒巴坦5 g 每8小时1次× 4 d,发热无明显缓解。
患者3个月前就诊于北京某医院,行CT主动脉造影(CTA)。降主动脉支架植入术后,支架水平主动脉周围软组织密度增高。考虑为支架周围感染(图1),予以美罗培南0.5 g 每8小时1次、万古霉素1.0 g每12小时1次联合抗感染3周,体温降至正常,肋下及后背部疼痛症状缓解,住院1个月后准予出院。2周后患者再次出现发热,体温最高38.7 ℃,伴随症状同前,再次就诊于当地县医院,予以头孢哌酮-他唑巴坦2 g 每8小时1次、万古霉素1.0 g 每12小时1次联合抗感染治疗2周后,体温降至正常,准予出院。约1个月后患者再次出现发热,体温最高38.5 ℃,症状同前,再次就诊于当地县医院,予以氨曲南1 g 每8小时1次×1 d,头孢哌酮-他唑巴坦2 g 每8小时1次×2 d抗感染治疗,患者仍有发热,为进一步诊治收入我科。
患者既往高血压病史10年,冠心病史8年,糖尿病史4年;2012年因降主动脉瘤行胸腹主动脉支架植入术;2014年3月因腹股沟淋巴结肿大行淋巴结活检,病理结果为淋巴结转移癌(鳞癌),行2次化疗。入院体格检查:体温36 ℃,脉搏81次 / min,双肺呼吸音清,未闻及明显干湿性啰音,心律齐,各瓣膜听诊区未闻及杂音,腹软,剑突下轻压痛,无反跳痛,肝脾肋下未触及。胸部大血管CTA(图2)示:降主动脉支架植入术后,支架形态完整,周围未见明显对比剂渗漏;左侧锁骨下动脉起始段、主动脉弓及降主动脉管壁不规则伴钙化,病源性质考虑为动脉硬化。电子肠镜示结肠多发息肉;直肠炎。病理结果示(乙状结肠)符合增生性息肉;(肝曲)管状腺瘤I级;(直肠)大肠黏膜重度慢性炎,腔缘见短杆菌样物。患者住院期间体温正常,诊断明确后,予以头孢地尼0.1 g每日3次口服,嘱其规律服用3个月,期间每个月随访1次,患者体温正常,无胸、腹、背部疼痛,饮食、睡眠正常。
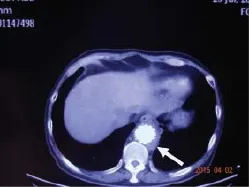
图1 感染性主动脉瘤支架周围感染CTA图像Figure 1 Computed tomography angiography image showing stent infection in infective aortic aneurysm

图2 感染吸收后CTA图像Figure 2 Computed tomography angiography image after resolution of infection
2 讨论
本例患者主要表现为间歇发热,给予抗感染治疗后,体温可降至正常,未予重视。上述症状4个月内反复发生,血培养结果为“鸡沙门菌”。2012年曾因降主动脉瘤行胸腹主动脉支架植入术,此次发热时行主动脉CTA,示支架水平主动脉周围密度增高影。根据患者症状、体征及辅助检查结果,考虑为感染性主动脉瘤。感染性主动脉瘤依据感染途径可分为以下4类:①原发性感染性主动脉瘤,是由邻近的感染灶直接或通过淋巴途径感染主动脉壁引起的。②栓塞感染性主动脉瘤,源于远隔部位感染灶的感染栓子附着于动脉壁,形成感染病灶并造成动脉壁的感染性损害而形成动脉瘤,其中细菌性心内膜炎是最常见原因。③外伤感染性主动脉瘤,是由于动脉壁的穿通性外伤或留置导管、血管手术等医源性原因导致的动脉壁的细菌污染所引起。④隐源性感染性主动脉瘤,在菌血症或败血症时血中细菌通过动脉硬化造成的内膜损伤部位或通过滋养血管引起主动脉壁的感染性坏死而形成动脉瘤[3]。本例患者血培养阳性,存在动脉硬化,既往因降主动脉瘤行支架植入术,有主动脉内膜损伤,综合考虑为隐源性感染性主动脉瘤。
感染性主动脉瘤的病原体以细菌感染最为多见, 也可见到白念珠菌、梅毒螺旋体等病原微生物。其中沙门菌和金黄色葡萄球菌最为常见, 其他病原菌还有链球菌、大肠埃希菌、流感嗜血杆菌等毒力较强的细菌[4]。沙门菌偏爱吸附于受损的内膜,尤其是主动脉粥样硬化形成斑块的内膜,在感染性动脉瘤中占50 %[5],其中猪霍乱沙门菌又占所有沙门菌动脉瘤病例的80 %[6]。本例患者为鸡沙门菌感染,结合患者肠镜检查结果提示黏膜重度慢性炎症,腔缘见短杆菌样物,而鸡沙门菌形态为短棒状菌,故考虑为该细菌由损伤的肠黏膜入血,进而通过支架附近损伤的血管内膜引发感染,遗憾的是直肠黏膜标本细菌培养结果并不支持。
除了病原菌毒力外, 患者的自身免疫系统状态也是发病过程中的重要因素之一。感染性主动脉瘤的患者往往同时合并一种或多种免疫抑制因素,如类固醇激素的应用、慢性肾衰竭、艾滋病、恶性肿瘤、糖尿病等。在ODERICH等[7]所报告的43例中, 这种情况占到了70 %。本例患者有糖尿病,2014年3月经右侧腹股沟淋巴结活检诊断为淋巴结转移癌,并行2次化疗,免疫功能受到一定抑制,也是其发生感染性动脉瘤的原因之一。
2001 年,ODERICH等[7]提出感染性主动脉瘤的诊断包括以下方面:①发热、C反应蛋白(CRP)及红细胞沉降率(ESR)升高,白细胞升高,血培养阳性。②影像学表现为局限性不规则的主动脉扩张而缺乏瘤壁钙化;多灶性囊状动脉瘤;主动脉壁周低密度软组织肿块或可见气体; 主动脉管径急速扩张。③术中主动脉壁周可见炎性肉芽肿或脓液,标本培养阳性。当然,患者一旦被怀疑为感染性主动脉瘤时,就会根据常见的病原菌给于抗生素经验治疗,故术中所进行的动脉瘤壁的细菌培养可呈阴性, 如果排除了其他部位的感染,术前曾应用过抗感染治疗1 周以上, 仅通过动脉瘤周围典型的化脓性感染表现也能诊断感染性主动脉瘤[2]。本例患者以间歇发热为主要临床表现,化验检查提示CRP、ESR均升高,外院检查白细胞升高,血培养阳性。外院主动脉CTA提示支架水平降主动脉周围软组织密度影。均符合感染性主动脉瘤表现。但因患者为动脉瘤支架植入术后,支架完整,管腔通畅,且经抗感染治疗后复查CTA,提示支架周围异常密度影已消失,故未进行外科手术取出支架,无法得知主动脉壁情况,也没有局部脓液的培养结果,其感染性主动脉瘤的诊断是基于临床和血培养结果得出的。患者曾行3次血培养,仅1次血培养结果阳性,考虑与血标本采集时间、血标本处理时机及抗生素的使用均有关。当然,血培养结果对于感染性主动脉瘤而言意义重大,这也提示我们在今后工作中如果怀疑感染性主动脉瘤,应在抗生素使用前多次抽取血培养,并于寒战、高热时反复抽取血培养,尽可能完善病原学检查。
在感染性主动脉瘤的治疗中,以外科手术治疗为主,当然,敏感、足量和完整疗程的抗感染治疗也是治疗成功的关键,但对抗生素的应用疗程并无统一意见, 疗程从6~8周到终生服用抗生素治疗。大多数医师建议静脉应用抗生素6~8周,随后序贯口服3~6个月。采用腔内方法治疗的患者,因并未去除感染灶,有的学者建议需要终身抗感染治疗[4,8]。本例患者4个月内间歇发热,每次使用抗生素后体温均可降至正常,考虑与致病菌为敏感菌,且毒力不是很强有关。但患者4个月内反复发热,考虑为抗生素疗程不足,不能够彻底清除支架周围感染。故按照多数专家共识,考虑该患者外院静脉滴注抗生素前后共7周余,且入院后体温一直正常,嘱该患者继续口服头孢菌素类抗生素3个月治疗。在此期间,我们每个月定期随访,患者无再次发热。可见,充足疗程的抗感染治疗尤为重要。
总之,感染性主动脉瘤是一种临床罕见、却病情凶险的疾病,由于瘤体有破裂风险,致死率高,早期诊断对治疗至关重要。因此,有长期不明原因的发热、腹部肿块、腰背部疼痛、反复菌血症等表现时应高度警惕感染性主动脉瘤的可能性,及时行彩超、CTA 等相关检查,以免耽误最佳治疗时机。
[1] HERTZER NR. Fatal myocardial infarction following abdominal aortic aneurysm resection. Three hundred forty-three patients fouowed 6-11 years postoperatively [J]. Ann Surg, 1980, 192(5): 667-675.
[2] MUELLER BT, WEGENER OR, GEABITZ K, et al.Mycotic aneurysms of the thoracic and abdominal aorta and iliac arteries:experience with anatomic and extra-anatomic repair in 33 cases[J]. J Vasc Surg, 2001, 33(1):106-113.
[3] GOUDARD Y, PIERRET C, DE LA VILLEON B, et al.In situ repair of a primary Brucella-infected abdominal aortic aneurysm: long-term follow-up[J]. Ann Vasc Surg, 2013,27(2):241-245.
[4] 曾嵘,刘昌伟.感染性主动脉瘤[J].临床外科杂志,2008,16(11):785-787.
[5] PARSONS R,GREGORY J,PALMER DL. Salmonella infections of the abdominal aorta[J]. Rev Infect Dis,1983,5(2):227-231.
[6] CHAN P,TSAI CW,HUANG JJ, et al. Salmonellosis and mycotic aneurysm of the aorta. A report of 10 case[J]. J Infect,1995,30(2) : 129-133.
[7] ODERICH GS,PANNETON JM,BOWER TC, et al. Infected aortic aneurysms: aggressive presentation,complicated early outcome,but durable results[J]. J Vasc Surg,2001, 34(5):900-908.
[8] 孙岩,张十一,刘洋,等. 感染性腹主动脉瘤患者的诊断与治疗[J].中华外科杂志, 2011, 91 ( 43 ) : 3071-3073.
A case report of mycotic aortic aneurysm and literature review
JIN Liyan, ZHU Guangfa. (Department of Infectious Diseases, Beijing Anzhen Hospital, Capital Medical University, Beijing 100029, China)
R543.11
D
1009-7708 ( 2016 ) 06-0785-03
10.16718/j.1009-7708.2016.06.019
首都医科大学附属北京安贞医院感染科,北京 100029。
靳丽妍(1984—),女,硕士研究生,医师,主要从事呼吸系统感染性疾病诊治。
朱光发,E-mail:gfzhu6388@sina.com。
2015-11-30
2016-01-20
