原发性侵袭性肺曲霉病2例
2016-11-29刘本洪赵景全高松凤王玉新徐永运
刘本洪, 于 佳, 赵景全, 高松凤, 王玉新, 徐永运
·病例报告·
原发性侵袭性肺曲霉病2例
刘本洪, 于 佳, 赵景全, 高松凤, 王玉新, 徐永运
原发性; 肺疾病; 曲霉病
曲霉是条件致病真菌,多在免疫功能缺陷的人群致病。发生于无任何基础疾病、免疫功能正常宿主的侵袭性肺曲霉病称为原发性侵袭性肺曲霉病[1],临床罕见,且病死率高,极易误诊。现报道我院收治原发性侵袭性肺曲霉病2例,结合相关文献进行分析,以提高对原发性侵袭性肺曲霉病的诊断意识。
1 临床资料
病例1,患者男,61岁,因“发热、咳嗽、咯痰1周,胸痛1 d”入院。患者为污水处理厂工人,平素体健。患者1周前受凉后出现发热,体温最高达39 ℃,伴咳嗽、咯痰、胸痛。胸部CT示:双肺多发斑片状高密度影,右肺下叶见厚壁空洞(图1A)。体格检查:体温37 ℃,心率80 次/ min,心律齐,心脏各瓣膜区无杂音。血压146/72 mmHg。呼吸 20次/min,双肺呼吸音粗, 未闻及干湿啰音。实验室检查:白细胞 15.77×109/L, 中性粒细胞 12.44 ×109/L,淋巴细胞 1.52 ×109/L ,血小板350×109/L;超敏C反应蛋白 140 mg/L;降钙素原<0.1 μg/L;结核抗体阴性。诊断为肺部感染,予左氧氟沙星0.4 g,每日1次静脉滴注症状无缓解,体温最高达39 ℃。支气管镜检查示支气管黏膜炎症,反复痰细菌培养、痰找抗酸杆菌、痰找真菌检查均阴性,血培养阴性。1周后复查胸部CT示双肺多发片状实变影伴磨玻璃密度增高影,范围较前扩大(图1B),改用美罗培南1.0 g,每8小时1次静脉滴注。半乳甘露聚糖检测(GM试验)为1.073 μg/L(参考范围:0~0.8 μg/L),1,3-β-D- 葡聚糖检测(G试验)阴性。考虑原发性侵袭性肺曲霉病可能性大,予伏立康唑第1天负荷量 400 mg,每12小时1次,静脉滴注,第2天起维持量200 mg,每12小时1次,静脉滴注,合并美罗培南抗细菌治疗。2 d后患者体温正常,10 d后复查胸部CT示双肺高密度实变影较前吸收,2周后患者症状缓解,复查超敏C反应蛋白、血常规正常,好转出院。出院后口服伏立康唑,200 mg,每12小时1次,随访期间无发热,无咳嗽、咯痰等症状,复查胸部CT示双肺高密度影逐渐吸收(图1C,图1D),3个月后停药。
病例2,患者男,41岁,因“咳嗽、咯痰、发热1周”入院。患者1周前无明显诱因出现咳嗽,咯黄痰,痰液黏稠,伴发热,最高体温38.8 ℃,无咯血,无胸痛,院外静脉滴注左氧氟沙星治疗2 d无效。患者为铜厂废弃铜处理工人,平素体健。体格检查:体温36.6 ℃,脉搏82次/min,血压132/82 mmHg,双肺呼吸音粗,左肺可闻及固定性湿啰音。胸部CT示双肺炎症,左肺支气管扩张(图2A);实验室检查:白细胞 31.33×109/ L, 中性粒细胞 27.00×109/L,淋巴细胞 1.97 ×109/L,血小板 234×109/L;超敏C反应蛋白 194.9 mg/L;降钙素原 4.28 μg/L;结核抗体阴性。 诊断为支气管扩张并感染,予左氧氟沙星0.4 g/d静脉滴注、哌拉西林-他唑巴坦 4.5 g,每日2次静脉滴注10 d,患者体温降至37.5 ℃左右,但仍有咳嗽、咯大量黄痰,复查血常规:白细胞 20.42×109/L, 中性粒细胞 17.17 ×109/L,淋巴细胞 2.32 ×109/L,血小板 266×109/L;超敏C反应蛋白 61.6 mg/L。胸部CT示双肺炎症较前明显进展(图2B),考虑抗感染效果差,改用美罗培南1.0 g,每8小时1次静脉滴注联合万古霉素1 g,每12小时1次静脉滴注治疗,1周后患者咳嗽、咯痰加重,体温升至38 ℃左右。入院后连续2次痰培养曲霉阳性,G试验277.2 ng/L(阳性>100 ng/ L),GM试验为1.08 μg/ L。考虑患者原发性侵袭性肺曲霉病可能,加用伏立康唑第1天负荷量400 mg,每12小时1次,第2天起予维持量200 mg,每12小时1次,同时合并美罗培南抗细菌治疗。抗真菌治疗7 d后患者症状缓解,复查超敏C反应蛋白、血常规正常,胸部CT示双肺高密度实变影较前略吸收(图2C),好转出院。出院后继续口服伏立康唑,200 mg,每12小时1次,随访期间无发热,无咳嗽、咯痰等症状,复查胸部CT示双肺高密度影逐渐吸收(图2D),3个月后停药。
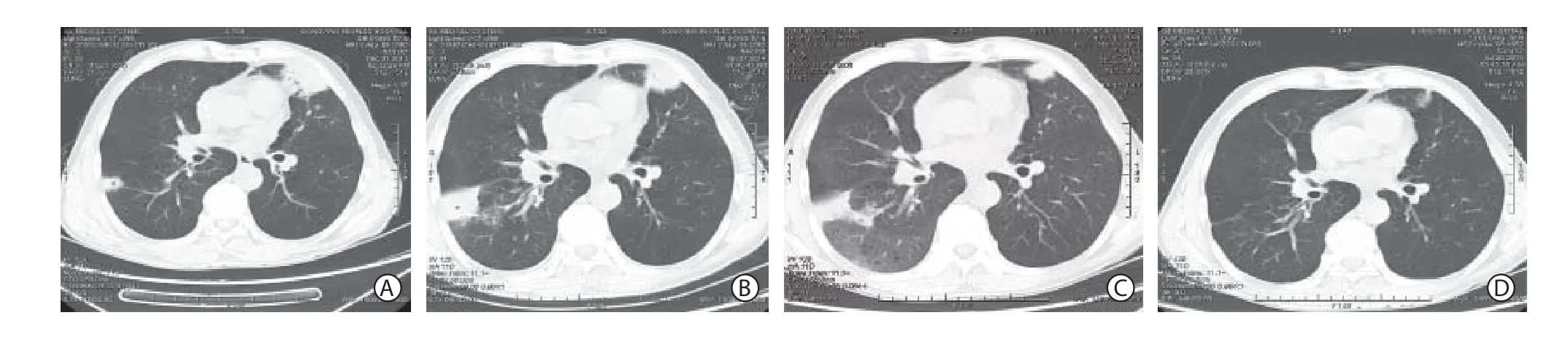
图1 胸部CT:双肺实变影Figure 1 Chest CT images showing consolidations in both lungs
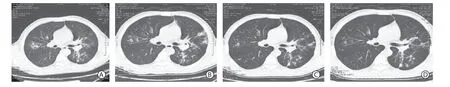
图2 双肺多发斑片影Figure 2 Chest CT images showing multiple patchy opacities in both lungs
2 讨论
曲霉广泛存在于自然界, 侵袭性肺曲霉病主要由烟曲霉引起,占85 %以上,其次为黄曲霉、黑曲霉,多在免疫功能缺陷或慢性病抵抗力低下时致病[2-3]。原发性侵袭性肺曲霉病主要发生于免疫功能正常的宿主,病情进展迅速,未经治疗者病死率高达90 %以上[4-5]。患者多有霉菌环境暴露史,当人体长期处于存在大量曲霉孢子的环境,吸入的曲霉孢子量超过机体的防御能力时,便会导致肺部感染,并可能播散导致全身播散性感染。2例患者均为接触曲霉孢子的工人,我们认为其主要致病因素为吸入职业环境中大量曲霉孢子。曲霉具有很强的嗜血管性,侵袭性肺曲霉病的主要病理特点表现为曲霉菌丝侵犯血管导致的血栓、坏死及出血性梗死等改变。CLANCY等[6]报道的12例原发性侵袭性肺曲霉病患者均死亡,其中有10例患者出现双侧肺浸润,3例发生肺部空洞,2例出现淋巴结侵犯情况,经病理分析,4例患者是播散型曲霉病,3例患者出现肺栓塞及坏死改变。
原发性侵袭性肺曲霉病的临床表现缺乏特异性,因真菌种类、病情轻重、病理类型的不同各异,VAIDEESWAR等[7]的研究表明发热、气短、咳黏液脓性痰、胸痛及咯血是最常见症状, 亦有40 %患者缺乏呼吸道症状或仅为发热,另有部分患者因仅表现为喘息、呼吸困难而被误诊为支气管哮喘。本文2例患者均以发热、咳嗽、咯痰为主要表现,1例伴有胸痛,临床表现与细菌性或病毒性肺炎难以区别。
侵袭性肺曲霉病患者胸部CT表现多变,以伴有晕轮征及空洞的结节影和以胸膜为基底的楔形实变影为最常见的征象,在疾病的不同阶段,CT征象有所不同。晕轮征常在发病后5~7 d出现,对侵袭性肺曲霉病的早期诊断极其重要,新月征多在病后2~3周出现,为晚期征象。研究指出[8],结节、实变及磨玻璃影3种病灶在不同免疫状态的侵袭性肺曲霉病患者发生率无明显差异,但免疫抑制者更容易出现多发病灶,可理解为免疫抑制的患者病变更易发生肺内播散。本组2例患者入院时均处于疾病早期,胸部CT以双肺多发实变影、空洞为主要表现,1周后复查胸部CT病灶明显进展,提示病情进展迅速,因此,对疑诊侵袭性肺曲霉病的患者,胸部影像学的动态变化极其重要。
侵袭性肺曲霉病确诊有赖于组织或除血液外的无菌体液分离或培养出非腐生曲霉,因此,当胸部CT有典型表现时,尽早行CT引导下经皮肺穿刺活检对于疾病的诊断具有重要意义。此外,气管镜检查可直观地观察病变的镜下改变,并在病变部位抽吸分泌物或灌洗液培养,对诊断同样具有很大帮助。研究表明[9], 在诊断侵袭性肺曲霉病时,呼吸道标本培养的灵敏度仅为30 %,但对于多次痰培养曲霉阳性的肺炎患者,特别是抗感染治疗无效时,一旦下呼吸道分泌物连续培养曲霉阳性,无论宿主免疫状态如何,都应考虑侵袭性肺曲霉病的可能。而且,对于反复痰培养阴性的患者,也同样不能排除侵袭性肺曲霉病的可能。体液GM试验对诊断侵袭性肺曲霉病灵敏度达80.7 %,特异度达89.2 %,而G试验对系统性真菌病的诊断有重要的筛查意义。不足之处在于2种方法均可受到药物、食物、交叉感染等因素的影响而出现假阳性结果。
侵袭性肺曲霉病患者初始治疗首选静脉或口服伏立康唑,病情严重者首选静脉方式。如初始治疗失败或对药物不耐受,可选择卡泊芬净、米卡芬净、两性霉素B脂质体、泊沙康唑进行补救治疗。初始治疗不推荐常规采用联合治疗,而在标准治疗不能耐受、多重耐药菌感染或广泛感染时可考虑联合治疗。
综上所述,原发性侵袭性肺曲霉病发病快、病死率高,应引起临床医师的高度重视。对于广谱抗生素治疗无效或合并哮喘的肺炎患者,特别是有霉菌环境暴露史者,在积极抗感染及规范平喘治疗无效时,均应想到合并曲霉感染的可能,做到及时诊治,降低病死率。
[1] 朱元钰,陈文彬.呼吸病学[M]. 北京:人民卫生出版社,2003:758.
[2] DENNING DW. Aspergillus species[M] //MANDELL G,DOUGLAS J, BENNETT D. Principles and Practice of Infectious Disease. Philadelphia: Churchill Livingstone,2000:2675- 2685.
[3] 郑旭婷,陈佰义.原发性侵袭性肺曲霉病1例[J]. 中国感染与化疗杂志,2012,12(2):142-144.
[4] 刘来昱,蔡绍曦,佟万成,等.原发性侵袭性肺曲霉病一例[J].中华结核和呼吸杂志,2006,29(9):644- 645.
[5] 陈瑞英,孙培宗,靳建军,等.原发性侵袭性肺曲霉病四例分析[J]. 中国呼吸与危重监护杂志,2007,6(5):385-387.
[6] CLANCY CJ, Nguyen MH. Acute community-aquired pneumonia due to Aspergillus in presumably immunocompetent hosts: clues for recognition of a rare fatal disease[J]. Chest,1998,114(2):629.
[7] VAIDEESWAR P, PRASAD S, DESHPANDE JR, et al. Invasive pulmonary aspergillosis: A study of 39 cases at autopsy[J]. J Postgrad Med, 2004, 50(1): 21- 26.
[8] 李静波, 张静萍, 陈佰义. 56 例侵袭性肺曲霉菌病临床分析[J]. 中华医院感染学杂志,2011,21(10):2009-2011.
[9] VOGESER M,WANDERS A,HAAS A,et al. Afour-year review of fatal Aspergilosis[J]. Eur J Clin Microbiol Infect Dis,1999,18(1):42-45.
Primary invasive pulmonary aspergillosis: a report of 2 cases
LIU Benhong, YU Jia, ZHAO Jingquan, GAO Songfeng, WANG Yuxin, XU Yongyun. (Department of Respiratory Medicine, Dongying General Hospital, Dongying Shandong 257000, China)
R519.8
D
1009-7708(2016)06-0797-03
10.16718/j.1009-7708.2016.06.023
山东省东营市人民医院呼吸内科,山东东营 257000。
刘本洪(1980—),男,医学硕士,主治医师,主要从事呼吸内科临床工作。
于佳,E-mail:29way@163.com。
2015-09-28
2016-03-03
