基于碳纳米管负载的电催化剂高效检测还原型谷胱甘肽
2016-11-28熊乐艳张楠李雪妮郭赞如郑龙珍
熊乐艳张楠李雪妮郭赞如郑龙珍
(华东交通大学化学化工系,南昌330013)
基于碳纳米管负载的电催化剂高效检测还原型谷胱甘肽
熊乐艳张楠李雪妮郭赞如*郑龙珍*
(华东交通大学化学化工系,南昌330013)
通过两步法合成了10-甲基吩噻嗪/2-羟丙基-β-环糊精主客体化合物修饰的多壁碳纳米管复合材料MPT-HP-β-CD/ MWNT,并用FT-IR、UV-Vis、荧光光谱、拉曼光谱、TEM等对其组成进行表征。通过CV曲线、i-t曲线对谷胱甘肽(GSH)的催化性能以及对催化剂阻抗的研究,证明了MWNT可以提高导电能力,提高对GSH的催化活性。此外,还研究了pH值、温度、扫速等对催化剂催化活性的影响,表明该复合材料可用于GSH的电化学检测,并具有良好的稳定性、重现性以及很高的灵敏度。最优检测浓度范围为5×10-7~4.95×10-5mol·L-1,检测限为3.96×10-8mol·L-1(S/N=3)。
谷胱甘肽;2-羟丙基-β-环糊精;10-甲基吩噻嗪;多壁碳纳米管;电化学检测
0 引言
谷胱甘肽(GSH)存在于所有哺乳动物的组织内,浓度在1~10 mmol·L-1范围,可以作为丰富的非蛋白巯基来抵抗体内的氧化反应[1]。谷胱甘肽浓度的改变是生物体内或组织内某些疾病产生的信号,例如白血病[2]、糖尿病[3]、DNA受损[4]和细胞癌变[5]。到目前为止,用来检测谷胱甘肽的方法主要有滴定法[6]、汞电极法[7]、离子交换法[8]、高效液相色谱法[9]、毛细管电泳法[10]、荧光探针法[11]、流动注射分析法[12-13]和荧光猝灭恢复法[14]等。电化学检测[15-16]是一种选择性好、检测时间短、测试费用低、灵敏度高的测定方法,可以被用来检测GSH。其中,Wang[17]等利用氧化石墨烯与CdTe制备了改型的电致化学发光量子点,可以在巯基化合物的干扰中选择性检测谷胱甘肽,检测范围0.04~0.29 μg·mL-1。
10-甲基吩噻嗪(MPT)是具有三苯环共轭体系,杂环上含有N,S等原子的疏水物质,这使得它成为一个富电子的体系,失去电子可以成为具有氧化性的活性阳离子。因而MPT具有很好的电化学活性和生理活性[18-19],研究MPT与一些生命物质之间的反应也越来越受大家的关注。碳纳米管(CNTs)是一种具有特殊结构的材料,常被用作电极材料。CNTs具有一维石墨结构,良好的机械强度和导电性、高的比表面积、化学稳定性强、生物相容性[20]良好等优点。因此它常被用做催化剂载体来促进催化剂均匀分散以及加快电极与催化剂之间电子的转移速度[21-22]。Zhang[23]等利用普鲁士蓝(PB)与碳纳米管之间π-π键的相互耦合作用,制备了SWCNTs-PB催化剂,实验证明该催化剂具备两者之间的优点,氧化还原性能得到很好的提升。Liu[24]等将多壁碳纳米管和石墨烯层层组装得到GR-MCNTs复合电极膜,这种复合电极膜与多壁碳纳米管和石墨烯电极相比,可以显著提高界面电子转移速率,在人类免疫球蛋白检测方面,表现出良好的选择性、稳定性和再现性。因此本文利用主客体反应将MPT包结在2-羟丙基-β-环糊精(HP-β-CD)的空腔中,并以SWCNTs为载体,将MPT-HP-β-CD催化剂负载到其表面,制备化学修饰电极,获得对GSH较好的催化氧化能力以及更低的检测限。
1 实验部分
1.1仪器与试剂
2-羟丙基-β-环糊精(阿拉丁股份有限公司),10-甲基吩噻嗪(东京化成工业有限公司),多壁碳纳米管(Sun Nanotech Co.Ltd.),N,N-二甲基甲酰胺(DMF) (西陇化工股份有限公司),还原型谷胱甘肽(阿拉丁股份有限公司),NaH2PO4·2H2O(西陇化工股份有限公司),Na2HPO4·12H2O(西陇化工股份有限公司),NaCl,HCl,N2(99.9%,国腾气体有限公司)、二次蒸馏水等。
傅立叶变换红外光谱仪(Nicolet5700,PerkinElmer公司),紫外可见分光光度计(Lambda 35,PerkinElmer公司),电化学工作站(CHI 760E,上海辰化仪器公司),荧光分光光度计(Cary Eclipse spectrometer,Varian,USA),拉曼光谱仪(LabRAM HR,HORIBA,France,以785 nm He-Ne激光为光源),透射电子显微镜TEM(Tecnai G2 F20 S-TWIN,FEI Co.Ltd.,USA,加速电压为200 kV)
1.2实验方法
1.2.1羧基化碳纳米管的制备
将100 mg MWNT溶解于装有120 mL混酸溶液的烧杯中,V浓硫酸∶V浓硝酸=3∶1。超声分散3 h后,将溶液转移到150 mL的三口烧瓶中,60℃油浴中冷凝回流2 h。将溶液缓慢倒入到600 mL的去离子水的烧杯中,水解12 h。抽滤,洗涤至pH=7.0。干燥,即得到水溶性良好的羧基化MWNT。称取10 mg羧基化的MWNT溶于10 mL DMF中,超声分散1 h,得到分散均匀的溶液。
1.2.2MPT-HP-β-CD催化剂的制备
准确称取10 mg MPT和80 mg HP-β-CD溶解于1 mL的DMF溶液,超声2 h,确保HP-β-CD成功包结MPT。烘干备用。
1.2.3MPT-HP-β-CD/MWNT催化剂的制备
准确量取1 mL羧基化的MWNT的DMF溶液加入到MPT-HP-β-CD的DMF溶液中。超声1 h,得到混合均匀的10-甲基吩噻嗪、2-羟丙基-β-环糊精和MWNT复合材料。将溶液在室温下,磁力搅拌12 h,使得MPT-HP-β-CD与MWNT之间可以通过吸附作用,将MPT-HP-β-CD吸附到MWNT表面,在烘箱中100℃下干燥12 h,最终得到MPT-HP-β-CD/MWNT粉末,过程如图1所示。将粉末溶解在10 mL二次蒸馏水中,超声30 min,待用。

图1 MPT-HP-β-CD/MWNT催化剂的制备示意图Fig.1 Schematic illustrates the reaction steps of MPT-HP-β-CD/MWNT catalyst
1.2.4电化学测试
将电极分别用粒径为0.1、0.3 μm的Al2O3在圆形帆布上打磨,在体积比为1∶1的乙醇水溶液中,超声清洗。电极在0.5 mol·L-1H2SO4溶液中活化,电位从-0.2 V到1.0 V,用CV曲线扫描20圈,用二次蒸馏水冲洗,N2吹干,然后滴加5 μL MPT-HP-β-CD/ MWNT催化剂于电极表面,室温下干燥。本实验用的PBS(pH=7.0)溶液是由NaH2PO4·2H2O、Na2HPO4· 12H2O和NaCl配置的,用HCl调节pH值(3.0~9.0)。电化学测试采用传统的三电极系统,玻碳电极(GCE)作为工作电极,Ag/AgCl作为参比电极,铂丝作为对电极。
2 结果与讨论
2.1催化剂的表征
2.1.1光谱表征
样品的FTIR光谱如图2所示。由图2可以清晰地看到所有样品在3 434 cm-1处有一个很宽的特征吸收峰,是-OH峰。图2a是MPT的红外光谱图,在1 592和1 458 cm-1处有2个典型的苯环的特征吸收峰,C-N键伸缩振动峰出现在1 133、1 259和1 327 cm-1处,C-S键的伸缩振动峰显示出现在744和862 cm-1处。图2b是MPT-HP-β-CD的红外光谱图,从图上可以看到在744、862、1 133、1 259和1 327 cm-1处有MPT的红外特征峰,说明可能形成了HP-β-CD和MPT的复合物。图2d是MWNT的红外谱图,在1 588 cm-1处为碳纳米管的C=C结构峰[24]。对于MPT-HP-β-CD/MWNT(图2c),在1 588 cm-1处出现了碳纳米管的C=C结构峰,属于MWNT,说明存在MPT-HP-β-CD/MWNT复合物。

图2 MPT(a)、MPT-HP-β-CD(b)、MPT-HP-β-CD/MWNT (c)、MWNT(d)和HP-β-CD(e)的傅立叶变换红外谱图Fig.2 FTIR spectra of MPT(a),MPT-HP-β-CD(b),MPTHP-β-CD/MWNT(c),MWNT(d)and HP-β-CD(e)
图3是样品的紫外吸收光谱(溶剂为乙醇)。结果显示MWNT、HP-β-CD在230~375 nm之间没有紫外特征吸收峰,MPT在254和308 nm处有2个特征吸收峰,这与MPT的三苯环共轭体系相对应。然而MPT-HP-β-CD在251 nm处有峰,与MPT相比特征峰发生了蓝移。其原因是由于疏水性的MPT进入HP-β-CD的疏水内腔里,减弱了生色基团之间的共轭效应,类似结构疏水性化合物进入CD的疏水内腔里也观测到类似的蓝移现象[25]。结合红外光谱可以说明HP-β-CD和MPT形成的复合物是HP-β-CD包结MPT的结构。而MPT-HP-β-CD/MWNT的特征峰在254 nm处,与MPT-HP-β-CD相比特征峰发生了红移。这可能是由于MWNT具有共轭双键,共轭的π键之间相互作用,生成了大π键,此时由于键的平均化,电子容易激发,生色作用就大大增强。

图3 MPT-HP-β-CD(a)、MPT(b)、MPT-HP-β-CD/MWNT (c)、MWNT(d)和HP-β-CD(e)的紫外吸收光谱Fig.3 UV-visible absorption spectra of MPT-HP-β-CD(a), MPT(b),MPT-HP-β-CD/MWNT(c),MWNT(d)and HP-β-CD(e)
样品的荧光光谱如图4所示。由图4可知,在275 nm波长激发下,MPT在350~500 nm之间有2个荧光特征峰(图4a),当加入HP-β-CD以后,MPT的特征峰发生了少量的红移和增强(图4b),这是由于环糊精对客体分子包结导致产生的荧光增强效应所引起的[26],进一步说明HP-β-CD包结了MPT。在我们加入MWNT后,由于HP-β-CD被MWNT吸附,原来属于MPT的特征峰几乎消失,如图4c所示。这可能是因为MWNT的加入,增强了MPT、HP-β-CD和MWNT三者之间的电子转移速率或者是能量转移,这也意味着MPT-HP-β-CD与MWCNT之间可能形成了π-π键[27]。

图4 MPT(a)、MPT-HP-β-CD(b)和MPT-HP-β-CD/ MWNT(c)的荧光光谱Fig.4 Fluorescence emission spectra of MPT(a),MPTHP-β-CD(b)and MPT-HP-β-CD/MWNT(c)
图5是以玻璃片为基底、激发波长632.8 nm下MPT-HP-β-CD/MWNT、MWNT、MPT-HP-β-CD和 HP-β-CD的拉曼光谱图。从图中可以看出MPT-HP-β-CD和HP-β-CD没有明显的拉曼峰,MWNT在1 306和1 566 cm-1处有2个特征峰,而MPT-HP-β-CD/MWNT在1 329和1 598 cm-1处有2个特征峰,相对于MWNT,2个特征峰都发生了不同程度的蓝移。这是由于MPT-HP-β-CD/MWNT复合材料导致MWNT内化学环境发生了变化,π键之间的电子云密度发生了改变,可能生成了大π键,此时由于键的平均化,电子容易激发,向短波方向移动[28]。
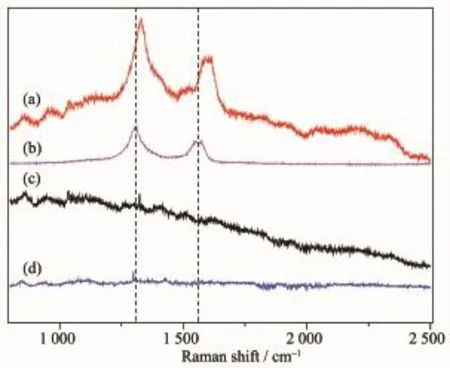
图5 (a)MPT-HP-β-CD/MWNT,(b)MWNT,(c)MPTHP-β-CD,(d)HP-β-CD的拉曼光谱图Fig.5 Raman spectra of(a)MPT-HP-β-CD/MWNT, (b)MWNT,(c)MPT-HP-β-CD,(d)HP-β-CD
2.1.2TEM表征
图6a是羧基化MWNT的透射电镜(TEM)照片,可以看出为管状结构。通过局部放大,可以清晰地看出其多壁结构(图6b),且壁厚度为0.34 nm,说明其为多壁碳纳米管。图6c为MPT-HP-β-CD/MWNT的TEM图。和羧基化MWNT(图6a)相比,MPT-HP-β-CD/MWNT(图6c)中不仅能看出多壁碳纳米管,还能在其表面清晰地看出一层包结物质存在(图中标示)。从其局部放大图中(图6d)可以进一步清晰地看出MWNT多壁结构以及包结物质厚度(图中标示),说明MWNT表面包结了一层MPT-HP-β-CD。因此,可以认为通过超声处理、长时间的搅拌吸附以及12 h的热处理,已经使得MPT-HP-β-CD复合材料成功的紧密包结在MWNT表面。
2.1.3不同催化剂的阻抗检测
采用三电极系统进行电化学阻抗测试,玻碳电极为工作电极,铂电极为对电极,Ag/AgCl电极为参比电极。通过测量阻抗来了解经过改性后的电极的导电能力的大小。从图7可以清楚的看到玻碳电极(GCE),MPT-HP-β-CD、MWNT、MPT-HP-β-CD和MPT -HP-β-CD/MWNT修饰电极的阻抗大小顺序为MPT-HP-β-CD>MPT-HP-β-CD/MWNT>GCE>MWNT,通过它们的半圆直径来估算它们的阻抗,分别为900、523、93和64 Ω。MPT-HP-β-CD>GCE是由于电极表面的HP-β-CD膜阻碍了MPT+与电极的接触,抑制了电极表面的电化学反应,但MPT-HP-β-CD>MPT-HP-β-CD/MWNT,则是因为羧基化的MWNT具有良好亲水性、导电性和大的比表面积,既能和电极表面紧密相连,又能与MPT-HP-β-CD紧密相连,该复合材料中MWNT的存在提高了MPT-HP-β-CD/MWNT的导电性和电子传递的速率。

图6 羧基化MWNTs(a,b)和MPT-HP-β-CD/MWNT催化剂(c,d)的TEM照片Fig.6 TEM images of MWNTs(a,b)and MPT-HP-β-CD/MWNT catalyst(c,d)
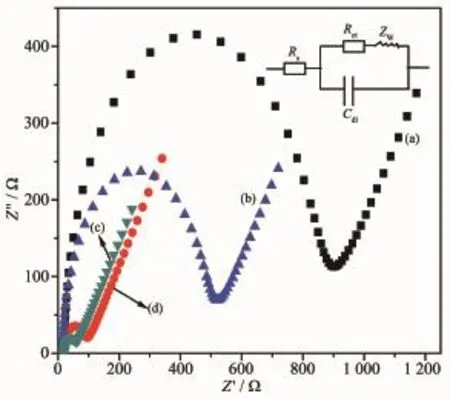
图7 修饰电极和玻碳电极在溶液中的阻抗图及其等效电路图Fig.7 Nyquist plots of modified GC and GCE
2.2MPT-HP-β-CD/MWNT修饰电极催化的催化活性
2.2.1氧化GSH
在图8A中可以清楚地看到MPT、MPT-HP-β-CD、MPT-HP-β-CD/MWNT修饰电极在中性的PBS溶液中含有一对可逆的MPT氧化还原峰。MPT氧化还原电位相比MPT-HP-β-CD的氧化还原电位右移,这说明HP-β-CD成功的将MPT包结在空腔内,且MPT在HP-β-CD中可以自由的移动[29]。而MPTHP-β-CD/MWNT的氧化还原电位介于MPT与MPT-HP-β-CD之间,这说明MPT-HP-β-CD成功的负载在MWNT表面,由于MWNT良好的导电性,以及MPT-HP-β-CD与MWNT之间的相互作用,使得电位向左移动。图8B展现的是GCE,MWNT,MPTHP-β-CD,MPT-HP-β-CD/MWNT修饰电极对GSH的催化能力,可以看到GCE和MWNT修饰电极对GSH没有催化效果,MPT-HP-β-CD/MWNT修饰电极的电流是MPT-HP-β-CD修饰电极的2.1倍,氧化电位从0.6 V左移至0.56 V,左移40 mV。这说明高效检测GSH的催化剂被成功制备。由图8C可以看出MPT-HP-β-CD/MWNT催化活性明显高于MPTHP-β-CD。这可能是由于具有良好导电性的MWNT提高了电子传递速率。
2.2.2温度、扫速和pH值对MPT-HP-β-CD/MWNT修饰电极催化活性的影响
不同温度下,催化剂展现出不同的催化活性,比如生物酶在高温下会失去活性,从而催化效果降低[30],因此研究温度的影响是非常重要的。而且可以通过阿仑尼乌斯公式计算出反应进行所需的活化能,进一步证明催化剂的催化活性。图9A显示的是不同温度下,MPT-HP-β-CD/MWNT催化剂对GSH的催化能力,随着温度的升高,氧化峰电流逐渐增大;以峰电流的对数和温度的倒数作图,得到线性直线如图9B所示,具有极好的线性关系,R2= 0.998 5,线性方程为y=8.164-1 987.532x,根据阿仑尼乌斯公式[31]ln i=-Ea/(RT)+B,可以计算出该反应所需的活化能为16.5 kJ·mol-1,这与我们之前工作测得MPT-HP-β-CD催化氧化GSH的活化能38.92 kJ·mol-1相比降低了1倍左右[32]。进一步证明了MPTHP-β-CD/MWNT比MPT-HP-β-CD更容易催化氧化GSH。
图10A是MPT-HP-β-CD/MWNT在不同扫速下的CV曲线,随着扫速的减小,氧化还原峰电流逐渐降低。在扫速为100 mV·s-1时,Ep=|Epa-Epc|=90 mV。以氧化峰电流和还原峰电流为纵坐标,以扫速的平方根为横坐标作图,得到两条线性良好的直线(图10B),线性相关系数为R2=0.997 7,这意味着该反应过程受扩散控制[33]。
pH值对催化反应的催化活性有非常大的影响,因此,研究了MPT-HP-β-CD/MWNT催化剂的最适pH值。图11A是不同pH值下,MPT-HP-β-CD/ MWNT对GSH的CV曲线。从图11B可以看到随着pH值的变化,峰电压几乎不变。但是峰电流在pH=7.0的时候达到最大值,同时向两边减小。因此,选择pH=7.0为该工作的实验最适条件。
2.2.3MPT-HP-β-CD/MWNT修饰电极对GSH的计时电流响应

图8 (A)GCE电极(a)、MPT(b)、MPT-HP-β-CD(c)、MPT-HP-β-CD/MWNT(d)修饰电极在PBS溶液中的CV曲线; (B)GCE电极(a)、MWNT(b)、MPT-HP-β-CD(c)、MPT-HP-β-CD/MWNT(d)修饰电极在含有9.6 μmol·L-1GSH的PBS(pH=7.0)溶液中的CV曲线(扫速50 mV·s-1);(C)MPT-HP-β-CD(a)和MPT-HP-β-CD/MWNT(b)修饰电极催化GSH的i-t曲线(氧化电位:0.58 V vs Ag/AgCl)Fig.8(A)CV curves of GCE(a)and MPT(b),MPT-HP-β-CD(c),MPT-HP-β-CD/MWNT(d)modified GC;(B)GCE(a) and MWNT(b),MPT-HP-β-CD(c),MPT-HP-β-CD/MWNT(d)modified GC in 9.6 μmol·L-1GSH+0.1 mol·L-1PBS(pH=7.0)solution(Scan rate:50 V·s-1);(C)Chronoamperometric responses of 16 μmol·L-1GSH at (a)MPT-HP-β-CD,(b)MPT-HP-β-CD/MWNT modified GC(Potential applied:0.58 V vs Ag/AgCl)

图9 (A)不同温度下288~333 K(间隔5 K),MPT-HP-β-CD/MWNT修饰电极在0.1 mol·L-1PBS (pH=7.0)+9.6 μmol·L-1GSH溶液中的CV曲线;(B)ln i与1/T的线性关系Fig.9(A)CVs of MPT-HP-β-CD/MWNT modified GC in 0.1 mol·L-1PBS+9.6 μmol·L-1GSH solution(pH=7.0) at different temperature(288~333 K,interval:5 K);(B)Linear relation between lni and 1/T

图10 (A)不同扫速条件下MPT-HP-β-CD/MWNT修饰电极在0.1 mol·L-1PBS(pH=7.0)溶液中的CV曲线; (B)峰电流与扫速平方根的线性关系Fig.10(A)CVs of MPT-HP-β-CD/MWNT modified GC in 0.1 mol·L-1PBS solution(pH=7.0)at different scan rates; (B)Plots of peak current against square root of scan rate
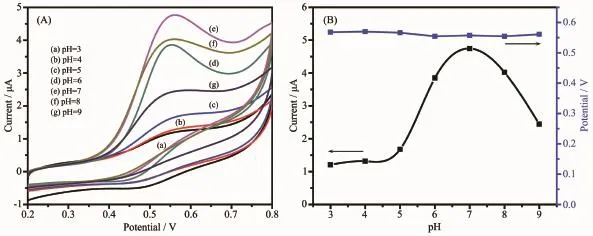
图11 (A)不同的pH值(3~9)条件下,MPT-HP-β-CD/MWNT修饰电极在9.7 μmol·L-1GSH+0.1 mol·L-1PBS溶液中的CV曲线;(B)峰电流、峰电压与pH值的关系Fig.11(A)CVs of MPT-HP-β-CD/MWNT modified GC in 9.7 μmol·L-1GSH+0.1 mol·L-1PBS solution at different pH values(3~9);(B)Plots of peak current and Potential against pH value

图12 (A)MPT-HP-β-CD/MWNT修饰电极催化氧化GSH的i-t曲线;(B)响应电流与GSH浓度的关系曲线Fig.12(A)Chronoamperometric response of MPT-HP-β-CD/MWNT modified GC to GSH;(B)Calibration curve of oxidation currents on different concentrations of GSH
MPT-HP-β-CD/MWNT修饰电极对GSH具有很高的催化氧化活性。因此,采用时间-电流(i-t)法对不同浓度的GSH进行检测。在恒电位0.56 V条件下,在0.1 mol·L-1PBS(pH=7.0)溶液中连续加入2μmol·L-1GSH溶液,得到比较稳定的响应电流。如图12A所示,随着GSH的不断增加,响应电流逐渐增大,这说明MPT-HP-β-CD/MWNT修饰电极对GSH浓度的变化具有很好的快速的电流响应。以响应电流对GSH的浓度作图(图9B),在浓度为5×10-7~4.95×10-5mol·L-1的浓度范围内呈现出良好的线性关系。线性方程为i/μA=0.152 4+0.0581 6c/(μmol· L-1)(R2=0.998 5),检出限为3.96×10-8mol·L-1(S/N=3)。
2.2.4MPT-HP-β-CD/MWNT修饰电极的抗干扰测试、稳定性和重现性
在0.1 mol·L-1PBS溶液(pH=7.0)中,加入抗干扰物质后对GSH进行测定,结果如图13所示。20倍浓度的果糖、淀粉、甘氨酸、葡萄糖等物质对实验结果不产生干扰,响应电流几乎不变,可见催化剂具有良好的抗干扰能力。
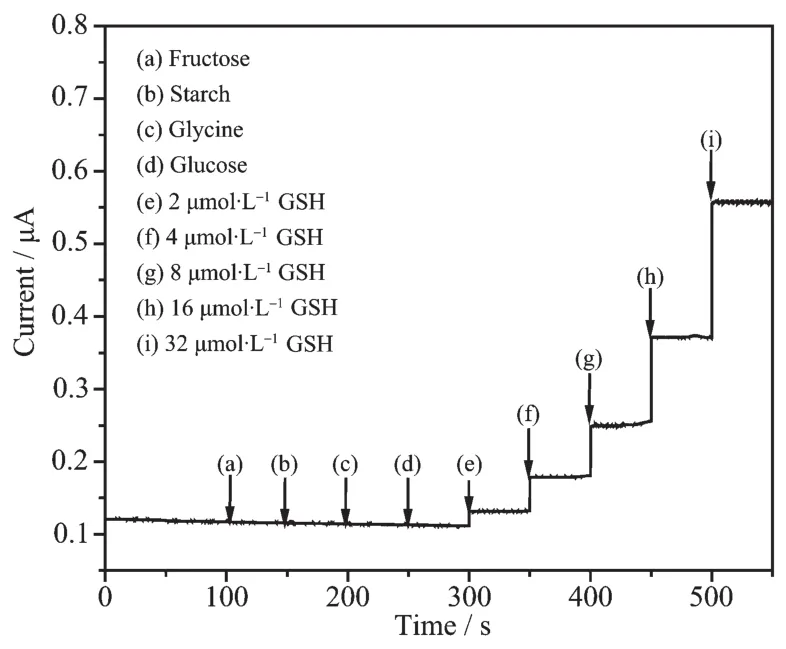
图13 MPT-HP-β-CD/MWNT修饰电极在干扰物质存在的条件下对不同浓度GSH的i-t曲线Fig.13 Chronoamperometric response of MPT-HP-β-CD/ MWNT modified GC to various concentrations of GSH with different interfering compounds
利用同一根MPT-HP-β-CD/MWNT修饰的玻碳电极在含0.96 μmol·L-1GSH的0.1 mol·L-1PBS溶液中平行测定10次,测得氧化峰电流值的大小相对标准偏差为1.5%,这证明MPT-HP-β-CD/ MWNT修饰电极重现性良好。对该电极进行储存实验,将修饰电极放置于4℃下冰箱中保存,每天检测阳极氧化峰电流,发现21 d后电流下降到92.5%,表明MPT-HP-β-CD/MWNT具有良好的稳定性。
2.2.5实际样品的检测
修饰电极在0.1 mol·L-1PBS溶液中加入药物还原型谷胱甘肽片进行加标回收实验,结果如表1所示,回收率为97%~102%,表明构建的修饰电极准确度和精确度较好,可用于实际样品的分析和检测。

表1 修饰电极对药物还原型谷胱甘肽片样品的分析结果Table1 Results of oxidation of reduced GSH tablets on modified electrode
2.2.6MPT-HP-β-CD/MWNT修饰电极电催化氧化GSH的机理
图14是MPT-HP-β-CD/MWNT修饰电极电催化氧化GSH的示意图,其反应机理可以解释为:MPT失去电子后,变成·MPT+,然后与GSH反应,生成GS·和MPT,即完成了对GSH的催化氧化[34]。电极与MPT-HP-β-CD之间有MWNT,它主要负责电极与MPT之间的电子传递,由于MWNT的导电性良好,因此可以加快电子的传递速率,从而加快反应。

图14 MPT-HP-β-CD/MWNT修饰电极电催化氧化GSH的示意图Fig.14 Reaction scheme for the electric catalytic oxidation of GSH on MPT-HP-β-CD/MWNT modified electrode
3 结论
用两步法成功地制备了MPT-HP-β-CD/MWNT催化剂,该催化剂对GSH展现出极好的催化氧化性能。MPT-HP-β-CD/MWNT修饰电极表现出一个很大的检测范围(5×10-7~4.95×10-5mol·L-1),检测限为3.96×10-8mol·L-1(S/N=3)。抗干扰实验还证明其对糖类具有很强的抗干扰能力。通过对实际样品的检测,表明构建的催化剂准确度和精确度较好,可用于实际样品的分析和检测。新型的MPT-HP-β-CD/MWNT催化剂在生物分析检测低浓度的还原型谷胱甘肽方面将会有许多潜在的应用。
[1]Ookhtens M,Kaplowitz N.Semin.Liver Dis.,1997,18(4):313 -329
[2]Hwang C,Sinskey A J,Lodish H F.Science,1992,257(5076): 1496-1502
[3]Devi G S,Prasad M H,Saraswathi I,et al.Clin.Chim.Acta, 2000,293(1):53-62
[4]McDonagh M,Ali L,Kahn A,et al.Biochem.Soc.Trans., 1997,25(1):146S-146S
[5]Halliwell B.Free Radical Res.,1998,29(6):469-486
[6]Singh S V,Xu B H,Tkalcevic G T,et al.Cancer Lett.,1994, 77(1):15-24
[7]Nagendra P,Yathirajan H S,Rangappa K S,et al.J.Indian Chem.Soc.,2002,79(7):602-604
[8]Tabor C W,Tabor H.Anal.Biochem.,1977,78(2):543-553
[9]LIN Li(林丽),CAO Xu-Ni(曹旭妮),ZHANG Wen(张文), et al.Chin.J.Anal.Chem.(分析化学),2003,31(3):261-265
[10]WANG Qing-Jiang(王清江),CHEN Xiang(陈相),DING Fei (丁飞),et al.Chin.J.Anal.Chem.(分析化学),2005,33(7): 969-971
[11]Kim G J,Yoon D H,Yun M Y,et al.RSC Adv.,2014,4 (36):18731-18736
[12]Redegeld F A M,Van Opstal M A J,Houdkamp E,et al. Anal.Biochem.,1988,174(2):489-495
[13]Satoh I,Arakawa S,Okamoto A.Sens.Actuators B,1991,5 (1):245-247
[14]Raoof J B,Ojani R,Karimi-Maleh H,et al.Anal.Methods, 2011,3(11):2637-2643
[15]Ndamanisha J C,Bai J,Qi B,et al.Anal.Biochem.,2009, 386(1):79-84
[16]Budnikov G K,Ziyatdinova G K,Valitova Y R.J.Anal. Chem.,2004,59(6):573-576
[17]Wang Y,Lu J,Tang L,et al.Anal.Chem.,2009,81(23):9710 -9715
[18]Domelsmith L N,Munchausen L L,Houk K N.J.Am.Chem. Soc.,1977,99(20):6506-6514
[19]Domelsmith L N,Munchausen L L,Houk K N.J.Am.Chem. Soc.,1977,99(13):4311-4321
[20]Fan S,Chapline M G,Franklin N R,et al.Science,1999, 283(5401):512-514
[21]Wang Z,Xiao S,Chen Y.J.Electroanal.Chem.,2006,589 (2):237-242
[22]Zhang Y,Wen Y,Liu Y,et al.Electrochem.Commun.,2004, 6(11):1180-1184
[23]Liu Y,Liu Y,Feng H,et al.Biosens.Bioelectron.,2012,35 (1):63-68
[24]CHEN Chuan-Sheng(陈传盛),LIU Tian-Gui(刘天贵),CHEN Xiao-Hua(陈小华),et al.Rare Metal Mater.Eng.(稀有金属材料与工程),2009,S1:477-480
[25]Guo Z,Feng Y,Zhu D,et al.Adv.Funct.Mater.,2013,23 (40):5010-5018
[26]WANG Guang-Hui(王光辉),HUANG Lei(黄磊),YU Rong (于荣).J.Yunnan University:Nat.Sci.Ed.(云南大学学报:自然科学版),2008,30(6):606-610
[27]Guo Z,Yin H,Feng Y,et al.RSC Adv.,2016,6(44):37953-37964
[28]Jiang C M,Lin X Q.J.Power Sources,2007,164(1):49-55
[29]Kang Y,Yuan J,Yan Q,et al.Polym.Adv.Technol.,2012, 23(2):255-261
[30]Tian X,Cheng C,Yuan H,et al.Talanta,2012,93:79-85
[31]Zheng L Z,Xiong L Y,Liu Q,et al.Electrochim.Acta, 2011,56(27):9860-9867
[32]Li X N,Zheng L Z,Wang Y M,et al.RSC Adv.,2015,5 (88):71749-71755
[33]Fajerwerg K,Foussard J N,Perrard A,et al.Water Sci. Technol.,1997,35(4):103-110
[34]Gong X,Li H.J.Electrochem.Soc.,2000,147(1):238-241
An Electrocatalyst Based on Carbon Nanotubes with a High Sensitivity for Detection of Reduced Glutathione
XIONG Le-Yan ZHANG Nan LI Xue-Ni GUO Zan-Ru*ZHENG Long-Zhen*
(Department of Chemistry and Chemical Engineering,East China Jiaotong University,Nanchang 330013,China)
10-Methylphenothiazine/2-hydroxypropyl-β-cyclodextrin guest-host compounds were mixed with singlewalled carbon nanotubes to give composite materials MPT-HP-β-CD/MWNT by a two-step method,which were characterized by FT-IR,UV-Vis,fluorescence spectroscopy,Raman spectrum and TEM.The applications of these composite materials toward the catalytic oxidation of glutathione(GSH)were demonstrated by cyclic voltammetry measurements.These results proved that the presence of MWNT could improve the electrical conductivity and catalytic activity of the composite material.The influences of the pH value,temperature,and scan rate on the catalyst activity were examined.These studies suggest that the MPT-HP-β-CD/MWNT composite materials could be used for the electrochemical detection of GSH with good stability and reproducibility and high sensitivity.The optimal detection concentration is 5×10-7~4.95×10-5mol·L-1and the detection limit is 3.96×10-8mol·L-1(S/N=3).
glutathione;2-hydroxypropyl-β-cyclodextrin;10-methylphenothiazine;multi-walled carbon nanotubes; electrochemical detection
O657.1
A
1001-4861(2016)11-1942-09
10.11862/CJIC.2016.225
2016-01-07。收修改稿日期:2016-09-07。
国家自然科学基金(No.21465011,51563009)、江西省青年科学基金(No.20151BAB213015)和江西省主要学科学术和技术带头人计划(No.20133BCB22007)资助项目。
*通信联系人。E-mail:guozanru@ecjtu.edu.cn,zlz@ecjtu.edu.cn
