Fe(Ⅱ)掺杂Nb2O5微纳球的水热合成及其电化学性能
2016-11-28张迎霞米常焕李洪森
张迎霞 米常焕 李洪森
(江苏省能量转换材料与技术重点实验室,南京航空航天大学材料与科学技术学院,南京210016)
Fe(Ⅱ)掺杂Nb2O5微纳球的水热合成及其电化学性能
张迎霞米常焕*李洪森
(江苏省能量转换材料与技术重点实验室,南京航空航天大学材料与科学技术学院,南京210016)
采用一步水热法合成Nb2O5和Fe(Ⅱ)掺杂的五氧化二铌微纳米球(Fe-Nb2O5),并利用X射线衍射(XRD)、扫描电子显微镜(SEM)及透射电子显微镜(TEM)等测试手段分别对其结构和形貌进行了表征。结果发现,所合成的Fe-Nb2O5和Nb2O5均为正交晶相,Nb2O5为尺寸分布在50~300 nm之间的形貌不规则颗粒,而Fe-Nb2O5是由约50 nm的一次颗粒自组装而成的直径约为1 μm的均匀微纳米球,即具有多级结构,其有利于增大电极材料与电解液的接触界面。电化学测试结果表明,Fe-Nb2O5的循环稳定性和倍率性能得到明显改善,在50 mA·g-1电流密度下,100次循环后放电容量仍保持在193.2 mAh·g-1,即使在5 A·g-1的电流密度下,容量仍可达到108.4 mAh·g-1。并分析了其性能改善的原因。
锂离子电池;负极材料;五氧化二铌;掺杂;电化学性能
0 引言
Nb2O5属于n-型过渡金属氧化物半导体,其较大的禁带宽度导致其较低的导电率(σ≈3×10-6S· cm-1),可以看做绝缘体[1-2]。Nb2O5存在多种晶型,以伪六方(H-Nb2O5),正交(O-Nb2O5),四方(T-Nb2O5),单斜(M-Nb2O5)四种晶体结构最为常见[2-4]。晶体结构与煅烧温度有关[4],不同晶体结构只是层状的剪切面上NbO6八面体数目不同[3]。从热力学角度来看MNb2O5最为稳定,H-Nb2O5是最不稳定的,适当的热处理很容易转换M-Nb2O5[4]。Nb2O5以其高折光率、较宽的带隙、高化学稳定性以及耐腐蚀性等独特的物理化学性质在气体传感器、[5]催化、[6]及色素增感太阳能电池的光电极[7-8]等领域的潜在应用引起研究者的广泛关注。Reichman和Bard报道了Nb2O5可应用于非水系锂离子电池负极材料[9];Kumagai提出Nb2O5是为数不多的几个充电电压低于2 V的负极材料[3],Kodama经测试证明正交型Nb2O5在脱嵌锂过程中晶型结构保持不变,晶胞体积膨胀不超过1%,具有良好的结构稳定性[10],并发现正交晶型的Nb2O5的放电比容量相对较高,并且具有赝电容特性[2-4]。目前,Nb2O5作为锂离子电池负极材料存在的主要问题:(1)Nb2O5较大的禁带宽度导致其较低的导电率,因此在充放电过程中会产生较大的极化,从而影响其电化学性能[1];(2)材料颗粒之间及颗粒与集流体之间的电接触也会影响电极导电性,随着充放电循环的进行,接触电阻逐渐增大[3];(3)Nb2O5不同晶型导致其嵌入活化能以及离子扩散路径不同,从而导致其脱嵌锂性能不同[3,9]。为了改善Nb2O5电化学性能,目前报道的途径主要有:减小颗粒尺寸[2,4,10]、碳复合及离子掺杂来改善其离子和电子电导率[4,11-18]。例如,Wang等[13]通过水热法在碳管上原位生长Nb2O5,在0.25C的电流密度下,容量可达到232 mAh·g-1,即使在100C的电流密度下,仍保持在44 mAh·g-1,改善了其倍率性。Wang等[14]通过无定型碳来包覆Nb2O5纳米片,其在100 mA·g-1的电流密度下充放电100次循环后,放电比容量仍高达369 mAh·g-1。碳包覆只是提高晶粒间的导电性,大电流时易破坏晶粒间的晶体结构[15],而金属离子的掺杂可以通过晶格畸变而使晶体内部脱嵌锂空穴量增加,从而改善锂离子传输路径,提高锂离子扩散速率,进而提高电导率[16-18]。Veit[4]通过静电纺丝的方法制备了Ta(Ⅱ)掺杂(原子比为15%)的Nb2O5循环稳定性得到大大提升,放电比容量从第2次到第50次容量只衰减了10%。Xu[11]制备了Ti(Ⅱ)(原子比为19.4%)掺杂Nb2O5其储Li+容量从157.9 mAh·g-1提高为204.3 mAh·g-1,在5C的电流密度下,1 000次循环后容量保持率为88%。
Li等[19]提出,Fe(Ⅱ)离子可以作为V2O5晶格的稳定剂作用,提高其氧化还原反应的可逆性,且Fe(Ⅱ)掺杂的V2O5电极表现出比V2O5对应更好的性能。将铁掺杂铌位的报道却很少见于报道。本文采用水热法制备了Fe(Ⅱ)掺杂的正交晶型的Nb2O5尺寸均一的微纳米球。并探究了Fe-Nb2O5作为锂离子电池负极材料在1~2.6 V电压下的电化学性能,同时还探究了Nb2O5的电化学性能。结果表明,利用该方法制备的Fe(Ⅱ)掺杂Nb2O5纳米材料表现出较高的电化学可逆容量和优异的循环稳定性。
1 实验部分
1.1Nb2O5及Fe-Nb2O5的制备
将1 mmol的NbCl5(阿拉丁试剂有限公司)分散在10 mL的无水乙醇(国药集团化学试剂有限公司)中,搅拌20 min后,加入10 mL的蒸馏水再搅拌20 mL,放入30 mL的聚四氟乙烯反应釜中,200℃反应24 h后,分别用去离子水和无水乙醇经离心机清洗若干次后,80℃干燥12 h。最后放入管式炉中,以2℃·min-1速率升温到800℃空气氛下煅烧2 h后样品即为Nb2O5。Fe-Nb2O5的合成除了在反应釜中多加入0.033 4 mg无水FeCl3(国药集团化学试剂有限公司)(Fe和Nb的原子比为1∶5)外,其余步骤同上。
1.2材料表征
XRD测试采用德国Bruker-D8型X射线衍射仪,辐射源Cu Kα(λ=0.154 18 nm),管电压40 kV,管电流40 mA,扫描范围10°~80°。FT-IR测试采用美国尼高利公司的NEXU670傅里叶变换红外光谱仪,采用日本岛津公司的UV-3600紫外可见近红外分光光度计测试紫外可见吸收光谱。通过HITACHI公司的S-4800型电场发射式-扫描电子显微镜、牛津X射线能谱仪X-MAX-20和日本JEOL公司的JEM-2010型透射电子显微镜观察表观形貌。
1.3电池组装及电化学性能测试
将Nb2O5(或Fe(Ⅱ)掺杂Nb2O5),乙炔黑(上海彬彬科技有限公司),聚偏氟乙烯(PVDF),按照7∶2∶1的质量比研磨均匀,并用N-甲基吡咯烷酮(NMP)(化学纯,国药集团化学试剂有限公司)调浆后均匀涂在铜箔上,然后将其置于真空烘箱内110℃保温12 h。将金属锂片作为负极,分别将Nb2O5和掺杂铁的Nb2O5作为正极,聚丙烯(pp)膜(Cellgard 2400)作为隔膜,电解液为1 mol·L-1LiPF6(聚乙烯酯(EC)、碳酸甲乙酯(EMC)和碳酸二甲酯(DMC)体积比为1∶1∶1),在高纯氩气氛的手套箱中组装成CR2016型纽扣电池,在室温下静置12 h后,采用LAND CT2001A电池测试系统进行充放电以及倍率测试,电压范围为1~2.6 V。循环伏安曲线在CHI 660D电化学工作站(上海辰华仪器有限公司)上进行,测试电位为1~2.6 V。
2 结果与讨论
2.1结果与形貌分析
Nb2O5、Fe(Ⅱ)掺杂的Nb2O5(Fe-Nb2O5)的XRD图如图1(a)所示,可以看出Nb2O5属于正交晶型,其衍射峰与标准卡片PDF#030-0873一致,主要峰值:2 2.61°、28.40°、28.87°、36.60°、36.99°、46.16°、50.88°、50.92°、55.08°、56.36°、63.78°、70.35°、71.52°。Fe-Nb2O5与Nb2O5的XRD图对比可知,主要的衍射峰(180)、(181)向更小的角度偏移(分别为0.092°、0.108°),Fe-Nb2O5的晶格参数为a=0.617 6 nm,b= 2.993 1 nm,c=0.393 6 nm比Nb2O5(a=0.617 5 nm,b=2.917 5 nm,c=0.393 nm)的大,由于Fe(Ⅱ)离子半径(0.064 5 nm)比Nb(Ⅱ)离子半径(0.064 nm)略大[11],晶格常数有变大的趋势,说明Fe(Ⅱ)的成功掺杂。EDS分析(图1(b))表明纳米粒子由Nb、O、Fe 3种元素组成(Si和C来自于测试所用的硅片和导电胶),此结果进一步表明该纳米粒子为Fe(Ⅱ)掺杂的Nb2O5,与XRD的分析结果一致。Fe比Nb的原子百分数之比为4.01∶23.94(可能FeCl3极易吸水,在称量过程中存在误差)。Fe(Ⅱ)的掺杂使Fe-Nb2O5中含有Nb(Ⅱ)),很难确定Fe-Nb2O5中O的含量,可以简化Fe(Ⅱ)掺杂的Nb2O5化学式为FexNb2O5(x=0.33)[19-20]。
图1(c)为Nb2O5以及Fe-Nb2O5的红外光谱图,二者均在3 406 cm-1存在羟基与水分子形成氢键引起的伸缩振动峰,在1 622 cm-1为水分子的弯曲振动特征吸收振动峰,表明材料中仍然存在少量的水分子。同时,图谱中都含有808 cm-1处Nb-O-Nb的振动吸收峰和564 cm-1处Nb-O振动吸收峰[21-22]。在570 cm-1处Fe-O-Nb的吸收峰没有出现,可能与Nb-O振动吸收峰重合。图1(d)为紫外吸收光谱图,可以看出Fe-Nb2O5的吸收带边大约位于490 nm,较Nb2O5(410 nm)吸收带红移约80 nm。其原因可能Fe原子的3d轨道与Nb原子的3d轨道、O原子的2p轨道杂化,在Nb2O5的导带与价带之间形成了新的杂质能级,改变了电子跃迁能级,使得吸收带边产生了红移[23-25],也有可能因为微纳米结构Fe-Nb2O5具有更大的比表面积及多孔结构使其有更好的捕光效果[26]。

图1(a)Nb2O5以及Fe-Nb2O5的XRD图;(b)Fe-Nb2O5的EDS谱图;(c)Nb2O5以及Fe-Nb2O5的红外光谱图; (d)紫外可见吸收光谱图Fig.1(a)XRD of Nb2O5and Fe-Nb2O5,(b)EDS image of Fe-Nb2O5,(c)FT-IR spectra and (d)UV-Vis absorption spectra of Nb2O5and Fe-Nb2O5
图2分别给出了Nb2O5的SEM(a)及Fe-Nb2O5的SEM(b),TEM(c)和HRTEM(d)图。从图2(a)可以看出,Nb2O5颗粒是不规则的,其尺寸分布在50~300 nm之间,而掺杂Fe(Ⅱ)后出现了不同的形貌,如图2 (b)所示,Fe-Nb2O5是由约50 nm的一次颗粒自组装而成的直径约为1 μm的二次颗粒,即具有多级结构的微纳球,颗粒与颗粒之间有丰富的空隙。由于杂质Fe(Ⅱ)的引入,降低了Nb反应物的过饱和度,抑制了溶剂热反应过程中的Nb2O5晶粒的成核与长大,所以Fe-Nb2O5一次颗粒比纯Nb2O5小而且均匀[27]。微纳米球的形成可能是因为高温条件下,Fe(Ⅱ)的水解作用所致[28]。从图2(c)中可以清楚的看到Fe-Nb2O5颗粒尺寸在1 μm左右,而图2(d)表明晶格间距为0.226 nm,对应(001)晶面。据报道,整个ab平面(001)之间的空隙为锂离子传输提供自然的途径,需要克服较低的能垒[29],另外,纳米颗粒在结构上沿着(001)方向增长[29]。

图2 Fe-Nb2O5的SEM(a),TEM(c)和HRTEM(d)图以及Nb2O5的SEM(b)Fig.2 SEM images of sample Fe-Nb2O5(a)and Nb2O5(b);(c)and(d)TEM images of sample Fe-Nb2O5at low magnification and high magnification
2.2电化学测试
Nb2O5和Fe-Nb2O5循环伏安(CV)测试如图3所示。图3a描述了Nb2O5前3次CV循环曲线,首次还原峰分别为1.76和1.49 V,对应着Nb(Ⅱ)还原成Nb(Ⅱ),Nb(Ⅱ)还原成Nb(Ⅱ),氧化峰为1.81 V是由于锂离子脱出形成,公式为Li++x e-+Nb2O5⇌LixNb2O5[30-31],第二循环和第三循环还原峰为1.62和1.42 V,氧化峰为1.82 V。首次和第二、三循环具有较大的差异是由于SEI膜的形成和电解液的分解会造成一部分Li+的不可逆损失[32-34],第二、三循环几乎完全重合表明循环性能好;图3b给出了Fe-Nb2O5前3次CV循环曲线,首次还原峰分别为1.78和1.68 V,氧化峰为1.81 V。通过比较,第二循环和第三循环氧化峰未发生明显的偏移,良好的重现性表明Fe-Nb2O5电极的储锂反应有着非常好的可逆性。明显的发现Fe-Nb2O5的循环伏安曲线的氧化还原峰间距(0.15 V)比Nb2O5小(0.42 V)并且更对称、更尖锐,这是因为Fe(Ⅱ)的掺杂使Nb2O5导电率增加,从而增强了Nb2O5可逆性和反应活性。
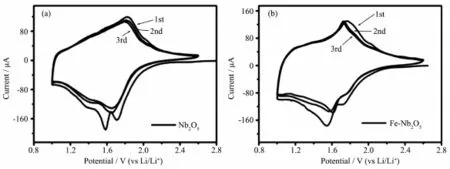
图3 Nb2O5(a),Fe-Nb2O5(b)在扫速为0.2 mV·s-1的CV图Fig.3 CV curves of sample Nb2O5(a)and Fe-Nb2O5(b)at 0.2 mV·s-1
图4分别为Nb2O5和Fe-Nb2O5在电流密度为50 mAh·g-1(0.25 C)下的充放电曲线。Nb2O5典型的放电曲线(如图4(a))表明Nb2O5是嵌入型的电化学反应,并且Li+嵌入的电极材料过程仍然是单相过程,在整个充放电过程中,没有两相界面形成,没有一个恒定的电压平台,已经被Viet等人[2]证实。在首次充放电过程中,Nb2O5电极放电以及可逆的比容量分别为163.1、116.8 mAh·g-1,首次库伦效率为72.8%。而Fe-Nb2O5电极材料首次放电以及可逆的容量分别为325、245.8 mAh·g-1,首次库伦效率为75.6%。首次充放电过程中不可逆的容量损失主要因为SEI膜的形成及电解液的分解造成一部分Li+的不可逆损失[21-22,26],Fe-Nb2O5首次库伦效率高于Nb2O5,说明Fe-Nb2O5导电性优于Nb2O5。
可逆性和循环稳定性是判断储锂性能的重要因素,因此进行了倍率性和循环稳定性测试来描述Fe-Nb2O5和Nb2O5的储锂行为。图5展示了Fe-Nb2O5和Nb2O5在不同的电流密度下容量对比图,随着电流的增加,容量有衰减的趋势,当从低电流密度50 mA·g-1(0.25C)到高电流密度5 A·g-1(25C),Fe-Nb2O5和Nb2O5的容量分别从245.8和131.2 mAh·g-1衰减到108.4和56 mAh·g-1,这是由于大的电流密度导致极化严重。当电流密度再回到50 mAh·g-1,Fe-Nb2O5容量可达到243.3 mAh·g-1,而Nb2O5容量只能达到126.6 mAh·g-1。相对而言,Fe-Nb2O5具有更优异的倍率性能。在电压区间为1~2.6 V,50 mAh·g-1的电流密度下测试二者的循环性能,Nb2O5从第2次到100次放电以及可逆的比容量保持在69、68.5 mAh·g-1,放电容量保持率为63%,库伦效率为98.6%。Fe-Nb2O5从第2次到100次后放电以及可逆的比容量保持在194.3、193.6 mAh·g-1,放电容量保持率为81%,库伦效率为99.6%。意味着Fe-Nb2O5具有更好的循环性能和良好的电极过程动力学[35]。可以看出,两种电极材料放电容量都有衰减,根据文献报道,衰减是因为Nb2O5导电性差并且随着充放电循环的进行,接触电阻逐渐增大[3],主要发生在放电曲线倾斜的地方,电极材料的极化导致。可以看出Fe-Nb2O5表现出了更高的循环稳定性,造成这种差异的原因主要来自两方面:(1)Fe(Ⅱ)的掺杂提高层状结构的稳定性,能够抑制活性物质溶解[20],并且在测试电压范围内Fe(Ⅱ)是嵌锂惰性的[35-36];(2)Fe-Nb2O5微纳米球的构建,克服了动力学的局限性,提高了储锂性能,有效改善电化学性能[37-38]。
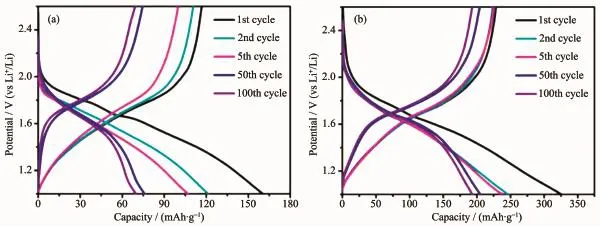
图4 Nb2O5(a),Fe-Nb2O5(b)在50 mA·g-1(0.25C)的电流密度下的充放电曲线Fig.4 Discharge/charge curves of Nb2O5(a)and Fe-Nb2O5(b)for selected cycles at current rate of 50 mA·g-1(0.25C)

图5 (a)Nb2O5、Fe-Nb2O5在不同电流密度下的倍率性能;(b)Nb2O5、Fe-Nb2O5在50 mAh·g-1(0.25C)电流密度下的循环稳定性Fig.5(a)Relationship between capacity and current density of sample Nb2O5and Fe-Nb2O5; (b)Capacity retention during 100 cycles at a current density of 50 mA·g-1(0.25C)of sample Nb2O5and Fe-Nb2O5
3 结论
本文采用水热法合成了Fe(Ⅱ)掺杂的正交晶型的多级结构的五氧化二铌,Fe(Ⅱ)掺杂不仅提高了导电率(通过四探针法测电导率为2×10-3S·cm-1)还提高了晶体结构的稳定性,使Fe-Nb2O5的倍率性能和循环稳定性得到了明显改善。同时,自组装成微纳米球结构,提高了其活性物质的利用率进而提高了其容量。50 mA·g-1电流密度下首次放电比容量从163.1 mAh·g-1提高到325 mAh·g-1,Fe-Nb2O5从第2次到第20次容量保持率为92%;即使在大的电流密度下5 A·g-1,容量仍可保持在108.4 mAh·g-1。
[1]Wang X,Li G,Chen Z,et al.Adv.Energy Mater.,2011,1(6): 1089-1093
[2]Viet AL,Reddy M,Jose R,et al.J.Phys.Chem.C,2009, 114(1):664-671
[3]Kumagai N,Koishikawa Y,Komaba S,et al.J.Electrochem. Soc.,1999,146(9):3203-3210
[4]Le Viet A,Reddy M,Jose R,et al.Electrochim.Acta, 2011,56(3):1518-1528
[5]Wang Y D,Yang L F,Zhou Z L,et al.Mater.Lett.,2001,49 (5):277-281
[6]Carniti P,Gervasini A,Marzo M.J.Phys.Chem.C,2008, 112(36):14064-14074
[7]Jose R,Thavasi V,Ramakrishna S.J.Am.Ceram.Soc., 2009,92(2):289-301
[8]Chen S G,Chappel S,Diamant Y,et al.Chem.Mater.,2001, 13(12):4629-4634
[9]Reichman B,Bard A J.J.Electrochem.Soc.,1981,128:344-346
[10]Kodama R,Terada Y,Nakai I,et al.J.Electrochem.Soc., 2006,153(3):A583-A588
[11]Wang X,Lee P S.J.Mater.Chem.A,2015,3(43):21706-21712
[12]CAO Yan(曹艳).Iron Steel Vanadium Titanium(钢铁钒钛), 2011,32(3):7-11
[13]Wang X,Li G,Tjandra R,et al.RSC Adv.,2015,5(51): 41179-41185
[14]Wang L,Ruan B Y,Xu J T,et al.RSC Adv.,2015,5(45): 36104-36107
[15]Ge H,Li N,Li D,et al.Electrochem.Commun.,2008,10(7): 1031-1034
[16]Wolfenstine J,Allen J L.J.Power Sources,2008,180(1):582 -585
[17]Kallel W,Bouattour S,Ferreira L F V,et al.Mater.Chem. Phys.,2009,114(1):304-308
[18]Shenouda A Y,Murali K R.J.Power Sources,2008,176(1): 332-339
[19]Li S R,Ge S Y,Qiao Y,et al.Electrochim.Acta,2012,64: 81-86
[20]Park H K.Solid State Ionics,2005,176(3):307-312
[21]Risti M,Popovi S,Musi S.Mater.Lett.,2004,58(21):2658-2663
[22]ZHANG Yan(张妍),YU Jian-Qiang(于建强),GAO Xing-Long(高行龙),et al.Chinese J.Inorg.Chem.(无机化学学报),2011,27(1):141-144
[23]HUANG Sheng-Dong(黄东升),CHEN Chao-Feng(陈朝凤), LI Yu-Hua(李玉花),et al.Chinese J.Inorg.Chem.(无机化学学报),2007,23(4):738-742
[24]ZHANG Xue-Jun(张学军),GAO Pan(高攀),LIU Qing-Ju(柳清菊).Chin.J.Phys.(中国物理学报),2010,59(7):4930-4938 [25]Habibi M H,Mokhtari R.J.Inorg.Organomet.Polym Mater., 2012,22(1):158-165
[26]Jiang Z,Tang Y,Tay Q,et al.Adv.Energy Mater.,2013,3 (10):1368-1380
[27]Marpuga Azat(马尔甫哈·阿扎提),Nyssanbayeva S,Beysen Sadeh(拜山·沙德克).Phys.Eng.(物理与工程),2014,24(6): 22-25
[28]WANG Xiao-Ming(王小明).Thesis for the Doctorate of Huazhong Agricultural University(华中农业大学博士论文).2015.
[29]Augustyn V,Come J,Lowe M A,et al.Nat.Mater.,2013,12 (6):518-522
[30]Kim J W,Augustyn V,Dunn B.Adv.Energy Mater.,2012,2 (1):141-148
[31]Kumagai N,Tanno K,Nakajima T,et al.Electrochim.Acta, 1983,28(1):17-22
[32]Itagaki M,Yotsuda S,Kobari N,et al.Electrochim.Acta, 2006,51(8):1629-1635
[33]Gnanaraj J S,Zinigrad E,Asraf L,et al.Electrochem. Commun.,2003,5(11):946-951
[34]Wang Z,Luan D,Hu Y,et al.Energy Environ.Sci.,2012,5: 5252-5258
[35]Zheng H,Fang S,Tong Z,et al.J.Mater.Chem.A,2015,3 (23):12476-12481
[36]Zhou G W,Wang J,Gao P,et al.Ind.Eng.Chem.Res., 2012,52(3):1197-1204
[37]Saravanan K,Ananthanarayanan K,Balaya P.Energy Environ. Sci.,2010,3(7):939-948
[38]Gao S,Yang S,Shu J,et al.J.Phys.Chem.C,2008,112(49): 19324-19328
Electrochemical Properties of Fe(Ⅱ)-Doped Nb2O5Micro/nano Spheres via Hydrothermal Synthesis
ZHANG Ying-Xia MI Chang-Huan*LI Hong-Sen
(Jiangsu Key Laboratory of Materials and Technology for Energy Conversion,College of Matrials Sciense Engineering, Nanjing University of Aeronautics and Astroautics,Nanjing 210016,China)
Fe(Ⅱ)-doped niobium oxide(Fe-Nb2O5)and Nb2O5were prepared by the one-step hydrothermal route. Both samples were characterized by X-ray diffraction(XRD),electron microscopy(SEM),Transmission electron microscope(TEM)and so on.The results showed that Fe-Nb2O5and Nb2O5were orthorhombic phase.Nb2O5was irregular particle with the wider size distribution of 50~300 nm,and Fe-Nb2O5was homogeneous micro/nano sphere with the diameter of 1 μm,which assembled from 50 nm sized nano-particles The porous multistage structure could increase the contact interface between electrode materials and electrolyte.Electrochemical analyses showed that Fe-Nb2O5has the better rate performance and cycle stability with a discharge capacity of 193.2 mAh·g-1retained up to 100 cycles at 50 and 108.4 mAh·g-1at 5 A·g-1,and the possible reasons were analyzed.
Li-ion battery;anode materials;Nb2O5;doping;electrochemical properties
O614.81+1;O614.51+2
A
1001-4861(2016)11-1905-06
10.11862/CJIC.2016.247
2016-03-28。收修改稿日期:2016-08-19。
中央高校基本科研业务费专项资金(No.NS2016058)和江苏高校优势学科建设工程资助项目。*通信联系人。E-mail:mchmse@nuaa.edu.cn
