洪湖碘泡虫的再描述及其近缘种的鉴别性研究
2016-11-24刘晓聪杨承忠赵元莙
刘晓聪 杨承忠 赵元莙
(重庆师范大学生命科学学院, 动物生物学重庆市重点实验室, 重庆 401331)
洪湖碘泡虫的再描述及其近缘种的鉴别性研究
刘晓聪 杨承忠 赵元莙
(重庆师范大学生命科学学院, 动物生物学重庆市重点实验室, 重庆 401331)
研究基于形态特征和18S rDNA序列相似度、遗传距离、变异位点、GC含量和系统发育比较分析, 对采自河南龙湖的寄生于异育银鲫鳃部的一种黏孢子虫以及相似性极高且易混淆的黏孢子虫种类(洪湖碘泡Myxobolus honghuensis Liu, et al. 2012、瓶囊碘泡虫Myxobolus ampullicapsulatus Zhao, et al. 2008、咽碘泡虫Myxobolus pharynae Lu, et al. 2012和吴李碘泡虫Myxobolus wulii (Wu & Li, 1986) 进行了系统的鉴别研究。研究结果显示: 河南龙湖异育银鲫鳃部所检获的黏孢子虫为洪湖碘泡虫, 该种群对所寄生的异育银鲫未造成疾病症状; 咽碘泡虫与洪湖碘泡虫各种群在形态上极相似, 两者间18S rDNA序列相似度为99%—100%, 遗传距离为0—0.0013, GC含量均为44.31%, 变异位点为2个, 表明咽碘泡虫与洪湖碘泡虫应为同一物种。
洪湖碘泡虫; 咽碘泡虫; 形态学; 18S rDNA
黏孢子虫(Myxosporidia)是一类种类繁多、分布广泛的后生动物寄生虫, 其主要寄主为鱼类, 也有少数寄生于环节动物、昆虫、两栖动物、爬行动物和哺乳动物等[1—6]。迄今, 已鉴定的黏孢子虫约2200种[3,6], 其中绝大多数种类的鉴定是基于其形态学特征[7—9]。然而, 形态学描述易受主观因素的影响, 不同学者对同一形态可能做出不同的判断。因此, Lom和Arthur[10]对黏孢子虫的形态学研究标准进行了规范, Abdel-Ghaffar等[11]和Molnár等[12]提出对黏孢子虫形态学的描述应从宿主、发育、孢子形态3个方面开展, 这一标准普遍被人们接受, 并对黏孢子虫分类学的发展产生了巨大的促进作用。
碘泡虫属(Myxobolus)的形态学数据已得到了大量的补充和完善[13,14], 但仅仅依据形态学特征依然无法进行所有类群的准确鉴定, 特别是对那些形态、宿主和生境相似性高的类群之间的鉴别更为困难。近年来, 分子生物学迅猛发展, 使得黏孢子虫的分类学研究取得了很大的进步[15]。如吴李碘泡虫Myxobolus wulii (Wu & Li, 1986)、关桥碘泡虫Myxobolus guanqiaoensis (Wu & Wang, 1997)以及寄生于日本金鱼鳃丝的碘泡虫未定种Myxobolus sp. 过去一直被认为是三个不同的物种, 但Zhang等[16]综合形态学数据及分子数据的研究结果表明,这三者不仅形态十分相似, 且三者的18S rDNA 序列高度一致, 指出三者实为同一物种, 即吴李碘泡虫。近年来, 学者们通过形态结合分子数据对黏孢子虫的分类鉴定做了大量工作, 厘清了一些过去存疑的种类和类群[17,18]。
瓶囊碘泡虫Myxobolus ampullicapsulatus Zhao,et al. 2008、洪湖碘泡虫Myxobolus honghuensis Liu,et al. 2012、吴李碘泡虫Myxobolus wulii (Wu & Li,1986)和咽碘泡虫Myxobolus pharynae Lu, et al. 2012是形态学特征相似度很高, 也是极易混淆的几个近缘物种, 尤其是瓶囊碘泡虫和洪湖碘泡虫。如,寄生异育银鲫咽的洪湖碘泡虫曾被误鉴定为瓶囊碘泡虫[19]; 已有研究发现瓶囊碘泡虫对鲫是不致病的, 而洪湖碘泡虫寄生在异育银鲫咽时, 对宿主鱼是致病的, 二者的形态差异性小, 仅在极囊瓶颈大小和极丝圈数上略有差异[20,21]。另外, 洪湖碘泡虫与吴李碘泡虫的形态也很相似, 但分子证据明确支持两者为独立有效种[21]。本研究从异育银鲫鳃重新检获洪湖碘泡虫, 在其研究过程中, 对这几个易混淆的近缘种(洪湖碘泡虫、瓶囊碘泡虫、咽碘泡虫和吴李碘泡虫)进行了系统比较研究, 并对这些易混淆的近缘种进行了有效的区分。
1 材料与方法
1.1 样本采集与虫种鉴定
寄主鱼异育银鲫Carassius auratus gibelio于2014年4月采自河南龙湖, 检查19尾鱼(长度为6.7—12.5 cm), 其中2尾鱼的鳃部被黏孢子虫感染(感染率为10.5%), 但未见形成孢囊。黏孢子虫分离、观察、测量、鉴定方法以及形态学特征描述等参照Lom等[10]、赵元莙等[22]。
1.2 DNA的提取、扩增与测序
DNA的提取: 将寄主鱼的鳃用镊子小心的摘取后在载玻片上涂片观察, 将有孢子的玻片用灭菌蒸馏水将孢子分离到1.5 mL离心管中, 离心富集, 悬浮2—3次以去除杂质[23,24], 再于10×40倍倒置显微镜下用微吸管逐个吸取成熟孢子。用DNEASY TISSUE KIT (QIAGEN)试剂盒按照商家提供的使用说明进行样本DNA的提取, 将提取的总DNA进行电泳检测, DNA样本保存在-20℃备用。DNA的扩增与测序: 本研究对样本DNA进行18S rDNA扩增, 扩增引物为: ERIB1 (5′-ACCTGGTTGATCCT GCCAG-3′)和ERIB10 (5′-CTTCCGCAGGTTCA CCTACGG-3′)[25]。25 μL的PCR反应体系, 包括2.5 μL 10× Ex Taq Bwffer (Mg2+free), 2.5 μL MgCl2(25 mmol/L), 2.5 μL dNTP (25 mmol/L), 引物各0.5 μL (10 μmol/L), 1.2 ng的模板DNA, 0.2 μL Ex Taq酶(5 U/μL) (TaKaRa), 用灭菌双蒸水补足至25 μL。反应程序为: 95℃预变性5 min, 95℃变性45s, 56℃退火50S, 72℃延伸2 min, 循环35次, 最后72℃延伸10 min, 反应完成后保温12℃。取3 μL扩增产物于1%的琼脂糖凝胶电泳检测, 然后将PCR产物用胶回收试剂盒Gel Extraction Kit (OMEGA)进行纯化回收。最后将纯化产物送公司测序 (使用测序仪为ABI, 3730XL)。
1.3 序列选取和系统发育分析
将本研究获得洪湖碘泡虫河南种群的18S rDNA序列, 在GenBank中经BLAST进行同源性比对。根据比对结果并结合Zhao等[22]所选的部分黏孢子虫序列, 即从GenBank中选取序列相似度最高的前10条序列和形态特征相似性大的碘泡虫序列,涉及瓶囊碘泡虫、洪湖碘泡虫、吴李碘泡虫、咽碘泡虫及本研究所获得的洪湖碘泡虫, 多涅茨尾孢虫Henneguya doneci作为外群, 共16条黏孢子虫的18S rDNA序列 (序列信息见图 2), 序列多重比对通过CLUSTAL W程序按照缺省参数进行, ML法构建的18S rDNA系统树采用PAUP(4.0)软件按照缺省参数完成, ML树运算100代。系统树绘制由Treeview[26]和Photoshop软件完成[27]。
对所选序列两两之间的遗传距离利用MEGA(4.0)软件进行计算。所选黏孢子虫之间的最大相似度用GenBank的BLAST工具计算获得。变异位点分析借助Bioedit和MEGA (4.0)完成。
2 结果
2.1 洪湖碘泡虫Myxobolus honghuensis Liu, et al. 2012河南种群的形态学描述
采自河南龙湖寄生在异育银鲫鳃的洪湖碘泡虫, 其成熟孢子壳面观呈梨形, 缝面观呈梭形, 前端稍尖后端钝圆(图 1、表 1), 孢子长(17.6±0.9) μm(16.2—19.2 μm), 宽(10.3±1.2) μm (8.6—11.9 μm)。两个一大一小的梨形极囊并行排列在孢子前端, 约占胞腔1/2, 两极囊前端紧贴, 极囊纵轴之间的夹角约为30°, 大极囊长(8.6±0.5) μm (8.1—9.7 μm), 宽(3.8±0.5) μm (3.2—4.6 μm), 小极囊长(7.4±0.5) μm(7.0—8.1 μm), 宽(3.2±0.2) μm (3.2—3.6 μm), 极丝7—9圈(图 1、表 1)。
2.2 基于18S rDNA序列对洪湖碘泡虫及其近缘种的分析
洪湖碘泡虫及其近缘种18S rDNA序列相似度
通过测序获得洪湖碘泡虫河南种群(M. honghuensis HN)的18S rDNA长度为1892个核苷酸 (nt),GenBank登录号为KR049222。相似度计算结果为:瓶囊碘泡虫 7个种群间18S rDNA序列相似度为99%; 吴李碘泡虫3种群间相似度为99%; 洪湖碘泡虫 5种群间的相似度为99%—100%; 洪湖碘泡虫河南种群与咽碘泡虫的相似度为100%, 洪湖碘泡虫河南种群、咽碘泡虫分别与瓶囊碘泡虫不同种群之间的相似度为98%—99%和98%—99%; 洪湖碘泡虫河南种群、咽碘泡虫与两个洪湖碘泡虫湖北种群(M. honghuensis HB, JF340216, KJ725074)的相似度均为100% (表 2)。
洪湖碘泡虫及其近缘种基于18S rDNA序列的遗传距离的分析 瓶囊碘泡虫7种群间遗传距离为0—0.0033, 吴李碘泡虫3种群间遗传距离为0.0013—0.0020, 洪湖碘泡虫3种群间遗传距离为0—0.0013, 这3种碘泡虫种间遗传距离为0.0127—0.0828。洪湖碘泡虫河南种群与瓶囊碘泡虫各种群的遗传距离为0.0127—0.0148, 与吴李碘泡虫各种群的遗传距离为0.0806—0.0813, 与洪湖碘泡虫其他种群的遗传距离为0—0.0013; 咽碘泡虫与瓶囊碘泡虫各种群的遗传距离0.0127—0.0148,与吴李碘泡虫各种群的遗传距离为0.0806—0.0813,与洪湖碘泡虫各种群的遗传距离为0—0.0013; 瓶囊碘泡虫各种群与吴李碘泡虫各种群的遗传距离为0.0792—0.0807, 与洪湖碘泡虫各种群的遗传距离为0.0127—0.0161。另外洪湖碘泡虫湖北种群(JF340216)、洪湖碘泡虫湖北种群(KJ725074)、洪湖碘泡虫河南种群(KR049222)、咽碘泡虫(JQ726700)四个黏孢子虫序列彼此间的遗传距离为零, 这四者与瓶囊碘泡虫江苏种群M. ampullicapsulatus JS (HM188545)(实为洪湖碘泡虫江苏种群[18])的遗传距离均为0.0013。
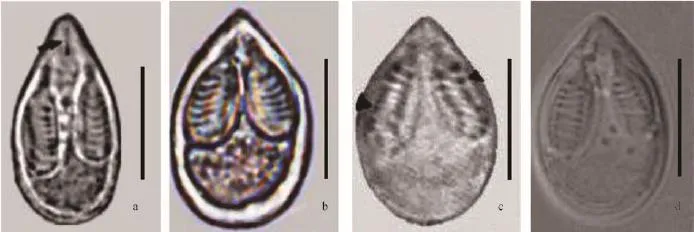
图 1 瓶囊碘泡虫、洪湖碘泡虫和咽碘泡虫的孢子形态比较Fig. 1 The morphological comparison of spore among M. ampullicapsulatus, M. Honghuensis and M. pharynae
洪湖碘泡虫及其近缘种基于18S rDNA的系统发育和GC含量分析 基于18S rDNA序列构建的黏孢子虫ML树的拓扑结构见图 2, 碘泡虫属的种类形成了三大支系, 即吴李碘泡虫枝、洪湖碘泡虫枝和瓶囊碘泡虫枝。从洪湖碘泡虫枝系中可见, 洪湖碘泡虫河南种群和洪湖碘泡虫湖北种群(KJ725074)首先聚枝, 然后与江苏盐城的咽碘泡虫(JQ726700)聚枝, 再与洪湖碘泡虫湖北种群(JF340216)聚枝, 最后与江苏盐城的洪湖碘泡虫江苏种群(HM188545)形成洪湖碘泡虫的单系枝。洪湖碘泡虫枝又与瓶囊碘泡虫枝构成为姐妹枝, 二者有高靴攀值(100)支持的同源性。另外, 吴李碘泡虫位于系统进化树的基部位置。
16条黏孢子虫的18S rDNA序列同源性比对后截取137—1669 bp区段内的GC含量显示: 吴李碘泡虫各种群GC含量为45.08%—45.14%, 洪湖碘泡虫各种群与咽碘泡虫的GC含量均为44.31%, 瓶囊碘泡虫的GC含量在44.12%—44.37%。
洪湖碘泡虫及其近缘种18S rDNA序列变异位点分析 选取瓶囊碘泡虫7种群和洪湖碘泡虫4种群及咽碘泡虫共12条18S rDNA序列, 进行变异位点的分析。结果显示: 瓶囊碘泡虫和洪湖碘泡虫这两个物种间共存在23处不同的碱基位点。瓶囊碘泡虫各种群间有9个变异位点(图 3)。洪湖碘泡虫各种群序列与咽碘泡虫序列相似度极高, 除洪湖碘泡虫江苏种群(HM188545)在571和851处各有1个变异位点外, 其余4条序列完全相同(图 3)。
3 讨论
成熟孢子形态学比较研究结果表明, 本研究从河南龙湖检获的洪湖碘泡虫M. honghuensis HN(KR049222)的孢子形态与瓶囊碘泡虫(DQ339482)、洪湖碘泡虫(JF340216)、咽碘泡虫(JQ726700)都很相似[20,21,28], 除瓶囊碘泡虫(DQ339482)形态差异较大外, 其他三者差异极小。瓶囊碘泡虫(DQ339482)孢子更为细长, 两个极囊内含9—10圈极丝, 呈并行排列且大小相等; 而其余三者(洪湖碘泡虫河南种群KR049222、洪湖碘泡虫JF340216、咽碘泡虫JQ726700)的孢子略宽短, 两个极囊一大一小, 且极囊前端靠近而末端分开, 极囊内极丝圈数分别为7—9、7—8和7—8。洪湖碘泡虫河南种群(KR049222)、洪湖碘泡虫(JF340216)、咽碘泡虫(JQ726700)的孢子宽度分别为10.3±1.2 (8.5—12.0) μm、10.4±0.4 (9.0—11.3) μm和10.26±0.43(9.12—10.88) μm, 而瓶囊碘泡虫(DQ339482) 的孢子宽度则为9.3±0.4 (8.5—10.0) μm, 孢子宽度明显小于前三者(图 1、表 1)。同时, 洪湖碘泡虫河南种群(KR049222)、咽碘泡虫(JQ726700)、洪湖碘泡虫(JF340216) 的寄主均为异育银鲫, 而瓶囊碘泡虫(DQ339482)的寄主为鲫。总之, 孢子及极囊形态、极丝缠绕圈数、寄主的比较分析均表明, 洪湖碘泡虫河南种群(KR049222)、洪湖碘泡虫(JF340216)和咽碘泡虫 (JQ726700)具有高度的相似性, 故河南龙湖检获的种群应为洪湖碘泡虫; 咽碘泡虫和洪湖碘泡虫应为同一物种。
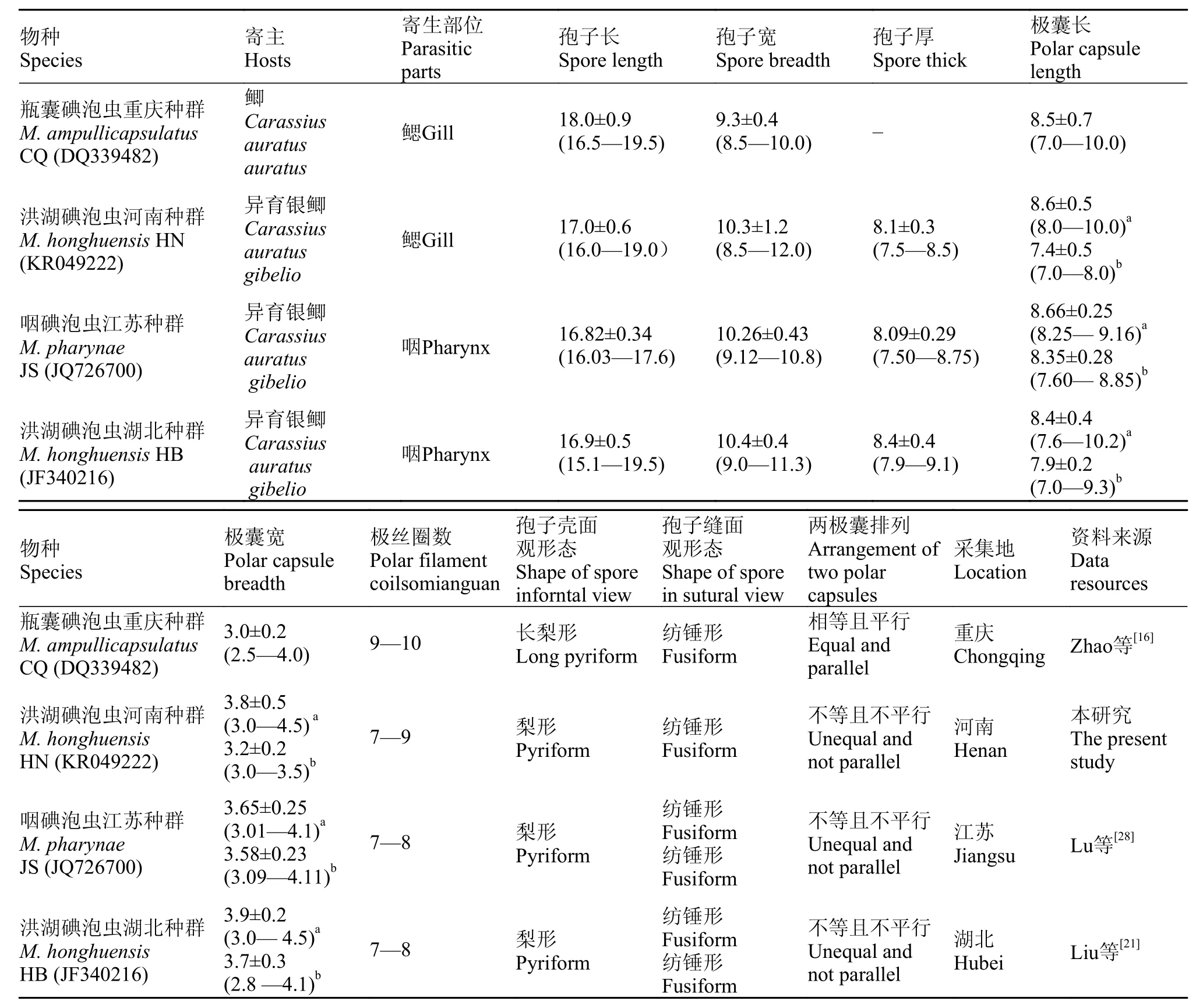
表 1 洪湖碘泡虫河南种群与相关碘泡虫物种的特征比较Tab. 1 Comparison of Henan population for M. honghuensis with the related Myxobolus species (μm)
就致病性而言, 本研究从河南龙湖异育银鲫鳃所获得的洪湖碘泡虫未见对其宿主造成疾病症状。先前的研究表明: 洪湖碘泡虫寄生异育银鲫咽喉时, 表现严重的疾病[19,21,28]。资料还显示: 洪湖碘泡虫感染异育银鲫早期, 受感染鱼体无明显症状,感染后期, 患病鱼喉部被孢囊覆盖, 病鱼出现明显厌食、游动迟缓、组织坏死及炎症病症[29]; 而在本研究中, 感染的异育银鲫未表现明显的疾病症状,可能存在两个原因: 原因之一可能洪湖碘泡虫的致病性具有咽部组织趋向性[19,21,28]。从先前的研究来看, 洪湖碘泡虫致病主要在于感染宿主咽喉所致[19,21,28], 而本研究所得到的孢子寄生于宿主鳃部,因此未能引起病症; 第二个原因可能是由于宿主处于感染初期, 虽然有孢子出现或尚未形成孢囊, 故未显著影响异育银鲫的游泳、呼吸、摄食等生理活动, 从而未显示明显的疾病症状。
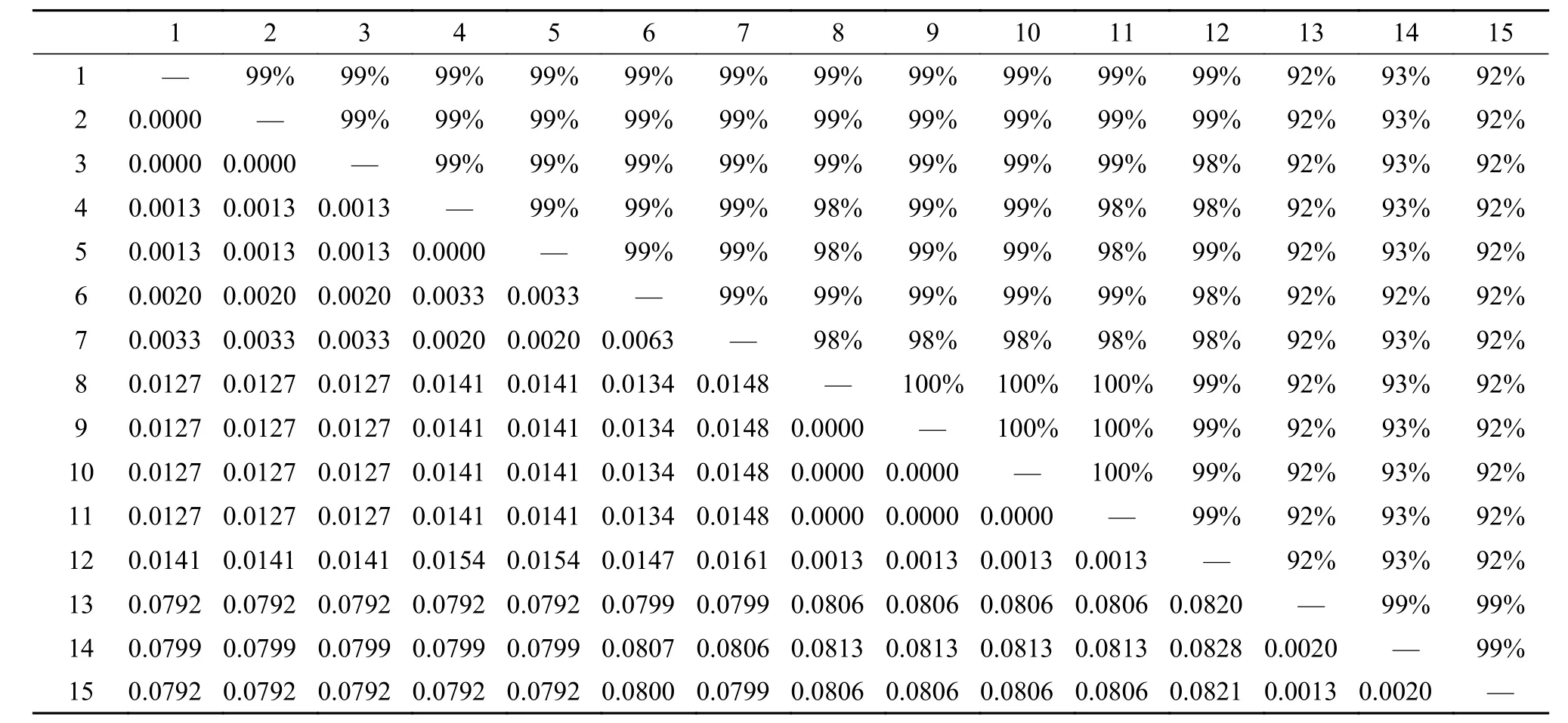
表 2 15种黏孢子虫基于18SrDNA序列的相似度和遗传距离Tab. 2 Fifteen Myxosporea’s gene similarity and the genetic distance based on 18S rDNA sequence
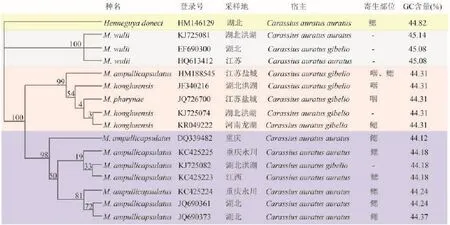
图 2 利用ML(最大似然法)基于18S rDNA序列构建的系统发育树Fig. 2 Phylogenetic tree generated by ML (maximum likelihood) based on the 18S rRNA gene sequences
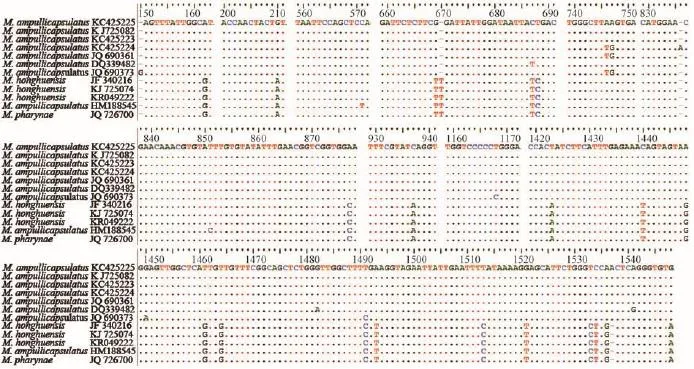
图 3 瓶囊碘泡虫和洪湖碘泡虫各种群的核糖体小亚单位基因序列比对后截取的变异区段; (-)表示空位; (.)表示相同碱基Fig. 3 The variable sites of small subunit ribosomal RNA gene sequences for different populations of M. ampullicapsulatus and M. honghuensis; (-) Blank; (.) The same basicgroup
遗传距离比较和分析结果表明, 洪湖碘泡虫、瓶囊碘泡虫和吴李碘泡虫三种碘泡虫的种间遗传距离为0.0127—0.0828; 而其种内遗传距离分别为0—0.0013、0—0.0033和0.0013—0.0020, 该遗传距离远远小于种间水平[30,31]; 3种碘泡虫的种间和种内的遗传距离存在10倍的差别(表 2)。洪湖碘泡虫湖北种群(JF340216)、洪湖碘泡虫湖北种群(KJ725074)、洪湖碘泡虫河南种群(KR049222)、咽碘泡虫(JQ7267000) 四者彼此间的遗传距离为零, 四者与洪湖碘泡虫江苏种群(HM188545)之间的遗传距离均为0.0013, 由此可见咽碘泡虫(JQ726700) 与洪湖碘泡虫各种群应为同一物种。
序列相似度分析结果表明, 种间序列相似度为92%—99%, 种内序列相似度为99%—100%。洪湖碘泡虫湖北种群(JF340216)、洪湖碘泡虫湖北种群(KJ725074)、洪湖碘泡虫河南种群(KR049222)和咽碘泡虫(JQ726700)之间的相似度为100%, 它们与洪湖碘泡虫江苏种群(HM188545) 的相似度为99%,此结果吻合Zhao等[18]的观点, 这5者应为同一物种。这一结论同样得到了系统发育和变异位点分析结果的支持: 系统发育分析表明咽碘泡虫与所有洪湖碘泡虫聚在一起, 并且位于洪湖碘泡虫支系的内部(图 2), 这表明咽碘泡虫(JQ726700)与洪湖碘泡
[1]Kent M L, Andree K B, Bartholomew J L, et al. Recent advances in our knowledge of the Myxozoa [J]. Journal of Eukaryotic Microbiology, 2001, 48(4): 395—413
[2]Canning E U, Okamura B. Biodiversity and evolution of the Myxozoa [J]. Advances in Parasitology, 2004, 56: 43—131虫应为同种; 从变异位点的个数来看, 除洪湖碘泡虫江苏种群(HM188545)外, 咽碘泡虫与其他所有洪湖碘泡虫序列完全相同, Zhao等[18]认为当两个物种的18S rDNA序列变异位点小于10个时应将其归于同一物种。分析结果显示: 尽管咽碘泡虫(JQ726700)与洪湖碘泡虫江苏种群(HM188545)有2个碱基的差异, 相比与瓶囊碘泡虫各种群之间的9个变异位点而言, 2个碱基的差别应属于种内水平的变异[18,31]。同时, 咽碘泡虫(JQ726700)GC含量与所有的洪湖碘泡虫一致, 这进一步说明咽碘泡虫(JQ726700)与洪湖碘泡虫的同源性。
综上, 结合形态及分子数据研究结果显示, 本研究从河南龙湖异育银鲫鳃检获的黏孢子虫为洪湖碘泡虫(M. honghuensis); 与寄生于异育银鲫咽的洪湖碘泡虫不同的是, 寄生于异育银鲫鳃的洪湖碘泡虫未表现明显的疾病症状; 洪湖碘泡虫(M. honghuensis)和咽碘泡虫(M. pharynae JS (JQ726700)应为同一物种。
[3]Lom J, Dykova I. Myxozoan genera: definition and notes on taxonnmy, life-cycle terminology and pathogenetic species [J]. Folia Parasitologica, 2006, 53(1): 1—36
[4]Zhao Y J, Song W B. Systematic revision on the order Bivalvida (Myxosporea) [A]. In: Song W B, Zhao Y J, Xu K D, et al. Pathogenic protozoa in mariculture [C]. Beijing: Science Press. 2003, 265—290 [赵元莙, 宋微波.双壳目黏孢子虫属级阶元修订.见: 宋微波, 赵元莙, 徐奎栋, 等. 海水养殖中的危害性原生动物. 北京: 科学出版社. 2003, 265—290]
[5]Canning E U, Curry A. Further observations on the ultrastructure of Cystosporogenes operophterae (Canning,1960) (phylum Microsporidia) parasitic in Operophtera brumata L. (Lepidoptera, Geometridae) [J]. Journal of Invertebrate Pathology, 2004, 87(1): 1—7
[6]Suo D, Zhao Y J. Morphological rediscription of Thelohanellus nikolskii Achmerov, 1955 (Myxozoa, Bivalvulida) and phylogenic analysis of Thelohanellus nikolskii inferred from 18S rDNA [J]. Acta Zootaxonomica Sinica,2010, 35(1): 90—95 [索栋, 赵元莙. 尼氏单极虫(黏体门, 双壳目)的重描述及基于18S rDNA的系统地位分析. 动物分类学报, 2010, 35(1): 90—95]
[7]Chen Q L, Ma C L.China Fauna: Myxozoa, Bivalvulida(Freshwater) [M]. Beijing: Science Press. 1998, 332—528[陈启鎏, 马成伦. 中国动物志: 黏体动物门, 黏孢子纲(淡水). 北京: 科学出版社. 1998, 332—528]
[8]Kaur H, Singh R. Two new species of Myxobolus (Myxozoa: Myxosporea: Bivalvulida) infecting an Indian major carp in Ropar and Kanjali wetlands (Punjab) [J]. Journal of Parasitic Diseases, 2011a, 35(1): 23—32
[9]Kaur H, Singh R. Two new species of Myxobolus (Myxozoa: Myxosporea: Bivalvulida) from freshwater fishes of Punjab wetlands (India) [J]. Journal of Parasitic Diseases, 2011b, 35(1): 33—41
[10]Lom J, Aathur J R. A guideline for the preparation of species descriptions in Myxosporea [J]. Journal of Fish Diseases, 1989, 12(2): 151—156
[11]Abdel-Ghaffar F, Abdel-Baki A A, Bayoumy E M, et al. Light and electron microscopic study on Henneguya suprabranchiae Landsberg, 1987 (Myxozoa: Myxosporea) infecting Oreochromis niloticus, a new host record [J]. Parasitology Research, 2008, 103(3): 609—617
[12]Molnár K, Székely C, Sascha L, et al. Some remarks on the occurrence, host-specificity and validity of Myxobolus rotundus Nemeczek, 1911 (Myxozoa: Myxosporea)[J]. Systematic Parasitology, 2009, 72(1): 71—79
[13]Moln R K. Redescription and histopathology of Myxobolus cyprinicola Reuss, 1906, an intestinal parasite of the common carp (Cyprinus carpio L.) [J]. Acta Protozoologica, 2002, 41(3): 297—283
[14]Camus A C, Griffin M J. Molecular characterization and histopathology of Myxobolus koi infecting the gills of a koi, Cyprinus carpio, with an amended morphological description of the agent [J]. Journal of Parasitology, 2010,96(1): 116—124
[15]Lu Y S, Nie P. Phylogeetic analyses of the myxosporeans parasitic in freshwater fish of China based on 18S ribosomal DNA [J]. Acta Hydrobiologica Sinica, 2004,28(6): 587—591 [鲁义善, 聂品. 淡水鱼类黏孢子虫的18S rDNA分子系统学研究. 水生生物学报, 2004, 28(6): 587—591]
[16]Zhang J Y, Yokoyama H, Wang J G, et al. Utilization of tissue habitats by Myxobolus wulii Landsberg & Lom,1991 in different carp hosts and disease resistance in allogynogenetic gibel carp: redescription of M. wulii from China and Japan [J]. Journal of Fish Diseases, 2010,33(1): 57—68
[17]Székely C, Hallett S L, Atkinson S D, et al. Complete life cycle of Myxobolus rotundus (Myxosporea: Myxobolidae), a gill myxozoan of common bream Abramis brama[J]. Diseases of Aquatic Organisms, 2009, 85(2): 147—155
[18]Zhao Y J, Li N N, Tang F H, et al. Remarks on the validity of Myxobolus ampullicapsulatus and Myxobolus honghuensis (Myxozoa: Myxosporea) based on SSU rDNA sequences [J]. Parasitology Research, 2013,112(11): 3817—3823
[19]Xi B W, Xie J, Zhou Q L, et al. Mass mortality of pondreared Carassius gibelio caused by Myxobolus ampullicapsulatus in China [J]. Diseases of Aquatic Organisms,2011, 93(3): 257—260
[20]Zhao Y J, Sun C Y, Kent M L, et al. Description of a new species of Myxobolus (Myozoa: Myxobolidae) based on morphological and molecular data [J]. The Journal of Parasitology, 2008, 94(3): 737—742
[21]Liu Y, Whipps C M, Gu Z M, et al. Myxobolus honghuensis n. sp. (Myxosporea: Bivalvulida) parasitizing the pharynx of allogynogenetic gibel carp Carassius auratus gibelio (Bloch) from Honghu Lake, China [J]. Parasitology Research, 2012, 110(4): 1331—1336
[22]Zhao Y J, Ma C L, Song W B. Illustrated guide to the identification of pathogenetic Protozoa in mariculture—II. Diagnostic methods for the Myxosporea [J]. Ocean University Qingdao, 2001, 31(6): 681—688 [赵元莙, 马成伦, 宋微波. 海水养殖中原生动物病原虫的鉴定: II.黏孢子虫原生动物的研究及鉴定方法. 青岛海洋大学学报, 2001, 31(6): 681—688]
[23]Dong J L, Zhao Y J, Tang F H, et al. Redescription of Unicauda pelteobagrus Ma, 1998 (Myxozoa,Bivalvulida), with phylogenic analysis inferred from 28S rDNA and ITS-5.8 sequence data [J]. Acta Zootaxonomica Sinica, 2011, 36(1): 84—92 [董江丽, 赵元莙, 唐发辉, 等. 黄颡单尾虫(黏体门.双壳目)的重描述及基于28S rDNA和ITS-5.8S序列的系统地位分析. 动物分类学报, 2011, 36(1): 84—92]
[24]Sun C Y, Zhao Y J, Chen Z G. Genetic diversity of four populations of Henneguya doneci (Schulman) revealed by RAPD [J]. Chinese High Technology Letters, 2006,16(10): 1097—1100 [孙春燕, 赵元莙, 陈子桂. 多涅茨尾孢虫Henneguya doneci 4个种群遗传多样性的RAPD分析. 高技术通讯, 2006, 16(10): 1097—1100]
[25]Barta J R, Martin D S, Libertor P A, et al. Phylogenetic relationships among eight Eimeria species infecting domestic fowl inferred using complete small subunit ribosomal DNA sequences [J]. The Journal of Parasitology, 1997, 83(2): 262—271
[26]Page R D M. TREEVIEW: an application to display phylogenetic trees on personal computers [J]. Computer Applications in the Biosciences, 1996, 12: 357—358
[27]Li N N, Zhao Y J, Tang F H, et al. Phylogenetic study on genus Unicauda (Myxozoa, Bivalvulida) based on 18S rDNA sequences [J]. Neijiang Normal University, 2012,27(12): 38—42 [李楠楠, 赵元莙, 唐发辉, 等, 基于18S rDNA序列对单尾虫属(黏体门, 双壳目)的系统学研究.内江师范学院学报, 2012, 27(12): 38—42]
[28]Lu H D, Cai S J, Zhu Y T, et al. Morphological and molecular analysis of Myxobolus pharynae n. sp.(Myxosporea) causing high mortality of Carassius auratus gibelio in pond aquaculture, China [J]. Marine Fisheries, 2012, 34(4): 406—416 [陆宏达, 蔡水局, 竹攸汀, 等, 引起池养异育银鲫高死亡率的黏孢子虫新种咽碘泡虫形态和分子分析. 海洋渔业, 2012, 34(4): 406—416]
[29]Gu W. The Survey and classification of myxosporean parasitic on Carassius auratus auratus from Jiangsu Province [D]. Thesis for Master of Science. Nanjing Agricultural University, Nanjing. 2012 [顾伟, 江苏地区鲫鱼寄生黏孢子虫种类调查与分类研究. 硕士学位论文, 南京农业大学, 南京. 2012]
[30]Ran J, Yang C Z, Zhao Y J. Taxonomic research of the Myxosporidia based on genetic distance [J]. Journal of Chongqing Normal University (Natural Science), 2014,31(3): 31—34 [冉佼, 杨承忠, 赵元莙. 基于遗传距离的黏孢子虫分类研究. 重庆师范大学学报(自然科学版),2013, 31(3): 31—34]
[31]Zhang J, Mo X, Li N N, et al. Supplementary description of Hennegyya zikawiensis Sikamal, 1938 and its molecular phylogeny [J]. Journal of Neijiang Normal University,2015, 30(4): 5—10 [张婧, 莫西, 李楠楠, 等, 徐家汇尾孢虫Henneguya zikawiensis Sikamal, 1938补充描述及其分子系统学研究. 内江师范学院学报, 2015, 30(4): 5—10]
REDESCRIPTION OF MYXOBOLUS HONGHUENSIS LIU ET AL. 2012 AND IDENTIFICATION ON ITS GENETIC RELATED SPECIES
LIU Xiao-Cong, YANG Cheng-Zhong and ZHAO Yuan-Jun
(Chongqing Key Laboratory of Animal Biology, College of Life Sciences, Chongqing Normal University, Chongqing 401331, China)
The present study investigated the relationship of Myxobolus species from gills of Carassius auratus gibelio,Long Lake, Henan with other similar species such as Myxobolus honghuensis, Myxobolus ampullicapsulatus, Myxobolus pharynae, and Myxobolus wulii based on the comparative analysis of morphological characters, sequence similarity,genetic distance, mutation sites, GC content of 18S rDNA, and the phylogenic trees. The results indicated that the gill parasitic Myxobolus species from Carassius auratus gibelio, Long Lake, Henan was Myxobolus honghuensis, and no obvious host symptom was observed by this species. The further investigation showed that Myxobolus pharynae and Myxobolus honghuensis were similar in morphology and in sequence that reached 99%—100%, and that the genetic distance was only 0—0.0013, and that they had the same 44.31%, GC content with only two mutation sites. These results indicated that these two species should the same species.
Myxobolus honghuensis; Myxobolus pharynae; Morphology; 18S rDNA
10.7541/2016.47
S941.51
A
1000-3207(2016)02-0350-08
2015-04-20;
2015-09-16
国家自然科学基金项目(No. 31172068, No. 31471980); 重庆市科委基金项目(No. cstc 2010ca1010; No. cstc 2014jcyja80014); 重庆市教委科技项目(KJ1400502)资助 [Supported by the National Natural Science Foundation of China (No. 31172068, No. 31471980); the Project of Chongqing Science & Technology Commission (No. CSTC, 2010CA1010; No. cstc2014jcyjA80014); the Science Research Foundation of the Education Committee of Chongqing (No. KJ1400502)]
刘晓聪(1988—), 女, 河南人; 硕士研究生; 研究方向为鱼类寄生虫学。E-mail: lxcong2015@163.com
赵元莙, E-mail: zhaoyuanjuncqnu@126.com
