不同二氧化碳浓度培养对两株栅藻碳固定速率及油脂积累的影响
2016-11-24琪郑凌凌沈伟宋立荣
郭 琪郑凌凌沈 伟宋立荣
(1. 中国科学院水生生物研究所, 中国科学院藻类生物学重点实验室, 武汉 430072; 2. 中国科学院大学, 北京 100049)
研究简报
不同二氧化碳浓度培养对两株栅藻碳固定速率及油脂积累的影响
郭 琪1,2郑凌凌1沈 伟1宋立荣1
(1. 中国科学院水生生物研究所, 中国科学院藻类生物学重点实验室, 武汉 430072; 2. 中国科学院大学, 北京 100049)
人类在利用化石燃料的过程中会导致大量有害温室气体CO2的排放, 促进全球气候变暖。微藻可通过光合作用固定CO2, 同时大量的微藻生物质还能作为生物能源的原料[1], 因此, 越来越多的研究关注于微藻生物固碳以达到降低碳排放的目的。利用微藻光合作用进行CO2固定是一种能量节约型和环境友好型技术手段[2]。
在利用微藻进行CO2生物固定以及生物燃料生产时,研究微藻的CO2固定能力、CO2对微藻的生长以及油脂积累的影响等都是十分重要的。国内外利用微藻进行生物固碳已有大量报道, 夏建荣等[3]通过研究极大螺旋藻的生长, 发现添加高浓度CO2有利于提高螺旋藻产量;Morais等[4]研究发现4株微藻Chlorella kessleri、C. vulgaris、Scenedesmus obliquus 和Spirulina sp. 在6% CO2浓度下达到最大生长速率; Tang等[5]的研究结果显示S.obliquus 在10% CO2浓度条件下具有最大生长速率和碳固定速率; Fulke等[6]的研究结果表明Chlorella sp. 生长和油脂积累的最适CO2浓度为3%; 李爱芬等[7]研究发现通入0.5% CO2促进了核粉油球藻的生长以及不饱和脂肪酸的积累; 另外, Chiu等[8]的研究报道则显示Nannochloropsio culata 生长的最适CO2浓度为2%, 当CO2浓度超过一定范围(>5% CO2), 会对微藻生长产生抑制作用。工业排放废气中CO2浓度往往高达10%—15%, 甚至更高[9], 因此欲利用微藻进行CO2固定实现减排, 藻种的选取显得极为重要。
前期经过初步筛选获得了油脂含量较高的栅藻Scenedesmus sp. FACHB-1545和Scenedesmus sp. FACHB-1600, 在此基础上, 探究了它们在不同CO2浓度下的生长、CO2固定以及油脂积累情况, 为筛选评价高效固碳且富含生物油脂的优良微藻种质资源提供依据。
1 材料与方法
1.1 藻种来源及培养
栅藻Scenedesmus sp. FACHB-1545和Scenedesmus sp. FACHB-1600藻种来自中国科学院淡水藻种库。培养基BG-11[10](去除Na2CO3, 以同等Na+摩尔浓度的NaCl代替, 排除外源碳源的影响), 光照强度150 μmol/(m2·s), 持续光照培养, 温度为(25±1)℃。
采用长60 cm、内径2.6 cm的柱状光反应器培养, 通入气体浓度设置为10% CO2、5% CO2和空气, 每组三个平行, 气体流量为400 mL/min。初始接种浓度为A680=0.2, 培养周期为18d。
1.2 生物量测定
生物量以藻细胞干重(DW)来表示, 接种后, 每3天取V mL藻液, 用GF/C滤膜(Whatman, UK)抽滤, 滤膜提前烘干至恒重并记录重量为W0(g), 然后将滤有藻细胞的滤膜置于105℃, 24h烘干至恒重, 并再次称重记录重量为Wt(g)。
生物量X (g/L)计算公式即为: X (g/L)=1000×[Wt(g)-W0(g)]/V (mL)
生物量产率P [mg/(L·d)]=1000×(X1-X0)/(t1-t0)
比生长速率μ (/d)=(lnX1-lnX0)/(t1-t0)
其中, X1、X0分别为t1、t0时间下的生物量。
1.3 CO2固定速率测定
Rco2=Cc×P×(Mco2/Mc), Cc表示微藻细胞中的含碳量, P是生物量产率, Mco2和Mc分别表示CO2分子和C元素的分子量。参考Chisti[11]的微藻生物质的分子式CO0.48H1.83N0.11P0.01, Cc约为51.37%, 计算CO2固定速率=1.88×生物量产率[mg/(L·d)]。
1.4 油脂提取
取一定体积的藻液离心收集, 并冻干至藻粉。参考Bigogno等[12]的方法提取油脂: 称取干燥的藻粉W1(g)(50 mg≤W1≤100 mg), 经10%的二甲亚枫-甲醇溶液(v/v)和正己烷︰乙醚混合液(1︰1, v/v)抽提得到上层有机相, 氮气吹干浓缩后, 转移浓缩液到已称重为W2(g)的玻璃瓶中, 再经氮气吹干至恒重, 称重玻璃瓶质量W3(g)。
总脂百分含量(% DW)=[(W3-W2)/W1]×100%
油脂产率[mg/(L·d)]=生物量产率×总脂百分含量
1.5 脂肪酸组成
参照Lee 等[13]的方法进行。取1 mg提取的总脂样品,进行脂肪酸甲酯化反应, 经NaCl饱和溶液和正己烷萃取得到上层有机相, 氮气吹干后, 用正己烷定容至1 mL, 待气相色谱检测。
1.6 数据分析
实验数据采用平均值±标准差表示, 数据采用Origin 8和SPSS 18.0分析软件进行分析, 各组实验数据的显著性差异分析利用SPSS 18.0统计软件进行, 显著水平为P<0.05。
2 结果
2.1 不同CO2浓度对两株栅藻生长的影响
如图 1所示, 两株栅藻Scenedesmus sp. FACHB-1545和Scenedesmus sp. FACHB-1600在较高CO2浓度(5%和10% CO2)培养下生长良好, 生长速率明显快于空气组。第18天, Scenedesmus sp. FACHB-1545的最大生物量达到5.973 g/L (5% CO2), Scenedesmus sp. FACHB-1600的最大生物量达到5.503 g/L (10% CO2), 分别是空气组的2.3倍和1.6倍; 此外, 两株栅藻Scenedesmus sp. FACHB-1545和Scenedesmus sp. FACHB-1600均在10% CO2下获得最大生物量产率和最大比生长速率, 最大生物量产率分别为0.818和1.146 g/(L·d), 最大比生长速率分别为1.298和1.415 /d 。
2.2 不同CO2浓度对两株栅藻碳固定速率的影响
如图 2所示, 相比空气组, 两株栅藻Scenedesmus sp. FACHB-1545和Scenedesmus sp. FACHB-1600在较高浓度的CO2(5%和10%)下均表现出更高的固碳速率, 并且随着碳浓度的升高, 藻株的碳固定速率随之升高。Scenedesmus sp. FACHB-1545在10% CO2浓度下达到最大碳固定速率, 稍高于5% CO2培养组, 分别为1.538和1.378 g/(L·d), 两者都显著高于空气组[0.271 g/(L·d);P<0.05]。藻株Scenedesmus sp. FACHB-1600也在10% CO2下有最大碳固定速率, 为2.155 g/(L·d), 显著高于空气组[0.381 g/(L·d); P<0.05]。
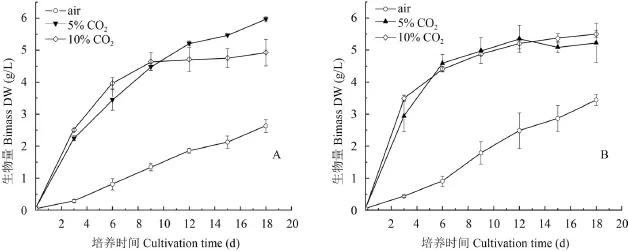
图 1 两株栅藻在不同CO2浓度培养下的生物量浓度(平均值±标准偏差)Fig. 1 Biomass of the two strains of Scenedesmus under different CO2concentrations (Mean±SD)
2.3 不同CO2浓度对两株栅藻油脂积累及脂肪酸组成的影响
CO2浓度的增加与栅藻Scenedesmus sp. FACHB-1545和Scenedesmus sp. FACHB-1600总脂含量并无显著相关性(表 1)。Scenedesmus sp. FACHB-1545的油脂产率随着CO2浓度的升高而增加, 在5% CO2浓度和10% CO2浓度时获得的油脂产率分别为101.132和101.857 mg/(L·d), 两者都显著高于空气组的油脂产率[52.5 mg/(L·d);P<0.05]; 而Scenedesmus sp. FACHB-1600则在5% 的CO2浓度下油脂产率最大, 为104.163 mg/(L·d), 在10% CO2浓度时的油脂产率次之, 为86.729 mg/(L·d), 而空气组最低, 为68.912 mg/(L·d)。
两株藻Scenedesmus sp. FACHB-1545Scenedesmus sp. FACHB-1600的脂肪酸组成主要成分为C16-C18脂肪酸, 在3个CO2浓度下, C16-C18含量占脂肪酸组成的85% 以上。Scenedesmus sp. FACHB-1545的不饱和脂肪酸相对含量达到82%以上, 而Scenedesmus sp. FACHB-1600的不饱和脂肪酸相对含量则达到91%以上,符合生物柴油的性质, 这两株栅藻具备生产生物柴油的潜力(表 2)。
3 讨论
CO2是微藻光合作用的碳源, 对大多数微藻来说, 最适CO2浓度通常在0.038%—10%[14]。通入合适浓度的CO2可以促进微藻的生长, 当CO2浓度超过一定范围时,其生长可能会受到抑制。Cheng等[15]研究发现Chlorella vulgaris 在通入1% CO2时生长良好, 但CO2浓度超过1%时其生长会受到影响; Lee等[16]的研究发现Chlorella pyrenoidosa能够在5% CO2浓度下较好的生长, 当CO2浓度高于5% 时, 生长也会受到抑制; 还有些藻株能够在富含高浓度CO2的烟道气(10%—15%)中生长, 但是固碳速率和生物量产率却不及较低CO2浓度培养[17]。Tang等[5]对Scenedesmus obliquus SJTU-3和Chlorella pyrenoidosa SJTU-2的研究发现, 这两株微藻在10%的CO2浓度下生长最快, 最大生物量浓度分别为1.84和1.55 g/L; Anjos等[18]发现通气速率为36 mL/min时, 随着CO2浓度的增加(2%—6%), Chlorella vulgaris p12的最大生物量浓度和生物量产率增加了近45%。
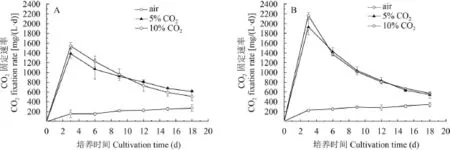
图 2 两株栅藻在不同CO2浓度培养下的CO2固定速率(平均值±标准偏差)Fig. 2 CO2fixation rate of the two strains of Scenedesmus under different CO2concentrations (Mean±SD)

表 1 两株栅藻在不同CO2浓度培养下的总脂含量和油脂产率(平均值±标准偏差)Tab. 1 The total lipid and lipid productivity of the two strains of Scenedesmus under different CO2concentrations (Mean±SD)
本文研究的两株栅藻Scenedesmus sp. FACHB-1545和Scenedesmus sp. FACHB-1600在10% CO2浓度下均具有最大生物量产率, 这与Tang等[5]的结果相似, 由于本实验采用的柱状光生物反应器, 促进了藻株在培养过程中的光利用率、营养盐利用率等, 最大生物量可高达5.973和5.503 g/L, 明显高于Tang等[5]所得到的最大生物量浓度。此外, Scenedesmus sp. FACHB-1545和Scenedesmus sp. FACHB-1600在5%和10% CO2浓度下具有很好的固定碳的能力, 在10%浓度下固碳速率最高。Cervantesa等[19]研究Scenedesmus obtusiusculus 在不同CO2条件培养下也有相似结果, 该藻株在10% CO2下表现出最大CO2固定速率为970 g/(m3·d); Wang等[20]研究了海洋硅藻Chaetoceros muelleri 在不同CO2浓度下的变化, 发现C. muellleri 在10% CO2下具有最大CO2固定速率0.428 g/(L·d), 而本研究中的两株藻的最大固碳速率分别为1.538和2.155 g/(L·d), 固碳速率具有明显优势, 表明它们是进行生物固碳的潜在优质藻种资源。因CO2的固定还会受如pH、光强、气体流速、CO2补给速率等条件的影响[20], 后期还需针对这些因素深入研究藻种的固碳速率,进一步挖掘固碳潜力。
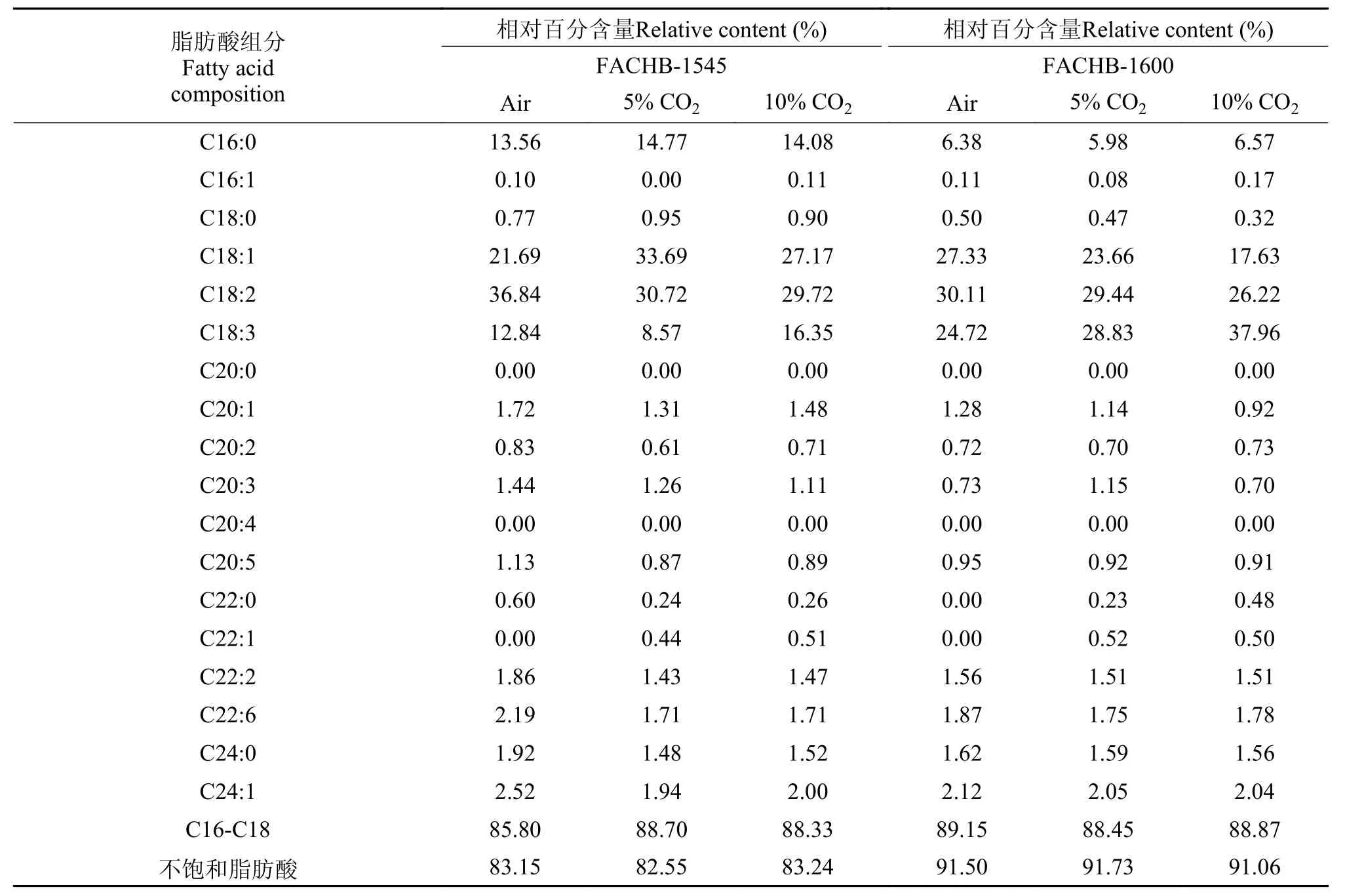
表 2 两株栅藻在不同CO2浓度培养下的脂肪酸组成Tab. 2 The fatty acid composition of the two strains of Scenedesmus under different CO2concentrations
评价微藻生物柴油生产的经济可行性, 需综合考虑微藻生物量产率、总脂含量以及油脂产率等参数。近来有一些研究报道指出, 在一定范围内CO2浓度的升高可以促进油脂的积累。徐芳等[21]研究Nannochloropsis sp.时发现, CO2浓度的升高会降低总脂肪酸含量; Chiu等[8]研究N. oculata NCTU-3时发现, CO2浓度为2% 时油脂含量最高, 但是CO2浓度在2%—15% 时, 油脂含量有降低趋势。本研究中的藻株Scenedesmus sp. FACHB-1545和 Scenedesmus sp. FACHB-1600, 在通入较高浓度的CO2培养时, 都获得了高于空气组的油脂产率, 并且差异显著(P<0.05), 这表明我们筛选的两株栅藻在较高浓度CO2下能够很好的积累油脂。油脂产率是结合了生物量和总脂含量的综合评价指标, 能够更好地衡量藻株的产油能力[22], 特别是在一些藻种的室外大规模培养时, 参考油脂产率来衡量藻株的产油潜力更加具有实际意义。
本文结果显示, 通过适当提高CO2浓度可以促进两株栅藻Scenedesmus sp. FACHB-1545和Scenedesmus sp. FACHB-1600的生长、CO2固定和油脂产率, 藻种具有高效固碳且富含生物油脂的优势。从应用角度看, 室内筛选的优良藻株能否推广到户外大规模生产, 还需考察藻株的其他一些性能如抗逆性、抗污染能力、采收性能等[20], 本文研究的两株栅藻, 尚需开展进一步户外试验,以确定其是否能真正进行户外生产。
[1]Miao X L, Wu Q Y. Biodiesel production from heterotrophic microalgal oil [J]. Bioresource Technology, 2006,97(6): 841—846
[2]de Morais M G, Costa J A V. Isolation and selection of microalgae from coal fired thermoelectric power plant for biofiaxtion of carbon dioxide [J]. Energy ConversionManagement, 2007a, 48(7): 2169—2173
[3]Xia J R, Gao K S. Effects of high CO2concentration on Growth and photosynthesis of Spirulina maxima [J]. Acta Hydrobilology Sinica, 2001, 25(5): 474—480 [夏建荣,高坤山. 高浓度CO2对极大螺旋藻生长和光合作用的影响. 水生生物学报, 2001, 25(5): 474—480]
[4]de Morais M G, Costa J A V. Carbon dioxide fixation by Chlorella kessleri, C. vulgaris, Scenedesmus obliquus and Spirulina sp. cultivated in flasks and vertical tubular photobioreactors [J]. Biotechnology Letters, 2007c, 29(9): 1349—1352
[5]Tang D, Han W, Li P, et al. CO2biofixation and fatty acid composition of Scenedesmus obliquus and Chlorella pyrenoidosa in response to different CO2levels [J]. Bioresource Technology, 2011, 102(3): 3071—3076
[6]Fulke A B, Mudliar S N, Yadav R, et al. Bio-mitigation of CO2, calaite formation and simultaneous biodiesel precursors production using Chlorella sp. [J]. Bioresource Technology, 2010, 101(21): 8473—8476
[7]Li A F, Liu R, Liu X J, et al. Effects of carbon sources on growth and fatty acid composition of Pinguiococcus pyrenoidosus CCMP 2078 [J]. Acta Hydrobilologica Sinica,2009, 33(3): 461—467 [李爱芬, 刘然, 刘晓娟, 等. 碳源对粉核油球藻生长和脂肪酸组成特性的影响. 水生生物学报, 2009, 33(3): 461—467]
[8]Chiu S Y, Kao C Y, Tsai M T, et al. Lipid accumulation and CO2utilization of Nannochloropsis oculata in response to CO2aeration [J]. Bioresource Technology,2009, 100(2): 833—838
[9]de Morais M G, Costa J A V. Biofixation of carbon dioxide by Spirulina sp. and Scenedesmus obliquus cultivated in a three-stage serial tubular photobioreactors [J]. Journal of Biotechnology, 2007b, 129(3): 439—445
[10]Rippka R, Deruelles J, Waterbury J B, et al. Generic assignments, strain histories and properties of pure cultures of cyanobacteria [J]. Journal of General Microbiology,1979, 111(1): 1—61
[11]Chisti Y. Biodiesel from microalgae [J]. Biotechnology Advances, 2007, 25(3): 294—306
[12]Bigogno C, Khozin-Goldberg I, Boussiba S, et al. Lipid and fatty acid composition of the green oleaginous alga Parietochloris incise, the richest plant source of arachidonic acid [J]. Phytochemistry, 2002, 60(5): 497—503
[13]Lee Y K, Chen W, Shen H, et al. Basic Culturing and Analytical Measurement Techniques [A]. In: Richmond A, Emeritus, Hu Q (Eds.), Handbook of Microalgal Culture: Applied Phycology and Biotechnology [C]. Wiley Blachwell. 2013, 16(2): 37—68
[14]Zhao B T, Su Y X. Process effect of microalgal-carbon dioxide fixation and biomass production: A review [J]. Renewable and Sustainable Energy Reviews, 2014, 31(2): 121—132
[15]Cheng L, Zhang L, Chen H, et al. Carbon dioxide removal from air by microalgae cultured in a membrane-photobioreactor [J]. Separation and Purification Technology,2006, 50(3): 324—329
[16]Lee Y K, Tay H S. High CO2partial pressure depresses productivity and bioenergenetic growth yield of Chlorella pyrenoidosa culture [J]. Journal of Applied Phycology,1991, 3(2): 95—101
[17]Ho S H, Chen C Y, Lee D J, et al. Perspectives on microalgal CO2-emission mitigation systems-a review [J]. Biotechnology Advances, 2011, 29(2): 189-198
[18]Anjos M, Fernandes B D, Vicente A A, et al. Optimization of CO2bio-mitigation by Chlorella vulgaris [J]. Bioresource Technology, 2013, 139(3): 149—154
[19]Cervantes A T, Morales M, Novelo E, et al. Carbon dioxide fixation and lipid storage by Scenedesmus obtusiusculus [J]. Bioresource Technology, 2013, 130(2): 652—658
[20]Wang X W, Liang J R, Luo C S, et al. Biomass, total lipid production, and fatty acid composition of the marine diatom Chaetoceros muelleri in response to different CO2levels [J]. Bioresource Technology, 2014, 161(6): 124—130
[21]Xu F, Hu H H, Cong W, et al. Effects of air flow rate and CO2concentration on the growth of Nannochloropsis sp. and EPA accumulation in an air lift photobioreactor [J]. The Chinese Journal of Process Engineering, 2004, 4(5): 457—461 [徐芳, 胡晗华, 丛威, 等. 通气量和 CO2对Nannochloropsis sp. 在光生物反应器中的生长和EPA合成的影响. 过程工程学报, 2004, 4(5): 457—461]
[22]Griffiths M J, Harrison S T L. Lipid productivity as key characteristic for choosing algal species for biodiesel production [J]. Journal of Applied Phycology, 2009, 21(5): 493—507
EFFECTS OF DIFFERENT CO2CONCENTRATION ON CO2FIXATION AND LIPID ACCUMULATION OF TWO STRAINS OF SCENEDESMUS SP.
GUO Qi1,2, ZHENG Ling-Ling1, SHEN Wei1and SONG Li-Rong1
(1. Key Laboratory of Algal Biology, Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China)
栅藻; 生物量产率; CO2固定速率; 油脂产率
Scenedesmus sp.; Biomass productivity; CO2fixation rate; Lipid productivity
10.7541/2016.55
Q949.9
A
1000-3207(2016)02-0414-05
2015-04-01;
2015-08-21
国家高技术研究发展计划 [Supported by National High-tech R&D Program of China (2014AA022001)]
郭琪(1990—), 女, 湖北仙桃人; 硕士; 从事产油微藻固碳研究。 E-mail: guoqi900520@163.com
宋立荣, E-mail: lrsong@ihb.ac.cn
