饲料精氨酸水平对斜带石斑鱼幼鱼生长和肠道形态的影响
2016-11-24迟淑艳韩凤禄谭北平董晓慧杨奇慧刘泓宇
迟淑艳 韩凤禄 谭北平 董晓慧 杨奇慧 刘泓宇 章 双
研究简报
饲料精氨酸水平对斜带石斑鱼幼鱼生长和肠道形态的影响
迟淑艳 韩凤禄 谭北平 董晓慧 杨奇慧 刘泓宇 章 双
(广东海洋大学 水产动物营养与饲料实验室, 湛江 524088)
精氨酸作为一种鱼类生长发育所必需的碱性氨基酸, 是机体合成蛋白质的重要成分[1], 对肠细胞的增殖分化和维持细胞形态结构具有重要的保护作用[2]。对陆生动物如羊[2]、仔猪[3,4]和鼠[5]等的研究表明, 日粮中添加精氨酸能显著提高肠道绒毛高度和隐窝深度, 从而提高肠道消化吸收能力。目前, 在鱼类的相关研究中, Cheng等[6]报道在饲料中添加精氨酸或谷氨酰胺能显著提高杂交条纹鲈(Morone chrysops×Morone saxatilis)和美国红鱼(Sciaenops ocellatus)[7]前肠和中肠的皱襞和微绒毛高度, 增大肠道吸收面积。肠道是动物吸收利用精氨酸的主要部位, 而精氨酸的代谢分两个途径: 一是精氨酸酶(ARG)途径; 二是一氧化氮合酶(NOS)途径, 其中前者为主要发生途径。精氨酸在ARG的作用下生成鸟氨酸和尿素, 鸟氨酸又经鸟氨酸脱羧酶的作用生成多胺(包括精胺、腐胺、精脒)。多胺不仅对肠上皮细胞的生长、分化和迁移起着重要作用, 还对肠细胞的成熟和肠道形态修复具有不可替代的作用[8]。其次, 精氨酸经NOS的作用生成瓜氨酸和一氧化氮(NO)。NO在动物机体内不仅起着重要的免疫作用, 还对胃肠细胞的增殖和凋亡具有重要的调控作用[9]。因此, 精氨酸是维持动物肠道健康必不可少的营养物质。
斜带石斑鱼(Epinephelus coioides)属鲈形目,科(Serranidae), 石斑鱼属(Epinephelus), 是一种低脂肪、高蛋白的暖水性中下层的肉食性名贵鱼类。在台湾、福建、广东、海南等地均有大量养殖[10,11], 已成为我国南方沿海海水养殖的高档经济鱼类之一。关于精氨酸对斜带石斑鱼肠道形态影响的研究未见报道。本文通过评估斜带石斑鱼前、中、后肠的形态结构的变化, 探讨饲料中不同水平的精氨酸, 与鱼类生长和肠道发育的相互关系。
1 材料与方法
1.1 实验设计与实验饲料
实验饲料配方见表 1, L-精氨酸(99%, 上海三杰生物科技有限公司)添加量分别为0、0.3%、0.6%、0.9%、1.2%、1.5%和1.8%, 实测值为2.13%、2.42%、2.71%、2.95%、3.20%、3.48%和3.74%(表 1), 配制7种等氮等脂的实验饲料。各原料经粉碎过60目筛后按比例逐级混匀, 经双螺杆挤条机(华南理工大学科技实业总厂, F-75型)制成粒径为3 mm沉性颗粒饲料, 室温风干后装进密封袋放于-20℃冰箱内备用。
1.2 实验用鱼与饲养管理
养殖试验在湛江东海岛海洋生物研究基地的室内养殖系统(1 m3玻璃钢桶)中进行。实验用鱼购自湛江东海岛浩利斜带石斑鱼良种场。驯养2周后, 挑选体格健壮、规格均一的斜带石斑鱼幼鱼, 随机分为7组[初始体质量为(7.52±0.02) g], 每组3个重复, 每个重复30尾鱼, 分别放养于养殖桶中, 每天08:00和16:00投喂实验饲料至表观饱食。整个养殖周期内保持水体溶氧在6 mg/L以上, pH 7.7—8.0, 水温26—30℃, 饲养8周。
1.3 样品处理
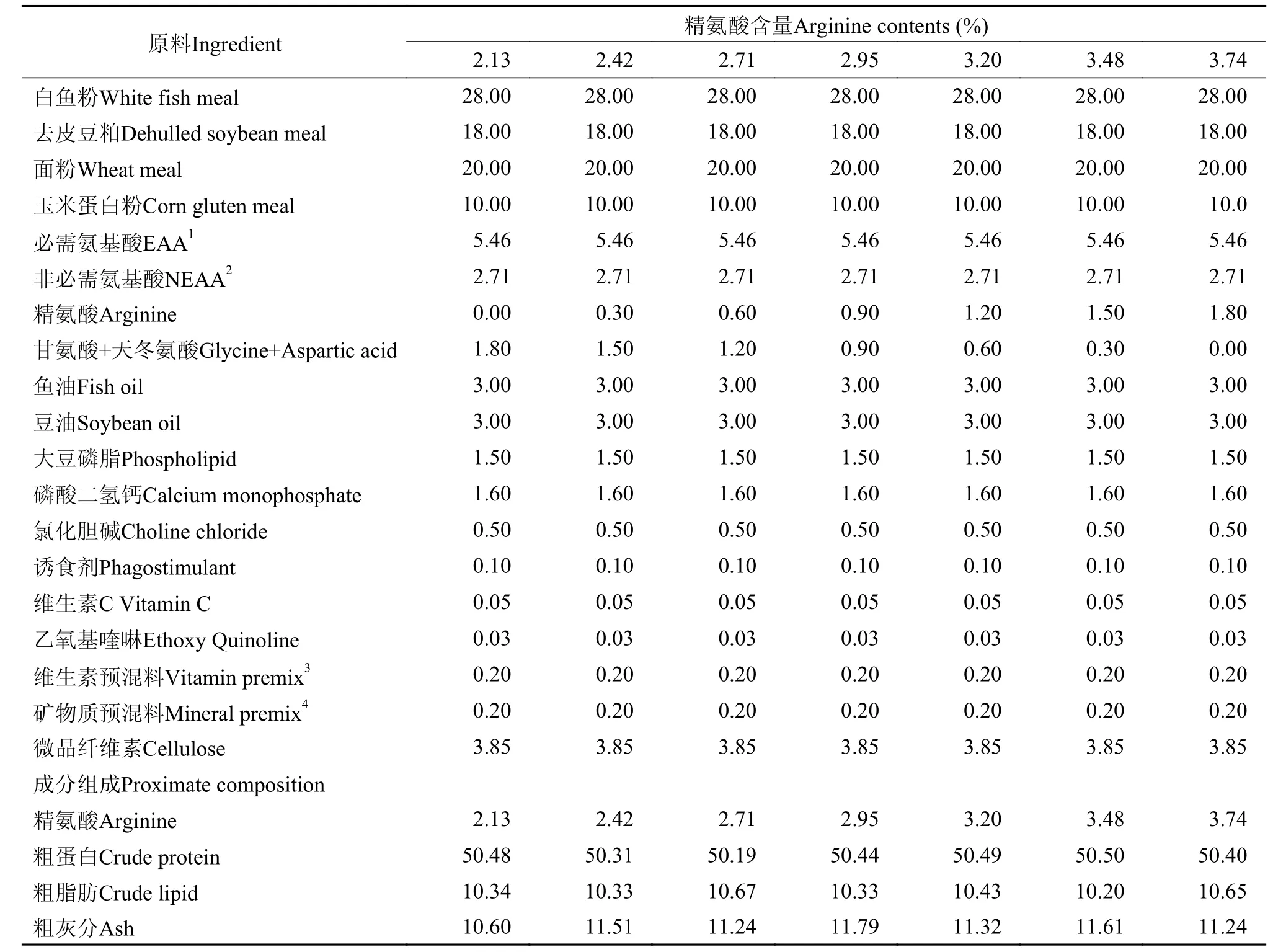
表 1 实验饲料配方和营养成分组成(干物质%)Tab. 1 Formulation and proximate analysis of trial diets (dry matter, DM %)
实验结束前, 对实验鱼进行饥饿24h, 然后分别对每个养殖桶计数、称重。每桶随机取4尾鱼, 按照肠道长度均分3段分别取其前、中、后肠, 用4%甲醛溶液固定保存, 用于制作组织切片。
1.4 肠道组织切片的制作与观察
取固定好的斜带石斑鱼前、中、后肠样本, 分别进行常规石蜡包埋切片, 厚度为6 μm, 苏木精-伊红(HE)染色, 制作切片。在10倍光镜下测量皱襞高度(Fold height,FH), 40倍光镜下测量肌层厚度(Muscular layer thickness,MLT), 每张切片分别测定20个皱襞高度和肌层厚度数据, 得到的均值作为测定数据进行分析。
1.5 相关指标计算公式
增重率(Weight gain ratio, WGR, %)=100×(Wt-Wi)/Wi
饲料系数(Feed coefficient ratio, FCR)=Wf/(WT+Wn-WI)
成活率(Survival rate, SR, %)=100×Nt/Ni
式中, Wt(g)为终末鱼体均重; Wi(g)为初始鱼体均重;WT(g) 为终末体总重; Wn(g)为死亡个体重量; WI(g)为初始体总重; Wf(g)为每桶实验鱼鱼摄食饲料总量(干重);Nt为终末鱼尾数; Ni为初始鱼尾数。
1.6 数据统计与分析
采用SPSS 19.0统计软件对实验数据进行ANOVA单因素方差分析, 若差异显著(P<0.05), 再进行多重比较(Duncan’s procedure), 所有的结果均以平均值±标准差表示。
2 结果
2.1 饲料中不同水平精氨酸对斜带石斑鱼幼鱼生长性能和存活率的影响
从表 2中可以得出, 各实验组斜带石斑鱼成活率都在98%以上, 饲料中精氨酸水平对成活率未产生显著性影响(P>0.05)。随着饲料中精氨酸水平逐渐升高, 斜带石斑鱼幼鱼增重率呈先升高后降低的趋势, 且在2.95%组达到最大值, 显著高于其他各组(P<0.05)。与2.13%相比, 其他各实验组的饲料系数显著降低(P<0.05)。
2.2 饲料中不同水平精氨酸对斜带石斑鱼幼鱼前肠形态的影响

表 2 饲料中精氨酸水平对斜带石斑鱼幼鱼的生长和饲料利用的影响Tab. 2 Effect of dietary arginine level on growth performance and feed utilization of juvenile grouper
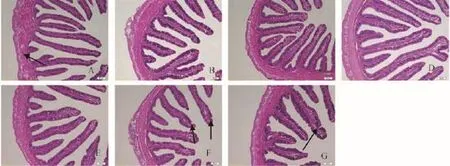
图 1 饲料不同水平精氨酸对斜带石斑鱼幼鱼前肠形态影响(20×)Fig. 1 Effect of dietary arginine level on histomorphology appearance of the foregut of juvenile grouper (20×)
由图 1可知, 2.13%组肌层厚薄分布不均, 且皱襞间质较窄; 2.42%组皱襞密度相对2.71%和2.95%组较小, 纹状缘排列不整齐; 2.71%和2.95%组皱襞间质明显变宽,皱襞数量增多; 从3.20%组开始出现FH降低, 3.48%和3.74%组甚至出现纹状缘受损现象, 皱襞数量明显减少。由表 3可以得知, 随着饲料精氨酸水平不断升高, 斜带石斑鱼前肠的FH和MLT都呈现先升高后降低的趋势。其中, 2.95%组MLT显著高于2.71%、3.20%、3.48%和3.74%组(P<0.05), 与2.13%、2.42%组差异性不显著(P>0.05),而2.71%和2.95%组前肠FH显著高于其他各组(P<0.05)。
2.3 饲料中不同水平精氨酸对斜带石斑鱼幼鱼中肠的形态影响
由图 2可知, 从2.13%组到3.74%组皱襞数量先逐渐增多后逐渐减少, 而皱襞宽度呈先变窄后逐渐变宽;2.13%、2.71%、2.95%和3.20%组纹状缘出现明显受损,而3.20%组受损较为严重; 其中, 3.48%组出现皱襞局部断裂; 3.74%组皱襞上的杯状细胞数量明显较少。由表4可知, 随着饲料中的精氨酸水平升高, 斜带石斑鱼中肠MLT呈先升高后降低趋势, FH则逐渐降低。其中,2.71%和2.95%组中肠MLT显著高于其他各组(P<0.05),中肠FH则是前四组显著高于后三组(P<0.05)。
2.4 饲料中不同水平精氨酸对斜带石斑鱼幼鱼后肠的形态影响
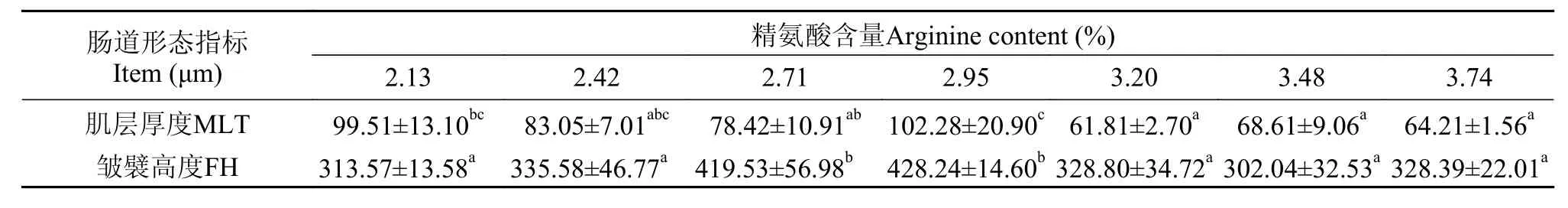
表 3 精氨酸水平对斜带石斑鱼幼鱼前肠形态的影响Tab. 3 Effect of dietary arginine level on foregut morphology of juvenile grouper
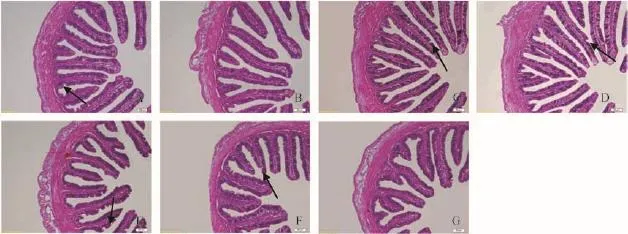
图 2 饲料不同水平精氨酸对斜带石斑鱼幼鱼中肠形态影响(20×)Fig. 2 Effect of dietary arginine level on histomorphology appearance of the midgut of juvenile grouper (20×)
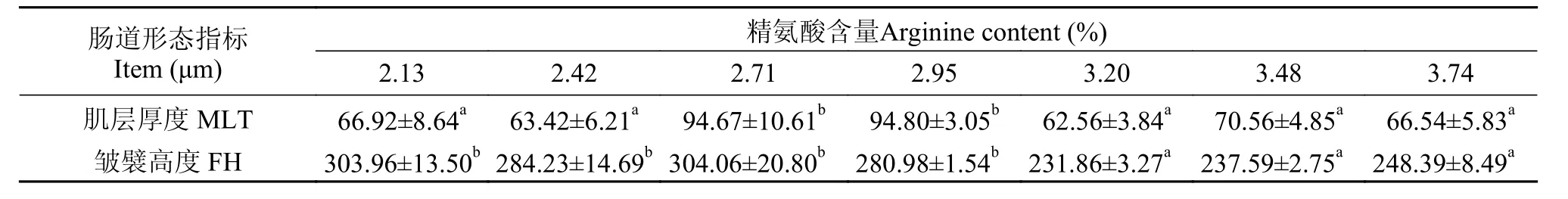
表 4 精氨酸水平对斜带石斑鱼幼鱼中肠形态的影响Tab. 4 Effect of dietary arginine level on midgut morphology of juvenile grouper
由图 3可知, 2.13%组皱襞间质明显较窄, 且发育不良; 2.42%、2.71%和2.95%组纹状缘排列整齐, 杯状细胞较多, 柱状上皮细胞紧密排列, 而2.71%和2.95%组皱襞间质明显变宽, 发育较好; 3.20%组出现纹状缘局部受损,皱襞间质变窄; 3.48%和3.74%组皱襞数量明显减少, 肌层明显变薄。由表 5可知, 斜带石斑鱼后肠FH和MLT都随着精氨酸水平的升高呈先升高后降低的趋势。其中2.71%组MLT与2.95%组差异性不显著(P>0.05), 但显著高于其他各组(P<0.05); 而3.20%组后肠FH与2.42%、2.71%和2.95%组差异性不显著(P>0.05), 但显著高于其他各组(P<0.05)。
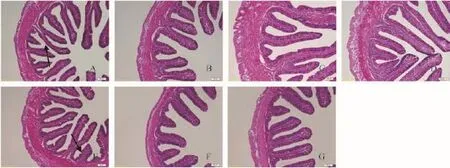
图 3 饲料不同水平精氨酸对斜带石斑鱼幼鱼后肠形态影响(20×)Fig. 3 Effect of dietary arginine level on histomorphology appearance of the hindgut of juvenile grouper (20×)

表 5 精氨酸水平对斜带石斑鱼幼鱼后肠形态的影响Tab. 5 Effect of dietary arginine level on hindgut morphology of juvenile grouper
3 讨论
精氨酸作为水生动物生长所必需的一种碱性氨基酸, 具有促进机体蛋白质合成和生长的重要作用[12]。在本实验条件下, 饲料精氨酸水平对斜带石斑鱼的成活率没有显著影响, 随着饲料中精氨酸水平的升高, 斜带石斑鱼的生长得到明显的改善。该结果与卵形鲳鲹(Trachinotus ovatus)[13]、牙鲆(Paralichthys olivaceus)[14]、尖吻鲈(Lates calcarifer)[15]、斜带石斑鱼[16]、黄颡鱼(Pelteobagrus fulvidraco)[17]、斑点叉尾(Ictalurus puctatus)[18]和美国红鱼(Sciaenops ocellatus)[19]的研究结果一致。本实验研究结果显示, 随着饲料中精氨酸水平的进一步升高, 斜带石斑鱼的生长受到了抑制, 这和研究虹鳟(Oncorhynchus mykiss)[20]和印度鲤(Cirrhinus mrigala)[21]的结果显示的趋势一致, 在对大西洋鲑(Salmo salar)的研究发现, 精氨酸和赖氨酸由于需要共同的氨基酸转运载体完成组织间的转运, 因此在肠道中的吸收存在竞争抑制现象[22], 从而导致氨基酸营养不平衡而使生长受到抑制。然而, 对牙鲆[23]和大鲮鲆(Psetta maxima)[20]的研究表明, 饲料中过量的精氨酸对生长无影响。因此, 精氨酸在鱼类体内的具体吸收和转运机制还有待进一步研究。在本实验中, 各组之间的饲料系数呈先降低后升高的趋势, 且都维持在较低水平(1.18—1.43)。这说明饲料中精氨酸的添加能够显著降低其饲料系数, 然而过高的精氨酸水平(超过2.95%)又会使其升高, 这在对黑鲷(Acanthopagrus schlegelii)[24]、青石斑鱼(Epinephelus awoara)[25]以及团头鲂(Megalobrama amblycephala)[26]的研究中也有类似报道, 这可能与鱼类对精氨酸的利用效率密切相关。
目前, 斜带石斑鱼肠段的划分还没有定论, 只是人为界定为前、中、后肠。其肠道由肠腔内到外依次分为黏膜层、黏膜下层、肌层和浆膜层共四层结构。黏膜层和黏膜下层向肠腔突起形成皱襞, 从而增大了肠道吸收面积, 皱襞的高低常作为评判肠道发育状况的指标, 如对美国红鱼[7,27]、大西洋白姑鱼(Argyrosomus regius)[28]和鲤(Cyprinus carpio carpio)[29]等的研究中, FH作为营养素影响鱼类肠道形态和生长的关键指标。本实验结果显示,饲料中适量精氨酸含量能显著提高斜带石斑鱼前、中、后肠的FH。饲料精氨酸能减轻生长期大鼠和断奶仔猪肠道黏膜损伤、增加绒毛(相当于鱼类肠道皱襞)高度和降低隐窝深度[30,31]。此外, Zhan等[32]研究长白仔猪的结果显示, 饲料中添加0.7%的精氨酸能显著提高小肠绒毛高度。Cheng等[6,7]报道了杂交条纹鲈和美国红鱼的研究结果与本实验的结果相类似。然而, 本实验中高剂量的精氨酸, 导致斜带石斑鱼幼鱼三个肠段的FH降低。可能是因为过量的精氨酸导致机体吸收的氨基酸不均衡, 以至不能很好的被肠道细胞所利用; 或者是由于过量的精氨酸分解代谢产生的NO与超氧化物阴离子反应, 生成了强氧化剂过氧亚硝基, 最终导致了羟基的产生引起氧化损伤[33], 从而抑制了肠道的生长发育。目前已有研究表明, 饲料中苏氨酸水平对草鱼幼鱼的肠道MLT和浆膜层厚度影响显著[34], 本实验饲料精氨酸水平显著影响三个肠段的MLT, 且整体趋势都呈先升高后降低, 表明饲料中适量的精氨酸能显著促进斜带石斑鱼幼鱼肠道肌层的生长。
结合斜带石斑鱼幼鱼生长状况分析可知, 肠道的FH、MLT和其形态完整性与斜带石斑鱼幼鱼的生长状况是密切相关的。其中, 2.71%和2.95%组的三个肠段的肠道发育水平明显好于其他各组, 这两组皱襞数量明显较多, 柱状上皮细胞排列整齐, 杯状细胞致密, 前肠和后肠的纹状缘排列紧密, 然而中肠的纹状缘局部出现损伤,表明斜带石斑鱼幼鱼不同肠段对精氨酸的利用能力不同, 导致其吸收细胞的微绒毛发育水平不一致; 而过低或过高水平的精氨酸都不利于斜带石斑鱼幼鱼肠道的生长发育, 出现了诸如肌层厚度不均匀、纹状缘受损、皱襞局部断裂和杯状细胞较少等症状, 同时与生长相呼应, 也表现出WGR明显偏低, 表明过低和过高水平的精氨酸都不利于斜带石斑鱼幼鱼对其的吸收和利用。饲料中精氨酸水平不同, 对斜带石斑鱼肠道发育的影响不同, 最终在整个机体的生长发育状况上表现出来[35]。
4 结论
在本实验条件下, 饲料中精氨酸水平能显著影响斜带石斑鱼幼鱼肠道皱襞高度和肌层厚度, 有利于肠道对食糜的消化和吸收, 进而对斜带石斑鱼幼鱼的生长产生显著影响。
[1]Kaushik S, Fauconneau B, Terrier L, et al. Arginine requirement and status assessed by different biochemical indices in rainbow trout (Salmo gairdneri R.) [J]. Aquaculture,1988, 70(1): 75—95
[2]Zhao H L, Effect of Arginine on the intestinal protein synthesis, expression of amino acid transport protein mRNA and gut health in the Fine-Wool sheep [D]. Thesis for Master of Science. Inner Mongolia Agricultural University, Hohhot. 2012 [赵宏丽, 精氨酸对细毛羊肠道蛋白质合成, 氨基酸转运蛋白mRNA表达及肠道健康的影响. 硕士学位论文, 内蒙古农业大学, 呼和浩特. 2012]
[3]Gookin J L, Rhoads J M, Argenzio R A. Inducible nitric oxide synthase mediates early epithelial repair of porcine ileum [J]. American Journal of Physiology-Gastrointestinal and Liver Physiology, 2002, 283(1): G157—G168
[4]Wu X, Ruan Z, Gao Y L, et al. Dietary supplementation with L-arginine or N-carbamylglutamate enhances intestinal growth and heat shock protein-70 expression in weanling pigs fed a corn-and soybean meal-based diet [J]. Amino Acids, 2010, 39(3): 831—839
[5]Koppelmann T, Pollak Y, Mogilner J, et al. Dietary L-arginine supplementation reduces Methotrexate-induced intestinal mucosal injury in rat [J]. BMC Gastroenterology,2012, 12(1): 41
[6]Cheng Z Y, Gatlin D M, Buentello J A. Dietary supplementation of arginine and/or glutamine influences growth performance, immune responses and intestinal morphology of hybrid striped bass (Morone chrysops × Morone saxatilis) [J]. Aquaculture, 2012, 36(2): 39—43
[7]Cheng Z Y, Buentello J A, Gatlin D M. Effects of dietary arginine and glutamine on growth performance, immune responses and intestinal structure of red drum, Sciaenops ocellatus [J]. Aquaculture, 2011, 319(1): 247—252
[8]Johnson L R. Regulation of gastrointestinal mucosal growth [J]. World Journal of Surgery, 1979, 3(4): 477—486
[9]Chung H T, Pae H O, Choi B M, et al. Nitric oxide as a bioregulator of apoptosis [J]. Biochemical and Biophysical Research Communications, 2001, 282(5): 1075—1079
[10]Mai X J, Huang X J, Ye F L, et al. Marine Fish Reproductive Biology and Artificial Breeding [M]. Beijing: China Ocean Press. 2005, 166—167 [麦贤杰, 黄伟健, 叶富良, 等. 海水鱼类繁殖生物学和人工繁育. 北京: 海洋出版社. 2005, 166—167]
[11]Chi S Y, Wang X W, Tan B P, et al. Effects of dietary methionine on the growth performance, anti-oxidation and acivities of gluconeogenesis-related enzyme in juvenile groupers, Epinephelus coioides [J]. Acta Hydrobiologica Sinica, 2015, 39(4): 645—652 [迟淑艳, 王学武, 谭北平, 等. 饲料蛋氨酸对斜带石斑鱼生长性能、抗氧化及糖异生相关酶活性的影响. 水生生物学报, 2015,39(4): 645—652]
[12]Wilson R P, Halver J E. Protein and amino acid requirements of fishes [J]. Annual Review of Nutrition,1986,6(1): 225—244
[13]Lin H Z, Tan X H, Zhou C P, et al. Effect of dietary arginine levels on the growth performance, feed utilization,non-specific immune response and disease resistance of juvenile golden pompano Trachinotus ovatus [J]. Aquaculture, 2015, 43(7): 382—389
[14]Han Y, Koshio S, Ishikawa M, et al. Interactive effects of dietary arginine and histidine on the performances of Japanese flounder Paralichthys olivaceus juveniles [J]. Aquaculture, 2013, 41(4): 173—182
[15]Murillo-Gurrea D, Coloso R, Borlongan I, et al. Lysineand arginine requirements of juvenile Asian sea bass Lates calcarifer [J]. Journal of Applied Ichthyology,2001, 17(2): 49—53
[16]Luo Z, Liu Y J, Mai K S, et al. Effects of dietary arginine levels on growth performance and body composition of juvenile grouper Epinephelus coioides [J]. Journal of Applied Ichthyology, 2007, 23(3): 252—257
[17]Zhou Q C, Jin M, Elmada Z C, et al. Growth, immune response and resistance to Aeromonas hydrophila of juvenile yellow catfish, Pelteobagrus fulvidraco, fed diets with different arginine levels [J]. Aquaculture, 2015,43(7): 84—91
[18]Buentello J A, Delbert M G. The dietary arginine requirement of channel catfish (Ictalurus punctatus) is influenced by endogenous synthesis of arginine from glutamic acid [J]. Aquaculture, 2000, 18(8): 311—321
[19]Barziza D E, Buentello J A, Delbert M G. Dietary arginine requirement of juvenile red drum (Sciaenops ocellatus) based on weight gain and feed efficiency [J]. Journal of Nutrition, 2000, 130(7): 1796—1799
[20]Fournier V, Gouillou-Coustans M, Metailler R, et al. Excess dietary arginine affects urea excretion but does not improve N utilisation in rainbow trout Oncorhynchus mykiss and turbot Psetta maxima [J]. Aquaculture, 2003,217(1): 559—576.
[21]Ahmed I, Khan M A. Dietary arginine requirement of fingerling Indian major carp, Cirrhinus mrigala (Hamilton)[J]. Aquaculture Nutrition, 2004, 10(4): 217—225.
[22]Berge G E, Bakke-Mckellep A M, Lied E. In vitro uptake and interaction between arginine and lysine in the intestine of Atlantic salmon (Salmo salar) [J]. Aquaculture,1999, 179(1): 181—193
[23]Alam S, Teshima S I, Yaniharto D, et al. Influence of different dietary amino acid patterns on growth and body composition of juvenile Japanese flounder, Paralichthys olivaceus [J]. Aquaculture, 2002, 210(1): 359—369.
[24]Zhou F, Study on effects of dietary lysine and arginine on growth performance, and the arginine/lysine antagonism mechanism in juvenile black sea bream, Acanthopagrus schlegelii [D]. Hangzhou: Zhejiang University. 2011 [周凡, 饲料赖氨酸和精氨酸对黑鲷幼鱼生长影响及其拮抗作用机理研究. 硕士学论文: 浙江大学. 杭州, 2011]
[25]Zhou Q C, Zeng W P, Wang H L, et al. Dietary arginine requirement of juvenile yellow grouper Epinephelus awoara [J]. Aquaculture, 2012, 350(3): 175—182.
[26]Ren M C, Liao Y J, Xie J, et al. Dietary arginine requirement of juvenile blunt snout bream, Megalobrama amblycephala [J]. Aquaculture, 2013, 414—415: 229—234
[27]Zhou Q C, Buentello J A, Gatlin D M. Effects of dietary prebiotics on growth performance, immune response and intestinal morphology of red drum (Sciaenops ocellatus)[J]. Aquaculture, 2010, 309(1): 253—257
[28]Ribeiro L, Moura J, Santos M, et al. Effect of vegetable based diets on growth, intestinal morphology, activity of intestinal enzymes and haematological stress indicators in meagre (Argyrosomus regius) [J]. Aquaculture, 2015,447(1): 116—118
[29]Geda F, Rekecki A, Decostere A, et al. Changes in intestinal morphology and amino acid catabolism in common carp at mildly elevated temperature as affected by dietary mannanoligosaccharides [J]. Animal Feed Science and Technology, 2012, 178(1): 95—102
[30]Hebiguchi T, Kato T, Yoshino H, et al. The effect of arginine supplementation on growth hormone release and intestinal mucosal growth after massive small bowel resection in growing rats [J]. Journal of Pediatric Surgery,1997, 32(8): 1149—1153
[31]Liu Y L, Huang J J, Hou Y Q, et al. Dietary arginine supplementation alleviates intestinal mucosal disruption induced by Escherichia coli lipopolysaccharide in weaned pigs [J]. British Journal of Nutrition, 2008, 100(3): 552—560
[32]Zhan Z F, Ou D Y, Piao X S, et al. Dietary arginine supplementation affects microvascular development in the small intestine of early-weaned pigs [J]. The Journal of Nutrition, 2008, 138(7): 1304—1309
[33]Brunini T M, Mendes-Ribeiro A C, Ellory J C, et al. Platelet nitric oxide synthesis in uremia and malnutrition: A role for l-arginine supplementation in vascular protection [J]. Cardiovascular Research, 2007, 73(2): 359—367
[34]Gao Y J, Yang H J, Liu Y J, et al. Effects of graded levels of threonine on growth performance, biochemical parameters and intestine morphology of juvenile grass carp Ctenopharyngodon idella [J]. Aquaculture, 2014,424—425: 113—119
[35]Klurfeld D M. Nutritional regulation of gastrointestinal growth [J]. Frontiers in Bioscience, 1999, 4(1—3): 299—302
EFFECTS OF DIETARY ARGININE LEVEL ON GROWTH PERFORMANCE AND INTESTINE MORPHOLOGY OF JUVENILE GROUPER EPINEPHELUS COIOIDES
CHI Shu-Yan, HAN Feng-Lu, TAN Bei-Ping, DONG Xiao-Hui, YANG Qi-Hui, LIU Hong-Yu and ZHANG Shuang
(Laboratory of Aquatic Animal Nutrition and Feed, College of Fisheries, Guangdong Ocean University, Zhanjiang 524088, China)
斜带石斑鱼; 精氨酸; 生长性能; 肠道形态
Grouper; Arginine; Growth performance; Intestine morphology
10.7541/2016.51
S965.3
A
1000-3207(2016)02-0388-07
2015-05-04;
2015-10-08
国家公益性行业(农业)专项资金(No. 201003020); 国家自然科学基金(No. 31402310); 广东省高等院校学科与专业建设科技创新项目(2013KJCX0097)资助 [Supported by Special Fund for Agroscientific Research in the Public Interest (No. 201003020); the National Natural Science Foundation of China (No. 31402310)]
迟淑艳(1977—), 女, 内蒙古赤峰人; 博士; 研究方向为水产动物营养与饲料学。E-mail: chishuyan77@163.com
谭北平(1967—), 男, 湖北巴东人; 博士; 研究方向为水产动物营养与饲料学。E-mail: bptan@126.com
