纳米氧化锌对斑马鱼鳃组织的氧化损伤
2016-11-24赵群芬
刘 林 赵群芬
研究简报
纳米氧化锌对斑马鱼鳃组织的氧化损伤
刘 林 赵群芬
(宁波大学海洋学院, 宁波 315211)
纳米颗粒是指粒径在1—100 nm, 表面积较大, 具有块状颗粒所没有的特有性质。由于纳米颗粒具有独特的理化性质, 近年来合成和生产纳米颗粒的产量大大增加[1]。纳米氧化物颗粒在科研和工业产品的应用正在逐年增加, 科学家预测依靠纳米技术创造的产品产生的价值, 到2015年可能达到1万亿美元[2]。随着纳米颗粒的使用, 它对人类健康和环境的风险也随之增加。因此了解纳米颗粒的不利影响, 确定对生物的影响, 确保纳米材料的安全使用是十分必要的[3]。
鳃是鱼类的呼吸器官, 它直接与水环境接触, 是污染物发挥毒性作用的主要靶器官, 其结构和生理变化可以直接反应污染物对鱼的毒害程度[4]。如甲砜霉素能引起松浦镜锂(Cyprinus carpio L.)鳃上皮细胞轻微肿胀, 并随着给药剂量的增加, 肿胀现象严重[5]; 重金属镉和汞离子能引起鲤鳃组织出现鳃小片顶端充血, 呈球状或棒状, 鳃小片弯曲, 上皮肿胀, 甚至出现鳃小片细胞脱落, 严重时出现鳃小片解体[6]。纳米铜颗粒能引起鳃组织水肿, 鳃丝棒状化, 鳃丝畸形增长, 鳃丝溶解等炎症[7]。
人工合成的纳米氧化锌颗粒(nZnO)应用于药品、牙膏、化妆品、防嗮霜、纺织品和涂料中[8], 生产和使用时不可避免的向环境中释放, 从而给环境造成潜在的风险[9]。生物体生活在nZnO污染的环境中能造成组织的病变, 组织病理能快速和有效检测纳米颗粒处理对组织或器官产生的不利影响[10], 鱼体内抗氧化酶对环境污染物非常敏感, 可作为生物标记物评估水体中污染物的污染程度[11]。水生生物特别是鱼类比哺乳动物对纳米颗粒的毒害更敏感[10], 可用于检测水体中低浓度的纳米颗粒的毒性。鲤暴露于nZnO溶液中21d后, 鳃组织受到不同程度的损伤, 鳃小片上皮细胞出现肿胀, 并伴有变性、脱落, 浸润的炎症细胞一起填满整个鳃小片间隙, 使鳃丝呈棍状[12]; 0.5、5和50 mg/L的nZnO处理鲤14d内, 使鳃中SOD、GSH-PX活性升高, 并引起鳃组织的氧化损伤[13]。组织的氧化损伤是调节细胞凋亡的关键环节, 过多的活性氧可以促进细胞的凋亡。另有研究发现多种环境污染物质可以诱导凋亡基因的表达而对凋亡产生影响, 如苯并芘能通过调节Bcl-2家族的表达对Daudi细胞的凋亡产生影响[14]。然而有关nZnO对鳃的毒性研究, 大多停留在生理水平检测或组织损伤观察上, 缺少nZnO对鳃组织毒性机理的研究。本研究以成年斑马鱼(Danio rerio)为实验对象, 通过nZnO诱导斑马鱼鳃组织损伤、抗氧化酶活性的变化和细胞凋亡相关基因表达量的影响, 探讨nZnO暴露下对鳃组织产生氧化胁迫后对细胞凋亡的影响, 对进一步研究纳米材料的生态效应和水生态环境安全提供科学依据。
1 材料与方法
1.1 材料
蓝色斑马鱼购于宁波市天胜花鸟市场, 鱼龄120d左右, 雌雄各半, 平均体重为(0.36±0.1) g, 平均体长为(3.00±0.6) cm, 驯养用水为自来水曝气12h, 水温(26±0.5)℃, 光照/黑暗周期为14h︰10h, 每日投喂2次, 驯养7d后用于急性毒理实验, 为保证试验期间水质, 试验期间停止投喂饵料。
nZnO [(25±2) nm]: 购于杭州大洋纳米新材料有限公司。RNAiso Plus试剂、SYBR® Premix Ex TaqTMⅡ (Tli RNaseH Plus)试剂购于大连TaKaRa公司。超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽过氧化物酶(GSHPX)测定试剂盒购于南京建成生物研究所。
1.2 方法
选择健康斑马鱼进行毒理实验, 实验组nZnO浓度设为0.05、0.1、5、10、25和50 mg/L, 另设对照组, 每组3个平行, 暴露试验参照GB/T13276—1991, 处理4h、24h和96h后解剖取鳃组织, 部分鳃组织加入RNA保存液(-80℃保存)用于RNA提取。余下鳃组织加入预冷的匀浆介质(0.01 mol/L Tris-HCl、0.001 mol/L EDTA-2Na、0.01 mol/L蔗糖, pH 7.4)研磨, 4℃, 2000—4000 r/min离心10min, 取上清用于抗氧化指标测定。另取处理7、15和30d斑马鱼鳃组织, 固定于10%甲醛中, 用于石蜡切片的制作。
斑马鱼鳃组织形态学观察 取固定于甲醛中的鳃组织, 酒精脱水, 浸蜡、石蜡包埋, 切片机切片、脱蜡、HE染色, 中性树胶封片, Nikon显微镜观察并拍照。
鳃组织中抗氧化指标的测定 采用考马斯亮蓝法对样品中上清液的蛋白含量进行测定; MDA含量、SOD活性、GSH-PX活性测定均按试剂盒说明书操作。
MDA以每mg组织蛋白中MDA的nmol数表示;SOD以每mg组织蛋白在1 mL反应液中SOD抑制率达50%时所对应的SOD量为一个SOD活力单位(U); GSHPX的活力规定为每毫克蛋白, 每分钟扣除非酶促反应的作用, 使反应体系中GSH浓度降低1 μmol/L为一个酶活力单位。
鳃组织中凋亡基因的检测 根据GenBank中斑马鱼Bcl-2基因序列、p53基因序列、MDM2基因序列和Bax基因序列, 以斑马鱼β-actin基因为内参, 设计Bcl-2、MDM2、p53、Bax和β-actin基因引物(表 1)。引物由上海生工有限公司完成, 选取处理4、24和96h实验组和对照组的鳃组织, 参考RNAiso Plus (TakaRa)试剂提取总RNA, A260/A280为1.90左右。根据PrimescriptTMRT reagent Kit with gDNA Eraser (TakaRa)试剂盒将各样品总RNA进行逆转录。
荧光定量RT-PCR反应体系(20 μL): SYBR Premix Ex TaqTMⅡ (2×) 10 μL、正向及反向引物各0.8 μL、cDNA模板2 μL、超纯水6.4 μL。扩增条件为: 预变性95℃ 3min, 40个循环(95℃ 20s, 57℃ 30s, 72℃ 25s), 反应结束后制备溶解曲线。每个反应设3个复孔, 为排除假阳性结果, 所有检测样品均包含1个无模板的阴性对照。采用2-ΔΔCt法分析荧光定量结果[15]。
1.3 实验数据的处理
数据用SPSS19.0统计分析软件进行单因素方差分析(One Way ANOVA), 显著性检测采用Tukey’s test多重比较; P<0.05为显著性差异, P<0.01为极显著差异。
2 结果
2.1 斑马鱼鳃组织结构的变化

表 1 目的基因及内参基因的引物Tab. 1 Primers of target and internal control genes

图 1 nZnO对斑马鱼鳃组织结构的影响Fig. 1 Effect of nZnO on structural change in gill of zebrafish (HE stain×400)
图 1所示为nZnO处理下斑马鱼鳃组织的结构变化,对照组鳃丝两侧排列着鳃小片(a-1、a-2、a-3), 鳃小片由上皮扁平细胞和柱状细胞构成, 上皮细胞单层扁平细胞排列在鳃小片表面, 柱状细胞在鳃小片内侧, 细胞核呈圆或椭圆形, 对照组15d时鳃丝中央静脉血窦明显可见(a-2)。与对照组相比, 最低浓度(0.05 mg/L)组在处理7d出现鳃上皮细胞脱落(b-1、b-2), 随着暴露浓度的增加和时间的延长, 其他实验组也发现相似现象(c-2、f-2、f-3、g-3); 0.1 mg/L组在处理7d就发现鳃上皮细胞增生现象(c-1), 随着处理时间的延长较低浓度(0.05 mg/L)组也观察到相同现象(b-2); 低浓度(5 mg/L)组在处理15d 时出现鳃小片边际通道扩张 (d-2), 随着暴露时间的延长, 0.05 mg/ L组也表现为鳃小片边际通道扩张的现象(b-3); 其他实验组还观察到鳃丝血管扩张(c-1), 淋巴细胞增多(e-1), 并伴有部分细胞坏死形成炎症聚集(e-1、f-2), 在高浓度(50 mg/L)组还发现鳃小片基部细胞有空泡化(g-2)和大量鳃上皮细胞脱落鳃丝呈棍状化的现象(g-3)。
2.2 nZnO对斑马鱼鳃组织中抗氧化酶活性的影响
nZnO胁迫下斑马鱼鳃中SOD活性的变化 如图2所示为斑马鱼鳃中SOD活性变化, 处理4h, 实验组斑马鱼鳃中的SOD活性升高, 且高浓度(25 和50 mg/L)组SOD活性极显著增加(P<0.01), 是对照组的1.41倍、2.07倍; 处理24h, 低浓度(0.05、0.1和5 mg/L)组, SOD活性高于对照组, 在其他浓度下, SOD活性均低于对照组;暴露96h后, 实验组鳃中SOD活性均低于对照组。
nZnO胁迫下斑马鱼鳃中MDA含量的变化nZnO暴露下斑马鱼鳃组织中MDA含量变化(图 3), 实验组斑马鱼鳃中MDA含量均高于对照组, 各个时刻下, 处理浓度为10 mg/L组, 鳃中MDA含量达最大, 分别是对照组的2.52倍、1.91倍和1.45倍。
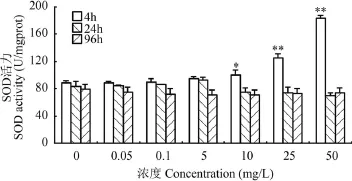
图 2 斑马鱼鳃中SOD活性的变化Fig. 2 Changes of SOD activity in zebrafish gill

图 3 斑马鱼鳃中MDA含量的变化Fig. 3 Changes of MDA content in zebrafish gill
nZnO胁迫下斑马鱼鳃中GSH-PX活性的影响 从图 4可见, nZnO胁迫4h后, 鳃中GSH-PX活性被诱导激活,呈上升趋势; 在处理24h后, 低浓度(0.05和0.1 mg/ L)组GSH-PX活性升高, 而在其他浓度下, GSH-PX活性均下降; 处理96h, GSH-PX活性下降。

图 4 斑马鱼鳃中GSH-PX活性的变化Fig. 4 Changes of GSH-PX activity in zebrafish gill
2.3 nZnO对斑马鱼鳃组织中p53、MDM2、Bax、Bcl-2基因表达量的影响
nZnO对斑马鱼鳃中Bcl-2基因的影响 如图 5所示为在nZnO胁迫下, 斑马鱼鳃组织中Bcl-2基因表达量的变化, 与对照组相比, 处理4h, 鳃中Bcl-2基因表达量均升高, 在浓度为50 mg/L时Bcl-2基因表达量最高, 是对照组的3.95倍; 暴露24h, 低浓度(0.05 和0.1 mg/L)组和高浓度(50 mg/L)组, Bcl-2基因表达量升高, 而在中浓度(5、10和25 mg/L)组Bcl-2基因表达量均降低; 处理96h, 除5 mg/ L 组外, 其余各实验组中Bcl-2基因表达量均高于对照组。

图 5 nZnO对斑马鱼鳃中Bcl-2基因的影响Fig. 5 Effects of the nZnO of Bcl-2 in zebrafish gill
nZnO对斑马鱼鳃中Bax基因的影响 由图 6可见,斑马鱼鳃中Bax基因表达量的变化, 处理4h, 低浓度组(0.05、0.1和5 mg/L), Bax基因表达量升高, 其他浓度组Bax基因表达量降低; 暴露24h和96h, Bax基因表达量均升高, 处理24h, 浓度为0.1 mg/L组Bax基因表达量显著升高(P<0.05), 是对照组的2.68倍; 处理96h, 50 mg/L组Bax基因表达量极显著升高(P<0.01), 是对照组的3.95倍。

图 6 nZnO对斑马鱼鳃中Bax基因的影响Fig. 6 Effects of the nZnO of Bax in zebrafish gill
nZnO对斑马鱼鳃中p53基因的影响 图 7所示为nZnO胁迫下斑马鱼鳃中p53基因表达量的变化, 处理4、24和96h, 鳃中p53基因的表达量均高于对照组, 处理4h,50 mg/L组p53基因的表达量极显著升高(P<0.01), 是对照组的3.79倍, 暴露96h时浓度为0.1 mg/L 组p53基因的表达量达最大, 是对照组的4.77倍。

图 7 nZnO对斑马鱼鳃中p53基因的影响Fig. 7 Effects of the nZnO of p53 in zebrafish gill
nZnO对斑马鱼鳃中MDM2基因的影响 斑马鱼鳃中MDM2基因表达量的变化(图 8), 实验组斑马鱼鳃中MDM2基因的表达量均高于对照组, 处理4h, 10 mg/L组MDM2基因表达量达最大, 是对照组的6.64倍; 处理24h,浓度为0.1 mg/L组MDM2基因表达量极显著升高(P< 0.01), 是对照组的4.91倍; 暴露96h, 低浓度(0.05 mg/L)组, MDM2基因表达量最高, 是对照组的6.98倍。

图 8 nZnO对斑马鱼鳃中MDM2基因的影响Fig. 8 Effects of the nZnO of MDM2 in zebrafish gill
3 讨论
nZnO能通过皮肤、鳃等组织进入到鱼体内, 从而引起一系列生理生化反应, 并且能诱导鳃组织结构发生变化, 同时还能引起凋亡相关基因表达量的变化。鳃是鱼类的呼吸器官, 也是吸收有毒物质的主要场所, 它直接与水环境接触, 可以比其他组织更迅速积累污染物, 因此易因水体污染而造成组织损伤。
3.1 nZnO对斑马鱼鳃组织结构的影响
环境污染物能造成鱼类鳃组织结构发生变化。环境污染物会诱导鳃中过多的氧自由基攻击细胞膜, 细胞膜受损, 释放细胞内含物, 细胞坏死, 鳃上皮细胞脱落[16], 出现鳃小片脱落现象, 甚至鳃丝呈棍状化[5]。同时鳃丝血管扩张, 物质交换能力增加, 从而减轻有毒物质对机体的损伤。但物质交换能力的变化, 会造成细胞中液体滞留而导致上皮细胞水肿[15,6], 水体中有害物也能诱使鳃中淋巴细胞增多, 减轻环境污染物对鳃的损伤, 鳃中坏死的细胞能聚集形成炎症聚集[17,18]。有研究者将鳃组织细胞受到外界毒物胁迫时造成的损伤划分为两大类: 一是因防御反应而产生的损伤, 包括鳃丝上皮细胞肥大和增生,鳃小片呼吸上皮水肿等; 二是直接造成的损伤, 包括鳃上皮脱落与坏死等[19]。在本研究中, 低浓度(0.05 mg/L)组首先出鳃丝上皮细胞增生, 上皮细胞水肿, 并伴有鳃丝上皮细胞的脱落, 说明nZnO可以从多个途径对鳃组织细胞产生毒性作用, 造成鳃组织的防御反应和直接损伤同时产生; 随着浓度的增大, 0.1 mg/L组出现血管扩张, 说明nZnO能诱导血液流通增大, 物质的交换能力增加, 增大物质的吸收能力, 来维持生物体正常的机能; 高浓度组出现细胞空泡化现象, 淋巴细胞增多, 大量上皮细胞坏死,上皮细胞脱落呈棍状化, 说明随着nZnO浓度增大, 能诱导产生大量的活性氧引起组织损伤。
3.2 nZnO对斑马鱼鳃组织中抗氧化酶活性的影响
超氧化物歧化酶(SOD)是清除超氧阴离子(O2-·)的专一性酶, 在生物体内最先与O2-·结合, 将其分解为H2O2和O2, 是生物体内最重要的抗氧化酶之一[20]。大量研究表明, 当水生生物受到外来污染物胁迫时, 机体内会产生大量的SOD清除组织中过多的超氧阴离子, 保护机体免受损伤[21]; 然而当环境污染物浓度过高或生物体长期生活在污染环境中时, 生物体的抗氧化系统造成损伤, 甚至会引起组织中SOD活性的下降[22]。研究者发现纳米镍能引起罗非鱼鳃组织中SOD活力呈先升高后下降的趋势[23];在本研究中实验组在暴露的起始阶段, 斑马鱼鳃组织中SOD活性升高, 清除活性氧自由基, 随着处理时间的延长和浓度的增加, 鳃组织抗氧化酶系统紊乱, SOD活性下降, 说明随着nZnO浓度增加和处理时间的延长, 鳃组织氧化受到损伤。
MDA是细胞膜系统受损伤的指标之一, 是脂质过氧化作用的产物, 在一定程度上, 根据MDA含量能评估组织的受损情况[24]。研究者发现, nZnO能诱使过多的氧自由基攻击细胞膜, 使椎实螺(Lymnaea luteola L.)[25]和鲤[26]体内的MDA含量升高。鳃组织在受到nZnO诱导时产生过多的自由基, 攻击细胞膜中不饱和脂肪酸, 使细胞膜破坏, 造成过多的脂质过氧化产物(MDA), 本研究结果显示, 处理24h内, 鳃中MDA含量先升高后下降, 高浓度(25和50 mg/L)组MDA含量低于中浓度(10 mg/L)组, 可能是高浓度组中nZnO沉积造成其毒性下降, 一定浓度范围内的nZnO处理, 使组织中MDA含量逐渐增加, 说明随着处理浓度的增加鳃组织受损程度加重, 而高浓度组nZnO沉积使得鱼类不能通过鳃呼吸进入到生物体内因而造成其毒性下降。
GSH-PX能分解有机和无机形式的过氧化物, 可以催化有机过氧化物(ROOH)转变为ROH, 可以在过氧化氢酶(CAT)含量低或者组织中H2O2产量低的组织中代替CAT清除H2O2, 进而防止机体造成损伤[27]。研究者发现,沙蚕(Nereis succinea)暴露于2.5 μg/g的纳米银中1d后体内的GSH-PX活性升高, 在较高浓度(5和10 μg/g)组GSHPX活性下降, 处理4d后, 沙蚕体内的GSH-PX活性均显著下降(P<0.05)[28]; 研究者在重金属镉(Cd2+)对尖紫蛤(Sanguinolaria acuta)的鳃毒性中发现, Cd2+能导致鳃中GSHPX活性呈现先升高后下降的趋势[29]; 生物体能通过适应性调节机体的相关生理机能活动, 从而增强机体抗氧化防御系统清除活性氧自由基的能力。本研究中也发现: nZnO处理短时间内(4h), 使鳃组织中GSH-PX活性升高,是生物体内的适应性调节机能, 而随着染毒时间的延长鳃中GSH-PX活性的降低, 可能是过多的氧自由基造成斑马鱼抗氧化系统功能损伤, 影响机体内自由基的代谢平衡, 引起鱼体的其他生理功能下降。
3.3 nZnO对斑马鱼鳃组织中p53、MDM2、Bax、Bcl-2基因表达量的影响
Bcl-2蛋白家族通过调节线粒体外膜通透性来调节细胞凋亡通路, 在凋亡信号引起的细胞反应中起重要作用, 其中Bcl-2和Bax分别属于Bcl-2家族中的抗凋亡和前凋亡基因[30], Bcl-2和Bax的比值决定了细胞凋亡的敏感性[31,32]。研究报道, 羟基磷灰石纳米粒子使组织中Bax/Bcl-2的比值升高, 并推测Bax/Bcl-2比值的升高可能会导致细胞凋亡[33]。也有研究者发现环境污染物能改变斑马鱼组织中Bax/Bcl-2的比值, 进而介导线粒体细胞色素c的释放, 从而引起细胞凋亡[34]。在本研究中发现, 处理4h后鳃中Bax/Bcl-2的比值减小, 而在暴露24h、96h后Bax/Bcl-2的比值增大, 说明随着处理时间的延长,nZnO能诱导鳃组织细胞发生凋亡。
p53能通过激活它的下游途径调控凋亡, 它能诱导应激信号引起凋亡[35], 当生物受到外界胁迫时p53的表达水平则明显增加。MDM2能负向调节p53诱导凋亡的能力,MDM2还可以降解p53, MDM2可能是p53最重要的抑制因子。有研究报道, 纳米二氧化硅包被氧化锰能诱导HeLa细胞、L929细胞中p53基因表达量升高, 能激活蛋白酶活性从而诱导细胞凋亡产生[36]。本研究也发现, 实验组鳃中p53基因和MDM2基因表达量升高, 说明nZnO能激活氧化应激信号, 使鳃中p53基因和MDM2基因表达量的升高, 进一步验证了nZnO能诱导鳃组织中细胞发生凋亡。
p53参与多种生物学过程, 包括DNA损伤修复、细胞凋亡、细胞周期调控等过程[37], 当组织中活性氧自由基含量过高时, p53诱导能引起的Bax和PUMA等基因的表达, 同时抑制抗氧化酶基因的表达, 使机体处于高强度的氧化应激状态, 最终导致细胞凋亡[38]。p53、Bcl-2、Bax基因的表达量能作为细胞凋亡发生的标志物, 这种标志物在环境毒理学中将发挥重要作用, 不仅能反应环境污染物早起作用并能准确预测生物可能的有害影响,而且还能研究污染物对细胞凋亡的影响并揭示污染物致病机理提供重要的参考价值[39]。本研究发现在nZnO胁迫下, 斑马鱼除了鳃组织受到损伤, 抗氧化酶活性发生变化外, 鳃中p53和MDM2基因的表达量升高, Bax/Bcl-2比值也发生变化, 这在以往研究纳米材料对生物的毒性文献中未见报道, 说明nZnO不仅仅是诱发斑马鱼鳃组织发生氧化损伤, 还会进一步引起鳃组织中细胞凋亡。
4 结论
[1]Nel A, Xia T, Mädler L, et al. Toxic potential of materials at the nanolevel [J]. Science, 2006, 311(5761): 622—627
[2]Kumar V, Kumari A, Guleria P, et al. Evaluating the Toxicity of Selected Types of Nanochemicals [M]. Reviews of Environmental Contamination and Toxicology. Springer New York. 2012, 39—121
[3]Hristozovd R, Gottardos, Critto A, et al. Risk assessment of engineered nanomaterials: a review of available data and approaches from a regulatory perspective [J]. Nanotoxicology, 2012, 6(8): 880—898
[4]Alazemi B M, Lewis J W, Andrews E B. Gill damage in the freshwater fish Gnathonemus petersii (Family: Mormyridae) exposed to selected pollutants: an ultrastructural study [J]. Environmental Technology, 1996,17(3): 225—238
在一定浓度nZnO胁迫下, 斑马鱼鳃上皮细胞增生,鳃丝脱落, 部分细胞空泡化, 鳃丝棍状化等。nZnO能引起鳃中MDA含量的增加, SOD、GSH-PX活性呈现先升高后下降的趋势, 抗氧化酶活性的变化能调节机体生理平衡, 使其免受氧化胁迫的损伤。nZnO暴露能引起鳃中Bax/Bcl-2的mRNA的表达量比值升高; p53、MDM2的mRNA表达量升高, 说明nZnO可以诱导鳃组织细胞凋亡。
[5]Yang H B, Wang D, Lu T Y. The tissue damage to songpu mirror carp (Cyprinus carpio L.) using thiamphenicol by oral administration [J]. China Fishery Quality and Standards, 2014, (3): 54—59 [杨洪波, 王荻, 卢彤岩. 口灌甲砜霉素对松浦镜鲤组织的损伤. 中国渔业质量与标准, 2014, (3): 54—59]
[6]Guan H H, Lin Y H. Constitution and the tolerance of several heavy metal on the gill tissue of carp [J]. Chinese Journal of Fisheries, 2004, 17(1): 68—71 [关海红, 蔺玉华. 鲤鱼鳃组织结构及鳃对重金属离子的耐受性. 水产学杂志, 2004, 17(1): 68—71]
[7]Al—Bairuty G A, Shaw B J, Handy R D, et al. Histopathological effects of waterborne copper nanoparticles and copper sulphate on the organs of rainbow trout (Oncorhynchus mykiss) [J]. Aquatic Toxicology, 2013, 126: 104—115
[8]Ma H, Williams P L, Diamond S A. Ecotoxicity of manufactured ZnO nanoparticles-a review [J]. Environmental Pollution, 2013, 172: 76—85
[9]Farré M, Gajda—Schrantz K, Kantiani L, et al. Ecotoxicity and analysis of nanomaterials in the aquatic environment [J]. Analytical and Bioanalytical Chemistry, 2009,393(1): 81—95
[10]Delistraty D, Taylor B, Anderson R. Comparisons of acute toxicity of selected chemicals to rainbow trout and rats [J]. Ecotoxicology and Environmental Safety, 1998,39(3): 195—200
[11]Oliveira M, Pacheco M, Santos M A. Organ specific antioxidant responses in golden grey mullet (Liza aurata) following a short-term exposure to phenanthrene [J]. Science of the Total Environment, 2008, 396(1): 70—78
[12]Cao J L, Chen J J, Wang J D. Effects of nano-ZnO on microstructure and ultrastructure of the gill of carp (Cyprinus carpio) [J]. Journal of Chinese Electron Microscopysociety, 2012, 30(6): 561—566 [曹谨玲, 陈剑杰, 王俊东. 纳米氧化锌对鲤鱼鳃显微和超微结构的影响. 电子显微学报, 2012, 30(6): 561—566]
[13]Hao L, Chen L. Oxidative stress responses in different organs of carp (Cyprinus carpio) with exposure to ZnO nanoparticles [J]. Ecotoxicology and Environmental Safety,2012, 80: 103—110
[14]Salas V M, Burchiel S W. Apoptsis in Dauli Human B cells in response to benzo[a] pyrene and benzo[a] pyrene-7, 8-dihydrodid [J]. Toxicology and Applied Pharmacology, 1998, 151(2): 367—376
[15]Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔctmethod [J]. Methods, 2001, 25(4): 402—408
[16]Al—Bairuty G A, Shaw B J, Handy R D, et al. Histopathological effects of waterborne copper nanoparticles and copper sulphate on the organs of rainbow trout (Oncorhynchus mykiss) [J]. Aquatic Toxicology, 2013, 126: 104—115
[17]de Souza Filho J, Matsubara E Y, Franchi L P, et al. Evaluation of carbon nanotubes network toxicity in zebrafish(Danio rerio) model [J]. Environmental Research, 2014,134: 9—16
[18]da Cruz A L, Prado T M,dasilva Maciel L A, et al. Environmental effects on the gills and blood of Oreochromis niloticus exposed to rivers of Bahia, Brazil [J]. Ecotoxicology and Environmental Safety, 2015, 111: 23—31
[19]PoleksiéV, Karan V. Effects of trifluralin on carp: biochemical and histological evaluation [J]. Ecotoxicology and Environmental Safety, 1999, 43(2): 213—221
[20]Xiong D W, Fang T, Chen X D, et al. Oxidative stress effects and damage of nanoscale TiO2and ZnO on zebrafish [J]. Environmental Science, 2010, 31(5): 1320—1327 [熊道文, 方涛, 陈旭东, 等. 纳米材料对斑马鱼的氧化损伤及应急效应研究. 环境科学, 2010,31(5): 1320—1327]
[21]Kelly K A, Havrilla C M, Brady T C, et al. Oxidative stress in toxicology: established mammalian and emerging piscine model systems [J]. Environmental Health Perspectives, 1998, 106(7): 375—384
[22]Wang T, Long X, Cheng Y, et al. The potential toxicity of copper nanoparticles and coppersulphate on juvenile Epinephelus coioides [J]. Aquatic Toxicology, 2014, 152: 96—104
[23]Chidambaram J, Abdul A R, Rajendiran R, et al. Effect of sub-acute exposure to nickel nanoparticles on oxidative stress and histopathological changes in Mozambique tilapia, Oreochromis mossambicus [J]. Ecotoxicology and Environmental Safety, 2014, 107: 220—228
[24]Shi Q, Zhu Z, Xu M, et al. Effect of excess manganese on the antioxidant system in Cucumis sativus L. under two light intensities [J]. Environmental and Experimental Botany, 2006, 58(1): 197—205
[25]Boyle D, Al-Bairuty G A, Ramsden C S, et al. Subtle alterations in swimming speed distributions of rainbow trout exposed to titanium dioxide nanoparticles are associated with gill rather than brain injury [J]. Aquatic Toxicology, 2013, 126: 116—127
[26]Hao L, Chen L, Hao J, et al. Bioaccumulation and subacute toxicity of zinc oxide nanoparticles in juvenile carp(Cyprinus carpio): a comparative study with its bulk counterparts [J]. Ecotoxicology and Environmental Safety,2013, 91: 52—60
[27]Elia A C, Anastasi V, Dörr A J M. Hepatic antioxidant enzymes and total glutathione of Cyprinus carpio exposed to three disinfectants, chlorine dioxide, sodium hypochlorite and peracetic acid, for superficial water potabilization [J]. Chemosphere, 2006, 64(10): 1633—1641
[28]Cozzari M, Elia A C, Pacini N, et al. Bioaccumulation and oxidative stress responses measured in the estuarine ragworm (Nereis diversicolor) exposed to dissolved,nano-and bulk-sized silver [J]. Environmental Pollution,2015, 198: 32—40
[29]Deng S P, Zhao Y T, Zhu C H, et al. Effect of cadmium on the antioxidant enzyme activity and lipid peroxidation in sanguinolaria acuta [J]. Acta Hydrobiologica Sinica,2012, 36(4): 689—695 [邓思平, 赵云涛, 朱春华, 等. 镉对尖紫蛤抗氧化酶活性及脂质过氧化的影响. 水生生物学报, 2012, 36(4): 689—695]
[30]Autret A, Martin S J. Bcl-2 family proteins and mitochondrial fission/fusion dynamics [J]. Cellular and Molecular Life Sciences, 2010, 67(10): 1599—1606
[31]Ferrer I, Planas A M Í. Signaling of cell death and cell survival following focal cerebral ischemia: life and death struggle in the penumbra [J]. Journal of Neuropathology & Experimental Neurology, 2003, 62(4): 329—339
[32]Pollack M, Phaneuf S, Dirks A, et al. The role of apoptosis in the normal aging brain, skeletal muscle, and heart[J]. Annals of the New York Academy of Sciences, 2002,959(1): 93—107
[33]Hu W, Feng Z, Levine A J. The regulation of multiple p53 stress responses is mediated through MDM2 [J]. Genes & Cancer, 2012, 3(3—4): 199—208
[34]Jiang J, Wu S, Wu C, et al. Embryonic exposure to carbendazim induces the transcription of genes related to apoptosis, immunotoxicity and endocrine disruption in zebrafish (Danio rerio) [J]. Fish & Shellfish Immunology,2014, 41(2): 493—500
[35]Trevisan R, Fleschs, Mattos J J, et al. Zinc causes acute impairment of glutathione metabolism followed by coordinated antioxidant defenses amplification in gills of brown mussels Perna perna [J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2014, 159: 22—30
[36]Wang L, Wang L J, Zhang F, et al. Cytotoxicity of ZnO nanoparticles in human lung cancer cell lines A549 [J]. Journal of the Graduate School of the Chinese Academy of Sciences, 2009, 26(1): 83—90 [王琳, 王莉娟, 张芳,等. 纳米氧化锌对人肺腺癌细胞A549的毒性. 中国科学院研究生学报, 2009, 26(1): 83—90]
[37]Li T, Kon N, Jiang L, et al. Tumor suppressions in the absence of p53-mediated cell-cycle arrest, apoptosis, and senescence [J]. Cell, 2012, 149(6): 1269—1283
[38]Qi Zh, Liu Y F, Luos W, et al. Molecular cloning, characterization and expression analysis of tumor suppressor protein p53 from orange-spotted grouper, Epinephelus coioides in response to temperature stress [J]. Fish & Shellfish Immunology, 2013, 35(5): 1466—1476
[39]Xu L H. Molecular basis of apoptosis-related integrated biomarkers and its significance in environmental toxicology [J]. Acta Hydrobiologica Sinica, 2005, 29(3): 329—335 [徐立红. 细胞凋亡相关的结合生物标志物的分子基础及其在环境毒理学中的意义. 水生生物学报,2005, 29(3): 329—335]
OXIDATIVE DAMAGE RESPONSES ON GILL TISSUES OF ZEBRAFISH WITH EXPOSURE TO ZINC DIOXIDE NANOPARTICLES
LIU Lin and ZHAO Qun-Fen
(School of Marine Sciences, Ningbo University, Ningbo 315211, China)
斑马鱼; nZnO; 鳃组织; 氧化损伤
Zebrafish; Zinc dioxide nanoparticles; Gill tissues; Oxidative damage
X171.5
A
1000-3207(2016)02-0395-08
10.7541/2016.52
2015-05-28;
2015-10-10
水产学浙江省重中之重(一级)学科开放基金(xkzsc1415)资助 [Supported by the Opening Project of Zhejiang Provincial Top Key Discipline of Fisheries (No. xkzsc1415)]
刘林(1987—), 男, 河南周口人; 硕士研究生; 主要从事纳米材料毒理学研究。E-mail: liuxiaolin6@126.com
赵群芬, E-mail: zhaoqunfen@nbu.edu.cn
