茵陈总黄酮的提取及富集工艺
2016-11-24郭文娟王娜娜张瑞平李香华
郭文娟,王娜娜,代 昭,张瑞平,李香华
(天津工业大学环境与化学工程学院,天津 300387)
茵陈总黄酮的提取及富集工艺
郭文娟,王娜娜,代 昭,张瑞平,李香华
(天津工业大学环境与化学工程学院,天津 300387)
采用超声波辅助提取法对茵陈总黄酮的提取和富集工艺进行研究,用正交实验优化茵陈总黄酮的最优提取工艺为:在40℃时,以料液比1∶15(g/mL)的蒸馏水超声提取60 min.以6种大孔吸附树脂对茵陈总黄酮的富集作用进行研究,结果表明D101型树脂对黄酮的吸附和解吸附效果最好.进一步优化最佳富集工艺条件为:上样液质量浓度0.55 mg/mL,pH 4.04,体积流量1.5 BV/h,洗脱溶剂乙醇质量分数70%.
茵陈;大孔吸附树脂;黄酮;富集;正交试验
茵陈是滨蒿(Artemisia scoparia Waldst.et kit)或茵陈蒿(Artemisia capillaris Thunb.)的干燥地上部分[1],是一种传统中药,具有清热利湿、利胆退黄和显著的保肝作用.黄酮类化合物[1-3]是茵陈的主要有效成分,其药理学活性广泛,具有抗氧化[4-5]、抗肿瘤[4,6]、抗病毒等活性[7-8].然而,因茵陈药用部位为地上全草,叶绿素含量高,给茵陈黄酮类有效成分的提取和纯化造成了困难.
大孔吸附树脂是一种高分子材料,近年发展起来应用于各种天然产物的吸附分离,具有吸附性能好[7-10]、适用范围广[11]、选择性高[12]、价格低廉[7]以及再生处理方便[10,12]等优点,将大孔吸附树脂应用于茵陈总黄酮的分离纯化,将有望提高茵陈总黄酮的纯度和收率,为茵陈总黄酮的进一步应用提供理论依据和实践参考.
本实验通过正交实验设计探讨超声波辅助法提取茵陈总黄酮的最佳工艺条件,并选择6种大孔吸附树脂,包括D101、ADS-17、FL-2、LSA-21、HPD450和YWD07a,对茵陈总黄酮的富集作用进行研究,获得了茵陈总黄酮的大孔吸附树脂最佳富集工艺,为茵陈总黄酮的应用奠定基础.
1 实验部分
1.1 仪器及材料
仪器:765MC紫外可见分光光度计,上海光学仪器厂产品;KH-250B超声波提取器,济南博鑫生物技术公司产品;TD2002A电子天平,上海银泽仪器设备公司产品;RE-52旋转蒸发仪,上海亚荣仪器厂产品;DK-S24电热式恒温水浴锅,上海森信实验仪器公司产品;101-2A电热恒温干燥箱,成都浩驰仪器公司产品.
材料:茵陈药材,安徽千草药业产品,经鉴定为茵陈蒿(A.capillaris);芦丁对照品,中国药品生物制品检定所产品;大孔树脂D101、ADS-17、LSA-21,南开大学化工厂产品;大孔树脂HPD450、YWD07a、FL-2,天津市海光化工有限公司产品;其他试剂均为分析纯.
1.2 茵陈总黄酮的含量测定[13]
精确称取芦丁标准品20.000 mg,置于50 mL容量瓶中用70%的乙醇定容得标准溶液.分别在25 mL容量瓶中精密加入0、1.0、2.0、3.0、4.0、5.0、6.0 mL芦丁标准溶液和0.3 mL 5%的亚硝酸钠(NaNO2)溶液,摇匀后静置6 min;再加入0.3 mL 10%的硝酸铝(Al(NO3)3)溶液,摇匀后静置6 min;再加4%的氢氧化钠溶液4.0 mL,用70%的乙醇稀释至刻度,摇匀,静置12 min,以70%乙醇作空白,用紫外分光光度计于510 nm处测定吸光度A,得标准曲线A=10.863C-0.002 9,R2= 0.999 2.式中:A为510 nm处吸光度;C为质量浓度(mg/mL).并进行稳定性、精密性、重现性、回收率实验,其RSD%值均小于2%.
1.3 总黄酮的提取工艺
本文利用功率为250 W的超声提取器提取茵陈中总黄酮,选用L9(34)正交表,以料液比(A)、提取时间(B)、提取温度(C)和乙醇浓度(D)为实验因子,各因子设3个水平,如表1所示.每组试验平行重复3次,用SPSS 20分析数据.

表1 正交试验L9(34)因素水平表Tab.1 Factors and levels of orthogonal test L9(34)design
1.4 大孔吸附树脂预处理
称取适量树脂,用0.5倍体积的乙醇先充分浸泡24 h后装柱,并用2~5倍体积的乙醇流通树脂,至流出液与水混合无白色浑浊,再用大量蒸馏水冲洗树脂至无醇味;然后用5%HCl冲洗树脂,并浸泡3 h,用大量蒸馏水洗至中性,最后用5%NaOH冲洗树脂,并浸泡3 h,大量蒸馏水洗至中性,抽干后备用[7].
1.5 不同型号大孔树脂的筛选
将已处理好的6种大孔树脂分别称取2.0 g,精密称量3次,置于6个具塞三角瓶中,各加入质量浓度为0.55 mg/mL的茵陈母液50 mL,置于恒温摇床中振摇2 h(60 r/min),取出放置24 h后过滤,对滤液进行总黄酮的测定.将过滤后的树脂加入70%乙醇30 mL,于恒温摇床中振摇2 h(60 r/min),取出放置24 h后过滤,对滤液进行总黄酮含量的测定.根据结果计算吸附量和吸附率、解吸附量和解吸率[14-15].
大孔树脂吸附量、吸附率、解吸附量、解吸附率的计算公式如下:
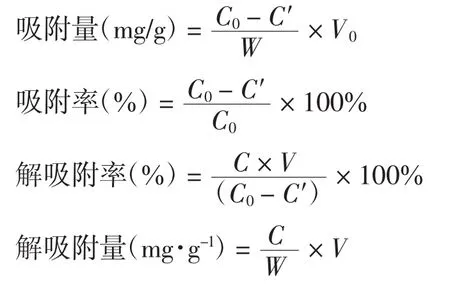
式中:C0为吸附前溶液中黄酮质量浓度(mg/mL);C′为吸附后溶液中黄酮质量浓度(mg/mL);C为解吸液中黄酮质量浓度(mg/mL);V0为吸附前溶液体积(mL);V为解吸溶液体积(mL);W为树脂质量(g).
1.6 富集纯化工艺影响因素
1.6.1 上样液质量浓度的影响
取5份处理好的D101型树脂2.0 g于100 mL具塞锥形瓶中,精确加入不同总黄酮质量浓度的供试液50 mL,置于恒温振荡器中振荡4 h后过滤,上清液测定茵陈总黄酮含量,计算吸附量、吸附率.树脂再精密加入30 mL 70%乙醇溶液,于恒温摇床中振摇2 h后过滤,上清液测定茵陈总黄酮含量,计算解吸附量、解吸附率[16].
1.6.2 上样液pH值的影响
称取6份处理好的D101型树脂各2.0 g,分别加入总黄酮质量浓度为0.55 mg/mL的母液50 mL,调节pH值,振荡吸附4 h后过滤,上清液测定茵陈总黄酮含量,计算吸附量与吸附率.过滤后的树脂精密加入70%乙醇溶液30 mL,于恒温水浴箱中振摇2 h后过滤,上清液测定茵陈总黄酮含量,计算解吸附量和解吸附率[16-18].
1.6.3 上样体积流量的影响
取茵陈提取液50 mL(0.55 mg/mL),以不同的体积流量(0.5、1.0、1.5、2.0、2.5 BV/h)上样,柱体积为10 mL.测定吸附后溶液中总黄酮质量浓度,计算吸附率[12,19].
1.6.4 洗脱溶剂乙醇浓度的影响
称取6份已经处理好的D101型树脂各2.0 g,分别加入总黄酮质量浓度为0.55mg/mL的母液50mL,振荡吸附4 h后过滤分离树脂,树脂中分别加入30%、40%、50%、60%、70%、80%的乙醇溶液30 mL,恒温震荡2 h,进行解吸附,计算解吸附率[12].
2 结果与讨论
2.1 正交实验分析正交实验结果和方差分析分别如表2、表3所示.
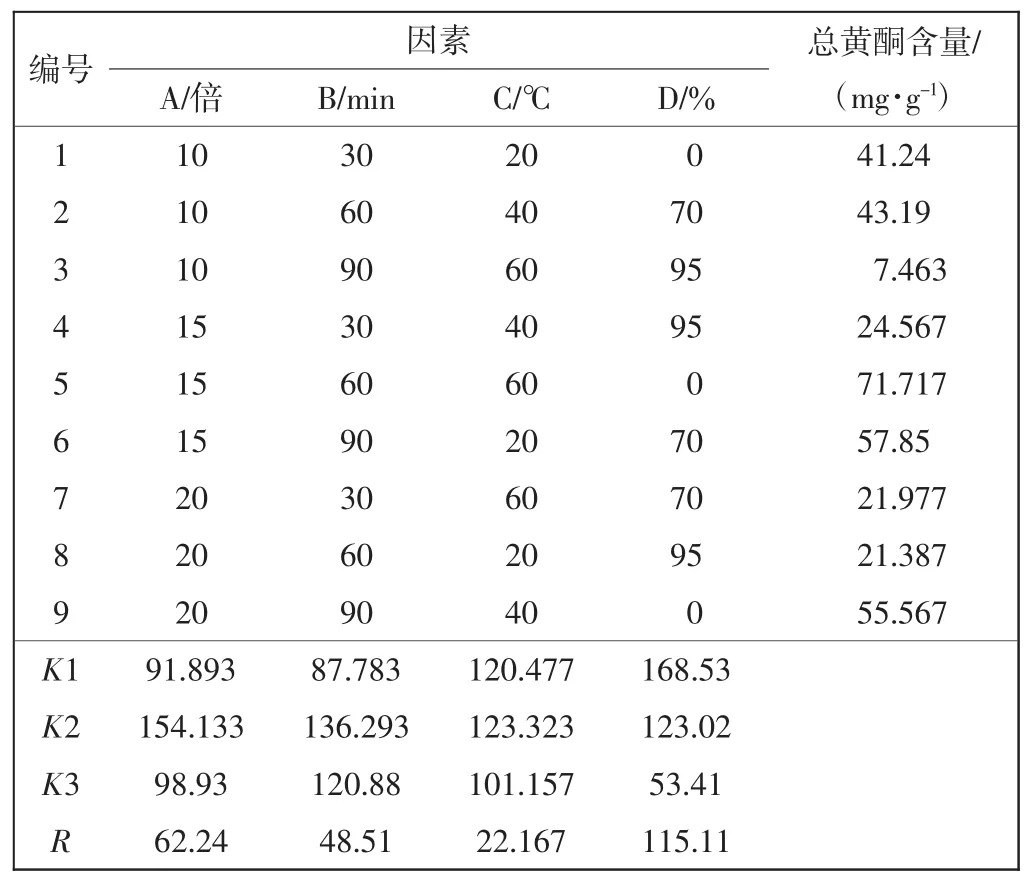
表2 总黄酮提取率正交试验L9(34)结果Tab.2 Result of extraction rate of flavonoids on orthogonal test L9(34)

表3 不同因素对总黄酮提取的方差分析Tab.3 Variance analysis of different factors on extraction rate of flavonoids
从表2和表3中可以看出,各因素对茵陈总黄酮提取的影响程度为D>A>B>C,即提取溶剂乙醇浓度对黄酮的提取效果影响最大,而影响最小的是提取时温度.方差分析结果表明料液比、提取时间、提取温度及溶剂的质量分数对茵陈中总黄酮含量的提取的影响达到极显著(P<0.01).因此确定超声波提取茵陈总黄酮的最佳提取条件:用蒸馏水超声提取,料液比1∶15(g/mL),提取时间60 min,提取温度40℃.
2.2 最佳提取工艺验证实验
平行称取3份茵陈药材5.0 g,按上述最佳提取方法进行验证,总黄酮含量分别为75.16、71.27和72.72 mg/g,结果显示此工艺稳定可行.
2.3 不同型号大孔树脂的筛选结果
本实验以吸附/解吸附率为筛选指标,寻找最合适的大孔树脂来纯化茵陈中总黄酮,其结果如图1所示.
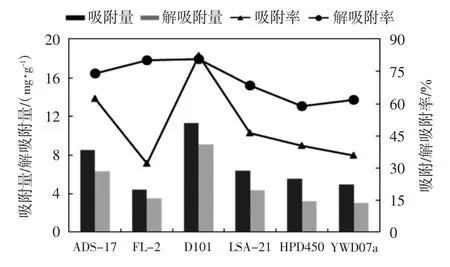
图1 不同型号大孔树脂的吸附和解吸作用Fig.1 Effect of adsorption and desorption of different macroporous resin
不同型号树脂对总黄酮的吸附/解吸率不同,从图1中可以看出,ADS-17和D101型树脂对总黄酮的吸附率较其他树脂要高,而FL-2型树脂对总黄酮的吸附率最低,这主要与树脂本身的结构和性能有关[12],如表面积、平均孔径以及吸附力等;此外,D101树脂的解吸附率要比其他树脂稍高.综合考虑,与其他树脂相比D101拥有较好的吸附和解吸附能力,因此选择D101进行黄酮的分离.
2.4 不同因素对黄酮富集纯化的影响
2.4.1 上样液质量浓度的影响
上样液质量浓度对大孔树脂分离纯化黄酮有很大的影响,如图2所示.

图2 上样液质量浓度对黄酮富集纯化的影响Fig.2 Effect of sampling concentration on flavonoid-enriched purified
由图2可以看出,随着上样液质量浓度的增大,吸附率逐渐减小,上样液质量浓度较低时,吸附率较高,但是不能完全发挥树脂的作用,浪费树脂且生产效率低;浓度太大,树脂的吸附量增加,但同时泄漏较多,造成了药液的浪费.综合考虑吸附率和解吸附率,在上样液质量浓度为0.550 mg/mL时,有较好的吸附率和解吸附率.
2.4.2 上样液pH值的影响
上样液初始pH值对茵陈总黄酮富集纯化的影响如图3所示.

图3 上样液pH对黄酮富集纯化的影响Fig.3 Effect of pH on flavonoid-enriched purified
上样液初始pH值是影响溶质和吸附剂之间的亲和力,从而影响了吸附剂吸附能力的最重要参数.由图3可知,上样液pH偏酸或者偏碱时,树脂的吸附率都偏低,总黄酮的最高吸附容量出现在上样液pH为4.04时,这是因为总黄酮含有许多羟基和酚羟基,呈弱酸性,所以在弱酸性溶液中是比较容易被吸附的,而在强酸条件下,总黄酮易生成佯盐;在偏碱条件下,会破坏总黄酮的结构,都不利于其吸附.
2.4.3 上样体积流量的影响
上样液体积流量对树脂的吸附能力也有一定的影响,如图4所示.
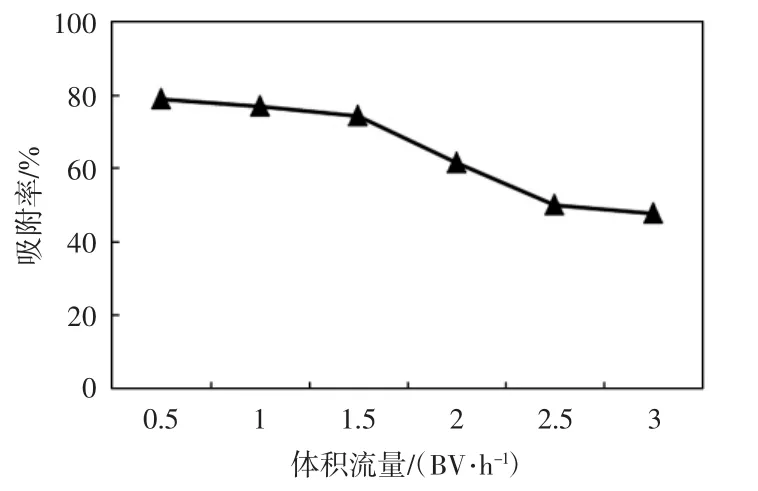
图4 上样液体积流量对黄酮吸附率的影响Fig.4 Effect of volumetric flow on flavonoid adsorption rate
由图4可见,当体积流量较小时,上样液流速慢,黄酮和大孔树脂充分接触,吸附率较大;当体积流量增大时,上样液流速也增大,样液吸附时间短,吸附率低.在体积流量从0.5 BV/h增加到1.5 BV/h时,吸附率变化平缓,在实验中,综合考虑缩短吸附时间和增大吸附量,上样液体积流量控制在1.5 BV/h.
2.4.4 洗脱溶剂乙醇浓度的影响
洗脱溶剂乙醇浓度对茵陈总黄酮解吸附率的影响如图5所示.

图5 洗脱剂乙醇浓度对黄酮解吸附率的影响Fig.5 Effect of eluent concentration on flavonoids desorption rate
由图5可见,随乙醇浓度不断增加解吸附率变化较大,呈上升趋势,当乙醇质量分数达到70%和80%时解吸附率达到最大.这是由于乙醇浓度小时,其极性与黄酮极性相差较大,而当乙醇质量分数达到70%时,两者极性相近,在用其洗脱时能最大限度地把黄酮类物质解吸下来.在乙醇质量分数达到80%时,洗脱液比较浑浊,可能会把其它杂质洗脱下来.
3 结论
(1)本实验采用正交试验L9(34)优化了超声波提取茵陈总黄酮的工艺条件,最优条件为用蒸馏水以1∶5(g/mL)的料液比在40℃时超声60 min,黄酮总提取量达到75 mg/g左右.
(2)本实验发现大孔树脂的吸附/解吸能力与其本身的结构特性有密切关系[12].6种不同型号的大孔吸附树脂对总黄酮的吸附率不同,FL-2型树脂吸附率最小,D101型树脂最好,其吸附率和解吸率都能达到80%以上,所以D101型树脂可用于茵陈总黄酮的富集纯化,并可进一步应用于茵陈总黄酮的精制.
(3)用大孔树脂纯化茵陈中总黄酮物质需要控制的因素很多,不同因素对茵陈中黄酮富集纯化的影响差别较大,在上样液质量浓度为0.55 mg/mL时,有较好的吸附率和解吸附率;上样液初始pH为4.04时,黄酮的吸附率最高;上样液体积流量为1.5 BV/h,缩短了吸附时间、增大了吸附量,同时又较好的吸附率;洗脱剂乙醇质量分数达到70%时,对总黄酮的解吸附效果最好,89%的黄酮都能洗脱下来.
[1]谢韬,梁敬钰,刘净.茵陈化学成分和药理作用研究进展[J].海峡药学,2004,16(1):8-13. XIE T,LIANG J Y,LIU J,Research progress of ArtemisiaScoparia and Artemisia Capillaris on chemical constituents and pharmacological effect[J].Strait Pharmaceutical Journal,2004,16(1):8-13(in Chinese).
[2]王志伟,谭晓杰,马婷婷,等.茵陈化学成分的分离与鉴定[J].沈阳药科大学学报,2008(10):781-784. WANG Z W,TAN X J,MA T T,et al.Isolation and identification of chemical constituents of Artemisia capillaris Thunb[J].Journal of Shenyang Pharmaceutical University,2008(10):781-784(in Chinese).
[3]林霄.茵陈蒿的药理作用研究[J].长春中医药大学学报,2008,24(6):663-663. LIN X.Study of Artemisia capillaris Thunb.on pharmacological effect[J].Journal of Changchun University of Traditional Chinese Medicine,2008,24(6):663-663(in Chinese).
[4]FU Y,CHEN J,LI Y J,et al.Antioxidant and anti-inflammatory activities of six flavonoids separated from licorice[J].Food Chemistry,2013,141(2):1063-1071.
[5]ZHU M Z,WU W,JIAO L L,et al.Analysis of flavonoids in lotus(Nelumbo nucifera)leaves and their antioxidant activity using macroporous fesin chromatograpHy coupled with LCMS/MS and antioxidant biochemical assays[J].Applied Spectroscopy,2015,20(6):10553-1065.
[6]AMADO N G,FONSECA B F,CERQUEIRA D M,et al. Flavonoids:Potential Wnt/beta-catenin signaling modulators in cancer[J].Life Sciences,2011,89(15/16):545-554.
[7]刘江波.大孔吸附树脂分离纯化黄酮类化合物的规律性研究[D].杭州:浙江大学,2012. LIU J B.Studies on the separation and purification of flavonoids with macroporous adsorption resins[D].Hangzhou:Zhejiang University,2012(in Chinese).
[8]王倩,常丽新,唐红梅.黄酮类化合物的提取分离及其生物活性研究进展[J].河北理工大学学报:自然科学版,2011,33(1):110-115. WANG Q,CHANG L X,TANG H M.Present situation in research of flavonoids bioactivities and its extraction and separation technology[J].Journal of Hebei United University:Natural Science Edition,2011,33(1):110-115(in Chinese).
[9]王谨慧,靳子明,李茂星.大孔吸附树脂富集纯化桃儿七中的鬼臼毒素[J].中成药,2016(1):212-215. WANG J H,JIN Z M,LI M X.Enrichment and purification of podophyllotoxin from hexandrum with macroporous resin[J]. Traditional Chinese Medicine Patent Prescription,2016(1):212-215(in Chinese).
[10]JIN Q,YUE J,SHAN L,et al.Process research of macroporous resin chromotograpHy for separation of N-(p-coumaroyl)serotonin and N-feruloylserotonin from Chinese safflower seed extracts[J].Separation&PurificationTechnology,2008,62(2):370-375.
[11]刘彬果,钟蕾,郭文勇,等.大孔树脂吸附法对黄芩总黄酮富集纯化工艺的研究[J].第二军医大学学报,2004,25(5):562-564. LIU B G,ZHONG L,GUO W Y,et al.Enrichment and purification process of total flavonoids from Scutellaria baicalensis with macroporous resins[J].Academic Journal of Second Military Medical University,2004,25(5):562-564(in Chinese).
[12]王竞红,王非,杨成武,等.大孔吸附树脂分离纯化紫穗槐叶总黄酮的研究[J].中南林业科技大学学报,2016,36(1):112-118. WANG J H,WANG F,YANG C W,et al.Separation and purification of flavones in Amorpha fruticosa leaf by macroporous adsorption resins[J].Journal of Central South University of Fore-stry&Technology,2016,36(1):112-118(in Chinese).
[13]LI Z P,YIN D L,SHI A H.Contrast of two extraction methods for artemisia capillaries thunb′s total flavones[J].Research Bulletin,2007,5:50-52.
[14]LIU W,ZHANG S,ZU Y G,et al.Preliminary enrichment and separation of genistein and apigenin from extracts of pigeon pea roots by macroporous resins[J].Bioresource Technology,2010,101(12):4667-75.
[15]ZHOU J C,FENG D W,ZHENG G S.Extraction of sesamin from sesame oil using macroporous resin[J].Journal of Food Engineering,2010,100(2):289-293.
[16]ZHANG Y,LI S F,WU X W.Macroporous resin adsorption for purification of flavonoids in houttuynia cordata thunb[J]. Chinese Journal of Chemical Engineering,2007,15(6):872-876.
[17]ZHAO Z,DONG L,WU Y,et al.Preliminary separation and purification of rutin and quercetin from Euonymus alatus,(Thunb.)Siebold,extracts by macroporous resins[J].Food& Bioproducts Processing,2011,89(4):266-272.
[18]LIU J,LUO J G,SUN Y,et al.Simple method for the simultaneous decoloration and deproteinization of crude levan extract from Paenibacillus polymyxa EJS-3 by macroporous resin[J].Bioresource Technology,2010,101(15):6077-6083.
[19]于宁,何承辉,邢建国,等.大孔吸附树脂分离纯化香青兰提取液工艺研究[J].中草药,2016(4):599-605. YU N,HE C H,XING J G,et al.Research on separation and purification of extract from Dracocephalum moldevica with macroporous resins[J].Chinese Traditional and Herbal Drugs,2016(4):599-605(in Chinese).
Extraction and enrichment process of total flavonoids from Artemisia capillaris Thunb.
GUO Wen-juan,WANG Na-na,DAI Zhao,ZHANG Rui-ping,LI Xiang-hua
(School of Environmental and Chemical Engineering,Tianjin Polytechnic University,Tianjin 300387,China)
The extraction and enrichment of total flavonoids from Artemisia capillaris Thunb.were studied by ultrasonic assistant extraction.The optimal extraction process obtained by orthogonal experiment was extraction 60 min by ultrasonic with distilled water at 40℃and liquid ratio was 1∶15(g/mL).Six kinds of macroporous resin were used to study the enrichment of flavonoids,and the results showed that D101 resin was the most appropriate.Further optimizing the optimum conditions for the enrichment process,when the conditions were the sampling concentration of 0.55 mg/mL,pH 4.04,volume flow rate of 1.5 BV/h,and ethanol concentration of 70%,the purified flavonoids could be scientifically and reasonably separated.
Artemisia capillaris Thunb.;macroporous resin;flavonoids;enrichment;orthogonal experiment
TQ461
A
1671-024X(2016)05-0037-05
10.3969/j.issn.1671-024x.2016.05.007
2016-06-30
天津市自然科学基金资助项目(15JCYBJC20500);公益性行业(农业)科研专项(201203046)
郭文娟(1980—),女,博士,副教授,主要研究方向为高分子材料在天然产物中的应用.E-mail:guowenjuan@tjpu.edu.cn
