PP纤维支撑蛋白质印迹海藻酸钙凝胶膜的制备和表征
2016-11-24宋云飞魏梦梦孙平平赵孔银
宋云飞,魏梦梦,陈 甜,焦 蕊,孙平平,赵孔银
(天津工业大学 省部共建分离膜与膜过程国家重点实验室,天津 300387)
PP纤维支撑蛋白质印迹海藻酸钙凝胶膜的制备和表征
宋云飞,魏梦梦,陈 甜,焦 蕊,孙平平,赵孔银
(天津工业大学 省部共建分离膜与膜过程国家重点实验室,天津 300387)
以海藻酸钠(NaAlg)为印迹材料,以牛血清白蛋白(BSA)为模板分子,以聚丙烯(PP)无纺布为支撑体,制备了PP无纺布支撑的BSA分子印迹海藻酸钙水凝胶膜(PP-s-CaAlg MIP).同时不加蛋白质制备了非印迹膜,记为PP-s-CaAlg NIP.通过扫描电镜(SEM)、红外光谱(FT-IR)对PP-s-CaAlg凝胶膜进行表征,测定了其在生理盐水中的溶胀性能.讨论了不同NaAlg浓度制备的PP-s-CaAlg水凝胶膜在不同缓冲液中对BSA的释放.研究了不同缓冲液下不同NaAlg浓度制备的PP-s-CaAlg MIP膜和NIP膜对BSA的吸附性能.结果表明:PP-s-CaAlg MIP膜对BSA的吸附量明显优于PP-s-CaAlg NIP膜;与对比蛋白质相比,PP-s-CaAlg MIP对模板蛋白质的吸附量更多,表明其具有一定的吸附选择性;PP-s-CaAlg MIP膜制备简单,成本低,生物相容性好,可用于细胞培养和组织工程领域.
蛋白质分子印迹;海藻酸钙凝胶膜;聚丙烯无纺布;释放;吸附
分子印迹技术[1-4]是指通过将模板分子(印迹分子)与单体共聚,制备对某一特定分子具有识别选择性的聚合物的技术[5].海藻酸钙(CaAlg)水凝胶作为一种保水性能佳、生物相容性好、制备成本低廉的软湿性材料受到广泛关注[6],目前已被用于蛋白质印迹[7].但纯海藻酸钙水凝胶的强度和稳定性差,容易受到印迹溶液环境的影响,其机械强度较低.Zhao等[8]用氯化钙作为交联剂,制备了印迹BSA的磷酸/海藻酸杂化微球,这种磷酸/海藻酸杂化微球与非印迹微球相比显示出了更高的吸附量.Zhang等[9]用氯化钙作为交联剂,将海藻酸钠与羟乙基纤维素复合,制备的BSA印迹海藻酸盐基复合微球具有很好的力学性能,和单纯的海藻酸钙微球相比具有更好的识别性能.
PP无纺布纤维具有良好的物理机械性能和柔韧性,比表面积较大,耐溶液腐蚀能力强,性能和外观结构稳定[10].Zhao等[11]以PP无纺布纤维为载体,通过紫外辐照接枝的方法制备了BSA印迹PP接枝聚丙烯酰胺水凝胶膜,该印迹膜对BSA具有较高的吸附量和吸附选择性.Kan等[12]以PP无纺布纤维为载体,通过紫外辐照制备了PP无纺布支撑的BSA印迹聚丙烯酰胺/海藻酸钙水凝胶膜.但是紫外照射引发单体聚合过程不可避免地产生热量,会引起蛋白质的变性或构象变化,造成吸附量偏低.宋欢语等[13]制备了不同厚度的BSA印迹CaAlg凝胶膜,但是得到的CaAlg水凝胶膜机械性能较差.
本文以海藻酸钠(NaAlg)为印迹材料,以BSA为模板分子,以PP无纺布为支撑体,采用温和的洗脱方式,制备了PP无纺布支撑的BSA分子印迹CaAlg水凝胶膜(PP-s-CaAlg MIP).采用扫描电子显微镜和红外光谱仪观测其形貌及结构,研究了不同海藻酸纳浓度对PP-s-CaAlg膜溶胀性的影响,以及在不同缓冲液的PP-s-CaAlg中对于蛋白质的释放和重吸附.初步研究了其选择性吸附性能.
1 实验部分
1.1 实验试剂
聚丙烯(PP)无纺布(22 g/m2),香河华鑫非织造布有限公司产品;海藻酸钠(NaAlg),化学纯,国药集团化学试剂有限公司产品;氯化钠和氯化钙,分析纯,上海申翔化学试剂有限公司产品;混合磷酸盐(PBS)缓冲液和Tris-HCl缓冲剂,天津市化学试剂二厂产品;卵清蛋白(Ova)、过氧化氢酶(Cat)和丙种球蛋白(Glo),色谱纯,天津市血液研究所提供;牛血清蛋白(BSA),色谱纯,联星生物科技有限公司提供.所有试剂使用前均未纯化.
1.2 实验仪器
TU-1901型紫外分光光度计,北京普析通用仪器有限责任公司产品;LLY-06F型拉伸试验机,莱州市电子仪器有限公司产品;扫描电子显微镜(S-4800, HITACHI),日本日立公司产品;傅里叶变换红外光谱仪(TENSOR37),德国BRUKER公司产品.
1.3 PP纤维支撑海藻酸钙凝胶膜的制备
取一个干燥的小烧杯,向其中加入20 mL质量浓度为1.34 mg/mL的BSA溶液,在磁力搅拌器上边搅拌边缓慢加入一定质量的NaAlg粉末,搅拌1 h,形成NaAlg质量分数分别为1.5%、2.0%、2.5%和3.0%的均一的水溶液,静置12 h以脱除气泡.取1片PP无纺布浸入到上述混合物水溶液中,将完全润湿的PP无纺布放置到干净的玻璃板上,将上述混合物水溶液倒在完全润湿的PP无纺布表面,用厚度为0.5 mm的刮膜棒刮膜,并刮掉表面多余的NaAlg溶液,放入CaCl2溶液(2.5%)中交联,5 min后取出,即可得到含BSA的PP无纺布支撑海藻酸钙水凝胶膜.
用pH=6.8的磷酸盐(PBS)缓冲液,0.9%的NaCl溶液和pH=8.32的Tris-HCl缓冲剂分别洗脱BSA的PP支撑海藻酸钙水凝胶膜,用紫外分光光度计和蛋白质显色剂测试在上述3种洗脱液中BSA的释放率.每隔8 h换一次洗脱液,待测试不出BSA释放率后认为模板蛋白质被充分洗脱[12],得到PP支撑的海藻酸钙BSA印迹凝胶膜,记为PP-s-CaAlg MIP.非印迹膜除了不加BSA,其制备与洗脱过程与上述步骤相同,得到的非印迹膜记为PP-s-CaAlg NIP.
1.4 PP纤维支撑海藻酸钙凝胶膜的表征
1.4.1 SEM
将样品放入冷冻干燥机中冷冻干燥,用导电胶将样品贴在样品台上,真空喷金之后采用QUANTA 200扫描电子显微镜观察PP-s-CaAlg膜的表面形态和膜表面的微观结构.
1.4.2 FT-IR
取PP-s-CaAlg与CaAlg凝胶膜的样品放入冷冻干燥机中冷冻干燥24 h,制样后用TENSOR37型红外光谱仪分别对样品成分含量和官能团进行检测,扫描波长范围为400~4 000 cm-1,分辨率为±2 cm-1.
1.5 PP纤维支撑海藻酸钙凝胶膜的溶胀性能
采用称量的方法研究PP-s-CaAlg膜在生理盐水中的溶胀性能.用蒸馏水把PP-s-CaAlg小圆片表面冲洗干净并用滤纸吸去表面的水并称量该膜片的初始质量W0,之后每隔一段时间取出,用滤纸将表面水分擦干后称重,直到小圆片的质量不再发生明显变化为止,即可判定海藻酸钙凝胶膜达到溶胀平衡.溶胀率(ESD)通过公式(1)计算:

式中:Wt为溶胀t时刻小圆片的质量(g);W0为溶胀前小圆片起始质量(g).
1.6 PP纤维支撑海藻酸钙凝胶膜对BSA的释放
取12个干燥透明的小玻璃瓶分为4组,每组3个.将制备好的NaAlg质量分数为1.5%、2%、2.5%和3%的含蛋白质的PP纤维支撑海藻酸钙膜裁剪成直径为20 mm的小圆片,用蒸馏水将表面残留CaCl2溶液冲洗干净,分别加入3组小玻璃瓶中.然后向每组的3个小玻璃瓶中分别加入PBS缓冲液(pH=6.86)、NaCl溶液(0.9%)和Tris-HCl缓冲液(pH=7.4)溶液各5 mL,振荡洗脱,在固定相隔时间用紫外分光光度计测定玻璃瓶中上清液在波长278 nm和330 nm处的吸光度,直到所得数值稳定,蛋白质浓度不再发生大的变化为止.根据吸光度数据和所使用蛋白质的标准曲线处理数据,求得洗脱液中的蛋白质含量,即为洗脱量.
1.7 PP纤维支撑海藻酸钙凝胶膜对BSA的重吸附
取表面用蒸馏水冲洗干净的PP-s-CaAlg MIP膜和PP-s-CaAlg NIP膜的小圆片放入到含5 mL浓度为20 μmol/L的BSA溶液的小玻璃瓶中,在室温下静置吸附.在固定相隔时间用紫外分光光度计测定玻璃瓶中上清液在波长278 nm和300 nm处的吸光度,并根据标准曲线计算蛋白质对应的浓度.蛋白质重结合吸附量Q(mg/g)采用以下公式进行计算:

式中:C0和Ct分别为重结合前后的蛋白质溶液的浓度(μmol/L);V为蛋白质溶液的体积,该实验中为5 mL;W为重结合实验所用膜片干态的质量(g).
1.8 PP纤维支撑海藻酸钙凝胶膜的吸附选择性
为测试PP-s-CaAlg MIP膜对BSA的选择性吸附性能,分别配制BSA、Ova、Cat和Glo的水溶液,质量浓度均为1.34 mg/mL.分别将PP-s-CaAlg MIP和NIP膜放入10 mL上述蛋白质溶液中,12 h后测试蛋白质溶液的紫外吸光度,计算其平衡吸附容量(mg/g).
2 结果与讨论
2.1 SEM分析
图1所示为PP和PP-s-CaAlg的数码照片和SEM照片.由图1可见,PP无纺布表面粗糙且有规则孔隙,在PP无纺布表面涂覆CaAlg膜之后,表面呈现出一层光滑透明的凝胶层,无纺布纤维有明显的凹凸孔穴和大孔结构,这种表面形态有利于蛋白质的释放吸附和在膜内的扩散过程.图1(c)、(d)中显示了PP纤维和PP支撑CaAlg膜的微观形貌,PP纤维表面光滑裸露,PP-s-CaAlg表面附着了一层光滑的CaAlg膜,可清楚看到PP纤维对CaAlg膜起到了有效的支撑作用.

图1 PP和PP-s-CaAlg的数码和SEM照片Fig.1 Digital and SEM photos of PP and PP-s-CaAlg
2.2 FT-IR分析
图2所示为CaAlg、PP、PP-s-CaAlg的红外光谱.海藻酸钙凝胶在3 430 cm-1附近显示出1个宽峰,这是O-H的伸缩峰.在1 630 cm-1处的1个尖锐的峰为COO-非对称伸缩,在1 403 cm-1处的峰为仲醇中的C-H变形,在1 089 cm-1和1 031 cm-1处2个峰分别为CH-OH结构中C-O的伸缩以及C-O-C结构中C-O的对称伸缩.与纯PP纤维的红外谱图相比,PP-s-CaAlg红外曲线在原有的峰的基础上叠加了CaAlg的吸附峰,没有新的峰出现.这说明通过表面涂覆制备PP支撑CaAlg膜,制备过程没有新官能团的产生.
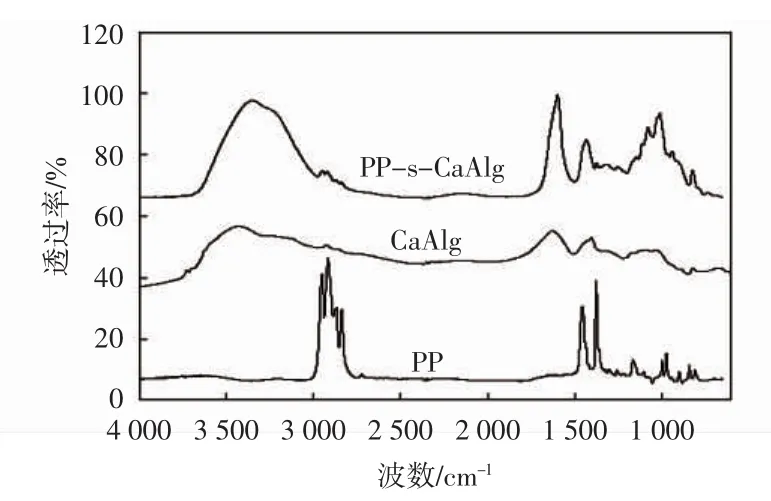
图2 CaAlg、PP、PP-s-CaAlg的红外光谱Fig.2 FTIR spectrogram of CaAlg,PP,PP-s-CaAlg
2.3 PP-s-CaAlg膜溶胀性能
不同浓度NaAlg制备的PP-s-CaAlg膜在0.9%的NaCl溶液中的溶胀性能如图3所示.
由图3可见,4种不同NaAlg含量的膜在2 h内均发生了明显的溶胀,溶胀率随时间的延长逐渐升高,最后溶胀率变化趋于平缓,对比4种NaAlg含量的PP-s-CaAlg膜,NaAlg质量分数为2.5%的膜片溶胀度最高,这说明NaAlg质量分数为2.5%的PP-s-CaAlg膜最适合用于对BSA的释放.NaAlg含量过低,海藻酸钠溶液会过多渗入PP纤维内部,因此溶胀能力受到刚性纤维的抑制[14].PP纤维确实起到了抑制CaAlg膜溶胀度过高的作用,防止出现CaAlg膜在溶液中溶胀过度而破裂的情况发生.而NaAlg含量过高会导致海藻酸钠溶液粘度大,NaAlg溶液不容易渗透到纤维中,造成水凝胶与PP无纺布脱落.

图3 不同浓度NaAlg制备的PP-s-CaAlg膜的溶胀性能Fig.3 Swelling properties of PP-s-CaAlg prepared with different NaAlg concentrations
2.4 PP纤维支撑海藻酸钙凝胶膜对BSA的释放
图4所示为不同NaAlg含量的PP-s-CaAlg膜对BSA的释放曲线.从图4中释放曲线可以看出,4种NaAlg含量的PP-s-CaAlg膜对BSA的释放率都随着时间不断的增加逐渐达到释放平衡.而在每个厚度所对应的不同洗脱液中,释放率最高的是PBS缓冲液,这主要是由于PBS缓冲液中富含磷酸根离子,会抢夺PP-s-CaAlg膜中的钙离子,使得海藻酸钙凝胶交联度下降,溶胀率上升,体积变化较大,方便了蛋白质的传质过程,更利于膜中BSA的释放.PP-s-CaAlg膜对BSA的总释放率有所下降,这主要是由于PP纤维一定程度上限制了CaAlg膜的溶胀.在所有的缓冲液中,NaAlg质量分数分别为1.5%、2%、2.5%、3%的PP-s-CaAlg膜对释放趋势类似,起初随着时间增加释放率缓慢增长,大约在200 min时达到释放平衡,过后随着时间增长,释放率不再发生明显变化.对比不同NaAlg含量的PP-s-CaAlg膜对BSA的释放率,可以发现释放率随着NaAlg含量的升高明显上升,主要原因是,随着NaAlg含量的升高,膜内形成的海藻酸钙网状结构的交联度也会升高,交联度分布较宽,大分子链的运动伸缩性较强,有利于负载更多的BSA,因此表现出的BSA的释放率也较大[5].

图4 不同NaAlg含量的PP-s-CaAlg膜对BSA的释放曲线Fig.4 BSA release curves of PP-s-CaAlg film with different NaAlg contents
2.5 PP纤维支撑海藻酸钙凝胶膜对BSA的重吸附
图5所示为不同NaAlg含量的PP-s-CaAlg膜对BSA的重吸附曲线.
由图5可见,随着时间的延长,PP-s-CaAlg膜对BSA的吸附量逐渐增加,大约在800 min达到吸附平衡,时间过长会造成膜表面BSA分子解吸附的现象.吸附速率在短时间内升高较快,这主要是由于膜表面印迹孔穴和位点起初大量与BSA分子结合引起的,随着印迹孔穴逐渐被BSA占据,吸附速率开始下降.对比PP-s-CaAlg膜在3种不同缓冲液中的吸附数据可以看出,PBS溶液中的吸附量最大,这与PP-s-CaAlg膜在PBS溶液中溶胀度较高有关系.PP纤维的支撑作用有效的改善了CaAlg膜在PBS溶液中吸附不稳定,表面印迹孔穴被破坏的情况,纤维支撑的CaAlg膜在3种溶液中对BSA的吸附量与纯CaAlg膜相比显著上升.由图5还可以发现,重结合量并没有随着NaAlg质量分数的升高而增加,NaAlg质量分数为2.5%的PP-s-CaAlg膜对BSA的重结合量最.NaAlg含量过低时,CaAlg凝胶膜内交联度过低且渗入PP纤维,因此溶胀度过低,不利于印迹孔穴和位点的形成和维持;NaAlg含量过高时又不利于BSA分子在CaAlg凝胶膜内部的传质过程,只有NaAlg质量分数为2.5%时为最佳的含量比,对BSA的重结合量最高.

图5 不同NaAlg含量的印迹和非印迹PP-s-CaAlg膜对BSA的重结合曲线Fig.5 BSA adorption curves of PP-s-CaAlg MIP and NIP film with different SA contents
图6所示为PP-s-CaAlg膜的印迹效率随时间的变化曲线.
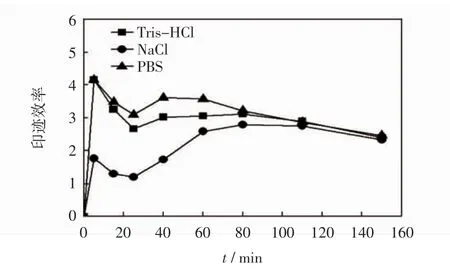
图6 PP-s-CaAlg MIP膜对BSA的印迹效率曲线Fig.6 Imprinting efficiency curves of PP-s-CaAlg MIP film BSA
由图6可见,PP-s-CaAlg膜在3种缓冲液中的印迹效率都是开始时较大,随着时间的延长逐渐减小.一方面原因是吸附开始时印迹位点较多,印迹速率上升快,随着印迹位点逐渐被BSA占据,印迹效率出现明显下降.另一方面原因是,蛋白质在洗脱液中由于外界因素干扰发生构象的变化,不能与印迹位点特异性的结合,导致印迹效率的降低.
2.6 PP-s-CaAlgMIP和NIP膜对BSA的吸附选择性
图7所示为PP-s-CaAlg MIP和NIP膜对单一的模板蛋白BSA及对比蛋白卵清蛋白(Ova),过氧化氢酶(Cat)和伽马球蛋白(Glo)的平衡吸附量.
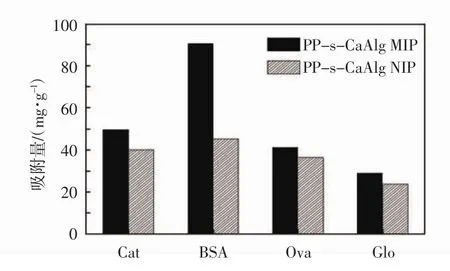
图7 PP-s-CaAlg MIP和NIP膜对BSA及对比蛋白的吸附量(用Tris-HCl做洗脱液)Fig.7 Adsorption capacities of PP-s-CaAlg MIP and NIP films for BSA and other proteins(films was washed by Tris-HCl buffer)
PP-s-CaAlg MIP膜对模板BSA的吸附容量比NIP,且对BSA的吸附量均大于其余蛋白质的吸附量.
而NIP对各种蛋白质的吸附量相差不大.这表明PP-s-CaAlg MIP具有一定的吸附选择性和识别能力.
3 结论
通过涂覆的方法可方便地制备PP无纺布支撑的BSA分子印迹海藻酸钙水凝胶膜(PP-s-CaAlg MIP),PP纤维对湿软性质的CaAlg凝胶起到了支撑作用. NaAlg质量分数为2.5%的PP-s-CaAlg膜的溶胀性能最好,NaAlg含量过低或过高引起的交联度过低或过高都不利于溶胀.PP-s-CaAlg膜在PBS缓冲液中的释放率明显高于在Tris-HCl和NaCl溶液中的释放率. PBS洗脱液得到的样品吸附量最大.PP纤维的支撑作用有效的改善了CaAlg膜在PBS溶液中吸附不稳定的情况,并且整个过程中没有用到有机溶剂,得到的材料生物相容性好.NaAlg质量分数为2.5%的PP-s-CaAlg膜对BSA的重结合量高于其他NaAlg含量的PP-s-CaAlg膜.
与对比蛋白质相比,PP-s-CaAlg MIP对模板蛋白质的吸附量更多,表明其具有一定的吸附选择性.
[1]BURES P,HUANG Y,ORAL E,et al.Surface modifications and molecular imprinting of polymers in medical and pharmaceutical applications[J].J Control Release,2001,72(3):25-33.
[2]申磊,魏俊富,赵孔银.辐射接枝聚丙烯纤维制备蛋白质分子印迹聚合物水凝胶[J].天津工业大学学报,2009,28(1):19-22. SHEN L,WEI J F,ZHAO K Y.Preparation of protein molecular imprinted polymer hydrogel by radiation grafting of polypropylene[J].Journal of Tianjin Polytechnic University,2009,28(1):19-22(in Chinese).
[3]张学炜,孙慧,董襄朝,等.分子印迹技术及其应用研究进展[J].天津农学院学报,2002,9(3):23-28. ZHANG X W,SUN H,DONG X C,et al.Molecular imprinting technique and its application[J].Journal of Tianjin Agricultural College,2002,9(3):23-28(in Chinese).
[4]王颖,李楠.分子印迹技术及其应用[J].化工进展,2010,29(12):2315-2323. WANG Y,LI N.Molecular imprinting technology and its application[J].Chemical Industry And Engineering Progress,2010,29(12):2315-2323(in Chinese).
[5]LIA S J,CAO S S,WHITCOMBEB M J,et al.Size matter:Challenges in imprinting macromolecules[J].Prog Polym Sci,2013,39:145-163.
[6]VERHEYEN E,SCHILLEMANS J P,WIJK M V,et al.Challenges for the effective molecular imprinting of proteins[J].Biomaterials,2011,32:3008-3020.
[7]BYRNE M E,PARK K,PEPPAS N A,Molecular imprinting within hydrogels[J].Adv Drug Deliv Rev,2002,54:149-161.
[8]ZHAO K Y,CHENG G X,HUANG J J,et al.Rebindingand recognition properties of protein-macrpmolecularly imprinted calcium phosphate/alginate hybrid polymer microspheres[J]. React Funct Polym,2008,68(3):732-741.
[9]ZHANG F J,CHENG G X,YING X G.Emulsion and macromolecules templated alginate based polymer microspheres[J]. React Funct Polym,2006,66(7):712-719.
[10]王红飞,杨浩,张黎明.具酯酶活性的温敏型分子印迹微凝胶[J].中国科学:化学,2011,41(3):524-530. WANG H F,YANG H,ZHANG L M.Temperature-sensitive molecularly imprinted microgels with esterase activity[J].SCIENTIASINICA:Chimica,2011,41(3):524-530(inChinese).
[11]ZHAO K Y,LIN B B,CUI W K,et al.Preparation and adsorption of bovine serum albumin-imprinted polyacrylamide hydrogel film grafted on non-woven polypropylene[J].Talanta,2014,121:256-262.
[12]KAN B H,LIN B B,ZHAO K Y,et al.Imprinting of bovine serum albumin in nonwoven polypropylene membrane supported polyacrylamide/calcium alginate interpenetrating polymer network hydrogel[J].RSC Advances,2014,99(4):55846-55852.
[13]宋欢语,赵孔银,李思迪,等.厚度可控蛋白质印迹海藻酸钙水凝胶膜的制备和表征[J].中国科学:技术科学,2016,46(9):1-9. SONG H Y,ZHAO K Y,LI S D,et al.Preparation and characterization of protein molecular imprinted calcium alginate hydrogel film with controllable thickness[J].SCIENTIA SINICA:Tech,2016,46(9):1-9(in Chinese).
[14]GEORGE M,ABRAHAM T E.Polyionic hydrocolloids for the intestinal delivery of protein drugs:Alginate and chitosan—a review[J].J Control Release,2006,114:1-14.
[15]ZHANG F J,CHENG G X,YING X G.Emulsion and macromolecules templated alginate based polymer microspheres[J]. React Funct Polym,2006,66:712-719.
Preparation and characterization of PP non-woven fiber supported protein molecular imprinted calcium alginate hydrogel film
SONG Yun-fei,WEI Meng-meng,CHEN Tian,JIAO Rui,SUN Ping-ping,ZHAO Kong-yin
(State Key Laboratory of Separation Membranes and Membrane Processes,Tianjin Polytechnic University,Tianjin 300387,China)
Bovine serum albumin (BSA)imprinted calcium alginate hydrogel film supported by polypropylene(PP)nonwoven fabrics(PP-s-CaAlg MIP)was prepared using sodium alginate as the molecularly imprinted materials,BSA as the template molecule,and PP non-woven fabrics as the matrix.At the same time the non-molecularly imprinted film was also prepared without BSA and named as PP-s-CaAlg NIP.The PP-s-CaAlg MIP was characterized by SEM and FT-IR,and its swelling performance was measured in physiological saline.The release properties of BSA on the PP-s-CaAlg hydrogel films prepared with different NaAlg concentrations were investigated in different buffers.The adsorption properties of the PP-s-CaAlg MIP and NIP films prepared with different NaAlg concentrations under different buffers were analyzed.The experimental results showed that the PP-s-CaAlg MIP film adsorbed more BSA than PP-s-CaAlg NIP film.Compared with contrast protein,PP-s-CaAlg MIP adsorbed more template protein,indicating that the PP-s-CaAlg MIP exhibited the performance of adsorption selectivity.PP-s-CaAlg MIP exhibited good biocompatibility and could be prepared by a fast,low-cost method,which would find its potential applications in the fields of cell culture and tissue engineering.
proteins molecularly imprinting;calcium alginate hydrogel film;polypropylene non-woven fabric;release;adsorption
TS102.54
A
1671-024X(2016)05-0005-06
10.3969/j.issn.1671-024x.2016.05.002
2016-06-16
国家自然科学基金资助项目(51103102);天津市应用基础与前沿技术研究计划项目(16JCZDJC37500);天津市科技特派员项目(16JCTPJC44800)
宋云飞(1989—),男,硕士.E-mail:sunshine5437@126.com
赵孔银(1979—),男,博士,副教授,主要研究方向为功能高分子材料.E-mail:zhaokongyin@tjpu.edu.cn
