大孔树脂纯化密花香薷总黄酮工艺研究
2020-12-30石子林李军乔王雅琼马新虎
石子林,李军乔,王雅琼,马新虎,侯 琴
(1.青海民族大学a.青藏高原蕨麻研究中心,b.生态环境与资源学院,c.经济与管理学院,中国 西宁 810000; 2.青海省特色经济植物高值化利用重点实验室,中国 西宁 810000 )
密花香薷(ElsholtziadensaBenth.)为唇形科(Labiatae)香薷属植物,又称咳嗽草、蟋蟀巴等,民间常作为茶叶以及草药使用,为药食两用植物[1]。其主要分布于甘肃、青海、四川、云南、西藏等海拔2 800~4 100 m 的地区[2]。密花香薷利水消肿,具有治疗胃病、发热无汗等功效,富含挥发油、黄酮、多糖等化学成分[3,4]。目前,对密花香薷挥发油类研究较多,但总黄酮类报道较少,尚无对密花香薷全草总黄酮分离纯化的报道。
目前常用超临界流体色谱(SFC)[5]、制备型高效液相色谱(HPLC)[6]、高速逆流色谱[7]、分子蒸馏技术[8]以及大孔树脂吸附等来分离纯化中药材中的各类化学成分。其中大孔树脂吸附相较于其他几种而言,有吸附时间较短、吸附样品较多、纯化效果较好、可再生、操作较为简单等优点[9,10],被广泛运用于中药材中黄酮类、生物碱类、萜类以及皂苷等物质的分离纯化[11-14]。
密花香薷在田间常被当做杂草,但含有丰富的黄酮类物质。本实验基于包锦渊提出的密花香薷全草总黄酮提取的最优工艺条件[15],对提取物进行分离纯化,以提高密花香薷全草提取液中总黄酮的含量,为密花香薷全草总黄酮类成分的药理活性的研究提供实验基础。
1 仪器与试药
Neofuge23R台式高速冷冻离心机(上海力申科学仪器有限公司)、UV-5500型紫外-可见光分光光度计(上海元析仪器有限公司)、HZQ-X160恒温震荡培养箱(苏州培英实验设备有限公司)、BT102S微型蠕动泵(保定雷弗流体科技有限公司)、EPED-20TH实验室级超纯水器(南京易普易达科技发展有限公司)、eppendorf移液枪(EPPENDORF)。
密花香薷于2019年7月采自青海省西宁市湟源县牧场村蕨麻种植基地,经青海民族大学生态环境与资源学院李军乔教授鉴定为唇形科香薷属植物密花香薷。B20771-芦丁标准品(上海源叶生物科技有限公司,纯度≥98%);乙醇、氢氧化钠、硝酸铝、亚硝酸钠、盐酸(天津市大茂化学试剂厂,均为分析纯);D101,AB8-8,NKA-9,S-8,HPD-100及DM130型大孔树脂(廊坊淼阳化工有限公司);纯水(实验室自制)。
2 方法
2.1 密花香薷全草总黄酮的测定
2.1.1 对照品溶液的制备 精密称量干燥到恒重的芦丁标准品20 mg,用70%乙醇(体积分数)溶解定容至50 mL,摇匀即得0.4 g·L-1芦丁对照品溶液。
2.1.2 芦丁标准曲线的绘制 精密移取1,2,4,6,8,10 mL对照品溶液于25 mL容量瓶中,分别加入70%乙醇6 mL及5%亚硝酸钠溶液1 mL,摇匀,静置6 min后加10%硝酸铝溶液1 mL ,摇匀,静置6 min后加4%氢氧化钠溶液10 mL,用70%乙醇定容至刻度,摇匀静置15 min。以空白样做对照,于510 nm处测吸光度。以芦丁质量浓度(x)为横坐标,吸光度(y)为纵坐标,绘制标准曲线,得到线性回归方程为:y=0.007x+0.008 7,r2=0.999 6,线性范围为0.016~0.160 g·L-1。
2.1.3 上样液的制备 将密花香薷全草自然风干至恒重,粉碎后过0.42 mm筛,精密称取适量样品粉末,转移至250 mL烧瓶中,按照包锦渊的最佳提取工艺操作[15]。提取液冷却后抽滤,浓缩,加纯水溶解,离心后取上清液即得。冷藏放置,备用。
2.1.4 总黄酮质量浓度的测定 用70%乙醇稀释上样液,并移取1 mL滴加于25 mL容量瓶内,按2.1.2的方法显色后,结合标准曲线即得溶液中黄酮含有量。
2.1.5 精密度试验 精密移取5份1.0 mL芦丁标准品溶液,按2.1.2的方法显色后,测得溶液吸光度RSD值为1.18%,结果表明仪器精密度良好。
2.1.6 稳定性试验 精密移取1.0 mL上样液,按2.1.2的方法显色后,分别于0.5,1.0,1.5,2.0,2.5,3.0 h测吸光度,测得其吸光度的RSD值为1.45%,表明上样液在3.0 h内保持稳定。
2.1.7 重复性试验 精密移取 5份1.0 mL上样液,按2.1.2的方法显色后测其吸光度,测得溶液吸光度的RSD值为1.54%,说明该方法的重复性良好。
2.1.8 加样回收率试验 精密移取 5份1.0 mL上样液,加入1 mL对照品试液,摇匀,按2.1.2 的方法显色,测完吸光度后得平均回收率为98.68%,RSD值为0.89%。
2.2 树脂的筛选
2.2.1 大孔树脂预处理 将各型号的大孔树脂用95%乙醇浸泡24 h,待充分吸胀后,除去小颗粒上浮物,将树脂倒入色谱柱(内径30 mm×600 mm)中,用纯水淋洗至流出液与水混合无白色浑浊现象,继续用大量纯水洗至流出液无醇味;再分别用4%盐酸和4%氢氧化钠溶液洗脱浸泡5 h,用纯水洗至中性,备用。
2.2.2 静态吸附-解析试验 称取2.0 g(湿重)已预处理好的6种型号大孔树脂于150 mL锥形瓶中,加入3.80 g·L-1的上样液15 mL,封口。在恒温振荡培养箱中,于25 ℃,60 r·min-1下吸附24 h。抽滤,取滤液测其吸光度,计算吸附率和吸附量。滤出的树脂用蒸馏水清洗掉表面残留的未被吸附黄酮后,置于150 mL锥形瓶中,加25 mL 70%乙醇,封口,其余操作同吸附。测吸光度,计算其解吸量和解吸率:
吸附量=(c0-c1)Vy/Ws,吸附率=(c0-c1)/c0,
解吸量=c2·Vx/Ws, 解吸率=c2·Vx/(c0-c1)·Vy。
其中,c0和c1分别为吸附前后样品溶液中总黄酮质量浓度(g·L-1);c2为解吸后样品溶液中总黄酮质量浓度 (g·L-1);Vy为上样液体积 (mL);Vx为解吸液体积(mL);Ws为树脂质量(g)。
2.2.3 静态吸附动力学曲线 取2.0 g DM130型大孔树脂于150 mL锥形瓶中,精密加入2.16 g·L-1上样液50 mL,在25 ℃,60 r·min-1下吸附24 h,于1,2,3,4,5,6,12,18,24 h时分别取样,测吸附率,平行实验3次,取平均值。
2.2.4 静态解吸动力学曲线 将2.2.3中吸附完全的树脂抽滤,纯水清洗至流出液无色后,置于150 mL锥形瓶内,加入70%乙醇50 mL,震荡吸附。后续操作同2.2.3。
2.3 单因素静态吸附试验
2.3.1 上样液浓度考察 称取6份处理好的DM130型树脂5 g湿法装柱(色谱柱规格:内径20 mm×300 mm),吸取总黄酮质量浓度分别为1.19,2.51,3.51,4.61,5.56,6.63 g·L-1且pH为7的上样液2 BV(18 mL),流速为2 mL·min-1,测溶液吸附后吸光度,得最佳上样液质量浓度为3.51 g·L-1。
2.3.2 上样液pH考察 固定上样液质量浓度3.51 g·L-1,流速2 mL·min-1,加入pH值分别为3,4,5,6,7,8的上样液2 BV。上样后,测溶液吸光度,得最佳上样液pH值为4。
2.3.3 上样液流速的考察 固定上样液质量浓度3.51 g·L-1,pH为4,分别以0.5,1,2,3,4,5 mL·min-1流速上样2 BV后,测溶液吸光度并结合实际操作,取最佳上样流速为1 mL·min-1。
2.3.4 上样量的考察(泄露曲线的绘制) 固定上样液质量浓度3.51 g·L-1, pH为4,流速1 mL·min-1上样7 BV,每1 BV收集一管,测定每管吸光度,计算树脂吸附率,以流出液浓度达上样液浓度的10%左右为泄漏点[16],得泄漏点为3 BV,从而得出最佳上样量为3 BV。
2.4 单因素静态解析试验
2.4.1 洗脱剂浓度的考察 称取5份在最佳上样条件下已吸附完全的树脂5 g,装柱,先用纯水洗涤树脂上沾有的未被吸附的溶剂,待流出液至无色后,固定流速4 mL·min-1,洗脱量3 BV,分别以 50%,60%,70%,80%及90%的乙醇洗脱过柱,收集流出液测吸光度,计算其解吸率,得最佳洗脱剂为70%乙醇。
2.4.2 洗脱剂流速的考察 固定洗脱剂为70%乙醇3 BV,以0.5,1.0,2.0,3.0,4.0,5.0 mL·min-1流速洗脱,收集流出液,测其吸光度,计算其解吸率,结合实际操作,从而得出最佳流速为1.0 mL·min-1。
2.4.3 洗脱量的考察(洗脱曲线的绘制) 取1份在最佳上样条件下已吸附完全的树脂5 g,装柱(树脂吸附的总黄酮为378.81 mg),固定洗脱剂为70%乙醇,流速1.0 mL·min-1,每1 BV收集一管,测其吸光度,计算洗脱率并绘制洗脱曲线,结合实际,确定最佳洗脱量为4 BV。
2.5 响应面试验优化
在上述单因素试验的基础上,采用Design-Expert 8.0.6软件进行Box-Behnken响应面试验设计,以树脂的吸附率为响应值,分别选取上样液浓度(A),上样液流速(B),上样液pH(C),3因素为自变量,进行3因素3水平响应面试验对纯化工艺进行优化,实验方案如表1。

表1 响应面因素水平表
2.6 数据分析
响应面试验用Design-Expert 8.0.6设计,图形均用Origin 2017制作,表格用Excel 2013处理。
3 结果
3.1 大孔树脂型号的筛选
大孔树脂不同的理化性质可显著影响其吸附、解吸效果,本实验选用6种不同性质的大孔树脂试验(吸附和解吸情况见表2)。其中DM130型大孔树脂吸附率最高达87.02%,解吸率达87.50%,AB-8型大孔树脂解吸率最高达90.06%,但其吸附率只有84.19%。结合实际,本实验选取DM130型大孔树脂作为密花香薷全草总黄酮纯化的最佳大孔树脂。
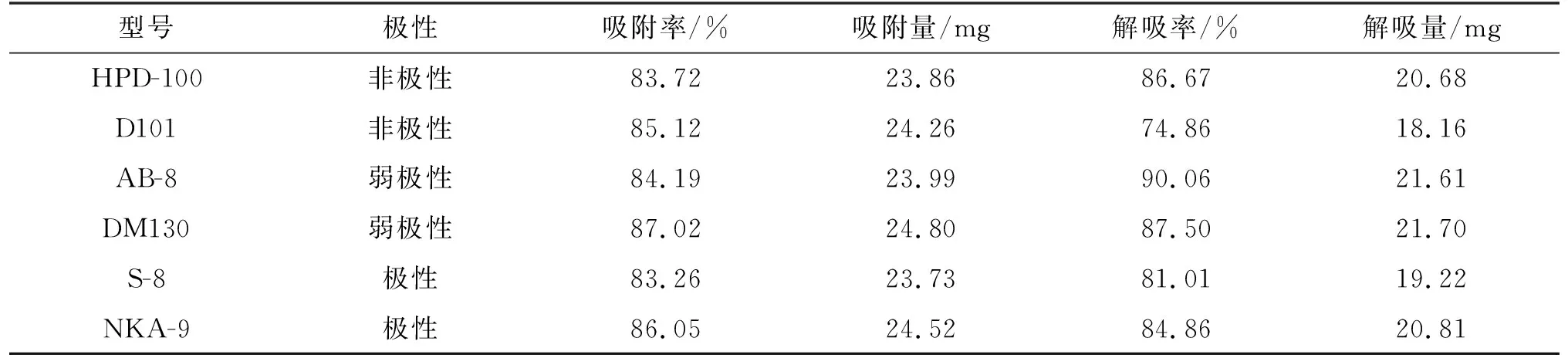
表2 大孔树脂静态吸附/解吸能力
3.2 静态吸附/解析动力学曲线
3.2.1 静态吸附动力学曲线 由图1可知,加入样品溶液后,树脂在0~6 h吸附率上升较快,在6~24 h内上升较平缓,结合实际操作,选择最佳静态吸附时间为6 h,此时吸附率为73.47%。
3.2.2 静态解吸动力学曲线 由图2可知,解吸时间在0~5 h时树脂解吸速率较快,在6~12 h时树脂解吸速率较平缓,结合实际操作,静态解吸选择的最佳解吸时间为5 h,解吸率为80.70%。

图1 DM130型大孔树脂静态吸附动力学曲线Fig. 1 Static adsorption kinetics curve of DM130 macroporous resin

图2 DM130型大孔树脂静态解析动力学曲线Fig. 2 DM130 macroporous resin static analytical kinetics curve
3.3 最佳上样液质量浓度的确定
当上样液总黄酮浓度逐渐升高时,吸附率也随之升高;当上样液中总黄酮质量浓度>3.51 g·L-1后,吸附率反而下降,结果如图3。证明树脂在3.51 g·L-1时已达其最大吸附率(88.85%)。
3.4 最佳上样液pH的确定
当上样液pH为4时,树脂的吸附率达最高值(89.36%),当pH>4后,吸附率反而下降,结果如图4。说明上样液酸性较强时有利于树脂对密花香薷全草中总黄酮的吸附,当酸性偏高或偏低以及偏碱性时,吸附率也随之降低。因此上样液最佳pH值为4,此时吸附率为89.36%。
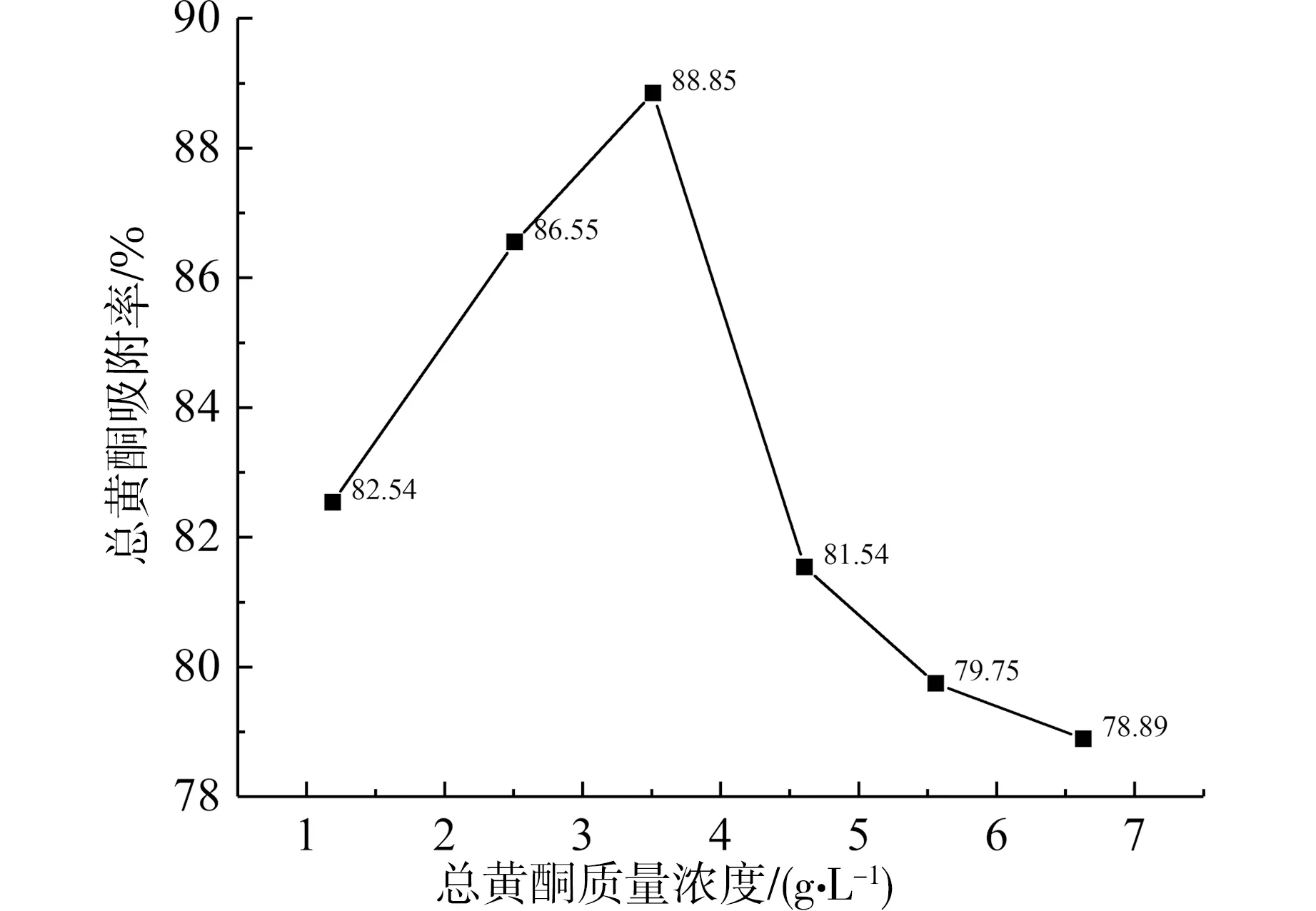
图3 上样液浓度对DM130型树脂吸附率的影响Fig. 3 Effect of concentration on adsorption rate of DM130 resin

图4 pH值对DM130型树脂吸附率的影响Fig. 4 Effect of pH value on adsorption rate of DM130 resin
3.5 最佳上样液流速的确定
当上样液流速逐渐加快时,吸附率也随之降低,当流速达0.5 mL·min-1,吸附率到最大值91.24%,考虑到实际操作,选择最佳上样流速为1 mL·min-1。结果见图5。
3.6 泄露曲线的绘制
由图6可知,当上样量为1 BV时开始泄露,当上样量为3 BV时,泄露的总黄酮质量浓度为0.33 g·L-1,即约达上样液质量浓度3.31 g·L-1的10%,可认为此点即为上样的泄漏点,过此点后,上样液泄漏量逐渐上升,结合实际操作等情况,选择最佳上样量为3 BV。

图5 上样液流速对DM130型树脂吸附率的影响Fig. 5 Effect of loading velocity on adsorption rate of DM130 resin

图6 DM130型大孔树脂吸附泄露曲线Fig. 6 Adsorption leakage curve of DM130 macroporous resin
3.7 洗脱剂体积分数的确定
当乙醇体积分数由50%依次增加到90%时,洗脱液中总黄酮浓度呈现先升高后降低的趋势,当乙醇体积分数达70%时,出现最大值,即为88.04%,由此可见,70%乙醇即为最佳的密花香薷全草中总黄酮洗脱剂。其结果见图7。
3.8 洗脱剂流速的确定
当洗脱剂流速逐渐加快时,洗脱率逐渐降低,当洗脱剂流速为0.5 mL·min-1时,洗脱液中总黄酮达最大值为91.57%,但结合实际操作,选择1 mL·min-1为最佳洗脱流速,此时解吸率为90.65%(图8)。

图7 洗脱剂体积分数对DM130型树脂解吸率的影响Fig. 7 Effect of eluent concentration on the resolution of DM130 resin

图8 洗脱剂流速对DM130型大孔树脂解吸率的影响Fig. 8 Effect of eluent velocity on the resolution of DM130 macroporous resin
3.9 洗脱曲线的绘制
由图9可知,当洗脱量为1 BV时,洗脱液中总黄酮达5.669 g·L-1,为洗脱总量的40.41%;当洗脱量为2 BV时,此时树脂已趋近淡黄色,大部分黄酮已被洗脱出,洗脱率为77.43%。出于回收率以及成本的考虑,本实验选择洗脱剂用量为4 BV,此时的洗脱率为91.85%。

图9 DM130型大孔树脂洗脱曲线 Fig. 9 DM130 macroporous resin elution curve
3.10 响应面设计结果
通过软件对表3的数据进行回归拟合分析,得吸附率与各因素水平之间的二次多项式方程,吸附率=8.33+32.56A+6.20B+12.44C-0.39AB+0.07AC+0.94BC-4.80A2-5.63B2-1.71C2。
对上述回归方程进行方差分析,由表4可知,各因素对吸附率的影响从大到小为:B(上样液流速)、A(上样液浓度)、C(pH)。回归模型的P=0.003 9 (P<0.01),说明该模型极显著且响应值与试验的各因素存在显著的线性相关性,回归决定系数R2=0.922 4,说明响应值的变化有92.24%来源于所选择因素的变化。同时失拟差P=0.191 3 (P>0.05),影响不显著,进一步表明该回归方程可较好地描述响应值与各因素之间的关系。综上,可确定该回归方程为总黄酮的优化提供了一个较为合适的模型。
通过响应面分析得出,最佳吸附条件为:上样液质量浓度3.51 g·L-1, 流速0.76 mL·min-1,pH值3.92,此时吸附率为90.22%。考虑到实际操作的可行性,选取上样液质量浓度3.50 g·L-1,流速1 mL·min-1,pH为4。
3.11 验证性试验
根据上述响应面吸附试验结果,确立最优工艺条件,在此条件下进行吸附-解吸,测完溶液吸光度后,再将洗脱液旋干至浸膏,烘干后称定其质量,计算总黄酮吸附率、解吸率、纯度及回收率:
总黄酮纯度=ca·Va/ma,总黄酮回收率=mb/mc。
式中,ca为洗脱液中总黄酮质量浓度(g·L-1),Va为洗脱液体积(mL),ma为洗脱液干燥后的质量(g),mb为洗脱液中总黄酮的质量(g),mc为上样液中总黄酮的质量(g)。
上述实验平行3次。结果显示,用上述方法吸附解吸后,吸附率达89.20%,解吸率达89.66%,纯度由之前的40.96%增至87.94%,回收率为77.85%。
为了更好地反映各因素对提取率的影响,绘制三维曲面图(图10,彩图见封三)。曲面图坡度的陡峭程度说明该因素对提取率影响的显著性,越陡则越显著。由图10可知,B(流速)对提取率的影响最大,A(浓度)次之,C(pH)则最小。

表3 Box-Behnken设计结果

表4 方差分析
4 讨论与结论
黄酮类化合物有诸多药理及生理学活性,如抗氧化、抗肿瘤、抗炎、抗骨质疏松、保肝护肝等。密花香薷全草中黄酮含量较高,具有良好的开发价值,本实验通过DM130型大孔树脂对密花香薷全草总黄酮进行纯化,为后续对密花香薷深度加工和应用奠定基础。

图10 各因素相互作用对吸附率影响的响应面图Fig. 10 Response surface polts showing the mutual effects of different factor on the yield of adsorption
本实验考察了S-8,HPD-100,NKA-9,DM130,AB-8及D101共6种大孔吸附树脂对密花香薷全草中总黄酮的吸附-解吸性能,发现DM130型大孔树脂具有较好的纯化效果,最佳工艺参数为上样液质量浓度3.50 g·L-1,上样液pH为4,体积为3 BV,流速为1 mL·min-1。洗脱前先用纯水将残留的黄酮洗除干净,待流出液至无色时再加洗脱剂洗脱。洗脱剂为70%乙醇,体积为4 BV,流速为1 mL·min-1。在该工艺下,其纯度由原先的40.96%提升至87.94%,回收率为77.85%,说明该纯化工艺行之有效,具有良好的分离纯化密花香薷全草中总黄酮的效果。
