哈萨克羊多胎新类型培育研究
2016-11-24罗生金
罗生金
(新疆哈密地区畜牧工作站,哈密839000)
哈萨克羊多胎新类型培育研究
罗生金
(新疆哈密地区畜牧工作站,哈密839000)
以含有FecB基因为候选基因的小尾寒羊和湖羊为父本,与当地哈萨克母羊进行杂交,采用多胎基因FecB分子标记技术与常规育种技术,组建理想型育种群。结果表明:杂交F1羊166只含等位基因B频率0.58,等位基因+频率0.42;横交F2羊检测64只,等位基因B频率0.41,等位基因+频率0.59;湖(寒)哈杂交及横交F2羊基因频率差异均不显著(P>0.05),但含BB基因型纯合子数量有所增多,通过基因检测验证了含FecB基因羊与哈萨克母羊杂交后,FecB基因显性效果好,遗传性能较为稳定。F1羊中含有FecB基因型(BB、B+、++)的母羊初生重、6月龄体重、12月龄体重差异均不显著(P>0.05);经测定6月龄和12月龄体高、体长、胸围、管围4项指标差异也均不显著(P>0.05)。通过对F1羊的跟踪调查,41只母羊产羔率159%(64/41),繁殖成活率146%(60/41),其中BB基因型1只,产羔2只,产羔率200%;B+基因型29只,产羔50只,产羔率172%;++基因型11只,产羔12只,产羔率109%;B+基因型产羔率与野生型(++)相比提高了63个百分点,差异极显著(P<0.01)。通过选育选配、横交固定,初步培育出了哈萨克羊多胎新类型,该类型能较好地适合哈密地区生态环境,为哈萨克羊多胎新类型的进一步选育提供依据。
哈萨克羊;FecB基因;多胎型;培育;小尾寒羊;湖羊
国内外采用常规育种与分子标记结合开展新品种(品系)培育工作,已取得了突破性进展。1919年澳大利亚的BSeear从新南威士州毛用型美利奴羊群中选出1只高繁殖力母羊,到1959年BSeear的羊群已经具有很高的繁殖力,平均产羔1.94只,育成了多胎的BooroolaMerino高产群[1]。Wilion等[2]发现骨形态发生蛋白受体-IB(bone morphogentic protein receptor-IB,BMPR-IB)基因编码区发生一处突变(A746G),导致了该受体激酶结构域的第249位氨基酸由谷氨酰胺突变为精氨酸(Q→R),造成Booroola Merino绵羊排卵数增加,1989年该基因被绵、山羊遗传命名委员会正式定名为FecB基因。在我国,王根林等[3]利用“forced”限制性酶切片段长度多态性PCR技术首次发现,湖羊和小尾寒羊存在FecB基因,与Booroola Merino绵羊的多胎主效基因FecB的表现型基本相同,两者产羔率分别为228.92%和270.00%。柳淑芳等[4]利用FecB基因对国内多胎品种进行了基因型与产羔数的关联分析,进一步确认了我国的湖羊、小尾寒羊等少数品种携带有多胎性能主基因。这些文献为哈密地区选育多胎新类型提供了理论依据。
近年来新疆自治区开展了肉羊标准化生产,肉羊养殖存在问题主要有:一是当地哈萨克羊适应性强、体质结实、善于爬山游牧、抓膘能力强,但生长速度慢、产肉率低,尾脂多,季节性发情,一年一胎繁殖性能低。二是缺乏专门化多胎肉羊品种,舍饲繁殖母羊依靠山东、江浙一带引进,这些品种在本地区环境适应性差,表现为繁殖率和成活率低、羊体质差、死亡率高等突出特点。针对以上存在的问题,自治区高技术项目“新疆地方绵羊品种多胎性类型创制”的子课题“哈萨克羊多胎新类型创制”,采用含有候选FecB基因纯合子的湖(寒)公羊与本地哈萨克母羊杂交,通过检测绵羊高繁殖率主效基因来选育哈萨克羊多胎新类型。
1 材料与方法
1.1 检测多胎基因FecB
本实验分4次采集血样,用装有肝素钠的采血器每只绵羊颈静脉采血3~5 mL,-20℃冷冻,分次进行绵羊多胎主效基因FecB分子检测筛选。
1.1.1 材料 绵羊血样,1.5 mL离心管,PCR引物,限制性内切酶AvaⅡ,琼脂糖,高速离心机,恒温摇床,PCR仪,电泳槽,电泳仪,凝胶自动成像仪,自动灭菌锅,电子天平,干热灭菌箱,移液枪。
1.1.2 方法 本实验采用聚合酶链式反应连接的限制性片段长度多态性分析(PCR-RFLP)检测,参照储明星等[5]方法分3步操作:第一步,提取绵羊基因组DNA,通过酚-氯仿法从绵羊全血或者组织提取DNA;第二步,进行PCR扩增FecB基因特异片段,通过PCR方法扩增包含突变位点的片段;第三步,PCR产物进行酶切和结果判定,根据突变位点选择特异性限制性内切酶对PCR产物进行酶切,酶切产物进行电泳,用分光光度计检测DNA纯度,根据电泳凝胶上DNA片段大小不同判定结果。
1.1.3 酶切产物分析 用限制性内切酶AvaⅡ对PCR扩增产物进行酶切消化。酶切体系:6 μL扩增产物;2 μL 10×Buffer;0.5 μL AvaⅡ限制性内切酶;双蒸水补至20 μL,然后37℃水浴6 h;酶切产物在3%(w/v)琼脂糖凝胶电泳检测,凝胶成像系统拍照,确定酶切图谱的基因型。
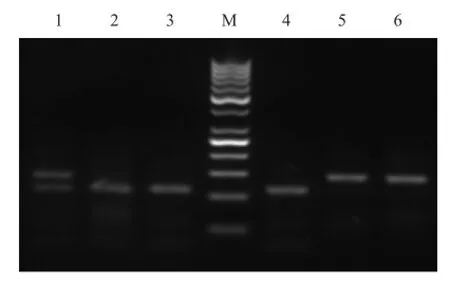
图1 绵羊FecB基因内切酶结果
1.2 制定育种技术方案
2013年8月确定项目实施点:哈密市沁城乡西路村。选取该村6户饲养的哈萨克母羊500只组群。通过多胎基因测定,从哈密地区长青种羊场检测FecB纯合子10只为被选公羊开展人工授精。2015年1月进入横交固定阶段,采用FecB杂合子6只公羊进行横交,做好各项数据收集。
1.3 种公羊饲养管理
种公羊日粮配合:混合精料1.2~1.4kg,青干草2.0kg,胡萝卜0.5~1.5 kg,鸡蛋2枚,配种前3~4周开始补料,对选定种公羊进行预饲,每天驱赶运动1~2 h,并进行采精训练,配种期种公羊日采精2~3次。
1.4 母羊饲养管理
选取2~5岁繁殖母羊组成基础群,怀孕前期以放牧为主,适量补饲饲草,怀孕后期及哺乳期每只羊补饲全价精饲料0.3 kg,补饲部分饲草。
1.5 羔羊饲养管理
羔羊出生称重、挂耳标,2周龄开始补羔羊料,填好各项产羔记录,做好疫苗接种、母幼适时分饲、定时哺乳及断奶工作,并做好断奶羔羊鉴定和记录。按一定比例对母羔采血进行多胎基因测定,初步建立了F1、F2公母羊的后备羊群,做好数据整理。
1.6 数据的统计分析方法
数据采用SPSS 19.0、Excel软件进行统计分析,用单因子方差分析(one-way ANOVA,LSD)进行平均数与标准差计算,差异显著时进行Duncan多重比较检验。结果用平均值±标准差表示。
2 结果与分析
2.1 FecB基因在杂交类群中的分布
由表1可知,在湖(寒)哈杂交及横交F2羊群中存在3种基因型:BB型、B+型、++型。杂交F1羊166只含等位基因B频率为0.58,等位基因+频率为0.42;横交F2羊检测64只,含等位基因B频率为0.41,含等位基因+频率为0.59;湖(寒)哈杂交F1羊与横交F2羊基因频率和基因型频率差异均不显著(P>0.05),但两者均与小尾寒羊和湖羊差异极显著(P<0.01)。说明含FecB基因羊与哈萨克母羊杂交后,FecB基因显性效果好,遗传性能较为稳定。
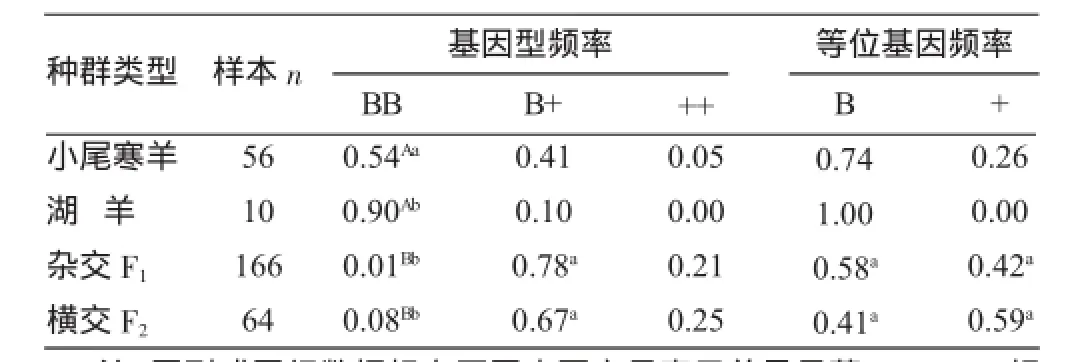
表1 成羊及杂交羔羊FecB基因型频率分布
2.2 初生、6月龄、12月龄体重及体尺测定结果比较
由表2可知,不同FecB基因型(BB、B+、++)羊初生、6月龄、12月龄体重均差异不显著(P>0.05)。同时测定6月龄和12月龄体高、体长、胸围、管围4项指标,结果表明,携带BB、B+与野生型(++)基因型育成羊体尺差异也均不显著(P>0.05)。说明育种群的遗传性能较为稳定,具有早期生长发育较快的特性,充分显示此类群生长发育状态良好。

表2 不同基因型羔羊初生重及6月龄、12月龄体重与体尺比较
2.3 横交固定FecB基因对初产母羊产羔数的影响
应用FecB基因选择提高产羔率,选择5只F1理想型B+基因型公羊与无亲缘关系的携带不同基因型的136只母羊配种,并对其中41只母羊产羔情况跟踪观察。由表3可知,41只母羊产羔64只,产羔率156%。其中BB基因型1只,产羔2只,产羔率200%;B+基因型29只,产羔50只,产羔率172%;++基因型11只,产羔12只,产羔率109%;B+基因型与野生型(++)相比产羔率提高了63个百分点,差异极显著(P<0.01)。以上研究表明,多胎基因FecB分子标记技术,可以用于对绵羊产羔数的辅助选择。因此,在开展横交固定及选育过程中,应优先选择携带多胎基因的公、母羊配种,以利于增加哈萨克羊新类型的多胎型。
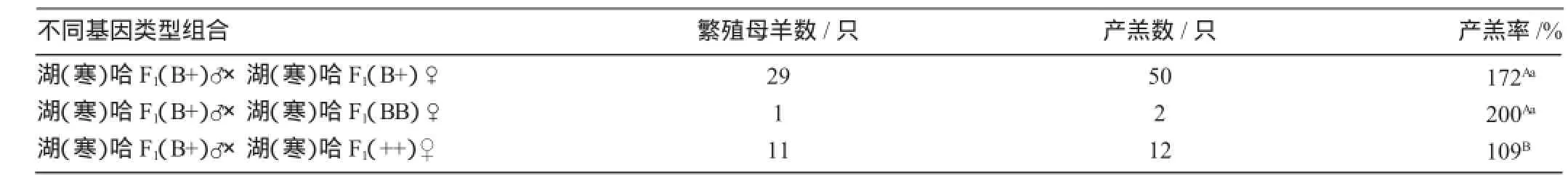
表3 横交组合FecB基因型对初产母羊产羔率的影响
2.4 哈萨克羊新类型繁殖性能
参与肉羊新类型培育的母本是本地哈萨克羊,属季节性发情,通过对哈密市牧祥养殖专业合作社湖(寒)哈杂交F1羊的跟踪调查,41只母羊产羔率156%(64/41),繁殖成活率146%(60/41)。原因在于初产母羊配种年龄较小、存在奶水不足等问题,导致羔羊死亡、繁殖成活率有所下降。F1母羊表现为早熟、常年发情、配种、产羔等特点。
2.5 哈萨克羊新类型培育与适应性观察
2.5.1 体型外貌 培育中的哈萨克羊多胎新类型,毛色为红白花、黑白花、白色等,以杂色居多。体型中等,结构匀称,背腰平直,四肢较高且结实。尾部呈现桃型,个别出现下垂尾,下一步应采用含有FecB基因的萨福克羊进一步杂交改良。
2.5.2 适应性观察 哈密是典型的温带大陆性干旱气候,昼夜温差大,风沙多。经观察哈萨克羊多胎新类型能在哈密山区生态条件下放牧,合群性强,能够忍受营养上的四季变化,生长性能较好,繁殖力超过哈萨克羊,采食速度快、范围广、不挑食。在舍饲养殖条件下各项生理指标在合理区间,发病率低。
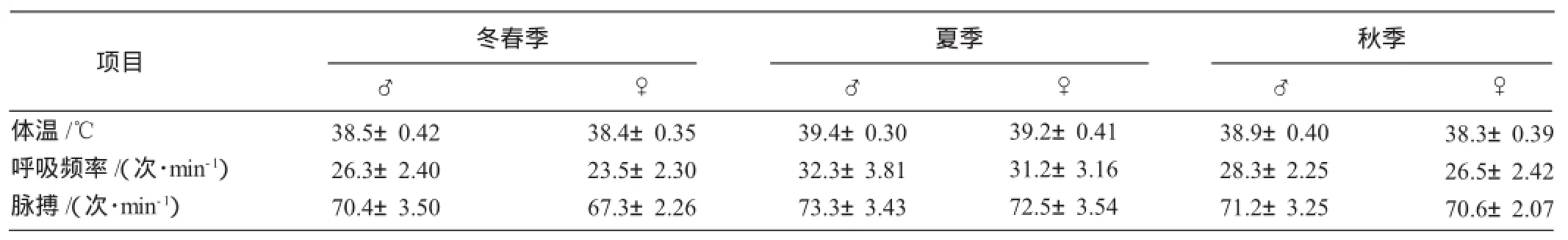
表4 各季节生理指标
3 讨论与小结
(1)绵羊多胎基因(FecB)的位点被定位在第6号染色体上,FecB基因是绵羊高繁殖力BMPR-IB基因突变的结果,具有提高排卵数和产羔数的生物学作用。本实验选用10只FecB基因突变BB基因型公羊与本地哈萨克母羊配种,抽样检测多胎基因型(BB)及杂合型母羔频率为0.78,公羔频率为0.86。检测横交F2羊64只,B+基因型频率为0.67;BB基因型频率为0.08,++基因型频率为0.25。但湖(寒)哈杂交F1羊及横交F2羊基因型频率差异均不显著(P>0.05)。检测结果表明,含FecB基因羊与哈萨克母羊杂交后,FecB基因显性效果好,遗传性能较为稳定,导入效果十分显著。
(2)关于FecB基因是否影响羔羊初生重和羔羊发育生长,目前还没有统一结论。本研究数据表明,BB基因型羔羊初生、6月龄、12月龄体重均低于B+、++基因型羔羊,但差异均不显著(P>0.05)。此结果与Kumar等[6]、WillingG等[7]的报道基本一致。
(3)哈萨克多胎新类型是选用小尾寒羊种公羊和湖羊种公羊与本地哈萨克母羊进行杂交,同时采用多胎基因FecB分子标记技术与常规育种技术,组建理想型育种群,通过选育选配、横交固定,初步培育出了哈萨克羊多胎新类型。该类型具有较高繁殖力,在舍饲条件下各项生理指标正常,发病率低,能很好地适应本地气候环境;缺点是个别羊出现下垂尾,不利于自然交配,毛色不一,繁殖性能不太稳定等问题,在今后的培育中有待继续完善与提高。
[1] Souza C J,Macdougall C,Campbell B K,et al.The Booroola(FecB)phenotype is associated with a mutation in bone morphogenetic receptor typeIB(BMPR1B)gene[J].Endocrinol,2001,169(2):1-6.
[2] Wilson T,Wu J L.Highlyprolific Booroola sheep have a mutation in the intracellular kinase domain of bone morphogenetic protein IB receptor(ALK-6)that is expressed in both oocyes and granulose cells[J].BiologyofReproduction,2001,64:1225-1235.
[3] 王根林,毛鑫智,Davis GH,等.DNA分析发现我国湖羊和小尾寒羊存在Booroola(FecB)多胎基因[J].南京农业大学学报,2003,26(1):104-106.
[4] 柳淑芳,姜运良,杜立新.BMPR-IB和BMPl5基因作为小尾寒羊多胎性能候选基因的研究[J].遗传学报,2003,30(8):755-760.
[5] 储明星,狄冉,叶素成,等.绵羊多胎主效基因FecB分子检测方法的建立与应用[J].农业生物技术学报,2009,17(1):52-58.
[6] Kumar S,Mishra A K,Kolte A P.Effects of the Boorla(FecB)genotypes on growth performance,ewe,s productivity efficiency and litter size in Garole Malpura sheep[J].Animal Reproduction Science,2008,105(3-4):319-331.
[7] Walling G A,Dodds K G,Galloway S M,et al.The consequences of carrying the Booroola fecundity(FecB)gene on sheep live weight[C]// Proceedingofthe British SocietyofAnimal Science.2000:43-47.
Study on the Breeding of Fecundity Type of Kazak Sheep
LuoShengjin
(Hami Animal HusbandryStation,Hami 839000,Xinjiang,China)
In order to breed an ideal fecundity type of Kazak sheep,Small Tail Han sheep and Hu sheep,containing FecB gene(multiple gene),were used as male parents.The results showed that the frequencies of B allele and+allele in F1were 0.58,0.42 respectively,thefrequenciesofBalleleand+alleleinF2were0.41,0.59respectively.Therewerenosignificantdifferencesinthebirth weight,sixmonthweightandtwelvemonthweightamongtheeweswithdifferentFecBgenotypes(BB,B+,++)(P>0.05),sowerethe body height,body length,chest circumference and tube around at the age of 6,12 month(P>0.05).The lambing rate and the reproductive survival rate ofF1were 159%(64/41)and 146%(60/41)respectively,the lambing rates of ewes with BB,B+,++ genotypeswere200%(2/1),172%(50/29),109%(12/11)respectively;comparedwiththelambingrateofgenotype++,the lambing rateofgenotypeB+washigherby63percentagepoints(P<0.01).Throughselectivebreedingandcrossingfixation,thefecunditytype ofKazak sheep was established initiallyand it was suitable tothe local ecological environment.
Kazak sheep;FecB gene;fecunditytype;breeding;Small Tail Han sheep;Hu sheep
S826.2
A
2095-3887(2016)03-0017-04
10.3969/j.issn.2095-3887.2016.03.005
2016-02-23
新疆维吾尔自治区科技厅高技术项目(2013110101)
罗生金(1973-),男,高级兽医师,执业兽医师,硕士,主要从事畜牧业科技推广与临床动物疫病诊治工作。
