过表达Lcy-b基因对烟草类胡萝卜素代谢及香气物质的影响
2016-11-23杨永霞张嘉炜张洪映张松涛贾宏昉崔红
杨永霞,张嘉炜,张洪映,张松涛,贾宏昉,崔红
国家烟草栽培生理生化研究基地 河南农业大学烟草学院,郑州市文化路95号 450002
生物技术
过表达Lcy-b基因对烟草类胡萝卜素代谢及香气物质的影响
杨永霞,张嘉炜,张洪映,张松涛,贾宏昉,崔红
国家烟草栽培生理生化研究基地 河南农业大学烟草学院,郑州市文化路95号 450002
为揭示类胡萝卜素代谢关键基因番茄红素β-环化酶基因(Lycopene beta-cyclase,Lcy-b)对类胡萝卜素及香气物质代谢的影响,通过同源克隆法获得烟草品种K326Lcy-b基因cDNA全长序列。采用农杆菌介导法导入烟草,测定Lcy-b过表达对类胡萝卜素各组分及烤后样香气物质含量的影响。序列分析表明:K326Lcy-b基因包含一个1503bp的开放读码框(ORF),编码500个氨基酸。预测蛋白二级结构以α螺旋和无规则卷曲为主,蛋白质分子量为56.06KDa,理论等电点(pI)为6.98。部分过表达阳性植株Lcy-b基因的表达量显著高于对照,类胡萝卜素组分中的β-胡萝卜素、新黄质、紫黄质比例增加,叶黄素所占比例降低。过表达植株烤后样β-胡萝卜素降解产物显著高于对照,而叶黄素降解产物则低于K326对照或与对照相当。研究结果说明Lcy-b过表达可以改变烟草类胡萝卜素组分比例,影响烤后烟叶香气物质含量。
烟草;Lcy-b基因;过表达; 类胡萝卜素;香气物质
类胡萝卜素是重要的光辅助色素,在光吸收和防止光氧化方面起着重要作用[1-2]。类胡萝卜素是烟草许多生理活性物质尤其是重要致香物质的前体物,其降解产物的种类及含量与烟叶品质有关[3]。在烟叶总挥发性香气成分中,类胡萝卜素降解产生的香味物质是影响烟叶香气质和香气量的重要组分[4]。关于烟草类胡萝卜素的代谢途径已有详细综述[5],在类胡萝卜素生物合成途径中,番茄红素可以在番茄红素β-环化酶(LCY-b)和番茄红素ε-环化酶(LCY-ε)的催化下发生环化作用,形成 β-胡萝卜素(β分支)和α-胡萝卜素(α分支)(见图1),这是类胡萝卜素合成途径中的关键分支点,α分支最终生成叶黄素,β分支最终生成紫黄质、新黄质等产物[6]。研究表明,Lcy-b基因编码番茄红素 β-环化酶,过表达Lcy-b基因烟草的耐盐和耐旱能力提高[7-8];过表达Lcy-b基因番茄的番茄红素含量减少;Lcy-b转录后基因沉默则会导致Lcy-b基因表达下调、β-胡萝卜素和叶黄素含量降低[9-10]。强光会诱导小麦Lcy-b基因强烈表达,β-胡萝卜素含量增加[11]。而 α 支路编码番茄红素ε-环化酶的Lcy-ε基因被干扰时下游产物叶黄素明显下降,处于 β 支路的 β-胡萝卜素含量却有所增长,植物的抗盐性能力也提高[12]。对两条支路关键基因的调控会影响支路(上)下游的物质代谢,调控Lcy-b基因对烟草中类胡萝卜素降解产生的香气物质的影响未见相关报道。本研究从烟草品种 K326 中克隆了Lcy-b基因,采用in-fusion方法构建Lcy-b基因过表达载体,农杆菌介导法转化烟草植株,探讨Lcy-b过表达对烟草香气物质代谢的影响,从而为调控烟草类胡萝卜素代谢,改善烟草香气品质提供理论基础。

图1 植物类胡萝卜素合成途径示意图Fig.1 Schematic diagram carotenoid biosynthesis pathway in plants
1 材料和方法
1.1 Lcy-b基因的克隆及序列分析
1.1.1 Lcy-b基因的克隆
试验材料为烟草品种 K326,按照 Invitrogen 公司 TRIzol RNA提取方法及反转录说明书提取烟草叶片总 RNA ,并反转录为cDNA。参考 GenBank 收录的烟草品种SamsunLcy-b基因序列(X81787.1),采用Primer Premier 5.0软件设计烟草品种K326Lcy-b全长基因扩增引物 F1/R1 (引物序列见表1)。PCR程序为:94℃ 5 min;94℃ 30 s,56℃ 30 s,72℃ 50 s,35个循环,72℃ 10 min。PCR 扩增产物采用 1% 琼脂糖凝胶电泳分离。回收纯化后送 Invitrogen 公司测序。
1.1.2 Lcy-b基因的生物信息学分析
利用NCBI网站的BLAST和ORF finder进行核苷酸序列比较和开放阅读框分析。采用DNAstar和Expasy Protparam软件推测该基因编码的氨基酸序列、蛋白质分子量和等电点。利用Conserved Domains和SMART软件进行蛋白质结构功能域预测。使用在线工具SOPMA进行蛋白质的二级结构预测。
1.2 过表达载体的构建及转基因植株的获得
采用in-fusion方法构建Lcy-b基因过表达载体pCAMBIA-NPT-Lcy-b,利用Primer Premier 5.0设计引物F2/ R2 (表1)。引物的5’末端分别包含与载体末端相同的17/16个碱基序列,引物的3’末端包含与目的基因片段相互补的特异碱基序列。以测序正确的阳性菌落摇菌扩繁后提取的pMD19-T-Lcy-b质粒为模版,扩增含有SpeI 和 EcoR I 酶切位点的 K326Lcy-b基因,用限制性内切酶SpeI-HF和EcoR I-HF双酶切pCAMBIA-NPT载体,回收目的片段后连接,得到pCAMBIA-NPT-Lcy-b过表达载体重组质粒,转化大肠杆菌感受态细胞 DH5α,挑选阳性克隆,菌落 PCR 及测序正确后,冻融法将构建好的pCAMBIA-NPT-Lcy-b过表达载体转到农杆菌LBA4404 中,在含有利福平、卡那霉素的 YEB固体培养基上筛选,菌落 PCR 鉴定后叶盘法浸染烟草品种K326叶片。共培养基上暗培养2~3 d后,用无菌水(含cef500)洗苗,在含有卡那霉素的分化培养基上进行阳性筛选,待芽长到 1~2 cm时,移至含卡那霉素的生根培养基上培养,得到T0代幼苗。将幼苗移到营养土中培养。
1.3 转基因植株的检测
1.3.1 转基因植株DNA的PCR鉴定
采用CTAB法提取转化苗及未转基因对照烟苗DNA,以其为模板,用包含Lcy-b基因起始密码子的引物F3和过表达载体序列的检测引物R3进行PCR验证,Lcy-b过表达质粒DNA为阳性对照,未转化植株叶片DNA为阴性对照,检测T0代转化苗中Lcy-b基因的转化情况。
1.3.2 转基因植株Lcy-b基因的表达分析
根据 K326Lcy-b基因 cDNA 序列设计Real Time PCR引物F4/R4,转基因叶片总RNA的反转录cDNA为模板,以烟草组成型表达的L25基因 (F5/R5)为内参。参照Invitrogen公司的Real MasterMix(SYBR Green)试剂盒说明书进行反转录实时定量PCR (Reverse Transcription Quantitative Real-Time PCR, RT-qPCR),每个样品3次重复。RT-qPCR 数据采用2-ΔΔCt算法进行分析,假设目的基因表达量是对照的N倍,N = 2-ΔΔCt,ΔΔCt = Treat(Ct样品 - Ct L25) - CK(Ct样品 - Ct L25)。

表1 引物序列Tab.1 Primer sequences
1.4 烟叶质体色素及香气成分的检测方法
将转基因阳性株系的无菌苗进行快繁,叶片剪成约1 cm2的小块,置于分化培养基(MS+IAA0.1+BA1.5+Kan30)上28℃进行培养,每15 d左右换一次培养基。待转基因苗不定芽长到1~2cm 时,转移到生根培养基(MS+ Kan30+NAA0.1)上生根,生根后长出7~8片叶时转移到含有育苗基质的漂浮盘上进行培养,之后将快繁后的T0代转基因植株移栽至大田,以K326做对照,用于质体色素和香气成分的检测。
1.4.1 烟叶质体色素含量的检测
在烟株旺长期和成熟期,取中部叶,-80℃冰箱冷冻后,用冻干机进行冷冻干燥处理,参照中华人民共和国烟草行业标准YC/T382-2010[13]烟草及烟草制品中质体色素的高效液相色谱法测定。
1.4.2 烤后样香气成分的检测
每个转基因T0代株系选取烟株长势、烟叶的叶色、叶片大小相对一致、成熟度基本相同的中部叶片,采用热动密集烤房,以三段式烘烤工艺烟夹挂杆烘烤。烘烤参数:变黄期36~42℃,36h;定色期42~55℃,50h;干筋期:55~72℃,50~60h。
烤后样选取C3F烟叶,参考文献[14]采用“水蒸气蒸馏、二氯甲烷溶剂萃取”法进行前处理,用HP5890II-5972气质连用仪对样品采用内标法进行定性分析。
1.5 数据处理
试验数据采用SPSS17.0软件进行单因素方差分析,由新复极差法分析均值差异的显著性, 显著性水平P< 0.05,以a、b、c 、d和e表示其差异性,数字后不含有相同字母表示差异有统计学意义;采用Excel 2013 软件绘图制表。
2 结果与分析
2.1 Lcy-b基因的克隆及序列分析
2.1.1 Lcy-b基因的克隆
采用TRIzol RNA提取法获得28S和18S比例较好的K326 RNA,同源克隆法得到1600 bp左右的片段(图2),回收相应片段,测序验证后获得基因全长序列1525 bp。

图2 Lcy-b扩增电泳检测图Fig.2 PCR amplification of Lcy-b
2.1.2 Lcy-b 基因的生物信息学分析
对克隆获得的序列进行ORF finder分析,该序列包含5’端 UTR 2 bp,3’端 UTR 20 bp,含有一个1503 bp的完整开放读码框(ORF),GC含量为 41.25 %。与NCBI收录的烟草品种Samsun(X81787.1)和Virginia Gold#1(KC484706)Lyc-b基因相似性均为 99%,仅有一个碱基的差异,证明该序列为 K326Lyc-b基因。生物信息学分析预测该序列编码500个氨基酸,其中碱性氨基酸 (Arg、Lys) 57个,强酸性氨基酸 (Asp,Glu) 59个,蛋白质分子量为 56.06KDa,理论等电点 (pI) 为6.98。应用 Conserved Domains 在线分析软件预测该基因编码的蛋白含有 LCY-b蛋白家族保守结构域。详见图3。

图3 LCY-b蛋白质结构域分析Fig.3 Protein domain analysis of LCY-b
蛋白二级结构预测表明,K326 LCY-b蛋白质二级结构中含有 35% 的 α 螺旋、21.8%的延伸链、9.4%的 β 折叠,33.8 % 的无规则卷曲。 LCY-b蛋白二级结构以α 螺旋和无规则卷曲为主。
2.2 转基因烟草植株的阳性检测
当转化苗长到8~10片叶时,提取全基因组DNA,以Lcy-b基因检测引物F3/ R3进行PCR检测,有6个株系扩增片段长度符合预期大小(1909 bp,其中包含基因全长序列1503 bp,过表达载体序列406 bp)(如图4)。提取转基因阳性植株叶片总RNA,反转录为cDNA后,应用RT-qPCR分析Lcy-b基因的表达,六个转基因株系中2、3、5Lcy-b基因表达量显著高于K326对照,株系4、6表达量显著低于K326对照,这可能是由于转基因插入位点的随机性,插入位点破坏了内源基因的完整性,进而导致内源基因表达量降低(如图5)。

图4 转基因植株的DNA检测Fig.4 DNA detection of transgenic plants

图5 Lcy-b过表达株系的基因表达检测Fig.5 Expression analysis of Lcy-b in transgenic plants
2.3 转基因株系的类胡萝卜素含量及烤后样中性致香物分析
选取过表达成功的转基因株系2、3、5,检测生长发育过程中转基因烟株中部叶的类胡萝卜素含量,测定烤后样中性致香物含量。
2.3.1 类胡萝卜素含量变化
由图6可知,除转基因株系3外,旺长期转基因各株系类胡萝卜素总量显著高于未转基因对照,成熟期差异不显著。从类胡萝卜素各组分来看,旺长期转基因中β-胡萝卜素、新黄质、紫黄质含量均高于K326,株系2和5均达显著水平。旺长期叶黄素含量株系2差异不明显,株系3显著低于对照。成熟期转基因株系3叶黄素含量显著低于K326对照,其余株系类胡萝卜素各组分与K326差异不显著。

图6 转基因株系类胡萝卜素含量Fig.6 Carotenoid contents in transgenic plants
2.3.2 类胡萝卜素组分变化比较
类胡萝卜素各组分分析结果如图7所示,在旺长期,各株系β-胡萝卜素/叶黄素、紫黄质/叶黄素和新黄质/叶黄素均显著高于CK。成熟期,β-胡萝卜素/叶黄素、新黄质/叶黄素与CK差异不明显,株系2和3的紫黄质/叶黄素显著高于CK。结合对类胡萝卜素各组分含量的分析结果可知,Lcy-b基因的过表达提高了类胡萝卜素中β-胡萝卜素、新黄质、紫黄质的组分比例和含量;此外,过表达株系叶黄素含量虽然总体变化不明显,但是由于类胡萝卜素其它组分增加,导致叶黄素在类胡萝卜素组分中所占的比例降低。

图7 转基因株系类胡萝卜素组分变化Fig.7 Carotenoid component changes in transgenic plants
2.3.3 烤后样中性致香物含量测定
香气物质含量测定结果显示,转基因株系5烤后样中性致香物总量和新植二烯含量显著高于K326对照,其余株系差异不显著;棕色化反应产物与对照相比差异均不显著;苯丙氨酸类香气成分均显著低于K326对照;类西柏烷类香气成分株系2显著高于K326,株系5与K326含量相当,株系3显著低于K326。类胡萝卜素降解产物总量株系2和株系5显著高于K326对照。
烟叶中β-胡萝卜素主要降解产物有β-二氢大马酮、香叶基丙酮、二氢猕猴桃内酯、β-环柠檬醛、藏花醛等[4],其中前四种物质含量较多,香气贡献大,本研究中将其作为β-胡萝卜素代表产物进行分析;叶黄素主要降解产物为巨豆三烯酮(4种同分异构体)、β-大马酮和氧化异佛尔酮等[4],其中巨豆三烯酮和β-大马酮含量最多,由于β-大马酮是叶黄素和新黄质的共同降解产物,本研究中将巨豆三烯酮作为叶黄素代表产物。如图8所示,转基因株系中类胡萝卜素降解产物组分有所变化,株系2和5中β-胡萝卜素降解产物代表产物总量显著高于K326,而转基因株系中叶黄素降解产物代表物质总量与K326相当。
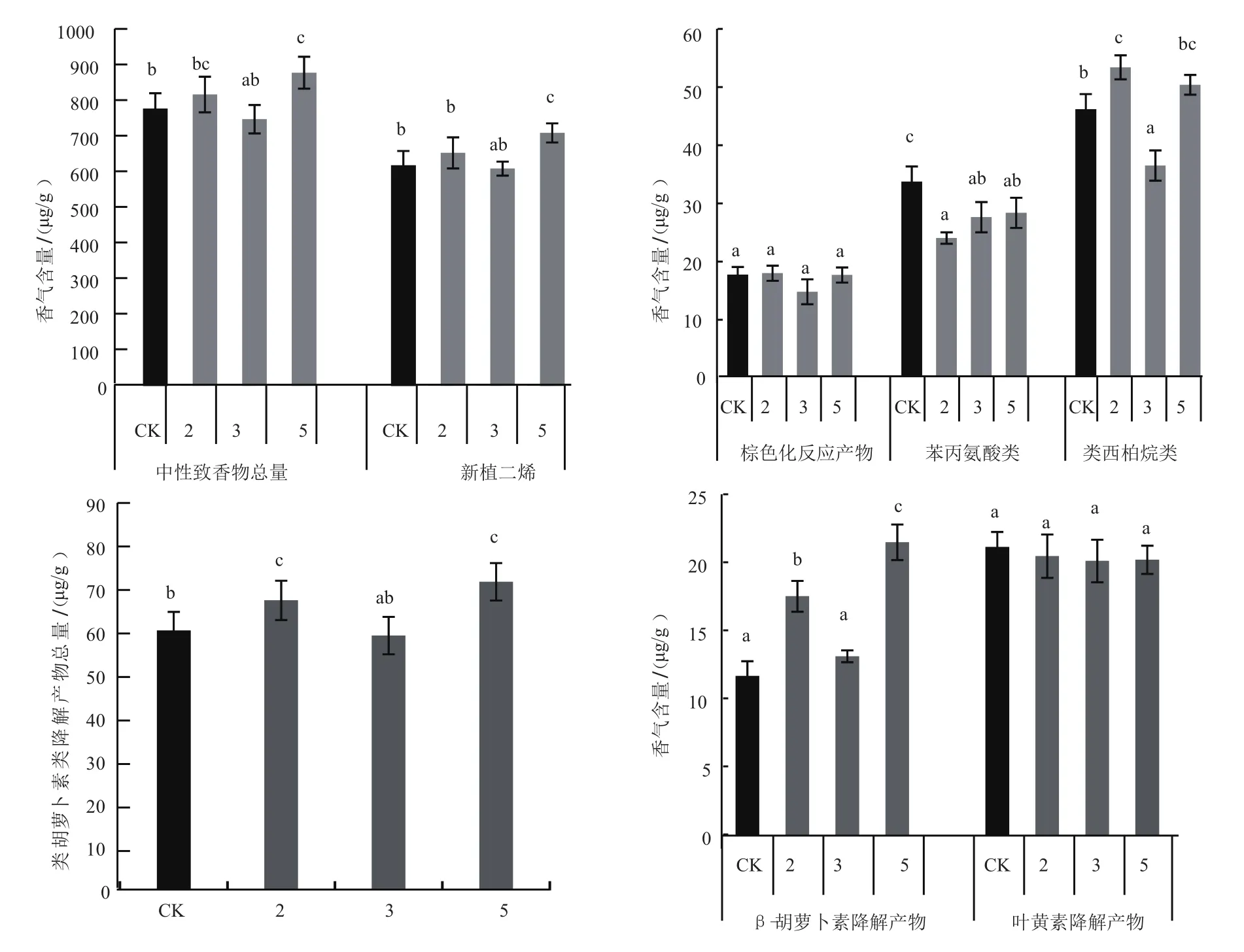
图8 转基因株系香气物质含量Fig.8 Content of aroma substances in transgenic plants
3 结论与讨论
Lyc-b基因是烟叶类胡萝卜素合成途径β-分支中合成β-胡萝卜素、紫黄质、新黄质的关键基因,其中β-胡萝卜素由γ-胡萝卜素在Lcy-b基因作用下直接形成,推测Lyc-b基因的过表达会影响烟叶类胡萝卜素合成途径中β-支路上相关产物的合成,使β-胡萝卜素、紫黄质、新黄质含量提高,导致类胡萝卜素组分的变化。基于此假设,本研究采用同源克隆法克隆了烟草Lcy-b基因,并对其进行生物信息学分析,结果发现K326Lcy-b基因包含一个1503 bp的开放读码框(ORF),与香料烟巴斯玛和烤烟弗吉尼亚品种的Lcy-b基因仅有一个碱基的差异,该基因编码500个氨基酸,预测蛋白质分子量分别为56.06 KDa,理论等电点(pI)为6.98。蛋白二级结构预测显示以α螺旋和无规则卷曲为主。过表达Lcy-b基因烟草植株的荧光定量PCR结果显示,株系2、3、5 的Lcy-b基因表达量显著提高,并在旺长期相应的提高了类胡萝卜素总量及β-分支代谢产物β-胡萝卜素、新黄质、紫黄质的含量及组分比例,其中对β-胡萝卜素含量的影响最为显著,而 α-分支代谢产物叶黄素的含量(及组分比例)不变或者减少。已有的研究表明,植物通过控制LCY-b和LCY-ε两种环化酶的相对数量以及相对活性来调节不同具环类胡萝卜素的数量、组分及种类[15],而LCY-b酶在两条环化途径中起主导作用[16-17],植物中过表达Lcy-b基因可能会导致番茄红素含量减少, α-分支LCY-ε底物量减少,进而影响下游代谢产物叶黄素的含量。对烤后样香气成分的分析表明,Lcy-b基因过表达株系的β-胡萝卜素降解产物β-二氢大马酮、β-环柠檬醛、香叶基丙酮、二氢猕猴桃内酯等明显增加。而叶黄素降解产物巨豆三烯酮(四种同分异构体)含量降低或者无显著变化。证实Lcy-b基因过表达可以改变类胡萝卜素合成途径β-分支和α-分支代谢产物的比例,进而影响烤后样类胡萝卜素类降解产物香气物质的含量。本研究还发现,过表达Lcy-b基因对旺长期类胡萝卜素含量影响较大,而对成熟期影响较小,结合对烤后样类胡萝卜素降解产物的分析结果,可以推测,与未转基因对照相比,成熟期转基因烟草植株的类胡萝卜素降解更为充分,可能与转基因植株复杂的转录后时空调控有关。
[1] Giuliano G, Tavazza R, Diretto G, et al. Metabolic Engineering of Carotenoid Biosynthesis in Plants[J]. Trends Biotechnol, 2008,26(3): 139-145.
[2] Tracewell C A, Cua A, Stewart D H, et al. Characterization of Carotenoid and Chlorophyll Photooxidation in Photosystem Ⅱ [J].Biochemistry, 2001,40(1): 193-203.
[3] Maldonado-Robledo G, Rodriguez-Bustamante E, Sanchez-Contreras A, et al. Production of Tobacco Aroma from Lutein.Specific Role of the Microorganisms Involved in the Process[J].Appl Microbiol Biot, 2003,62(5/6): 484-488.
[4] 史宏志,刘国顺,杨慧娟,等. 烟草香味学 [M]. 北京: 中国农业出版社,2011:137-144.SHI Hongzhi, LIU Guoshun, YANG Huijuan, et al. Tobacco flavor[M]. Beijing: China Agriculture Press,2011: 137-144. (in Chinese)
[5] 杨永霞,冯琦,王景,等. 烟草类胡萝卜素代谢的遗传及基因工程研究进展[J].中国烟草学报. 2013,19(1): 90-94.YANG Yongxia, FENG Qi, WANG Jing, et al. Recent advances in tobacco carotenoid metabolism researchand its application in genetic engineering[J]. Acta Tabacaria Sinica, 2013, 19(1): 90-94.(in Chinese)
[6] Cazzonelli C I, Pogson B J. Source to sink: regulation of carotenoid biosynthesis in plants[J]. Trends Plant Sci. 2010, 15, 266-274.
[7] Shi Y, Guo J, Zhang W, et al. Cloning of the Lycopene beta-cyclase Gene in Nicotiana tabacum and Its Overexpression Confers Salt and Drought Tolerance[J]. Int J Mol Sci, 2015, 16(12): 30438-30457.
[8] Chen X Y, Han H P, Jiang P, et al. Transformation of β-lycopene
cyclase genes from Salicornia europaea and Arabidopsis conferred salt tolerance in Arabidopsis and tobacco[J]. Plant Cell Physiol.2011, 52, 909-921.
[9] Rosati C, Aquilani R, Dharmapuri S, et al. Metabolic engineering of beta-carotene and lycopene content in tomato fruit[J]. Plant Journal, 2000, 24(3): 413-419.
[10] Guo F, Zhou W, Zhang J, et al. Effect of the Citrus Lycopene β-Cyclase Transgene on Carotenoid Metabolism in Transgenic Tomato Fruits[J]. PLoS ONE, 2012, 7, e32221.
[11] Zeng Jian, Wang Cheng, Chen Xi, et al. The lycopene β-cyclase plays a significant role in provitamin A biosynthesis in wheat endosperm [J]. BMC Plant Biol, 2015,15:112.
[12] Kim S H,Kim Y H,Ahn Y O, et al. Downregulation of the lycopene epsilon-cyclase gene increases carotenoid synthesis via the beta-branch-specific pathway and enhances salt-stress tolerance in sweetpotato transgenic calli. Physiol Plant, 2013, 147(4): 432-442.
[13] YC/T382-2010, 烟草及烟草制品, 质体色素的测定, 高效液相色谱法[S].YC/T382-2010, Tobacco and tobacco products, Determination of plastid pigments, High performance liquid chromatography method[S]. (in Chinese)
[14] 秦卫普,赵铭钦,瞿永生,等. 不同基因型烤烟烟叶质体色素及其降解产物含量的研究[J]. 江西农业学报,2009,21(11):17-19.QIN Weipu, ZHAO Mingqin, Qu Yongsheng, et al. Study on chromoplast pigment and its degraded products contents in different genotypes of flue-cured tobacco[J]. Acta Agriculturae Jiangxi,2009, 21(11):17-19. (in Chinese)
[15] 梁燕,王鸣,陈杭,等. 植物LYCs的特性功能及其相互关系[J].西北植物学报, 2002, 22(4): 993 -998.Liang Yan, Wang Ming, Chen Hang, et al. The Characteristics Functions and Relationships of LYCs in Plant. Acta Botanica Boreali-Occidentalia Sinica. 2002, 22(4): 993-998. (in Chinese)
[16] Cunningham F X Jr,Gantt E.Genes and enzymes of carotenoid biosynthesis in plants.[J].Plant Mol Biol,1998,49:557-583.
[17] 张建成, 刘和. 植物类胡萝卜素生物合成及其调控与遗传操作[J]. 植物农学通讯, 2007, 23(11): 211-218.Zhang Jiancheng, Liu He. Recent Advances in Carotenoid Biosynthesis, Regulation and Manipulation. Acta Agric Sci Bull,2007, 23(11):211-218. (in Chinese)
Effects of overexpression lycopene beta-cyclase gene on carotenoids metabolism and aroma compounds in tobacco
YANG Yongxia, ZHANG Jiawei, ZHANG Hongying, ZHANG Songtao, JIA Hongfang, CUI Hong
National Tobacco Cultivation, Physiology & Biochemistry Research Centre; College of Tobacco Science, Henan Agricultural University, Zhengzhou, 450002, China
In order to reveal function of lycopene beta-cyclase (Lcy-b) gene in the growth and development of tobacco plants, especially its influence on aroma substance metabolism, full-length cDNA sequence ofLcy-bwas cloned from tobacco variety K326 homology cloning strategy and effects of overexpression of lycopene beta-cyclase gene on carotenoid components and aroma compounds were determined by agrobacterium-mediated transformation. Sequences analysis showed that tobaccoLcy-bcontained 1503-bp open reading frame (ORF) and coded 500 amino acid residues, the calculated molecular mass was 56066.12Da with theoretical isoelectric point (pI) of 6.98. Secondary structure prediction results showed that they were mainly made up of alpha helix and random coil. The expression ofLcy-bgene was significantly higher in some of the transgenic positive plants than that of K326 untransformed control. Correspondingly, the proportion of beta-carotene, neoxanthin and violaxanthin increased and the proportion of lutein reduced. Aroma substance in the cured leaves also displayed that the amounts of beta-carotene degradation products were significantly higher in transgenic positive plants than that of K326 untransformed control while the lutein degradation products were equivalent to or lower than that of K326 control. These results showed thatLcy-bcould change the proportion of carotenoid components and affect the content of aroma components in cured samples.
tobacco;Lcy-bgene; overexpression; carotenoids; aroma compounds
杨永霞,张嘉炜,张洪映,等. 过表达Lcy-b基因对烟草类胡萝卜素代谢及香气物质的影响[J]. 中国烟草学报,2016,22(3)
中国烟草总公司特色优质烟叶开发重大专项浓香型项目(110200902045 TS-01)
杨永霞(1980—),博士,讲师,主要从事烟草生物技术研究,Email:yyx624@126.com
崔 红(1966—),教授,主要从事烟草生物技术研究,Email:cuihonger_13@163.com
2016-03-02
:YANG Yongxia, ZHANG Jiawei, ZHANG Hongying, et al. Effects of overexpression lycopene beta-cyclase gene on carotenoids metabolism and aroma compounds in tobacco [J]. Acta Tabacaria Sinica, 2016, 22(3)
