水飞蓟素PLGA肠溶纳米粒大鼠体内药代动力学研究
2016-11-21邱妍川邢于政杨宗芹朱照静
邱妍川,钟 玲,邢于政,杨宗芹,朱照静,何 静△
(1.重庆医药高等专科学校 401331;2.重庆药友制药有限责任公司 401121)
论著·基础研究 doi:10.3969/j.issn.1671-8348.2016.28.007
水飞蓟素PLGA肠溶纳米粒大鼠体内药代动力学研究
邱妍川1,钟 玲2,邢于政1,杨宗芹1,朱照静1,何 静1△
(1.重庆医药高等专科学校 401331;2.重庆药友制药有限责任公司 401121)
[摘要] 目的 研究水飞蓟素PLGA肠溶纳米粒在大鼠体内的药动学行为。方法 利用高效液相色谱(HPLC)法测定大鼠灌胃市售制剂水飞蓟素片益肝灵片与水飞蓟素PLGA肠溶纳米粒后的血药浓度,并采用3P97药代动力学软件处理数据。结果 在25.3~5 051.0 ng/mL范围内,水飞蓟宾血药浓度呈线性关系,r=0.999 9,日内、日间精密度RSD均小于8.5%;灌胃给药水飞蓟素PLGA肠溶纳米粒后,药-时曲线符合二室模型,药代动力学参数Cmax为(2 255.84±315.44)ng/mL,t1/2β 为(13.85±2.29)h,相对益肝灵片的生物利用度为126%。结论 本方法准确、简单、专属性好,适合大鼠血浆中水飞蓟素PLGA肠溶纳米粒药代动力学学研究。水飞蓟素PLGA肠溶纳米粒提高了口服生物利用度。
水飞蓟素;水飞蓟宾;药代动力学
[Abstract] Objective To investigate the pharmacokinetics of enteric coated silymarin-PLGA nanoparticles in rats.Methods Rats were given silymarin tablets and enteric coated silymarin-PLGA nanoparticles by intragastric administration.The HPLC method was established to detect drug concentration in plasma of rats,and the obtained data were processed with 3P97 software.Results In 25.3-5 051.0 ng/mL range,silybin plasma concentration showed a linear relation,r=0.999 9,the intra- and inter- precisions(RSD)were all lower than 8.5%.The concentration-time curve was fitted to a 2-compartment model,the pharmacokinetic parameters of the enteric coated silymarin-PLGA nanoparticle were as follows:Cmax was(2 255.84±315.44)ng/mL,t1/2β was(13.85±2.29)h,and the relative bioavailability espectively was 126%.Conclusion The method is accurate,simple and reproducible.It is fit to study the pharmacokinetics of the enteric coated silymarin-PLGA nanoparticle in plasma of rats.The enteric coated silymarin-PLGA nanoparticle could improve the oral bioavailability significantly.
水飞蓟素是从菊科植物水飞蓟果实中分离提取得到的,包含水飞蓟宾、水飞蓟宁、水飞蓟亭等成分的一类黄酮化合物的总称,其中,水飞蓟宾含量最高、药理活性最强[1-2]。临床上,水飞蓟素对慢性肝炎,各种肝损伤、肝纤维化和早期肝硬化等肝脏疾病有较好治疗作用[3-4],目前,市售制剂主要为普通口服制剂,但由于其难溶于水,口服后生物利用度低,影响了药物的治疗作用[5-6]。
肠溶纳米粒(enteric nanoparticles)是近年来发展的一项新技术,由于其能延长药物滞留时间,促进药物与肠壁接触,且使药物以分子状态分布于肠溶载体,提高了药物稳定性及口服生物利用度,得到了越来越多的关注[7-9]。本实验在前期研究制备得到水飞蓟素PLGA肠溶纳米粒自制制剂的基础上,选用含量最多,药理活性最强的水飞蓟宾作为指标成分,研究了自制制剂与市售制剂水飞蓟素片给药后大鼠体内药代动力学行为,比较了二者药代动力学参数与生物利用度的差异。
1 材料与方法
1.1 仪器 日本Shimadzu LC-2010C HT高效液相色谱(HPLC)仪;Min1512台式高速离心机(珠海黑马医学仪器有限公司);CP225D电子天平(德国赛多利斯公司),QL-901 旋涡混匀器(海门市其林贝尔仪器制造有限公司);LG-50F冷冻干燥机(湖南恒诺仪器设备有限公司);超速离心机(美国贝克曼库尔特有限公司);F1-A10超纯水器(默克密理博公司);Sartorius BS210S电子天平(德国Sartorius 公司);Eppendorf移液器(德国Eppendorf公司)。
1.2 药品与试剂 水飞蓟素(西安瑞林生物科技有限公司,纯度大于98%);水飞蓟宾对照品(中国食品药品检定研究院,批号:110856-200604),柚皮素(上海佳和生物科技有限公司,纯度99.6%);水飞蓟素片(商品名:益肝灵片,规格:38.5 mg,沈阳东陵药业股份有限公司);乳酸-乙醇酸共聚物PLGA(中科院成都有机化学研究所);羟丙甲纤维素邻苯二甲酸酯HPMCP(HP55,黏度40 cpa.s,日本信越化学工业株式会社);聚乙烯醇PVA(美国Sigma-Aldrich公司);β-葡萄糖醛酸酶(美国Sigma公司);乙醚(天津市科密欧化学试剂有限公司);丙酮(化学纯,重庆川江化学试剂厂);甲醇(色谱纯,美国Fisher公司)。自制水飞蓟素PLGA肠溶纳米粒:精密称取一定量水飞蓟素、PLGA和HPMCP溶于丙酮中,在磁力搅拌下,快速注入到1% PVA水溶液中,继续搅拌1 h,30 000 r/min高速离心30 min,用蒸馏水洗涤3次后冷冻干燥,得到水飞蓟素肠溶PLGA纳米粒。
1.3 动物 选取SD大鼠12只,健康合格,雌雄各半,体质量(250±30)g,由重庆医科大学动物实验中心提供,试验动物合格证号:SCXK(渝)2012-0001。
1.4 试验方法
1.4.1 色谱条件 色谱柱:Dikma-C18(4.6 mm×150 mm,5 μm);流动相:甲醇∶0.05 mol/L磷酸盐缓冲液(pH值2.77)=48∶52(v∶v);流速1.0 mL/min;检测波长288 nm;柱温30 ℃;进样量20 μL。
1.4.2 内标溶液的配制 精密称取柚皮素10 mg置25 mL 量瓶中,加甲醇溶解并稀释至刻度,制成内标储备液(400 μg/mL)。精密量取内标储备液1.0 mL于100.0 mL量瓶中,加流动相配成内标溶液(4 000 ng/mL)。
1.4.3 对照品溶液的配制 精密称取水飞蓟宾对照品置量瓶中,加甲醇溶解并稀释至刻度,制成水飞蓟宾储备液(50.51 μg/mL)。精密量取水飞蓟宾储备液1.0 mL于100.0 mL量瓶中,加流动相配成水飞蓟宾对照品溶液(505.1 ng/mL)。
1.4.4 血浆样品的处理 取血浆样品200 μL,加入磷酸盐缓冲液400 μL(pH值5.00),用50 μL β-葡萄糖醛酸酶溶液混匀,培育16 h(37 ℃水浴)。加内标溶液50 μL,硼酸盐缓冲液1.0 mL(pH值8.50),加入无水乙醚萃取2次(每次3 mL),离心,分离醚层,合并乙醚层,空气吹干,流动相100 μL 溶解残留,离心,取上清液进样20 μL进行测定。
1.4.5 专属性考察 采用1.4.1色谱条件,分别取空白血浆、对照品溶液及内标溶液进样考察空白血浆、水飞蓟宾、异水飞蓟宾(水飞蓟宾的同分异构体)、内标柚皮素的出峰时间。
1.4.6 血浆中水飞蓟宾标准曲线的建立 精密吸取血浆200 μL,加入水飞蓟宾储备液,使水飞蓟宾血浆样品浓度分别为:25.3、126.3、252.6、505.1、2 526.0、5 051.0 ng/mL,按1.4.3进行样品处理,在1.4.1色谱条件下测定,记录内标峰面积(Ai)并计算水飞蓟宾与异水飞蓟宾峰面积之和(As)与内标峰面积的比值(As/Ai),以水飞蓟宾浓度X对峰面积之比Y(As/Ai)进行回归分析。
1.4.7 最低检测限 分别以空白血浆定量稀释某一浓度的水飞蓟宾,按照1.4.5标准曲线项下操作,测定信号噪音比为3∶1时的浓度即为最低检测限。
1.4.8 回收率试验
1.4.8.1 相对回收率 分别配制含水飞蓟宾低、中、高3种浓度(25.3、505.1、5 051.0 ng/mL)的血浆样品各5份,按1.4.3处理,进样20 μL作HPLC分析,将所得峰面积比代入回归方程算得浓度,与标示浓度相比,即得相对回收率。
1.4.8.2 绝对回收率 分别配制含水飞蓟宾低、中、高3种浓度(25.3、505.1、5 051.0 ng/mL)的血浆样品各5份,按1.4.3处理,进样20 μL作HPLC分析,另用1.4.3处理所得的空白血浆配制相应浓度水飞蓟宾对照品溶液,直接进样,记录峰面积,将所得峰面积相比,即得绝对回收率。
1.4.9 精密度试验
1.4.9.1 日内精密度 分别配制含水飞蓟宾低、中、高3种浓度(25.3、505.1、5 051.0 ng/mL)的血浆样品各5份,按1.4.3处理,进样20 μL作HPLC分析,记录峰面积比,按回归方程计算样品浓度,计算日内精密度。
1.4.9.2 日间精密度 分别连续5 d配制含水飞蓟宾低、中、高3种浓度(25.3、505.1、5 051.0 ng/mL)的血浆样品各1份,按1.4.3处理,进样20 μL作HPLC分析,计算日间精密度。
1.4.10 样品稳定性试验
1.4.10.1 日内稳定性 分别配制含水飞蓟宾低、中、高3种浓度(25.3、505.1、5 051.0 ng/mL)的血浆样品各1份,按1.4.3处理后,常温下保存,在当天0、2、4、8、12、24 h分别进样,计算日内稳定性。
1.4.10.2 冰冻稳定性 分别配制含水飞蓟宾低、中、高3种浓度(25.3、505.1、5 051.0 ng/mL)的血浆样品各6份,置于-20 ℃的冰箱保存,分别在1、2、4、6、12、24 d各取出1份后,按1.4.3处理进样,计算冰冻稳定性。
1.4.11 药代动力学 SD大鼠12只,分成2组(每组6只),禁食12 h,自由饮水。以水飞蓟素32 mg/kg给药量,分别灌胃自制水飞蓟素PLGA肠溶纳米粒及水飞蓟素片(各制剂分别用超纯化水分散后按照剂量灌胃)。分别于0.15、0.35、0.5、1、2、4、6、8、12、24 h取血0.5 mL,肝素抗凝,分离血浆。-20 ℃冷冻保存待用。

2 结 果
2.1 方法可行性考察 在本试验色谱条件下,水飞蓟宾和异水飞蓟宾的保留时间分别约为16.5 min和18.6 min,内标保留时间为22.3 min,血浆中内源性物质不影响药物的分离测定,色谱图见图1。
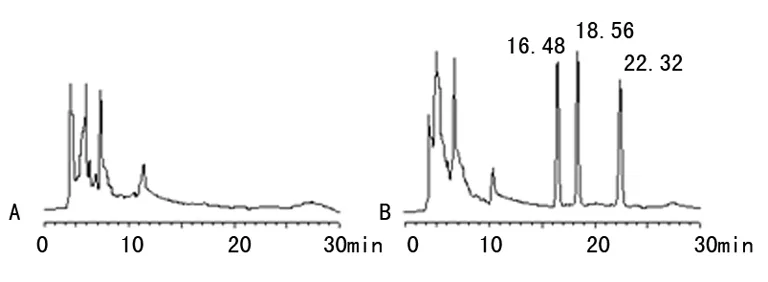
A:空白血浆;B:空白血浆+药物+内标。
图1 大鼠血浆中水飞蓟宾的HPLC图
2.2 血浆标准曲线 以峰面积比值R对血浆浓度C进行线性回归分析。求得线性回归方程R=0.0039C-0.018,相关系数r=0.999 9。结果表明,血浆样品中水飞蓟宾浓度在25.3~5 051.0 ng/mL范围内,峰面积比值与血药浓度具有良好的线性关系。
2.3 回收率 血浆中相对回收率为97.1%~98.5%,见表1,绝对回收率67.6%~72.1%,见表2,相对标准偏差(RSD)均小于10%,满足方法学要求。

表1 血浆中水飞蓟宾的相对回收率(n=5)

表2 血浆中水飞蓟宾的绝对回收率(n=5)
2.4 精密度 血浆样品日内RSD和日间RSD在0.1%~8.5%,均小于10.0%,满足方法学验证要求,见表3。
2.5 样品稳定性 血浆样品日内稳定性考察中浓度变化在97.8%~100.7%,见表4,冰冻稳定性考察中浓度变化在97.4%~100.2%,见表5,满足方法学验证要求。
2.6 最低检测限 以信噪比为3计算,得到水飞蓟宾在血浆中的最低检测限为10 ng/mL。
2.7 药动学研究 图2为12只SD大鼠给药后,获得的血药浓度-时间曲线。3P97软件计算得到两种制剂给药后的药代动力学主要参数,见表6。软件SPSS20.0统计结果显示,药动学参数Cmax,t1/2β,AUC(0~∞)差异有统计学意义。
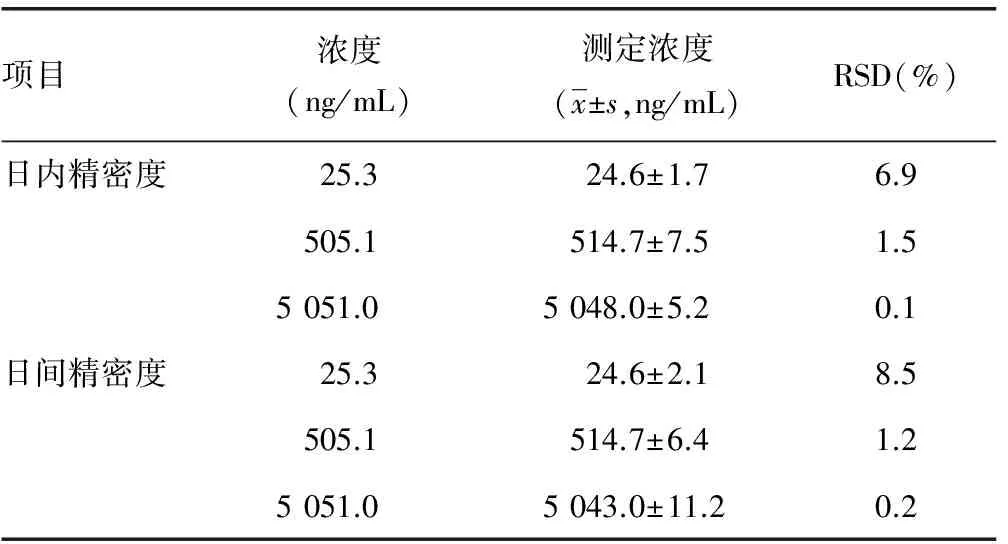
表3 水飞蓟宾在血浆中的精密度(n=5)
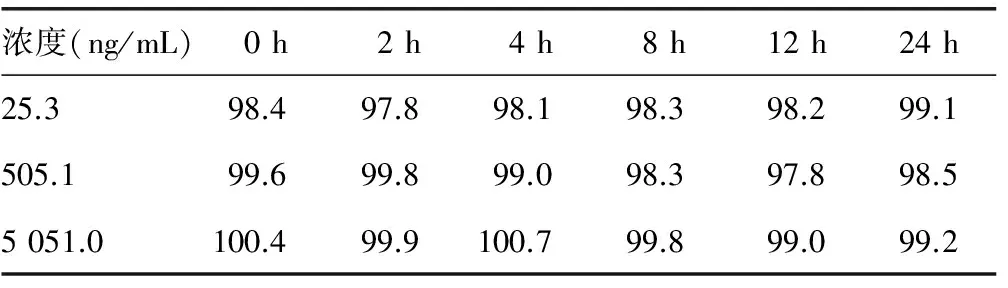
表4 日内稳定性试验结果(%)
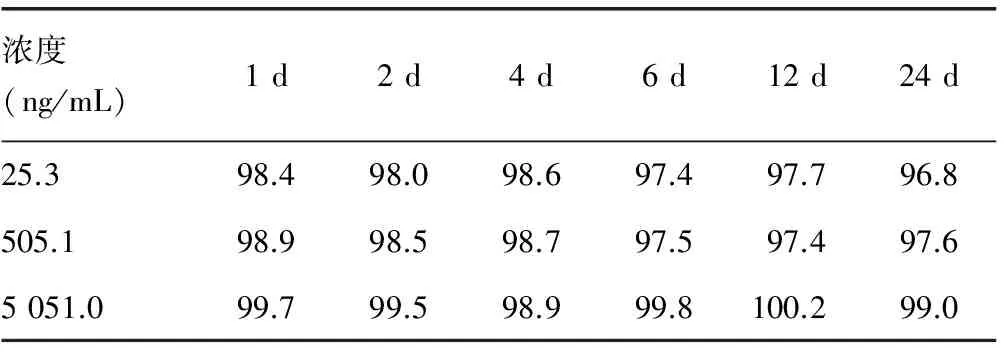
表5 冰冻稳定性试验结果(%)
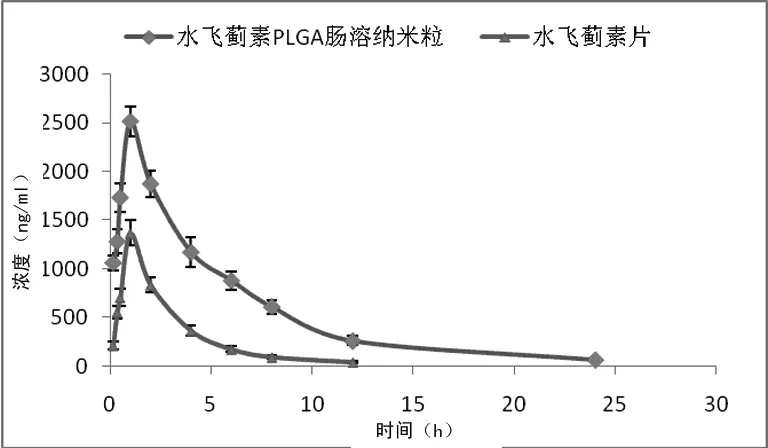
图2 水飞蓟宾血药浓度-时间曲线
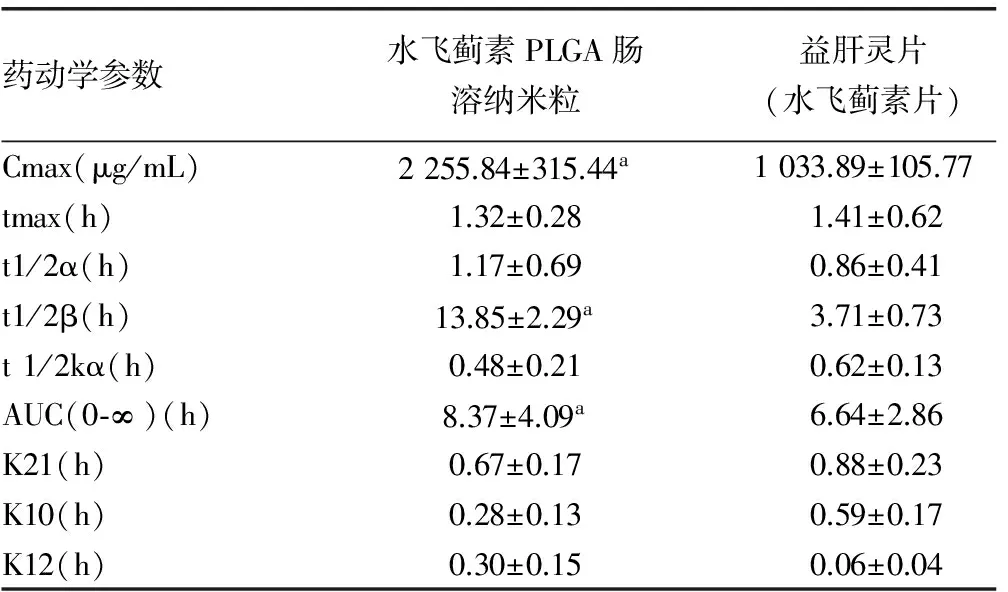
药动学参数水飞蓟素PLGA肠溶纳米粒益肝灵片(水飞蓟素片)Cmax(μg/mL)2255.84±315.44a1033.89±105.77tmax(h)1.32±0.281.41±0.62t1/2α(h)1.17±0.690.86±0.41t1/2β(h)13.85±2.29a3.71±0.73t1/2kα(h)0.48±0.210.62±0.13AUC(0⁃∞)(h)8.37±4.09a6.64±2.86K21(h)0.67±0.170.88±0.23K10(h)0.28±0.130.59±0.17K12(h)0.30±0.150.06±0.04
a:P<0.01,与益肝灵片比较。
3 讨 论
本实验建立了测定大鼠血浆中水飞蓟宾的方法,按照AIC最小原则[10],确定水飞蓟素PLGA肠溶纳米粒大鼠体内药代动力学过程符合二室模型,权重为1/C2,计算得到其药动学参数Cmax=(2 255.84±315.44) mg/mL,t1/2β=(13.85±2.29)h,较市售水飞蓟素片(益肝灵片)明显提高,相对生物利用度F=(AUC自制纳米粒/D自制纳米粒)/(AUC市售制剂/D市售制剂)为126%,表明将水飞蓟素制备成PLGA肠溶纳米粒后,口服吸收得到很大改善,且在检测过程中显示,市售水飞蓟素片(益肝灵片)给药后,24 h未能从血浆中检测出水飞蓟宾,而水飞蓟素PLGA肠溶纳米粒仍能检测到活性成分,表明市售制剂相对于自制水飞蓟素PLGA肠溶纳米粒消除更快。
分析其原因可能如下:(1)水飞蓟素制成PLGA肠溶纳米粒后,平均粒径减小,比表面积增大[11],提升了与肠道接触的机会;同时由于纳米粒的强黏附性,有利于延长药物滞留时间,提高药物口服吸收生物利用度[12-14]。(2)以纳米粒作为载体,改善了药物溶解、润湿状况,且文献报道表明,口服纳米粒可通过肠道内集合淋巴结(约占整个肠道黏膜的25%)[15-16]的微褶皱细胞(M细胞)吞噬,随淋巴细胞通过淋巴管从淋巴循环进入血液循环发挥疗效[17]。
[1]肖衍宇,宋赟梅,陈志鹏,等.水飞蓟素前体脂质体的制备和大鼠药代动力学的研究[J].药学学报,2005,40(7):758-763.
[2]Zeng QP,Liu ZH,Huang AW,et al.Preparation and characterization of silymarin synchronized-release microporous osmotic pump tablets[J].Drug Des Devel Ther,2016,10:519-531.
[3]Vargas MN,Madrigal SE,Morales GA,et al.Hepatoprotective effect of silymarin[J].World J Hepato,2014,6(3):144-149.
[4] Frank JB,Guqi W,Nguyan D,et al.SiIymarin and hepatoprotection[J].J Cent South Univ,2012,37(1):6-10.
[5] Cacciapuoti F,Scognamiglio A,Palumbo R,et al.Silymarin in non alcoholic fatty liver disease[J].World J Hepatol,2013,5(3):109-113.
[6]Kawabata Y,Wada K,Nakatani M,et a1.Formulation design for poorly water-soluble drugs based on biopharmaceutics classification system:basic approaches and practical applications[J].Int J Pharm,2011,420(1):1-10.
[7]DongW,Bodmeier R.Encapsulation of lipophilic drugs with in enteric microparticles by a novel coacervation method[J].International J Pharm,2006,326(1/2):128-138.
[8]Wang XQ,Dai XD,Chen Z,et al.Bioavailability and pharmacokinetics of Cyxlosporine A-loaded pH-sensitive nanoparticles for oral administration[J].J Controlled Release,97(3):421-429.
[9]王路军,邱瑞桂,李建宇,等.葛根素肠溶纳米粒的制备及体外释放度研究[J].解放军药学学报,2009,25(6):514-517.
[10]刘建平.生物药剂学与药物动力学[M].4版.北京:人民卫生出版社,2011.
[11]DoaneT,BurdaC.Nanopartielemediatednon-covalentdrugdelivery[J].AdvDrugDelivRev,2013,65(5):607-621.
[12]富天骄,刘建平,金方,等.胃肠道滞留型微粒释药系统的研究进展[J].中国医药工业杂志,2006,37(3):201-205.
[13]Woodley J.Bioadhesion:possibilities for drug administration[J].Clin Pharmacokinet,2001,40(2):77-84.
[14]Ma Y,He S,Ma X,et al.Silymarin-Loaded Nanoparticles Based on Stearic Acid-Modified Bletilla striata Polysaccharide for Hepatic Targeting[J].Molecules,2016,21(3):265.
[15]王绪兵,易以木.纳米粒胃肠道吸收影响因素[J].中国药学杂志,2002,37(7):484-487.
[16] Lavelle EC,Sharif S,Thomas NW,et al.The importance of gastrointestinal uptake of particles in the design of oral delivery systems[J].Adv Drug Del Rev,1995,18(1):5.
[17]黄雅洁,李雅彬,袁海龙,等.南五味子总木脂素肠溶纳米粒的制备和药代动力学初步研究[J].药学学报,2009,44(9):1046-1050.
Pharmacokinetics of enteric coated silymarin-PLGA nanoparticles in rats
QiuYanchuan1,ZhongLing2,XingYuzheng1,YangZongqin1,ZhuZhaojing1,HeJing1△
(1.ChongqingMedicalandPharmaceuticalCollege,Chongqing400016,China;2.ChongqingYaopharmaPharmaceuticalCo.Ltd.,Chongqing401121,China)
silymarin;silybin;pharmacokinetics
重庆市科技攻关计划基金资助项目(cstc2012gg-yyis10008)。 作者简介:邱妍川(1982-),讲师,硕士,主要从事药物制剂研究。△
R945
A
1671-8348(2016)28-3910-03
2016-06-08
2016-07-09)
