绵羊干扰素tau在毕赤酵母中的表达
2016-11-19邓桂馨梁果义刘京威倪和民
邓桂馨,梁果义,鲁 琳,刘京威,郭 勇,倪和民
(北京农学院,北京102206)
绵羊干扰素tau在毕赤酵母中的表达
邓桂馨,梁果义,鲁 琳,刘京威,郭 勇,倪和民
(北京农学院,北京102206)
干扰素-t au(interferon tau,IFNt)被认为是反刍动物滋养层分泌的,通过启动妊娠识别,参与妊娠建立的信号[1-2]。IFNt由IFNt基因编码,无内含子,属于Ⅰ型干扰素家族的重要亚型[3]。Steward等从绵羊CDNA文库中克隆了全长约1KB的mRNA。Ealy等研究表明,牛IFNt基因全长927 bp,ORF有595 bp[4]。张明等[5]克隆了牛IFNt成熟蛋白CDS区,并对其进行了原核表达和生物学功能研究。由于天然IFNt表达量低、时间短,应用基因工程体外表达生产IFNt,为其广泛应用前景提供了基础。甲醇酵母基因表达系统是一种发展迅速的外源蛋白质生产系统,其中毕赤酵母Pichia pastoris作为基因表达系统使用得最多、最广泛[6]。本研究拟利用毕赤酵母高效表达绵羊IFNt基因,对于我国绵羊妊娠率低,胚胎移植产业化发展滞后,具有一定的科学指导意义。
1 材料与方法
1.1 菌株,载体及试剂
大肠杆菌JM109菌株、毕赤酵母菌株Pichia pastoris GS115;质粒pUC19、pPIC9为本实验室保存。限制性内切酶及T4 DNA连接酶均为TaKaRa公司产品,PCR用Taq DNA聚合酶购自北京天为时代公司,dNTPs购自Promega公司;1 kb和100 bp DNA分子量标准购自全式金生物技术公司;DNA回收试剂盒为Omega公司产品;丙烯酰胺、N,N′-亚甲叉丙烯酰胺、无氨基酸酵母氮源(YNB)、生物素(biotin)、琼脂糖购自Sigma公司;酵母提取物、蛋白胨购自Oxoid公司;其余为国产分析纯试剂。毕赤酵母专用培养基BMMY,BMGY,YPG,RDB等见Invitrogen公司说明书。
1.2 IFNt基因的改造及重组质粒的构建
根据GenBank羊的干扰素tau(oIFN-τ)(NM_001123400. 1)基因核苷酸序列,按照毕赤酵母密码子的偏好性,在不改变其氨基酸序列的前提下对其进行了序列的分子改造,在序列中尽量避免富含AT序列的出现,由苏州金唯智技术公司合成。将合成的IFNt基因重组于载体pPIC9,得到重组质粒pPIC9-IFNt,转化感受态DH5ɑ,提取重组质粒进行Xho I、EcoR I酶切鉴定和测序。
1.3 酵母的电击转化及筛选
将重组质粒pPIC9-IFNt用Bgl II酶切使之线性化,与毕赤酵母GS115感受态混合,用电转仪电击转化毕赤酵母,电压为2.0 kV。立即向电击杯中加入1mL预冷的1mol/L山梨糖醇,温育后涂布RDB平板,每板涂布200μL。倒置平板于28~30℃培养箱,培养2~3 d至转化子出现。通过组氨酸营养缺陷型筛选阳性转化子。
1.4 SDS-PAGE检测及条件优化
重组酵母在50mLBMGY培养基中于28℃摇床培养48 h,离心收集菌体,加入10mLBMMY甲醇诱导培养基悬浮菌体,继续在28℃下诱导培养72~120 h。酵母诱导条件固定培养温度28℃;甲醇诱导浓度0.5%;诱导时间分别为24、48、72、96和120 h,最终选择96 h为最佳优化时间。取各菌株上清液样,SDS-PAGE电泳检测表达情况。
2 结果与分析
2.1 pPIC9-IFNt重组质粒酶切鉴定及测序
合成的IFNt基因与载体构建重组质粒pPIC9-IFNt,经Xho I、EcoR I酶切鉴定,结果表明IFNt基因已整合在酵母染色体上。测序结果表明,序列全长522 bp,与目的基因大小相同,证明质粒构建成功。见图1和图2。
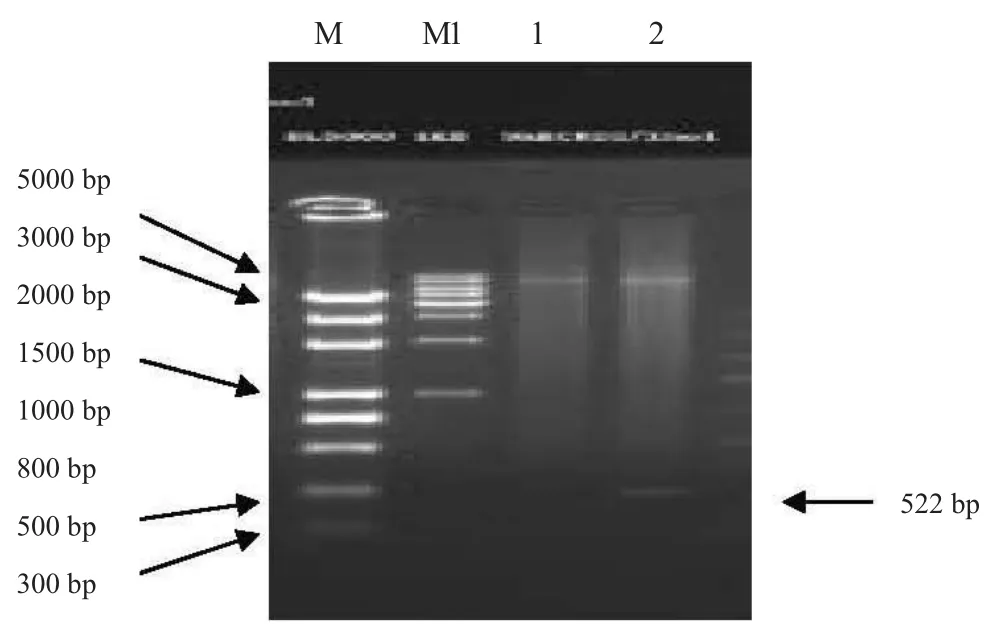
图1 pPIC9-IFNt重组质粒酶切鉴定结果

图2 重组质粒pPIC9-IFNt测序结果
2.2 重组酵母基因组PCR扩增
提取重组到酵母上的基因组DNA,设计引物进行PCR扩增,琼脂糖凝胶电泳检测,扩增产物为522 bp的目的片段(图3),与目的基因大小相同,结果表明pPIC9-IFNt已成功整合到酵母染色体。

图3 PCR扩增产物电泳分析
2.3 重组菌株的诱导表达及条件优化
通过RDB、MM和MD平板筛选,得到表型为his+ muts的克隆子(图4~6)。从80株重组酵母中筛选到26株表达IFNt的重组子。进一步在摇床水平上进行诱导表达,取菌株上清进行SDS-PAGE检测,蛋白条带在18KD左右,与目的蛋白相符(图7)。挑选表达量最高的2株扩大培养并纯化,做SDS-PAGE检测,18KD条带清晰,分泌表达蛋白纯度95%以上(图8)。
图4 RDB平板

图5 MD平板
图6 MM平板

图7 1~5不同菌株IFNtSDS-PAGE检测结果

图8 1~2高表达菌株纯化后的SDS-PAGE检测结果
3 讨论
IFNt在绵羊妊娠识别中发挥着重要作用,通过对PR、ER、PGF2ɑ及UCPR等的调节,完成黄体、子宫内膜和滋养层共同建立的妊娠识别。IFNt以旁分泌的方式作用于子宫内膜,抑制子宫内膜分泌PGF2a,从而阻断黄体溶解,保证妊娠建立[7]。连续向发情绵羊子宫灌注IFNt,检测发现,实验组子宫内膜ER的mRNA水平比对照组低,结果提示IFNt能够抑制ER和OTR转录[8]。研究表明,IFNt诱导的应答因子元件(IRF)能与ER启动子的调控元件结合,ER转录的降低,阻止ER的表达,会进而导致OTR的表达。目前认为IFNt不直接调控PR的表达,但是P抑制ER及OTR在PR阳性子宫内膜深层GE,基质细胞中的表达;IFNt抑制E2诱导的ER及OTR 在PR阴性子宫内膜深层GE,基质细胞中的表达[9]。因此,畜牧业应用基因工程体外表达技术生产具有活性的IFNt成为热点。
1990 年Klemann首先将bIFNt在大肠杆菌中进行了表达[10]。葛丽等[11]利用常规PCR方法获得成熟猪IFNa基因编码区,通过表达载体整合到毕赤酵母染色体中,得到了具有抗病毒活性的重组蛋白。王延群等[12]构建牛的重组质粒pPIC9K-boIFNa,实现了boIFNa在毕赤酵母中的高效表达。目前对IFNt的体外表达研究还不够深入。张明[13]将牛干扰素bIFNt的表达效率和纯化效率作为整体考虑,选择带有His6-Tag的PET-28a(+)高效表达载体,实现表达产物的亲和层析,诱导其在大肠杆菌中表达,建立了bIFNt的重组表达系统。高方方等[14]利用PGEMT载体进行了牛干扰素tau的原核表达及生物功能鉴定研究。
本研究根据GenBank羊的干扰素tau基因核苷酸序列,按照毕赤酵母密码子的偏好性,在不改变其氨基酸序列的前提下,应用DNAWORKS等在线工具,对其进行了序列的分子改造,通过诱导重组质粒pPIC9-IFNt,实现了IFNt在毕赤酵母中的分泌表达,最终通过不同诱导时间梯度优化,确定最终表达条件为:200 r/min,28℃,0.5%甲醇,96 h。应用疏水纯化和离子交换两步纯化法纯化分泌表达蛋白,经SDS-PAGE检测纯度可达95%以上。由于IFNt在本项研究中主要考虑其妊娠调节功能,故未对其抗病毒活性功能进行测定。此外,由于项目期短,未进行大量蛋白表达,其表达质量还需在后续的研究中加强。综上所述,未来真核表达绵羊IFNt基因工程的产业化对于直接或间接改善绵羊妊娠率,增加畜牧经济效益具有非常广泛的前景。
[1]Aida H,Yamaaguehi H,Katsumura M,et al.Identification of interferon tau at the matermal fetal interiface in shiba goats[J].J Repord Dev,1999,45(4):249-257.
[2]Greg A J.Interferon tau and progesterone regulate ubiquity cross-reactive protein expression in the ovine uterus[J].Biology of Reporduction,2000,62:622-627.
[3]Kristina JD,Kamila D,Anthony F.Trophoblast interferon and pregnancy[J].Reproduction,2001,121:41-49.
[4]Ealy A,Yang Q E.Control of interferon tau expression during early pregnancy in ruminants[J].Journal of Reproductive Immunology,2009,61:95-106.
[5]张明,管小斌,朱庆,等.中国黑白花奶牛干扰素tau成熟蛋白基因的克隆与序列分析及牛干扰素tau的分类[J].畜牧兽医学报,2007,38:5-7.
[6]赵翔,霍克克,李育阳.毕赤酵母的密码子用法分析[J].生物工程学报,2000,16(3):308-311.
[7]张翠霞,王红梅,陈士毅,等.干扰素tau及其在反刍动物中抗黄体溶解作用[J].Animal Husbandry and Veterinary Medicine,2008,40(7):94-97.
[8]Tonny M J,SK Holaday,Yahong S,et al.Expression,purification and characterization of interferon tau produced in Pichia pastoris grown in Minimal media[J].Journal of Interferon and Cytokine Research,1999,19:631-636.
[9]Spencer T E,Becker W C,George P,et al.Ovine interferon.tau regulates expression of endometrial receptors for estrogen and oxytoein but not progesterone[J].Biol Reprod,1995b,53(3):732-745.
[10]Spencer T E,Johnson G A,Bazer F W,et al.Fetal-maternal interactions during the establishment of pregnancy in ruminants[J].Soc Reprod Fertil Suppl,2007,64:379-396.
[11]葛丽,李震,于瑞嵩,等.猪a干扰素基因在毕赤酵母中的分泌表达[J].中国兽医学报,2005,25(3):289-292.
[12]王延群,张璐,李玉明,等.牛a干扰素在毕赤酵母中的高效分泌表达及活性鉴定[J].中国预防兽医学报,2013,35(10):845-848.
[13]张明.牛IFNt基因成熟蛋白CDS区的克隆、原核表达及其在妊娠建立过程中的生物学功能研究[D].雅安:四川农业大学,2007.
[14]高方方,吴忠义,曾申明.牛干扰素-tau基因的原核表达及生物功能鉴定[J].农业生物技术学报,2008,16(2):208-213.
Secretory Expression of Ovine Interferon tau in Pichia pastoris
Deng Guixin,Liang Guoyi,Ni Hemin,et al
(College of Beijing Agronomy,Bingjing 102206,China)
Ovine interferon tau(IFNt)gene was synthesized in terms of condon selection preference of Pichia pastoris and inserted into the vector pPIC9.The recombined pPIC9-IFNt was trnasformed into GS115 by electroporation and induced under optimized conditions,expression was detected by SDS-PAGE.The result showed that PIC9-IFNt was secretory expressed normally and optimized condition was 200 r/min,28℃,0.5%methanol,96 h.The study that supplied a relative productive evidence of IFNt eukaryotic expression.
ovine;IFNt;Pichiapastoris;expression摘要:应用绵羊的干扰素tau基因IFNt,根据毕赤酵母(Pichia pastoris)密码子选择偏好进行分子改造。改造后的基因IFNt克隆到毕赤酵母表达载体pPIC9上,构建得到重组毕赤酵母表达质粒pPIC9-IFNt。电转化于毕赤酵母GS115菌株,对转化后菌体诱导表达,上清SDS-PAGE检测,并优化诱导表达条件。结果表明:IFNt基因已重组到酵母染色体上,并能正常分泌表达,最佳诱导条件为:200 r/min,28℃,0.5%甲醇,96 h。该研究为真核表达绵羊IFNt的生产应用提供了一定的理论依据。关键词:绵羊;IFNt;毕赤酵母;表达
S826.2
A
2095-3887(2016)04-0005-04
10.3969/j.issn.2095-3887.2016.04.002
2016-06-03
北京自然基金(6132006)
邓桂馨(1977-),女,讲师,博士;并列第一作者:梁果义(1975-),男,副研究员。
倪和民,男,教授。研究方向:遗传育种与繁殖。
