阿勒泰羊高繁性状候选基因BMPR-IB、BMP15的研究
2016-11-19於建国托合塔森皮达巴依
於建国,郝 耿,陈 童,托合塔森·皮达巴依,徐 东
(1.新疆畜牧科学院畜牧所,乌鲁木齐830000;2.新疆维吾尔自治区畜牧总站,乌鲁木齐830000;3.新疆维吾尔自治区福海县齐干吉迭乡畜牧兽医站,福海836400)
遗传育种
阿勒泰羊高繁性状候选基因BMPR-IB、BMP15的研究
於建国1,郝 耿1,陈 童1,托合塔森·皮达巴依2,徐 东3
(1.新疆畜牧科学院畜牧所,乌鲁木齐830000;2.新疆维吾尔自治区畜牧总站,乌鲁木齐830000;3.新疆维吾尔自治区福海县齐干吉迭乡畜牧兽医站,福海836400)
试验以BMPR-IB的FecB位点,BMP15基因的B1、FecXG(B2)、FecXB(B4)3个位点为阿勒泰羊高繁性状候选基因,采用PCR-RFLP、SSCP技术检测了116只阿勒泰羊上述4个位点的单核苷酸多态性。结果表明:阿勒泰羊FecB、FecXG(B2)、FecXB(B4)位点只存在野生型,无多态性。B1位点检测到AA、AB、BB三种基因型,其基因型频率分别为0.63、0.29、0.08,等位基因A、B的频率分别为0.78、0.22。
阿勒泰羊;FecB;BMP15;RFLP;SSCP
阿勒泰羊是新疆优良的地方肉羊品种,在遗传进化分类上属于哈萨克羊的一个分支,在生物学分类上属于脂臀型粗毛羊。阿勒泰羊主要集中在阿勒泰地区的福海县、富蕴县、青河县等地,南北疆其他地区以及内地部分省份近年来也先后引进阿勒泰羊进行养殖。
阿勒泰羊具有耐粗饲、抗寒性强、善跋涉、生长速度快、屠宰率高、肉质好等优良性状。但其繁殖率相对较低,经产母羊产羔率110%,初产母羊产羔率103%[1]。在生产实际中阿勒泰羊存在连续2~3胎产双羔的个体,因此,如何建立具有高繁殖性能的阿勒泰羊群体,为地方肉羊良种羊建立具有高繁殖率的新类群是当前阿勒泰羊面临的重大问题。本研究通过开展与绵羊高繁殖率性能相关的候选基因BMPR-IB、BMP15的研究,分析4个突变位点的多态性与阿勒泰羊高繁殖率性状的相关性,为开展阿勒泰羊高繁殖率的新类群提供理论依据。
1 材料与方法
1.1 实验材料
阿勒泰羊血样采自新疆福海县齐干吉迭乡阿勒泰双羔羊繁育基地,用EDTA抗凝真空管进行颈静脉采血,每只3mL,共采集116只母羊血样,-20℃冻存,用酚氯仿抽提法提取基因组DNA,溶于TE中,4℃保存。
1.2 引物设计
BMPR-IB基因序列(FecB(A746G))扩增引物参照TheresaWilson等[2]发表的引物,BMP15基因B1、B2、B4序列扩增引物参照Hanrahan等[3]发表的引物,引物由生工生物工程(上海)股份有限公司合成。引物序列见表1。

表1 BMPR-IB和BMP15基因扩增区域引物序列与扩增片段长度
1.3 PCR扩增及酶切、SSCP分析
PCR扩增反应体系:20μL,其中10×缓冲液2μL,2.5mmol/L dNTP 1.5μL,DNA模板1μL,上下游引物各1μL,Taq DNA聚合酶1U,灭菌ddH2O 12.5μL。PCR产物用12%聚丙烯酰胺凝胶(PAGE)电泳检测或2%琼脂糖凝胶电泳检测。PCR扩增反应体系见表2。
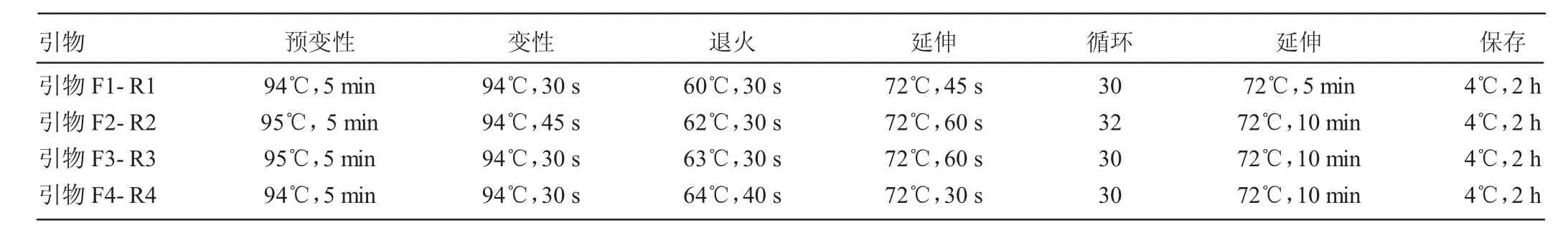
表2 BMPR-IB和BMP15基因扩增区PCR反应体系
酶切反应:BMPR-IB FecB位点PCR扩增产物用AvaII内切酶进行酶切;BMP15B2位点PCR扩增产物用Hinf I内切酶进行酶切;BMP15B4位点PCR扩增产物用Dde I内切酶进行酶切。37℃反应4 h,酶切产物用12% PAGE凝胶电泳检测。
SSCP体系:7μL PCR扩增产物,7μL变性缓冲液(98甲酰胺、0.025%溴酚蓝、0.025%二甲苯氰、pH=8的10mmol/LEDTA、10%甘油),0.2mL离心管混匀,98℃变性10min,迅速插入冰水,放置5min,4℃条件下,用8%聚丙烯酰胺凝胶电泳检测。
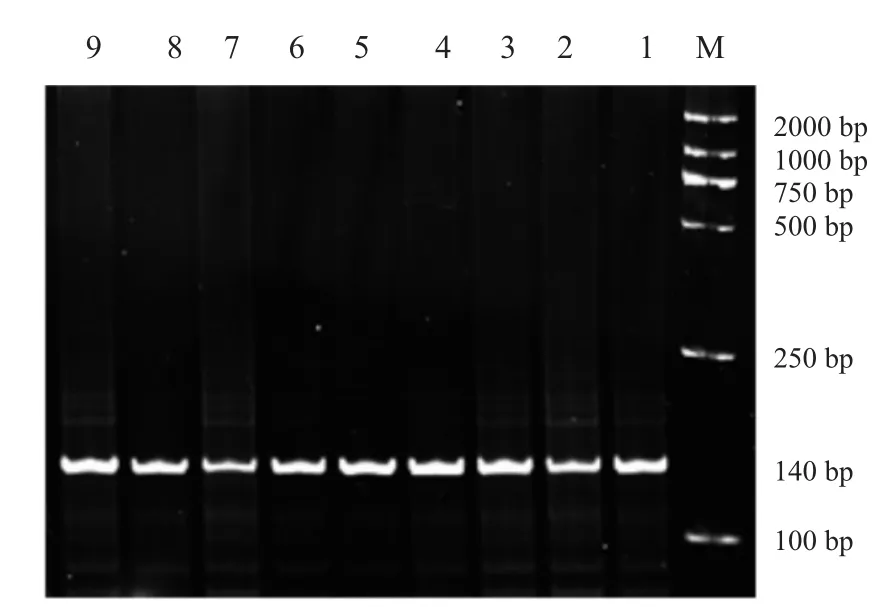
图1 BMPR-IB基因FecB位点PCR扩增产物
2 结果与分析
2.1 PCR扩增结果
FecB位点PCR扩增产物经12%聚丙烯酰胺凝胶电泳检测,BMP15B1、B2、B4三个位点PCR扩增产物经2%琼脂糖电泳检测,结果见图1~4。BMPR-IB FecB位点扩增产物为140bp,BMP15B1位点PCR扩增产物为234bp、B2位点PCR扩增产物为141 bp、B4位点PCR扩增产物为153 bp,4个突变位点PCR扩增产物长度均与预期结果一致。
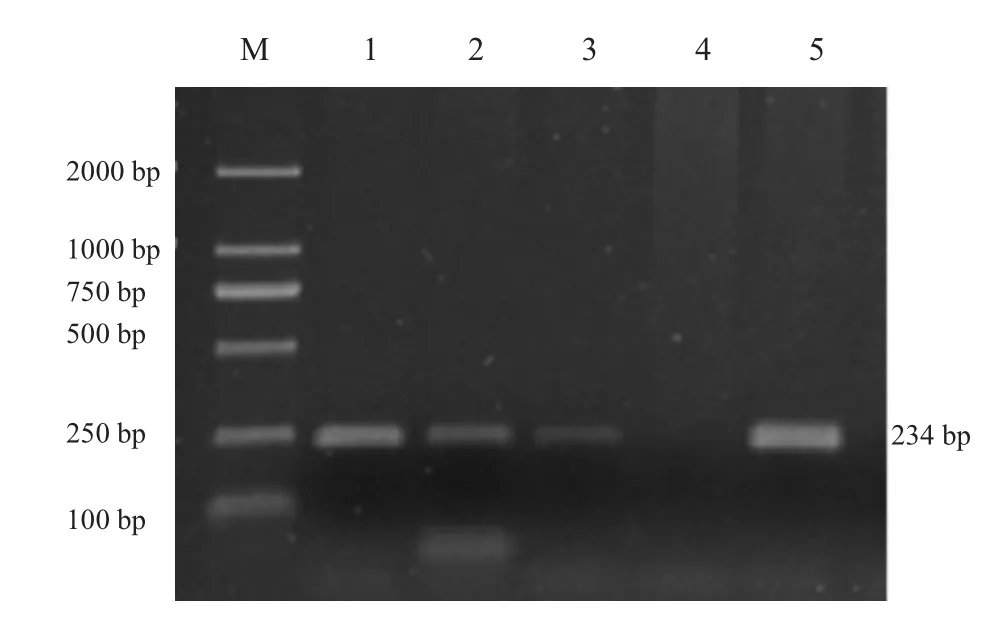
图2 BMP15基因B1位点PCR扩增产物
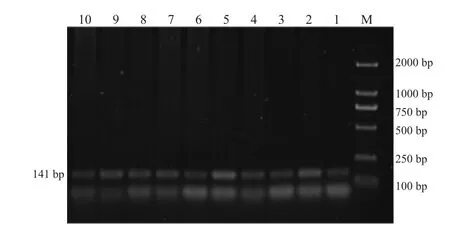
图3 BMP15基因B2位点PCR扩增产物

图4 BMP15基因B4位点PCR扩增产物
2.2 PCR产物SSCP多态性
BMP15B1位点PCR扩增产物经SSCP检测分析,发现该片段存在多态性,分别定义为:AA、AB和BB。如图5所示,电泳结果从左至右泳道基因型分别为:AA、AA、AB、AA、BB、AA、BB、AA和BB。等位基因A、B的频率分别为0.78、0.22,AA、AB和BB基因型频率分别为0.63、0.29、0.08,结果见表3。

图5 BMP15基因B1位点PCR扩增产物SSCP分析结果
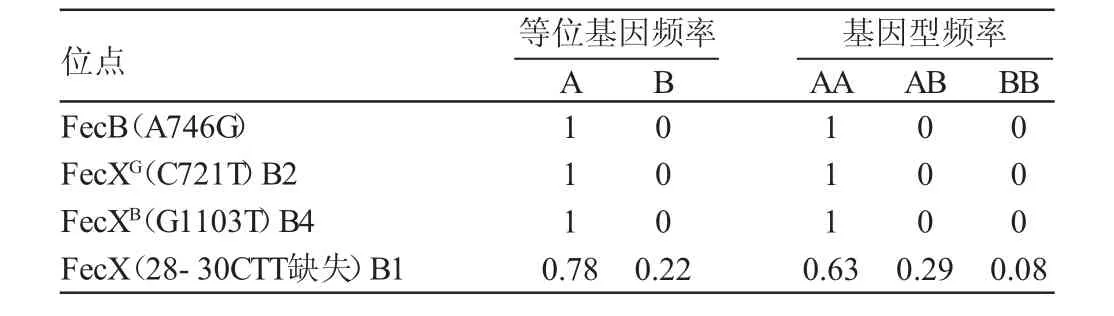
表3 FecB、B1、B2、B4位点基因频率和基因型频率(n=116)
2.3 PCR产物酶切结果
BMPR-IB FecB位点PCR扩增产物用AvaII内切酶进行酶切,酶切产物电泳后PCR扩增产物仍为1条带,未出现条带切开现象,表明所有个体在该位点上均为野生型,无多态性。BMP15B2位点PCR扩增产物用Hinf I内切酶进行酶切后得到2条片段(111 bp,30 bp),无多态性。BMP15 B4位点PCR扩增产物用Dde I内切酶进行酶切后得到2条片段(122 bp,31 bp),无多态性。3个位点PCR产物酶切结果表明,样本羊在该3个位点上均为野生型,结果见图6~8。

图6 BMPR-IB基因FecB位点PCR扩增产物酶切结果

图7 BMP15基因B2位点PCR扩增产物酶切结果
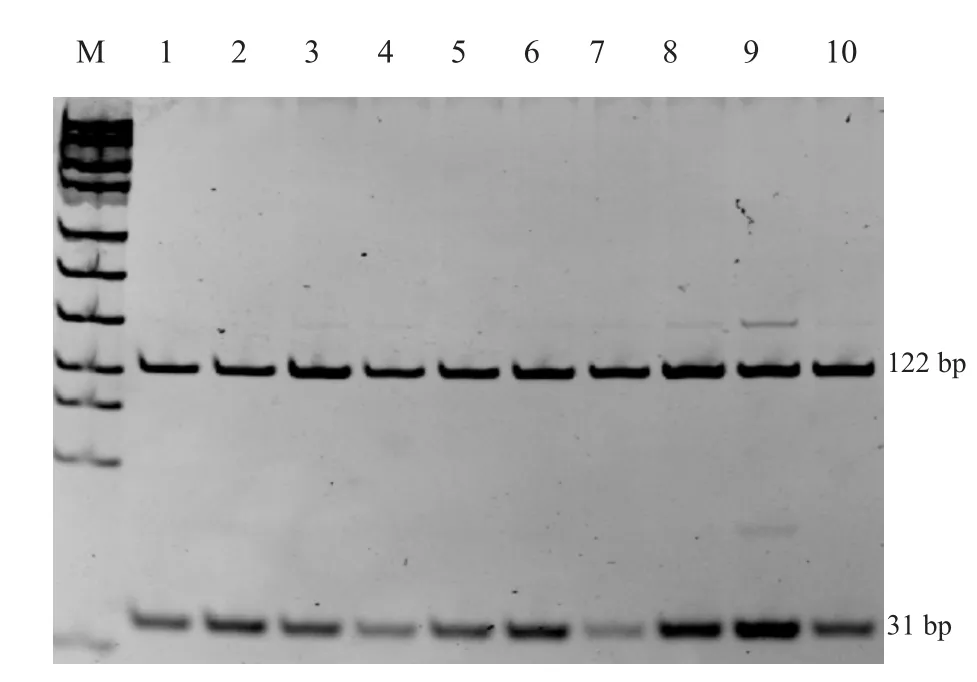
图8 BMP15基因B4位点PCR扩增产物酶切结果
3 讨论
BMPR-IB基因编码区746位点上发生A-G突变,导致对应位点上氨基酸由谷氨酰胺变成了精氨酸,该位点于1980年在Booroola羊上首次发现,并命名为FecB。FecB突变位点在我国的小尾寒羊、湖羊、策勒黑羊、多浪羊等绵羊品种中也先后被发现。韩颖洁等[4]通过检测小尾寒羊BMPR-IB基因多态性,发现该基因存在BB、B+ 和++三种基因型,基因型频率分别为0.067、0.360和0.573,平均产羔数分别为2.55、2.35和1.28只。吴丽丽等[5]在湖羊中开展BMPR-IB基因多态性研究,发现只存在BB、B+两种基因型,未检测到++基因型个体,其结果与王根林等[6]、管峰等[7]研究结果相一致,认为BMPR-IB基因是影响湖羊高繁殖力的一个主效基因。马海玉等[8]检测到吐鲁番黑羊BMPR-IB基因只存在1种基因型,没有多态性。哈萨克羊和策勒黑羊群体中的BMPR-IB基因具有多态性,存在3种基因型:++、B+和BB,其中BB基因型个体的产羔数显著高于++基因型个体(P< 0.05)。邵勇钢等[9]在策勒黑羊中检测到BMPR-IB基因存在多态性,BB、B+基因型间产羔数极显著高于++基因型(P<0.01),但BB、B+基因型间产羔数差异不显著(P>0.05),认为在策勒黑羊中B等位基因可用于对策勒黑羊产羔数的选择。本研究结果显示,在组建的阿勒泰羊多胎群体中未检测到BMPR-IB基因在FecB位点存在多态性,无突变基因B,初步认为,BMPR-IB基因FecB突变位点不是引起阿勒泰羊多羔群体产羔数增加的主效基因。
BMP15基因由2个外显子和1个内含子组成,位于X染色体上,编码序列全长1 179 bp。BMP15在卵母细胞发育过程中起着重要的调节作用,研究已发现,绵羊BMP15基因具有FecXI,FecXH,FecXL,B1,FecXG(B2),B3,FecXB(B4)共7个不同突变。Hanrahan等研究Cambridge和Belclare绵羊BMP15基因发现,在编码区有4个单核苷酸多态,第28~30位的碱基CTT缺失,导致编码区第10个氨基酸残基亮氨酸缺失,形成B1突变体,但该突变并不改变BMP15的功能;第718位的碱基C突变为T,导致了编码区239号氨基酸残基谷氨酰胺被一个早熟终止密码子代替,形成B2突变体,该突变可能导致了BMP15功能的彻底丧失;第1 100位的碱基G突变为T,导致了编码区367号氨基酸残基丝氨酸变为异亮氨酸,形成B4突变体,该突变改变了BMP15的功能。杨晶等[10]研究发现,在小尾寒羊和陶赛特羊中均检测到B1突变位点,但含突变基因的个体与野生型个体产羔数差异不显著(P>0.05),BMP15基因B1突变位点不能作为小尾寒羊高繁殖率的主效基因。刘永斌等[11]在蒙古羊中发现B1突变位点,但含突变基因的个体与野生型个体产羔数差异不显著(P>0.05),BMP15基因B1突变位点不能作为蒙古羊多胎群体高繁殖率的主效基因。本研究对阿勒泰羊BMP15基因上的B1、B2和B4突变位点进行检测分析发现,B2和B4突变位点没有多态性,只有B1突变位点具有多态性。B1突变位点等位基因A、B的频率分别为0.78、0.22,AA、AB和BB基因型频率分别为0.63、0.29、0.08,但含突变基因的个体与野生型个体产羔数差异不显著(P>0.05),初步认为B1不能作为阿勒泰羊多胎群体高繁殖率的主效基因。
[1]阿勒泰羊[S].NY/T 1816—2009.
[2]Theresa Wilson.Highly prolific Booroola sheep have a mutation in the intracellular kinase domain of bone morphogenetic protein IB receptor (ALK-6)that is expressed in both oocytes and granulose cells[J].Biology of Reproduction,2001,64:1225-1235.
[3]Hanrahan J P,Gregan SM,Mulsant P,et a1.Mutations in the genes for oocyte-derived growth factors GDF9 and BMP15 are associated with both increased ovulation rate and sterility in Cambridge and Belclare sheep(Ovisaries)[J].Biology of Reproduction,2004,70(4):900-909.
[4]韩颖洁,刘月琴,张英杰.小尾寒羊BMPR-IB基因多态性研究[J].中国草食动物科学,2014,34(增刊):90-92.
[5]吴丽丽,赵晓枫,张立凡.湖羊BMPR-IB、BMP15和GDF9基因的RFLP分析[J].中国草食动物,2011,31(4):9-12.
[6]王根林,毛鑫智,George HDavis,等.DNA分析发现我国湖羊和小尾寒羊存在Booroola(FecB)多胎基因[J].南京农业大学学报,2003,26(1):104-106.
[7]管峰,艾君涛,刘守仁,等.BMPR-IB和BMP15基因作为湖羊多胎性候选基因的研究[J].家畜生态学报,2005,26(3):9-12.
[8]马海玉,王琼,于茜,等.3个新疆绵羊品种中BMPR-IB基因的RFLP分析及比较[J].西北农业学报,2015,24(4):19-24.
[9]邵勇钢,米日尼萨汗·库尔班,刘武军.策勒黑羊BMPR-IB基因多态性与产羔数的相关性研究[J].中国畜牧兽医,2012,39(6):221-223.
[10]杨晶.小尾寒羊GDF9基因和BMP15基因多态性及其与高繁殖力关系的研究[D].北京:中国农业科学院,2006.
[11]刘永斌,何小龙,王峰.蒙古羊BMP15基因外显子1位点多态性与产羔性能关系分析[J].华北农学报,2008,23(5):30-34.
Study on BMPR-IB,BMP15 asCandidate Genes for Prolific Traits of Altay Sheep
Yu Jianguo,Hao Geng,Chen Tong,et al
(Xinjiang Academy of Animal Sciences,Urumqi830000,China)
In this study,the single nucleotide polymorphism of four loci(FecB of BMPR-IB,B1,FecXGand FecXBof BMP15)from 116 Altay sheep were detected using PRC-RFLP,SSCP technique.The results showed that there were no polymorphism in the loci of FecB,FecXGand FecXB,only wild type loci;there were three genotypes(AA,AB,BB)in the loci of B1,their frequencies were 0.63,0.29,0.08 respectively,the frequencies of allele gene A and B were 0.78 and 0.22 respectively.
Altay sheep;FecB;BMP15;RFLP;SSCP
S826.2
A
2095-3887(2016)04-0001-04
10.3969/j.issn.2095-3887.2016.04.001
2016-04-22
新疆自治区公益性科研院所基本科研业务费项目(KY2015010)
於建国(1977-),男,助理研究员。研究方向:动物遗传育种。
