灰树花菌丝体发酵培养及提取纯化的研究
2016-11-17杨庆伟
杨庆伟
(天津现代职业技术学院,天津 300350)
灰树花菌丝体发酵培养及提取纯化的研究
杨庆伟
(天津现代职业技术学院,天津 300350)
灰树花菌种经过14 d种子培养,发酵培养90 h时达到生物量和多糖含量最大值,分别为8.0,1.4 g/L,并对灰树花菌丝体进行提取纯化,得到水溶性多糖组分GF,经过Sepadex G200柱层析证明GF为均一组分。
灰树花;多糖;菌丝体
灰树花又名千佛菌、贝叶多孔菌、栗蘑莲花菌、舞茸,隶属担子菌纲、多孔菌目、多孔菌科、树花属,是一种珍稀的食用菌。国内外许多学者对灰树花菌丝体或者发酵液的营养价值、药用价值进行广泛研究[1];日本学者伊藤一雄(1940年) 和广江勇(1941年)最早从事灰树花栽培研究,并于1974年栽培驯化成功,产值达到100亿日元,作为香菇、金针菇等食用菌之后的新型食用菌[2]。灰树花的生产扩大化包括固体发酵和液体发酵2种,固态发酵培养优点是可获得食用和药用兼得的灰树花子实体;缺点是菌丝体生长慢、周期长;液体发酵培养优点是发酵出的菌丝体要比固态发酵培养的子实体简便迅速[3]。从灰树花中提取的胞内和胞外多糖等活性物质,已成为食品保健品研究的热点。本文在前期工作基础上,主要研究灰树花菌丝体的深层液体发酵培养、灰树花菌丝体胞内多糖的分离纯化,为后续工作提供理论基础。
1 材料与方法
1.1 材料与试剂
灰树花菌种;葡萄糖(分析纯),天津市北辰骅跃化学试剂厂产品。
1.2 仪器与设备
干燥箱,上海市实验仪器厂产品;SP-2102PC型分光光度计,上海光谱仪器有限公司产品;摇床,上海欣蕊自动化设备有限公司产品。
1.3 方法
1.3.1 灰树花菌丝体液态扩大培养
将灰树花菌种取出,在培养箱(25℃)培养2~3 d,然后将菌种接种到液体种子培养基里进行培养(25℃摇床,120 r/min,7 d),再转接到液体种子培养基里进行培养(10%一级种子,25℃摇床,120 r/min,7 d),最后转接到液体发酵培养基里进行发酵培养(10%二级种子,25℃摇床,120 r/min)。
1.3.2 发酵培养曲线测定
利用干质量法称菌丝体的干质量,并绘出灰树花菌丝体生长曲线。
1.3.3 灰树花菌丝体多糖含量测定
根据苯酚硫酸法的原理[4],利用标准葡萄糖溶液制成标准曲线,将烘干后菌丝粉样品加入到30 mL的85%乙醇中,在60℃水浴中保持1 h,然后离心处理,弃掉上清液,保留沉淀物,并加入200 mL蒸馏水,煮沸1 h,最后过滤,去除残渣,定容至200 mL,精确量取0.5 mL,加蒸馏水至2 mL,根据葡萄糖标准曲线制作操作流程,测定吸光度,代入回归方程,求多糖含量。
1.3.4 灰树花菌丝体多糖提取纯化
发酵结束后,利用布式漏斗抽提发酵培养基,利用烘箱烘干制成干菌丝粉(温度50℃),将菌丝粉在冰水浴下超声波浸提10 min,稀释制成质量分数4%溶液,80℃水浴6 h,取上清液将3倍体积95%乙醇与上清液混合,在冰箱中保存12 h,以转速4 500 r/min离心取沉淀利用Sevage法去蛋白,大孔树脂吸附,超滤并冷冻干燥得到水溶性多糖组分GF。
2 结果与分析
2.1 发酵培养曲线测定结果
灰树花经过一级种子培养、二级种子培养,转接做发酵培养,测定发酵曲线。
灰树花发酵菌丝体及多糖含量曲线见图1。
图1 灰树花发酵菌丝体及多糖含量曲线
由图1可知,灰树花菌丝体在液态发酵培养过程中,90 h以前菌丝体逐渐增长,90 h以后进入稳定期,在90 h左右菌丝含量最高,菌丝体干质量为8.014 g/L。
在发酵培养90 h,多糖含量最高,为1.432 g/L。在90 h以后发酵进入稳定期,但是菌丝体多糖含量在发酵90 h以后逐渐下降。这是由于灰树花菌丝体在进入稳定期以后开始分泌次级代谢产物,导致菌丝体多糖部分被代谢掉。

2.2 灰树花水溶性多糖(GF)含量及纯度分析结果×100%=0.66%. GF Sephadex G200凝胶过滤图谱见图2。
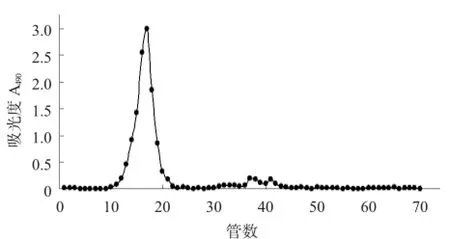
图2 GF Sephadex G200凝胶过滤图谱
GF柱层析分析,葡聚糖凝聚层析是分子排阻层析。根据分子筛的原理,依据分子量大小不同的化合物,在色谱柱中流速不同,将不同分子量的组分分离出来。Sephadex G200的分离范围5~60 kDa。由图2可知,菌丝体水溶性多糖GF是一种均一组分。
3 结论
本文主要目的是研究灰树花菌丝体发酵培养产量最大化的时间,经过以上工艺进行发酵培养90 h,菌丝体的生物量和菌丝体多糖含量达到最大值,分别为8.014,1.432 g/L,为灰树花菌丝体发酵生产提取理论依据。经过以上的提取工艺对灰树花进行提出纯化,得到的水溶性多糖GF为均一组分,为后续灰树花菌丝体多糖的活性研究提供基础。
[1]刘振伟,史秀娟.灰树花的研究开发现状 [J].食用菌,2001(4):6-7.
[2]郑云甲.迁西灰树花考察初报 [J].食用菌,1986(1):5-6.
[3]张松.食用菌学 [M].广州:华南理工大学出版社,2000:90-91.
[4]徐志祥.灰树花深层培养和诱变育种研究及海藻糖合成酶基因的克隆、表达 [D].广州:中山大学,2003.◇
Study on the Fermentation Culture and Purification of Grifola frondosa Mycelia
Yang Qingwei
(Tianjin Modern Vocational Technology College,Tianjin 300350,China)
After 14 days of Grifola frondosa seed culture,the maximum value of the biomass and polysaccharide content is 8.0,1.4 g/L on the 90 hours fermentation,respectively.GF is isolated and purified from the mycelium of Grifola frondosa,and the water soluble polysaccharide fractions are obtained by Sepadex G200 column chromatography.The GF is homogeneous.
Grifola frondosa;polysaccharide;mycelia
Q539
A
10.16693/j.cnki.1671-9646(X).2016.01.003
2015-12-02
杨庆伟(1983— ),男,硕士,讲师,研究方向为食品生物技术。
