土壤胡敏酸对镍离子吸附特征研究*
2016-11-16刘保峰魏世强
刘保峰,魏世强
(1.天津市疾病预防控制中心职业病预防控制所,天津300011;2.西南大学资源与环境学院,重庆400716)
·检测与评价·
土壤胡敏酸对镍离子吸附特征研究*
刘保峰1,魏世强2
(1.天津市疾病预防控制中心职业病预防控制所,天津300011;2.西南大学资源与环境学院,重庆400716)
采用C-25葡聚糖凝胶层析法研究了不同酸度、离子强度及温度条件下胡敏酸(HA)吸附镍离子(Ni2+)特征。结果表明:在离子强度0.10 mol·L-1、反应温度298 K,随着pH的升高,HA吸附Ni2+饱和吸附量Sm、吸附平衡常数K′增大,标准摩尔自由能变△Gmθ减小。在pH 7.00、反应温度298 K,离子强度从0.05~0.20 mol·L-1,饱和吸附量Sm随离子强度的增大而减小,而吸附平衡常数K′在离子强度为0.05~0.10 mol·L-1范围内随离子强度增大而减小,但当离子强度0.10~0.20 mol·L-1范围内,则随其增加而又增大。温度升高,HA吸附Ni2+的饱和吸附量Sm、吸附平衡常数K′越大,标准摩尔自由能变ΔGmθ越小,表明升高温度对吸附反应不利。摩尔焓变ΔrHmθ、标准摩尔熵变ΔrSmθ均小于零,说明HA吸附Ni2+反应为放热反应,反应向更有序状态进行。随着pH的降低,HA-Ni2+解吸率增大,当pH为2.03时,解吸率达93.41%,几乎全部解吸下来,说明HA吸附Ni2+的反应主要为表面吸附反应,HA吸附Ni2+反应不具有“两相”反应特征。
胡敏酸;Ni2+;吸附反应;吸附特征
HA作为腐殖酸重要组分之一,常以溶解或不溶解状态广泛存在于土壤、水体及沉积物中[1]。它是含有不同比率聚合芳香环的结构复杂的多元有机复合体,这些芳香环带有大量的-OH、-COOH等功能团[2-3],具有很高的反应活性,对环境中金属离子具有强烈结合能力,从而对重金属元素在环境中的迁移、转化和生物有效性起到重要的调控作用。因此,HA与金属离子的相互作用长期以来一直是土壤环境化学关注的热点。目前对钙、铜、镉、锰、铁等金属离子与HA的吸附解吸特征已有不少研究[4-11]。Österberg等[12-13]的研究表明,腐殖酸与金属离子的反应既包括表面络合作用,也包括金属离子进入腐殖酸分子结构内部的固持作用,即所谓“两相反应”。进入腐殖酸结构内部的金属离子即使在极低的酸度下仍然难以释放,而表面络合金属离子则容易释放,不同金属离子内部/表面分配比例有很大差异,如Cu2+绝大部分可以进入腐殖酸颗粒内部,而Ca2+则大部分为表面吸附。因此,研究不同金属离子在腐殖酸上的吸附特征,对于金属离子的活性调控与污染防治具有重要意义。
镍广泛分布于自然环境,火山爆发、岩石土壤风化等是其自然来源,化石燃料燃烧、工业生产以及镍制品的使用和处置等人为活动加重了环境镍负荷[14]。人体曝露在受镍污染环境中,可能导致皮肤过敏症、肺纤维化、肾和心血管系统病症和呼吸道癌以及诱发肿瘤恶化等[15-17]。普通人群镍暴露的主要途径是通过食物吸收,镍可以在土壤中富集,并通过食物链危害人群健康[18],土壤镍的含量与活性、作物累积特征及其对人群健康风险已受到国内外研究者的广泛关注[19-22]。HA对镍的吸附和解吸行为,势必对其在土壤中的形态转化产生重要影响,从而制约生物活性与危害,目前对HA吸附解吸Ni2+的研究还鲜见报道。为此,笔者探讨了不同酸度、离子强度及温度条件下HA吸附解吸Ni2+规律,为阐明镍在环境中的迁移转化、生物活性及污染调控等提供理论依据。
1 材料和方法
1.1HA的提取分离纯化及部分功能基团和基本性质测定
供试HA提取自重庆市缙云山常绿阔叶林表层腐殖土,土壤样品经风干,通过1 mm筛孔。HA的提取分离和纯化及HA部分功能基团和基本性质参照文献[23]进行测定,其结果见表1。

表1 纯化HA样品基本性质
1.2主要试剂
交连葡聚糖凝胶SP SephadexTMC-25(瑞典生产);Ni(NO3)2(AR)(中国成都试剂厂生产);99.99%高纯氩气(重庆北碚化学试剂厂);其他相关试剂包括NaCl、HCl、NaOH等均为分析纯试剂。
1.3实验方法
1.3.1胡敏酸-镍等温吸附试验
1)不同酸度条件下等温吸附试验。各取HA浓缩液2.0 mL(浓度10.38 g·L-1溶液)置于24支50 mL离心管中,加入约5 mL蒸馏水,分别加入不同浓度的Ni(NO3)2溶液,使体系中Ni2+浓度分别为0.2、0.4、0.8、1.6 mmol·L-1,再加入经计算的1 mol·L-1NaCl溶液,使最后反应体系离子强度为0.10 mol·L-1,用0.1 mol·L-1HCl或0.1 mol·L-1NaOH调节pH分别为3.0、4.0、5.0、6.0、7.0、8.0,并使定容后总体积为20mL。通高纯氩气30min,加盖密封,(25±0.5)℃避光振荡,并充分考虑腐殖酸溶液体系的非平衡特征,参考魏世强等[5]的相关指标,使反应进行24h,充分达平衡后,再在4000r·min-1转速下离心10 min,取上清液分别测定溶液中总镍、吸附总镍。总镍的测定:上清液各5.0 mL于三角瓶,加入5.0 mL浓HNO3和3.0 mL HClO4进行消煮,定容25.0 mL,采用原子吸收光谱仪测定总镍。吸附态镍含量的测定:取1.0 mL上清液通过交连葡聚糖凝胶C-25层析柱(图1所示),以蒸馏水为洗脱剂进行洗脱,未被HA吸附的金属离子留在层析柱上,金属离子被HA吸附后形成大分子物质,不被层析柱吸附,被蒸馏水洗出,收集全部洗脱液,定容25.0mL,取其中5.0 mL用浓HNO3和HClO4消煮后,定容25.0 mL,采用原子吸收光谱仪测定吸附总镍。

图1 葡聚糖凝胶层析示意
2)离子强度对HA吸附镍离子的影响。在体系pH为7.00、T=298K、HA浓度1.04g·L-1条件下,改变体系离子强度分别为0.05、0.10、0.20 mol·L-1,其它方法同1.3.1(1)。考虑离子强度的改变对吸附量的影响。
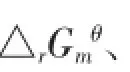

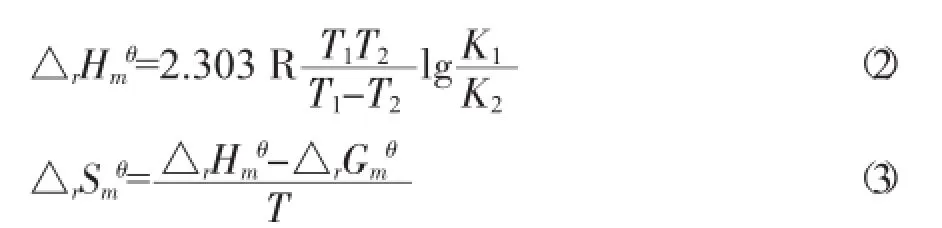
式中:R表示气体常数;T表示热力学温度;K′=k×换算系数,将腐殖酸浓度换算为mol·L-1,则吸附平衡常数可表示为K′=腐殖酸中有机碳的百分含量(%)×腐殖酸的相对分子质量(mg·mol-1)×反应液体积(L);K2、K1分别表示温度T2、T1下的吸附平衡系数。
1.3.2胡敏酸-镍等温解吸试验
取HA浓缩液(10.38 mg·mL-1)12.0 mL置于250 mL带塞锥形瓶中,加入约90 mL蒸馏水,加入0.05 mol·L-1Ni(NO3)2溶液,使体系中Ni2+浓度分别为1.6 mmol·L-1,再加入经计算的1 mol·L-1NaCl溶液,使最后反应体系离子强度为0.10 mol·L-1,用0.1 mol·L-1HCl或0.1 mol·L-1NaOH调节pH为7.0,并使定容后总体积为120 mL。通高纯氩气30 min,加塞密封,(25±0.5)℃避光振荡,并充分考虑腐殖酸溶液体系的非平衡特征,参考魏世强等[5]的相关指标,使反应24 h,充分达平衡后,分别吸取20 mL放入6支50mL离心管,用1mol·L-1HCl调节pH分别为7.0、6.0、5.0、4.0、3.0、2.0,通高纯氩气30 min,加塞密封,298 K避光振荡平衡24 h进行解吸。其它操作按1.3.1(1)中方法分别测定各pH条件下的吸附镍,并按下式计算解吸率θ:
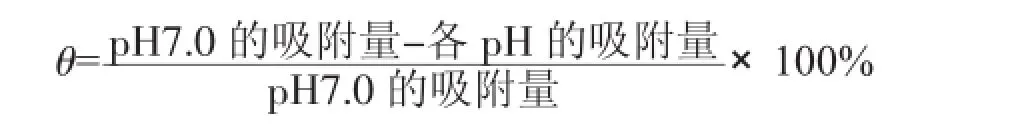
2 结果与讨论
2.1胡敏酸-镍等温吸附
HA对Ni2+的等温吸附主要用3种方程拟合:Linear方程S=K′C+b;Fruendlich方程S=K′Cn;Langmiur方程S=SmC/(C+1/K′)。其中:S为Ni2+在HA上的吸附量,C为平衡液浓度,K′为平衡吸附常数,Sm为饱和吸附量,b、n、A为常数。
2.1.1酸度对吸附反应的影响
不同pH下HA对Ni2+的等温吸附特征方程参数见表2。在pH<4.00时,用Linear方程和Fruendlich方程能很好地拟合结果;在pH>4.00时,Langmiur方程能更好地拟合结果,达到极显著相关水平。饱和吸附量Sm随pH的增加而升高,介于0.318~0.685 mmol·g-1。由于土壤和水体介质的pH一般在5.5~8.5,正好在本试验研究的pH范围之内,因此Sm对环境中重金属污染的控制具有重要的指导作用。
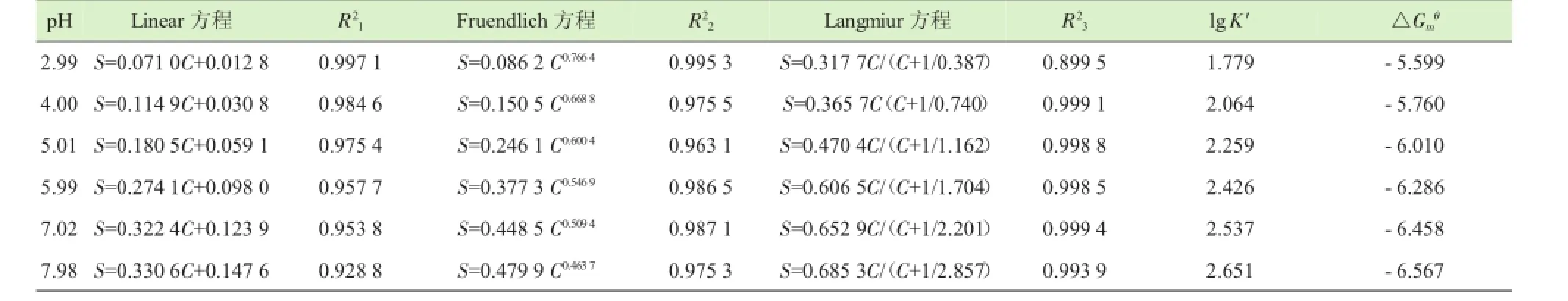
表2 不同pH下HA对Ni2+的等温吸附(n=6)
2.1.2离子强度对吸附反应的影响
对不同离子强度下胡敏酸与Ni2+的吸附曲线进行拟合,结果见表3。从表中可看出,在离子强度为0.05、0.10 mmol·L-1时,胡敏酸对镍离子的吸附可用Langmiur方程很好地进行拟合,而在离子强度为0.20 mmol·L-1时,用3个方程拟合效果都较好。从Langmiur方程拟合结果来看,胡敏酸对镍离子的最大吸附量Sm随离子强度的增大而减小,这是因为根据胡敏酸特有的大分子结构,以钠盐形式溶解在溶液中可将其看做带负电的亲水胶体。外界加入Na+,会依靠静电中和电荷。一方面使胡敏酸失去一部分水合水分子降低其稳定性;另一方面,带负电的胡敏酸胶体易团聚,导致胡敏酸分子空间结构增大,易阻碍镍离子与胡敏酸结合。同时,较多的Na+可与酚羟基(—OH)及弱酸性—COOH形成弱酸性钠盐,占据结合位点。此外,Cl-有一定的配位能力,当其浓度较大时,能与Ni2+配位,也会影响胡敏酸对Ni2+的吸附量。因此,增大体系的离子强度使吸附量降低。吸附平衡常数K′先随离子强度的增大而减小,而后又增大。说明离子强度增大,使胡敏酸吸附Ni2+的能力减弱,而胡敏酸对Ni2+的吸附强度变化更为复杂,原因还有待以后进一步探讨。

表3 不同离子强度下HA对Ni2+的等温吸附(n=5)
2.1.3温度对吸附反应的影响


表4 不同温度下HA对Ni2+的等温吸附(n=5)
2.2胡敏酸-镍等温解吸
不同pH条件下HA对Ni2+的解吸量和解吸率见表5。
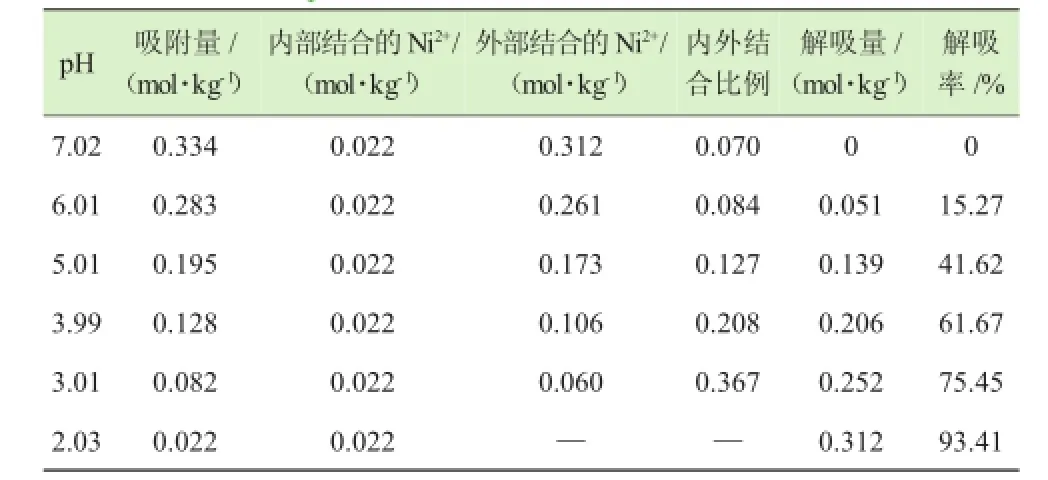
表5 不同pH条件下HA对Ni2+的解吸量和解吸率
表5显示了离子强度0.10 mol·L-1、温度298 K、不同pH条件下胡敏酸-镍解吸量及解吸率。从表5可看出,随着pH的降低,胡敏酸-镍解吸量增大,对解吸量曲线进行拟合,线性方程:
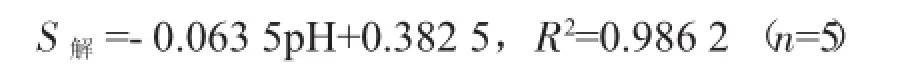
随pH的降低,胡敏酸-镍解吸率也增大,对解吸率曲线进行拟合,线性方程:

2个方程都具有显著的相关系数,表明酸度对胡敏酸镍的解吸具有内在的线性关联性。
据研究[12-13]表明,与HA表面结合位点结合的金属离子,在酸度很大时,如pH 2.0左右,由于H+更易与胡敏酸的功能团作用,H+能取代这些金属离子,从而使它们解吸下来;而扩散进入胡敏酸内部与内部结合位点结合的金属离子,即使在酸度很大时也不易解吸下来。假设胡敏酸对某种金属离子的吸附量包括内部和外部结合的2个部分,其中后一部分可以通过解吸量的大小来衡量,在极限条件如pH 2.0以下的解吸量可以认为是最大解吸量,因而解吸前吸附量(pH 7.0时的吸附量)和最大解吸量的差值可视为内部结合的部分,据此可求出内外结合的比例以及解吸率。从表5中已计算出给定条件下胡敏酸内部结合的镍量为0.022 mol·kg-1,而通过表面吸附的镍随着pH的降低而减小,最大解吸量为0.312 mol·kg-1,最大解吸率为93.41%,已基本全部解吸下来。
Sensi[24]认为胡敏酸与金属离子的配合有2种键合位置,一个是形成稳定的功能团,与金属离子的配合带有较强的共价性,键合后不易分离,也不易被其它离子取代;而另一个结合位置较弱,不稳定,较易被质子破坏。Schnitizer等[25]的研究认为,腐殖酸与金属离子的作用可形成外界配合物和内界配合物2种形式,外界配合物中金属离子被静电结合到阴离子上,而内界配合物中配位体功能团可以进入配位位置并强烈地取代围绕金属离子的水分子。从以上分析不难假想:胡敏酸吸附Ni2+的反应主要为表面吸附反应,吸附主要是形成了外界配合物,即胡敏酸-镍反应不具有“两相”反应特征。胡敏酸对Ni2+吸附不稳定,较易被质子破坏,进而释放到环境中,也说明了Ni2+在环境中有较高的迁移转化特性,Ni2+更有可能被作物吸收,从而进入食物链,随着“生物放大”效应危及人类健康。
3 结论
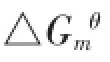
2)HA对Ni2+的最大吸附量Sm随离子强度的增大而减小,而吸附平衡常数K′随离子强度增大先减小而后又增大。说明离子强度增大,使HA吸附Ni2+的能力减弱,而HA对Ni2+的吸附强度变化更为复杂,原因还有待进一步探讨。
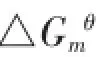
4)随着pH的降低,HA-Ni2+解吸率增大,当pH为2.03时,解吸率达93.41%,几乎全部解吸下来,说明HA吸附Ni2+的反应主要为表面吸附反应,HA-Ni2+反应不具有“两相”反应特征。
[1]Ashok K P,Shri D P,Virendra M.Stability constants of metal-humic acid complexes and its role in environmental detoxification[J]. Ecotoxicol Environ Saf,2000,47(4):195-200.
[2]Stevenson F J.Humic chemistry:Genesis,composition,reaction[M]. New York:Wiley,1994.
[3]Jansen S A,Varnum J M,Kolla S,et al.Metal uptake by metal free humic acid:In the role of humic substances in ecosystems and in environmental protection[M].Polish Society of Humic Substances,Wroclaw,Poland,1997.
[4]王强,魏世强,刘保峰.铁、锰、铝氧化物固体吸附剂对胡敏酸和富里酸吸附机理研究[J].土壤学报,2005,42(4):600-608.
[5]魏世强,李光林,Österberg R,等.腐殖酸—金属离子反应动力学特征与稳态指标的探讨[J].土壤学报,2003,40(4):554-561.
[6]杨亚提,张一平.土壤胡敏酸的解离及其与Cu2+的络合特征[J].环境科学学报,2001,21(6):731-736.
[7]李光林,魏世强,青长乐,等.镉在腐植酸上的吸附解吸特征研究[J].农业环境科学学报,2003,22(1):34-37.
[8]王强,魏世强.胡敏酸与Fe3+络合反应稳定性及热力学特征研究[J].环境科学学报,2006,26(1):118-123.
[9]Wang Q,Wei S Q,Huang Y M,et al.Characteristics of isothermal adsorption and desorption of aluminum ion to/from humic acids[J]. Acta Sci Circumst,2008,20(5):578-584.
[10]王强,魏世强.锰离子与胡敏酸络合反应特征研究[J].土壤学报,2011,48(1):120-125.
[11]Stenvenson F J,Chen Y.Stability constants of copper(Ⅱ)-humiate complexes determined by modified potentiometric titration[J]. Soil Sci Am J,1991,55:1586-1591.
[12]Österberg R,Wei S Q.Solution interaction of humic acids with Calcium ions involves of a two-phase system[J].Acta Chem Scand,1999,l53(6):974-984.
[13]Österberg R,Wei S Q,Shirshova,L.Inert copper ion complexes of humic acids[J].Acta Chem Scand,1999,53(2):172-153.
[14]Kasprzak K S,Sunderman J F W,salnikow K.Nichel carcinogenesis[J].MutatRes-FundamMolMechMut,2003,533(1/2):67-97.
[15]Liao Z J.Pollution hazard of heavy metals in environment and their transportationandconversion[M].Beijing:SciencePress,1989.
[16]Denkhaus E,Salnikow K.Nickel essentiality,toxicity,and carcinogenicity[J].Crit Rev Oncol Hematol,2002,42(1):35-56.
[17]Shi Z C.Nickel carbonyl:Toxicity and human health[J].Sci Total Environ,1994,148(2/3):293-298.
[18]廖自基.微量元素的环境化学及生物效应[M].北京:中国环境科学出版社,1992.
[19]Yusuf A A,Arowolo T A,Barngbose O.Cadmium,copper and nickel levels in vegetables from industrial and residential areas of Lagos City,Nigeria[J].Food Chem Toxicol,2003,41(3):375-378.
[20]Onianwa P C,Lawal J A,Ogunkeye A A,et al.Cadmium and nickel composition of Nigerian foods[J].J Food Compos Anal,2000,13(6):961-969.
[21]Cui Y J,Zhu Y G,Zhai R H,et al.Exposure to metal mixtures and human health impactes in a contaminated area in Nanning,China[J].Environ Int,2005,31(6):784-790.
[22]郑袁明,陈同斌,陈煌,等.北京市近郊土壤镍的空间结构及分布特征[J].地理学报,2003,58(3):470-476.
[23]文启孝.土壤有机质研究法[M].北京:农业出版社,1984.
[24]Sensi N,Rizzi F R.Fractac dimension of humic acids in aqueous suspension as a function of pH and time[J].Soil Sci,1996,60: 1773-1780.
[25]Schnitzer M,Khan S U.Soil organic matter[M].New York:Amsterdam Oxford,Elsevier Scientific Publishing Company,1978.
Adsorptive Characteristics of Humic Acid with Ni2+in Soil
Liu Baofeng1,Wei Shiqiang2
(1.Institute of Occupational Disease Prevention and Control,Tianjin Centers for Disease Prevention and Control,Tianjin 300011;2.College of Resource and Environment,Southwest University,Chongqing400716)
The characteristicsof humic acid adsorbing Ni2+at different acidity,ion strength and temperature were studied by sulphopropyl sephadex C-25 chromatography method.At ion strength 0.10 mol/L and temperature 298 K,with pH increasing,the max adsorption Smof humic acid with Ni2+,the stability constant K′increased,while△Gmθdecreased.At pH 7.00 and temperature 298 K,Smdecreased with ionic strength increasing at ion strength from 0.05 to 0.20 mol/L,while K′increased with ionic strength increasing at ion strength from 0.05 to 0.10 mol/L,but decreased at ion strength from 0.10 to 0.20 mol/L. With temperature increasing,Smand K′increased,while ΔGmθdecreased.It indicated that elevating temperature wasnot beneficial to the reaction of adsorption.ΔrHmθand ΔrSmθwere all lower than zero.The reaction of adsorption of humic acids with Ni2+isspontaneousand radiative.With pH decreasing,HA-Ni2+desorption rate increased.When pH was 2.03,the desorption rate was 93.41%that HA-Ni2+almost totally desorpted.It explained that the reaction of adsorption of humic acids with Ni2+maily occured on the surface without“two-phase”feature.
humic acids;Ni2+;adsorption reaction;adsorptive characteristics
X53
A
1005-8206(2016)03-0031-05
刘保峰(1978—),硕士研究生,工程师,主要研究方向为环境化学。
国家自然科学基金资助项目(40971147)
2015-10-16
