猪流行性腹泻病毒培养的工艺参数优化试验
2016-11-15陈申秒牛成明翟庆贺何福庆杨灵芝
陈申秒,牛成明,翟庆贺,何福庆,杨灵芝
(1.山东滨州沃华生物工程有限公司,山东 滨州 256600;2.山东博莱威生物技术研究所,山东 滨州 256606)
猪流行性腹泻病毒培养的工艺参数优化试验
陈申秒1,2,牛成明1,2,翟庆贺2,何福庆2,杨灵芝1,2
(1.山东滨州沃华生物工程有限公司,山东 滨州 256600;2.山东博莱威生物技术研究所,山东 滨州 256606)
为了提高猪流行性腹泻病毒的病毒滴度,建立最优的病毒培养条件,对影响病毒培养的细胞培养时间、接毒剂量、收毒时间等条件进行了研究。结果表明:细胞培养时间为主要因素,对于流行性腹泻病毒毒价影响较为显著,细胞培养72 h接毒平均毒价为107.44TCID50/0.1 mL,均高于其他两组;而收毒时间则为次要因素,平均毒价为107.21TCID50/0.1 mL;接毒剂量影响不显著,平均毒价为107.08TCID50/0.1 mL,本试验最佳工艺组合为细胞培养72 h接毒、接毒剂量为0.1%、收毒时病变程度为60%。
猪流行性腹泻病毒;细胞培养;佐剂
使用PEDV灭活疫苗是目前防治猪流行性腹泻的主要手段,但目前市场上的灭活疫苗普遍反映效果不理想,主要原因在于病毒培养难度大,病毒抗原很难达到很高的水平。有试验表明,如果乳汁中有高水平的IgG可以保护仔猪免受感染,这要求妊娠母猪免疫肌肉注射剂量每次不应少于107.0TCID50/mL,而且应进行两次免疫才能激发产生高水平中和抗体[1]。我国很早就在Vero细胞上培养PEDV,但是其来源的差异、毒株间的差异及培养条件对于PEDV的分离培养影响很大,不同学者所报道的方法在胰酶浓度、培养时间等方面差距较大[2],建立高病毒含量的生产工艺在实际生产中意义重大。为进一步优化生产工艺、提高半成品毒价,本研究从细胞培养时间、接毒剂量、收毒时间入手,研究三个因素对于半成品毒价影响的主次关系,以期筛选到最佳工艺组合,为腹泻发生提供依据。
1 试验材料
1.1细胞传代后48 h大转瓶Vero细胞,共18瓶,由灭活细胞苗车间提供。
1.2种毒PEDV-CV777 F79(F4),生产种毒,毒价为107.6TCID50/0.1 mL,-70℃保存,批号为140107;
1.3其他耗材MEM MD600,购自北京清大天一科技有限公司;新生牛血清,购自济南劲牛;96孔细胞培养板等。转瓶机,微量移液器,37℃温室,细胞培养箱等。
2 试验方法
2.1腹泻培养工艺的优化选取Vero细胞长至较密单层的大转瓶6个,按照1∶3比例,均匀传至18个大转瓶,待细胞长至单层后备用。将18个大转瓶Vero细胞随机分组,按照正交试验表分组接毒,共分为9组,每组2个重复。
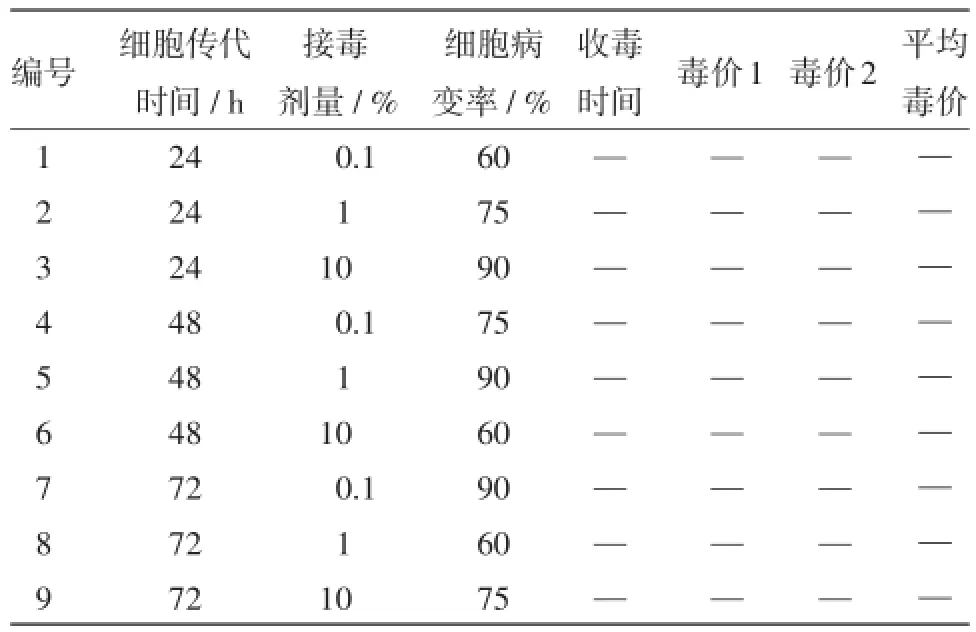
表1 腹泻工艺优化正交试验设计
接毒后逐日观察细胞病变情况,按照细胞病变的程度分别收获,冻融2次后,取样,用于毒价测定。大转瓶接毒工艺:选取长至需要时间的大转瓶细胞,弃去营养液,加入2%血清的MEM[含终浓度为100 IU(μg)/mL的双抗],1 000 mL/瓶,加入需要剂量的种毒(如1%接毒剂量,即加入10 mL种毒/瓶),摇匀,置于37℃培养,24 h后随时观察病变情况,当病变程度达到要求比例时(如90%细胞发生病变),收取大转瓶,置于-20℃冻存,冻融2次,取样,用于毒价测定。
2.2病毒毒价的测定按照常规方法培养Vero细胞,将细胞消化后铺于5块96孔细胞培养板内,待长满单层,弃去培养液,取维持液稀释好的病毒样品,10-5至10-8稀释度,加入上述96孔板内,每个稀释度6个重复,每孔100 μL,置于细胞培养箱培养96 h,逐日观察,记录病变情况,计算TCID50。
测定结束后,再对样品进行1次重复测定,若两次测定结果吻合,则分析数据,得出结论;反之,则需进行第3次重复测定。
3 试验结果
3.1接毒病变及毒价测定情况按照方案,分别于细胞传代后24、48、72 h接毒,并按照不同的病变程度收毒,取样后进行两次毒价测定,对于两次毒价测定结果差异较大样品,分别重新测定两次,最后取毒价指数平均值,作为该样品的毒价。具体数据见表2、图1。
3.2结果的统计分析利用极差分析方法,对细胞传代后不同时间、接毒剂量、病变程度等组合的累加毒价、平均毒价进行计算,进而计算各组内平均毒价的最大差距,即极差数值(R),并根据各组间极差的大小,判定主次因素对于毒价的影响程度,结果显示:细胞传代培养时间R值为0.41,大于病变程度的R值(0.35),大于接毒剂量的R值(0.27)。因此,对于毒价影响的主次因素依次为细胞培养时间、病变程度、接毒剂量。
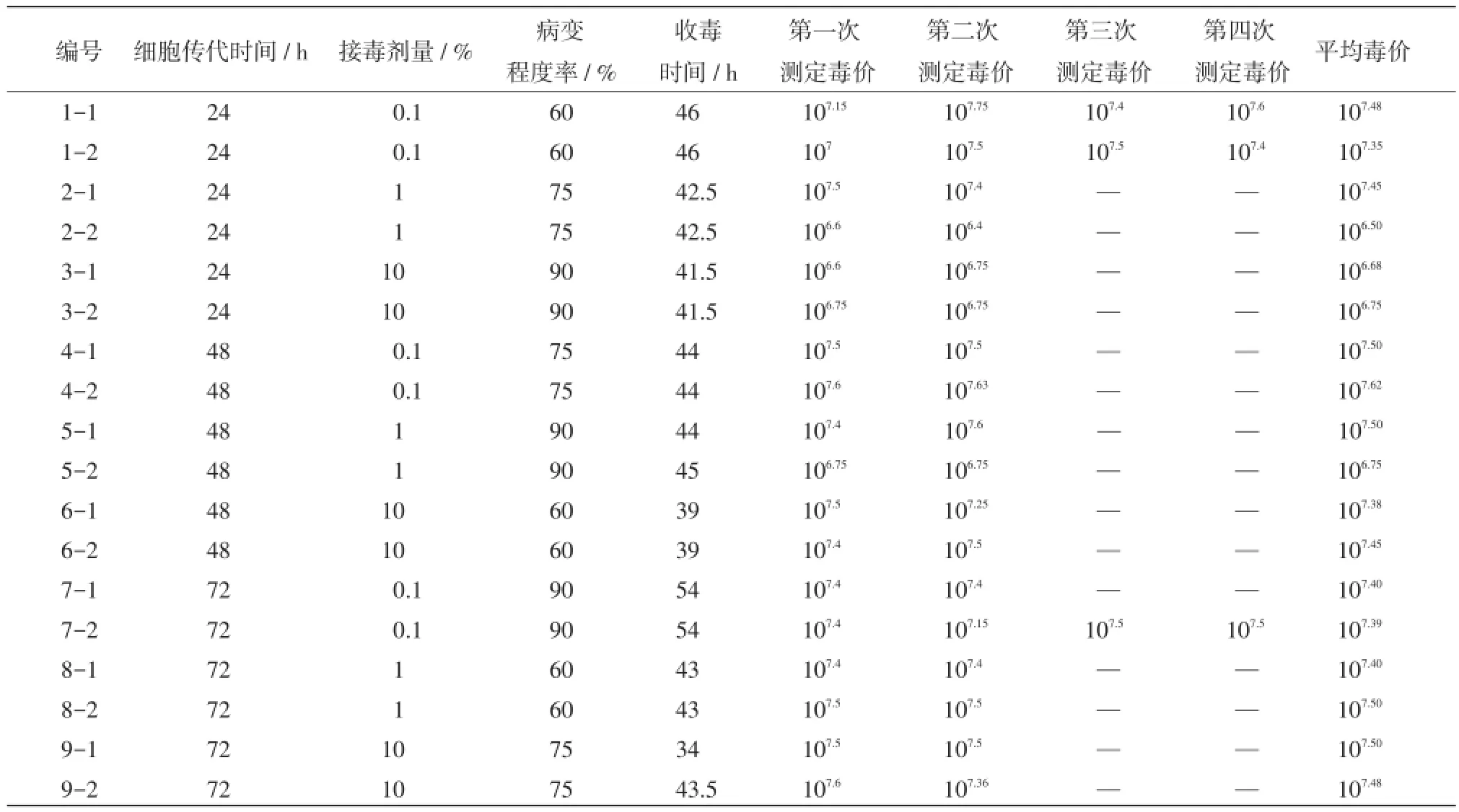
表2 各分组接毒、收毒及毒价测定情况
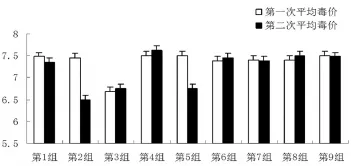
图1 不同试验组的平均毒价分布
利用SPSS软件进行显著性分析,结果与极差分析结果一致。细胞培养72、48 h均显著高于24 h;病变在60%时收毒,显著好于90%;接毒剂量为0.01%时,略好于其他接毒剂量,但差异不显著。
通过上述分析,最佳组合方案为细胞传代后72 h接毒、接毒剂量为0.01%、病变在60%时收毒,预期毒价较好。具体统计分析结果见表3、图2。
表3 正交试验统计分析

图2 不同条件下毒价均值分布情况
4 讨论
由上述试验结果可知,细胞培养144 h接毒,对于腹泻病毒毒价的影响较大。这表明,细胞密度对于腹泻病毒的大量增殖是必要的。因此,提高腹泻病毒毒价,关键是提高Vero细胞的培养密度。那么提高培养密度,除延长细胞培养时间外,还可以通过增大细胞培养面积的方法,例如生物反应器。
此外,在Vero细胞的传代培养过程中发现,试验所用Vero细胞系中存在两种形态的细胞,即马赛克形和梭形(类似柳叶性状)。其中,梭形Vero细胞生长较为迅速、且后期细胞密度较大,对于腹泻病毒增殖较为有利;而马赛克形的细胞则增殖较为缓慢,且后期细胞密度相对较低,对于腹泻病毒增殖可能不利,具体情况还得进一步试验证实。
5 结论
本试验最佳工艺组合为细胞培养72 h接毒,接毒剂量为0.1%,收毒时病变程度为60%;优势组合为:细胞培养72 h接毒,接毒剂量为10%,收毒时病变程度为75%;细胞培养48 h接毒,接毒剂量为0.1%,收毒时病变程度为75%。
[1]Calvo E,Escors D,Lopez J A,et al.Phosphorylation and subcellularlocalization of transmissible gastroenteritis virus nucleocapsideprotein in infected cell[J].J Gen Virol,2005,86:2255-2267.
[2]陈申秒,牛成明,何福庆,等.猪流行性腹泻病毒研究进展及疫苗研究前景[J].中国畜牧兽医,2014,41(3):223-229.
S852.65+1
B
0529-6005(2016)04-0117-02
2014-12-01
山东省自主创新成果转化重大专项(2010ZHZX1A 0417)
陈申秒(1983-),男,助理研究员,硕士,从事动物传染病的诊断与防治工作,E-mail:csmiao.science@163.com
