阿勒泰部分地区放牧马梨形虫病的流行病学调查
2016-11-15宋瑞其王振宝李永畅巴音查汗
宋瑞其,王振宝,张 杨,李永畅,巴音查汗
(1.新疆农业大学动物医学学院,新疆 乌鲁木齐 830052;2.伊犁出入境检验检疫局综合技术服务中心,新疆 伊宁 835000)
阿勒泰部分地区放牧马梨形虫病的流行病学调查
宋瑞其1,王振宝2,张杨1,李永畅1,巴音查汗1
(1.新疆农业大学动物医学学院,新疆 乌鲁木齐 830052;2.伊犁出入境检验检疫局综合技术服务中心,新疆 伊宁 835000)
为了解阿勒泰部分地区放牧马梨形虫病的流行情况,笔者运用前期所建立的TaqMan探针实时荧光定量PCR方法结合传统血涂片镜检方法,对吐尔洪乡、克孜勒希勒克牧场及铁买克乡等3个地区的134匹放牧马进行了马梨形虫病的流行病学调查;经FQ-PCR检测得出,以上3个地区的感染率分别为36.96%,45.76%和31.03%,以克孜勒希勒克牧场最为严重;3个地区均以感染驽巴贝斯虫为主;根据年龄段分析,幼驹的感染率高于成年马匹。应用SPSS软件分析得知,不同地区和不同年龄阶段的马匹感染梨形虫病差异不显著(P>0.05)。结果表明,阿勒泰地区是马梨形虫病的流行地区。
马梨形虫病;实时荧光定量PCR;血涂片镜检法;流行病学调查
马梨形虫病(Equine piroplasmosis)是一种寄生于马属动物的淋巴细胞和红细胞内的蜱源性传染病,又称马焦虫病、马血孢子虫病。病原分为马泰勒虫(Theileria equi)和驽巴贝斯虫(Babesia caballi)。此病主要集中发生于2~6月份和9~11月份等两个时间段。流行区域(自然疫源地)主要包括欧洲、非洲、亚洲、美洲等大部分热带及亚热带地区[1],在我国的甘肃、青海、黑龙江、新疆等多个北方地区常有相关报道[2]。发病初期体温呈间歇热或不定热型,精神不振,食欲减退,眼睑水肿,随继出现贫血、黄疸、出血和呼吸困难等症状,若诊断和治疗不及时,死亡率极高。为此笔者对阿勒泰随机抽取了吐尔洪乡、克孜勒希勒克牧场、铁买克乡等3个地区的无症状放牧马匹进行梨形虫病的检测。旨在了解该地区马梨形虫感染情况,为阿勒泰地区的放牧马群开展有效的马梨形虫病综合防制工作提供可靠的依据。
1 材料与方法
1.1样品来源134份放牧马抗凝血样品,于2014年7月份采自阿勒泰吐尔洪乡(46份)、克孜勒希勒克牧场(59份)、铁买克乡(29份)等3个地区,并现场制作血涂片。
1.2样品DNA提取取马全血200 μL,用北京赛百盛基因技术有限公司提供的树脂型TM基因组DNA提取试剂盒,进行马全血DNA的提取(在高盐状态下,DNA纯化树脂专一性地吸附DNA;而在低盐或水溶液状态下,DNA被洗脱下来)。提取的全血DNA置-20℃保存备用。
1.3试剂与仪器瑞氏-姬姆萨复合染色液:Ⅰ液和Ⅱ液(参照参考文献[3]);树脂型TM基因组DNA提取试剂盒(北京赛百盛基因技术有限公司);10×PCR Buffer、dNTPs、MgCl2、Taq DNA聚合酶宝生物工程(大连)有限公司;ND-2000c型紫外分光光度计(美国Thermo sciencetific公司);7500型荧光定量PCR仪(美国ABI公司)。
1.4引物与探针驽巴贝斯虫和马泰勒虫特异性引物及TaqMan探针均由本实验室建立,由北京鼎国昌盛生物技术有限责任公司合成。
1.5马梨形虫检测方法
1.5.1血液涂片检查将自然晾干的待染色血片水平放置,滴甲醇溶液至完全覆盖血膜,使其固定,自然晾干。滴加I液3滴,使其盖满血膜,室温在15℃左右时可染1 min,然后滴加Ⅱ液[3]6滴,轻轻摇动玻片与染液充分混合1.5 min后,用水冲去染液,待干后镜检。
1.5.2实时荧光定量PCR检测以树脂型TM基因组DNA提取试剂盒提取的马全血DNA为模板,采用实时荧光定量PCR的方法进行目的片段的扩增。检测马泰勒虫与驽巴贝斯虫的反应体系为(25 μL):10×PCR Buffer 2.5 μL,dNTP 2 μL,Mg2+2 μL,上下游引物(10 μmol/L)各0.75 μL,探针P 0.6 μL,rTaq DNA聚合酶 0.3 μL,加去离子水补至25 μL;反应条件为:95℃预变性2 min;95℃变性15 s,共40个循环;56℃退火50 s,每个循环退火延伸可收集荧光信号。
1.5.3统计学分析应用SPSS 19.0软件对134份荧光定量PCR检测全血样本的数据,进行不同地区、不同年龄段、感染率之间的统计学分析。
2 结果与分析
2.1血液涂片检查对阿勒泰地区采集的全血样品进行血涂片镜下观察,吐尔洪乡的46份血液中15份为阳性感染,感染率为19.57%,红细胞的平均染虫率为0.65%;克孜勒希勒克牧场的59份血液中14份为阳性感染,感染率为23.73%,红细胞的平均染虫率为0.70%;铁买克乡的29份血液中9份为阳性感染,感染率为31.03%,红细胞的平均染虫率为0.31%。马梨形虫分为马泰勒虫和驽巴贝斯虫,在显微镜下虫体多位于红细胞的中央。马泰勒虫呈圆形、逗点状;驽巴贝斯虫典型的虫体为双梨形,以其尖端联成锐角,每个虫体有两团染色质块。在一个红细胞内通常只有1~2个虫体染虫。红细胞大部分较完整,有时出现空泡,呈圆盘状,中间凹陷(见图1)。

图1 显微镜下观察梨形虫的部分结果
2.2实时荧光定量PCR检查
2.2.1不同地区马感染梨形虫病的情况荧光定量PCR检测结果显示,阳性样品出现了特异性的S形,阴性样品未出现特异性扩增(见图2)。
根据不同地区分析,吐尔洪乡,克孜勒希勒克牧场和铁买克乡等3个地区放牧马匹,经荧光定量PCR检测马梨形虫的感染率分别为36.96%, 45.76%和31.03%,经传统血涂片检测的感染率分别为19.57%,23.73%和31.03%。由此可得,荧光定量PCR方法灵敏度高且检出率明显高于或等于血涂片镜检方法(见表1)。经统计学分析,不同牧场之间感染梨形虫率差异不显著(P>0.05)。
2.2.2不同年龄段马感染梨形虫病的情况134份血液样本经荧光定量PCR检测后,不同年龄段的马感染梨形虫的情况见表2。

图2 荧光定量PCR检测梨形虫的部分结果
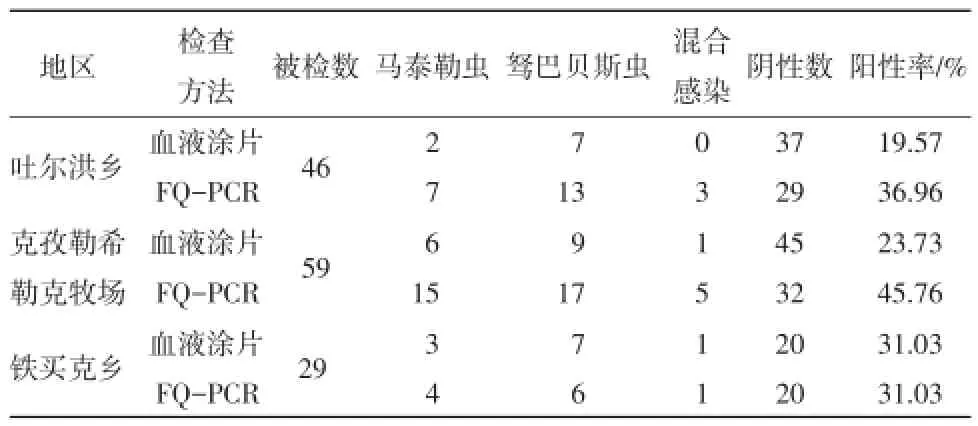
表1 马梨形虫病检查结果

表2 不同年龄段马感染梨形虫的情况
其中,驽巴贝斯虫的总阳性率为26.87%(36/ 134),马泰勒的总阳性率为18.66%(25/134),以感染驽巴贝斯虫为主;按不同年龄分组进行比较,各年龄段的马均可感染马梨形虫。在“<1岁”与“4-6岁”两个年龄段的感染率较高,分别为54.29%(19/35)和41.67%(5/12),幼驹相对易感。经SPSS软件分析,不同年龄段对感染马梨形虫率的影响无显著差异(P>0.05)。见图3。
3 讨论
近年来,马梨形虫病的发病较为普遍,严重影响了畜牧业的发展,一直倍受国内外兽医界关注。目前,马梨形虫病的诊断技术主要有根据临床症状[4-6]和血涂片染色镜检[7]的常规诊断方法、免疫学方法[8-10]、普通PCR方法[11]等,其中实时荧光定量PCR方法是一种特异性、敏感性均较高的方法。因此,本次试验采用实时荧光定量PCR方法对阿勒泰3个地区的放牧马进行了梨形虫病的检测,以此提高检测样本的准确度。

图3 不同年龄段马感染梨形虫的情况
通过本次试验得出,FQ-PCR方法检测的阳性率分别为36.96%,45.76%,31.03%。明显高于血涂片镜检方法检测的阳性率(19.57%,23.73%,31.03%)。为避免荧光定量PCR假阳性干扰,对镜检阴性而荧光定量PCR为阳性的样品进行测序验证。测序结果显示,这些样品均为驽巴贝斯虫及马泰勒虫阳性。表明荧光定量PCR方法检测结果并无假阳性干扰。对荧光定量PCR检测的结果利用SPSS软件分析得知不同牧场之间和不同年龄段之间,对感染马梨形虫病的影响均无显著差异。3个地区中克孜勒希勒克牧场的感染率最高为45.76%;驽巴贝斯虫病(26.87%)的感染率高于马泰勒虫(18.66%);在不同年龄段中幼驹(54.29%)的感染率高于成年马,幼驹较易感[5]。
马梨形虫病的传播必须依赖硬蜱[12],阿勒泰地区有着特殊的地理条件和丰富的草场资源,孳生的蜱虫种类较多,放牧条件下马匹极易受到蜱虫侵扰,这给马匹感染梨形虫提供了有利条件。应对草场和圈舍采用超低容量喷雾进行灭蜱[12],以从传播途径上阻断梨形虫的传播。针对该地区无症状的马匹(均为传染源),荧光定量PCR方法可以灵敏、准确、快速检测的马梨形虫感染与否。将分子诊断技术推广、常规化,可以起到早期诊断的作用[13]。为进一步对该病的诊治提供依据,望相关部门能对本病给予重视,以控制该病的继续蔓延和向更加严重的趋势发展。
[1]Bhoora R,Quan M,Paul T,et al.Sequence heterogeneity in the equi merozoite antigen gene(EMA-1)of Theileria equi and development of an EMA-1-specific TaqMan MGBTM assay for the detection of T.equi[J].Vet Parasitol,2010,27(172):33-45.
[2]谢俊仁,田占成,刘光远,等.马梨形虫病的流行规律和诊断与检测方法研究进展[C].中国畜牧兽医学会家畜寄生虫学分会第六次代表大会暨第十一次学术研讨会论文集,武汉:2011:88-92.
[3]高明巧.介绍改进的瑞氏一姬姆萨复合染色液[J].锦州医学院学报.1991,12(4):246.
[4]刘家国,王德云,张帆,等.1例马驽巴贝斯虫病的诊治[J].畜牧与兽医,2012,44(4):104-105.
[5]潘漳海.马巴贝斯虫病的防治[J].动物医学,2013,4:45.
[6]张满成.马类家畜弩巴贝斯虫病的诊断与防治[J].农技服务,2007,24(9):87.
[7]刘冰,于龙政,贾立军,等.吉林省部分地区马梨形虫病的流行病学调查[J].动物医学进展,2005,26(9):114-115.
[8]Ogunremi O,Georgiadis M P,Halbert G,et al.Validation ofthe indirect fluorescent antibody and the complement fixationtests for the diagnosis of Theileria equi[J].Vet Parasitol,2007,148(2):102-108.
[9]Salim B O,Hassan S M,Bakheit M A,et al.Diagnosis ofBabesia caballi and Theileria equi infections in horses in Su-dan using ELISA and PCR[J].Parasitol Res,2008,103(5):1145-1150.
[10]Asenzo G,Wilkowsky S,Barrandeguy M,et al.Developmentof an indirect ELISA for the diagnosis of equine piroplasmo-sis[J].Ann N Y Acad Sci,2008,1149:235-238.
[11]杨存性,高琪,王祥荣,等.用单克隆抗体检测疟原虫抗原的研究[J].中国寄生虫学与寄生虫病杂志,1987,5(4):248-250.
[12]梁茂茂.蜱虫的危害及防治[J].吉林畜牧兽医,2011,32(9):43-45.
[13]蒋春燕,王泰健,王琴,等.实时荧光定量PCR技术[J].动物医学进展,2005,26(12):97-101.
Epidemiological survey of Piroplasmosis in thegrazing horses in someparts Altay Prefectur
SONG Rui-qi1,WANG Zhen-bao2,ZHANG Yang1,LI Yong-chang1,BA Yinchahan1
(1.College of Animal Medicine,Xinjiang Agriculture University,Urumqi 830052,China;2.Yili Entry-exit Inspection and Quarantine Bureau,Yining 835000,China)
To understand the epidemic situation of grazing horses infected with piroplasmosis from some areas in Altay region,a epidemiological survey was conducted to examine piroplasmosis using Taqman prode-based RTFQ-PCR method and microscopic examination of Giemsa-stained blood smears.Total A total of 134 random samples were detected.The results showed that the infection rate detected by RTFQ-PCR method in Tuerhong,Kezilexileke,and Tiemaike were 36.96%,45.76%,and 31.03%,respectively.The severest region for the infection of piroplasmosis was Kezilexileke.The infection rate of Babesia caballi was higher than that in Theileria equi.The infection rate in foals was higher than that in adult horses.There were no significant differences in horses infected with piroplasmosis from different areas and different ages(P>0.05).The survey confirms that Altay region is an epidemic region of piroplasmosis.
Equine piroplasmosis;Taqman prode-based RTFQ-PCR;microscopic examination of Giemsa-stained bloodsmears;molecular epidemiology
BA Yinchahan
S852.7
A
0529-6005(2016)04-0013-03
2015-04-09
国家自然科学基金-新疆联合基金重点项目(U14-03283);自治区产学研联合培养研究生示范基地项目(xjaucxyyjs-20141003)
宋瑞其(1990-),男,硕士生,研究方向为预防兽医学,E-mail:812084208@qq.com
巴音查汗,E-mail:bynch@hotmail.com
