牦牛源多杀性巴氏杆菌C47-8株外膜蛋白H基因互补株的构建及生物学特性研究
2016-11-15李婷婷张红见
应 兰,李婷婷,张红见,赵 静
(青海大学农牧学院,青海 西宁 810003)
牦牛源多杀性巴氏杆菌C47-8株外膜蛋白H基因互补株的构建及生物学特性研究
应兰,李婷婷,张红见,赵静
(青海大学农牧学院,青海 西宁 810003)
根据GenBanK中发表的多杀性巴氏杆菌(Pasteurella multocida,P.multocida)HN06株(登录号为NC017027)的ompH核苷酸序列设计合成一对特异性引物,将PCR扩增获得的牦牛源P.multocida C47-8的ompH基因片段连接到pMR10载体上,构建了C47-8株ΔompH缺失株互补质粒pMR10-ΔompH,并将该质粒电转化至C47-8ΔompH缺失株中,成功获得其互补菌株。在此基础上,对C47-8亲本株、ΔompH缺失株以及互补株的生物学特性进行研究。形态学观察结果表明,3株菌的生长形态无差异;生化试验结果表明,除了缺失株发酵蕈糖、硝酸盐试验呈现阳性外,3株菌的其余生化特性未发生改变;体外生长曲线表明亲本株C47-8的生长速度比缺失株和互补株的生长速度慢,说明ompH基因对C47-8的生长有显著影响。本试验为深入研究P.multocida的致病机制以及研制安全有效的基因缺失减毒活疫苗奠定了基础。
牦牛;多杀性巴氏杆菌;ompH基因;互补株
牦牛出血性败血症是由多杀性巴氏杆菌(Pasteurella multocida,P.multocida)引起的牦牛的一种以高热、肺炎、间或呈现急性胃肠炎以及内脏器官广泛出血为特征的急性传染病,被列为青海省重点防控的疫病之一。
外膜蛋白H(ompH)是P.multocida的一个主要外膜蛋白,在病原体与宿主的相互作用和细菌感染宿主的过程中发挥关键作用[1]。本研究前期通过构建的P0910ΔompH株对Vero细胞的粘附实验发现,ompH是一种与细胞粘附相关联的重要蛋白。此外,通过P0910ΔompH株对BALB/c小鼠的致病性研究发现,P0910株缺失ompH基因后,对小鼠的致死能力显著下降,表明ompH有可能是多杀性巴氏杆菌的关键毒力因子之一。但是,ompH基因的缺失是否导致P.multocida产生了新的生物学表型?则需要通过遗传操作技术进行证实。本研究旨在为ompH蛋白介导牦牛出血性败血症的致病机制提供理论依据。
1 材料与方法
1.1菌株与质粒C47-8,购自中国兽医药品监察所;C47-8ΔompH缺失株,由本实验室构建保存;质粒PMR10(Ampr),中国农业大学动物医学院动物传染病实验室惠赠。
1.2主要试剂TSB液体培养基、TSA平板、SOC培养基、Bacterial Genomic DNA Extraction Kit、Ta-KaRa Agarose Gel DNA Purification Kit、DH5α,均购自TaKaRa公司。
1.3引物设计与合成根据GenBank中公布的P. multocida HN06株(登录号:NC017027)的ompH基因保守序列设计引物。上游引物Wu3436 5′-GCCCATGGATGAAAAAGACAATCGTAG-3′;下游引物Wu3437 5′-GCGGATCCTTAGAAGTGTACGCGTAAAC-3′,目的基因片段长度1 002 bp,由北京博奥生物有限公司合成。
1.4重组质粒PMR10-ΔompH的构建及鉴定按照文献[3]的方法并加以改进。
1.5C47-8ΔompH互补株构建及鉴定以1∶100的比例将P.multocida C47-8ΔompH接种到TSB液体培养基中,37℃振荡培养4 h,调整菌液浓度到109CFU/mL后与重组质粒pMR10-ΔompH混合至电极杯中,将电极杯放入BIORAD电穿孔仪进行电击,再向电极杯中加入600 μLSOC复苏液,置于37℃振荡复苏1 h。取复苏后菌液涂布于含Amp(100 μg/μL)的TSA琼脂平板,挑取单菌落进行PCR鉴定,扩增产物由北京奥美德诺公司进行测序。
1.6生物学特性试验
1.6.1形态特性观察将C47-8亲本株、ΔompH缺失株以及互补株接种到TSA平板上,37℃培养16~18 h后观察菌落形态,并进行涂片、革兰染色镜检。
1.6.2生化特性鉴定将3个菌株分别接种到14种生化培养基中,37℃培养48 h后观察结果。
1.6.3体外生长曲线的测定按文献[2]的方法测定3个菌株的OD600值,绘制细菌体外生长曲线,每个菌株做3个重复,用SPSS19.0软件进行分析,并根据生长曲线测定出细菌的代时。
2 结果
2.1重组质粒pMR10-ΔompH的构建及鉴定利用引物Wu3436/Wu3437成功扩增出了1 002 bp的C47-8的ompH基因片段,见图1。PCR鉴定重组质粒PMR10-ΔompH,结果见图2。将质粒测序后的结果与GenBank中P.multocida的ompH基因核苷酸序列进行Blast比对,显示重组质粒构建成功。
2.2C47-8-ΔompH互补株的构建及鉴定将重组质粒pMR10-ΔompH电转化至P.multocida C47-8ΔompH缺失株中,获得的阳性菌落经PCR鉴定,显示从构建的互补株中成功扩增出ompH目的基因,见图3。

图1ompH PCR扩增
图2 重组质粒PCR鉴定
图3 C47-8ΔompH互补株PCR鉴定
1:DL-2 000 Marker;2:C47-8 PMR10-ompH
2.3生物学特性研究
2.3.1形态学特性观察将3个菌株在TSA培养基上培养,菌落形态见中插彩版图4、图5、图6。从图中可见这3个菌株的菌落形态及大小差别不大,均呈灰白色露珠状针尖大小菌落。
2.3.2生化特性鉴定将3个菌株分别接种到葡糖糖等14种生化培养基中,结果见表2。
结果表明,除了缺失株发酵蕈糖,硝酸盐试验阳性外,3个菌株其余特性未发生改变。

表1 C47-8亲本株、ompH缺失株以及互补株生化试验结果
2.3.3体外生长曲线的测定将P.multocida菌液每隔1 h测定3次OD600值,将得到的数据用SPSS19.0软件进行统计学分析,并绘制体外生长曲线,结果见图7。
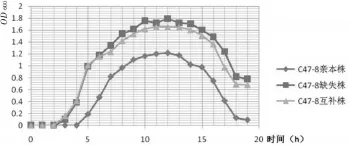
图7 C47-8亲本株、缺失株和互补株体外生长曲线的测定结果
从图7可知,亲本株生长速度较慢,而缺失株和互补株则生长速度较快,由此可以确定ompH基因明显影响了C47-8的生长。
2.3.4根据生长曲线测定出细菌的代时(G)C47-8亲本株代时为1.248 h,缺失株为0.727 h,互补株为0.765 h。表明C47-8亲本株代时最长,互补株居中,缺失株最快,说明ompH基因的缺失影响了P.multocida的生长。
3 讨论
3.1目前,青海省预防牦牛出血性败血症主要使用的是20世纪80年代从黄牛体中分离获得的C45-2全菌灭活苗,但免疫效果差。随着各种病原体反向遗传操作技术体系的建立,越来越多的人将注意力转移到了筛选与疾病流行相符合的地方血清型靶向缺失株,期望通过缺失关键的毒力相关基因,使毒力减弱,但保持免疫原性从而达到控制疾病的目的[3-5]。
3.2本研究前期选择ompH基因作为缺失目标,选用具有阳性Amp抗性基因和蔗糖阴性筛选基因sacB的pEX18AP质粒为缺失载体,成功构建了
3株无抗性基因标记的P.multocida的ompH基因缺失株,构建过程中没有插入新的基因,避免了外源基因对缺失菌株的干扰和潜在的生物安全危险,为基因缺失疫苗的研究提供了可能。
3.3本研究在对牦牛源P.multocida C47-8株外膜蛋白H基因的缺失株和互补株的形态学特性观察研究中发现3个菌株菌落形态没有发生改变,说明ompH不参与菌落形态的维持。生化试验发现C47-8缺失株发酵蕈糖,硝酸盐试验呈阳性,与亲本株和互补株不同,其原因可能是ompH蛋白对P.multocida起着负调控作用。该菌分解蕈糖可以为细菌在宿主细胞中的存活提供相应的碳源和氮源,而ompH基因的缺失使P.multocida的转录不再受到抑制,为细菌供应充足的碳源和氮源,以便细菌的大量繁殖。体外生长曲线表明缺失株和互补株的生长速度比亲本株快,并且缺失株和互补株的菌体繁殖活力比亲本株强,说明ompH基因对C47-8的生长有明显影响,但是该基因具体通过什么方式和途径影响菌体生长?其原因有待于进一步研究。
3.4ompH蛋白作为交叉保护的一种良好的候选抗原受到研究者们越来越多的关注[6]。本试验构建出的牦牛源P.multocida C47-8ΔompH互补株生物学特性试验发现,ompH基因的缺失导致产生了新的生物学表型,为下一步研制P.multocida基因缺失疫苗提供了重要的理论依据。
[1]Hofacre C L,Glisson J R.A serotypic survey of Pasteurella multocida isolated from poultry[J].Avian Dis,1986,30(3):632-633.
[2]曹素芳,黄青云.禽多杀性巴氏杆菌C48-1外膜蛋白H基因亚单位疫苗免疫效果的研究[J].中国兽医科学,200,26(6):464-467.
[3]康艳红.多杀性巴士氏杆菌的研究进展[J].中国畜牧兽医文摘,2013,29(6):34.
[4]王帅涛,宫强,秦翠丽,等.多杀性巴氏杆菌毒力因子、免疫原及重要基因研究进展[J].中国畜牧兽医,2010,37(03):186-188.
[5]魏凤,郭广君,吕素芳,等.伪狂犬病病毒gE/gI双基因缺失株的生物学特性[J].中国兽医学报,2014,34(1):75-82.
[6]Orth J H,Fester I,SiegertP,et al.Substrate specificity of Pasteurella multocida toxin for alpha subunits of heterotrimeric G proteins[J].FASEB J,2013,27:832-842.
Construction and Biological Characteristics of C47-8ompH Complementary Strain ofPasteurella MultocidaIn Yak
YING Lan,LI Ting-ting,ZHANG Hong-jian,ZHAO Jing
(Agriculture and Animal Husbandry College,Qinghai University,Xining 810003,China)
In the present study,a fragment of the outer membrane protein H(ompH)gene from yak P.multocida C47-8 standard strain was amplified to construct complementary plasmid PMR10-ΔompH of mutant strain.Primer were designed bases on P. multocida strain HN06(NC017027),and then the complementary plasmid PMR10-ΔompH was transferred into P.multocida C47-8 ΔompH strain and verified by PCR and sequencing.The biological characteristics for the wild,mutant and complementary strains were studied.The results showed that the morphological and biochemical characteristic of C47-8 ΔompH complementary strain did not change excepting fermentation trehalose and NTT,which are similar to mutant strain.In vitro,growth curves showed that growth rate of deletion mutant was slower than wild and mutant strain and ompH affected the growth of C47-8 strain.The current study will lay the theoretical foundation for the study of pathogenic mechanisms and gene-deleted attenuated vaccine.
yak;Pasteurella multocida;ompH;complementary strain
s:ZHAO Jing;ZHANG Hong-jian
S858.23
A
0529-6005(2016)04-0036-03
2015-12-07
青海省科学技术厅国际合作项目(2013-H-810);国家自然科学基金项目(31560701)
应兰(1990-),女,硕士生,研究方向为预防兽医学,E-mial:YL5586@163.com
赵静,E-mial:zhaojing67926@126.com;张红见,E-mial:707879673@qq.com
