高效液相色谱法测定蔬菜中除虫脲、灭幼脲和杀铃脲残留
2016-11-14郭爱华李堃李敏王玮郭蒙京
郭爱华,李堃,李敏,王玮,郭蒙京
(北京市西城区疾病预防控制中心,北京 100120)
高效液相色谱法测定蔬菜中除虫脲、灭幼脲和杀铃脲残留
郭爱华,李堃,李敏,王玮,郭蒙京
(北京市西城区疾病预防控制中心,北京 100120)
建立高效液相色谱测定蔬菜中除虫脲、灭幼脲和杀铃脲残留的检测方法。蔬菜样品用乙腈提取,经DisQuE分散固相萃取试剂盒净化,C18色谱柱(250 mm×4.6 mm,5 μm)分离,以乙腈-水(68∶32)溶液洗脱,二极管阵列(PDA)检测器检测,外标法定量。在0.02~1.0 mg/L范围内,除虫脲、灭幼脲和杀铃脲的质量浓度与对应的色谱峰面积线性相关,除虫脲和灭幼脲的检出限为0.010 mg/kg,杀铃脲的检出限为0.015 mg/kg。除虫脲、灭幼脲和杀铃脲标准溶液的色谱峰面积的日内相对标准偏差分别为1.03%,1.31%,0.82%(n=6),日间相对标准偏差分别为1.43%,1.56%,1.06%(n=6)。加标回收率为88.7%~108.0%。该方法简单、快速、准确,适合蔬菜中除虫脲、灭幼脲和杀铃脲残留的测定。
蔬菜;除虫脲;灭幼脲;杀铃脲;高效液相色谱法
除虫脲、灭幼脲和杀铃脲属于苯甲酰脲类杀虫剂,是几丁质合成抑制剂,能干扰靶标昆虫体内几丁质合成而导致其死亡,或直接降解昆虫几丁质[1]。因该类杀虫剂对人畜毒性相对较低,并能有效地防治对有机磷、有机氯有抗性的害虫,因而被用于多种农作物的害虫防治。由于该类农药对人类存在潜在危险,2014年国家卫生和计生委发布实施的食品安全国家标准《食品中农药最大残留限量》(GB 2763-2014)[2]规定了食品中除虫脲、灭幼脲和杀铃脲的最大残留量分别为20,3,0.1 mg/kg。目前测定果蔬中苯甲酰脲类农药的色谱方法主要有高效液相色谱法[3-5]、液相色谱-串联质谱法[6-8]、超高效液相色谱-串联质谱法[9]和气相色谱-质谱法[10]。国家标准方法GB/T 5009[11-12]测定除虫脲和灭幼脲亦采用液相色谱法,行业标准方法[13]测定除虫脲和灭幼脲采用高效液相色谱法,测定蔬菜、水果中的苯甲酰脲类农药残留时,需经过提取、净化、浓缩等步骤,使用的二氯甲烷试剂毒性大,采用固相萃取柱净化,过程繁琐且耗时较长,不利于日常样品的批量检测。而质谱法中无论是LC-MS/MS,UPLC-MS/MS,还是GC-MS,仪器均比较昂贵,很多实验室没有配备。笔者建立一种简单、快速、准确、环保的分散固相萃取和高效液相色谱相结合的方法,方法的准确度和精密度好,适用于蔬菜中除虫脲、灭幼脲和杀铃脲残留的日常批量检测。
1 实验部分
1.1主要仪器与试剂
高效液相色谱仪:LC-20AD型,配SPD-M20A二极管阵列检测器(PDA),日本岛津公司;
高速组织粉碎机:AMR600E型,中山市安蜜尔电器实业有限公司;
离心机:Sigma 2-16KL型和1-14型,美国Sigma公司;
涡旋仪:IKA MS3BS25型,德国IKA公司;
甲醇、乙腈、丙酮、石油醚、乙酸乙酯:色谱纯;
氯化钠:优级纯;
灭幼脲标准品:纯度不低于99.8%,标准物质编号为GBW(E) 060895,中国计量科学研究院;
除虫脲标准品:纯度不低于99.8%,标准物质编号为GBW(E) 060893,中国计量科学研究院;
杀铃脲标准溶液:100 mg/L,标准物质编号为GSB 05-1892-2008,农业部环境保护科研监测所;
分散固相萃取试剂盒:DisQuETMExtraction Tube2型,(1)50 mL(6 g无水MgSO4+1.5 g NaAc);(2)2 mL(150 mg无水MgSO4+50 mg PSA),美国Waters公司;
一次性滤膜:0.45 µm;
实验用水为超纯水。
1.2标准溶液的配制
1.2.1除虫脲、灭幼脲标准储备液
分别准确称取50 mg除虫脲、灭幼脲标准品,用甲醇溶解并定容至50 mL,此溶液除虫脲、灭幼脲的质量浓度均为1 000 mg/L。
1.2.2除虫脲、灭幼脲、杀铃脲混合标准系列溶液
准确吸取1.00 mL 1 000 mg/L的除虫脲、灭幼脲标准储备液及10.0 mL 100 mg/L的杀铃脲标准溶液,用乙腈-水(68∶32)溶液定容至100 mL,除虫脲、灭幼脲、杀铃脲标准使用液的质量浓度均为10.0 mg/L。分别吸取10.0 mg/L除虫脲、灭幼脲、杀铃脲标准使用液0.10,0.25,0.50,1.0,2.5,5.0 mL,用乙腈-水(68∶32)溶液定容至50 mL,配制成浓度分别为0.02,0.05,0.10,0.20,0.50,1.0 mg/L的混合标准系列溶液。
1.3色谱条件
色谱柱:Diamonsil C18(2)柱(250 mm×4.6 mm,5 µm);柱温:40℃;检测波长:除虫脲、灭幼脲为256 nm,杀铃脲为247 nm;流动相:乙腈-水(68∶32)溶液;流量:1.0 mL/min;进样体积:20 µL。
1.4实验方法
将蔬菜缩分后切碎,充分混匀,用高速组织粉碎机将样品粉碎成匀浆,制成待测样,备用。称取10 g粉碎样品(精确至0.01 g)于50 mL DisQuETMExtraction Tube2中,加入10 mL乙腈溶液及2 g NaCl,涡旋匀浆3 min,以10 000 r/min离心5 min。取上清液1.2 mL于2 mL DisQuETMExtraction Tube2中,涡旋匀浆1 min,以10 000 r/min离心5 min,取上清液经0.45 µm滤膜过滤后进样测定。同时做空白试验。
2 结果与讨论
2.1提取溶剂的选择
苯甲酰脲类农药不易溶于水,易溶于有机溶剂。实验考察乙腈、丙酮、乙酸乙酯和石油醚4种有机溶剂对除虫脲、灭幼脲和杀铃脲的提取效率及效果,4种溶剂提取效率见表1。结果表明,乙酸乙酯能提取许多大分子的脂质和蜡质的物质,使目标组分色谱峰变形,提取效率无法计算;石油醚的提取效率较低,不能满足实验要求;丙酮和乙腈的提取效率比较好,但丙酮能提取样品中大量油脂和色素,在目标峰前杂质峰响应值太大,当目标组分出峰时响应未回到基线水平;而乙腈除有较好的提取效率外,能沉淀蛋白质、提取的脂肪少,有利于后续的净化。故采用乙腈作为提取溶剂。

表1 4种溶剂的提取效率(添加水平0.5 mg/kg,n=3) %
2.2取样量的选择
分别考察10 g和20 g的蔬菜取样量,结果发现DisQuE分散固相萃取试剂盒能满足10 g和20 g样品的净化要求,但取样量为20 g时,提取溶剂用量少时提取效率低,而提取溶剂用量大时,部分样品(如韭菜、香菜、茴香等)与提取溶剂总体积会接近50 mL DisQuE分散固相萃取试剂盒的容量,涡旋匀浆的空间变小,这样亦会影响提取效率,故本实验选择蔬菜取样量为10 g。
2.3提取溶剂用量的选择
对提取溶剂用量进行考察,准确称取10.00 g样品,分别用10,20,30 mL乙腈提取,经DisQuE分散固相萃取试剂盒净化后,取上清液进样检测,结果发现乙腈用量10~30 mL时回收率相差不大,因此选择提取溶剂乙腈的用量为10 mL,既能降低检出限又可以节省溶剂。
2.4检测波长的选择
除虫脲、灭幼脲的最大紫外吸收波长为256 nm,杀铃脲的最大紫外吸收波长为247 nm,考虑到方法灵敏度,分别选择256 nm和247 nm作为检测波长。
2.5色谱条件的选择
分别以甲醇-水和乙腈-水溶液为流动相,考察流动相组成对3种脲类农药的分离情况。结果表明:以甲醇-水和乙腈-水溶液作为流动相均可将3种脲类农药有效分离,考虑到本实验采用乙腈为提取溶剂,故选择乙腈-水溶液为流动相。进一步对乙腈-水的体积比例进行优化,当乙腈-水体积比为68∶32时,样品杂质峰与3种脲类农药峰达到基线分离,且保留时间适中(20 min内),除虫脲、灭幼脲、杀铃脲混合标准溶液色谱图和黄瓜空白加标样品色谱图分别见图1、图2。
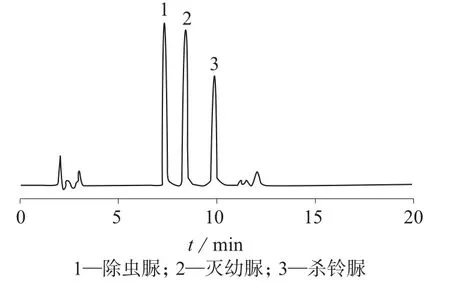
图1 除虫脲、灭幼脲和杀铃脲标准色谱图(1.0 mg/L)
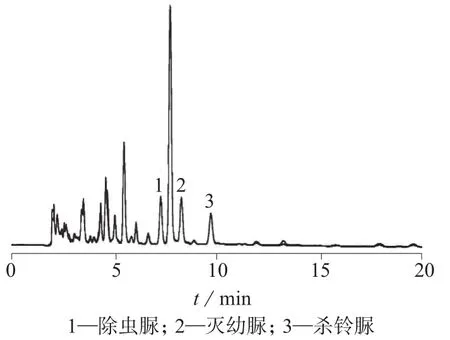
图2 黄瓜空白加标(0.80 mg/kg)样品色谱图
2.6线性范围与检出限
以3种农药的质量浓度为横坐标,色谱峰面积为纵坐标绘制标准工作曲线,结果表明在0.02~1.0 mg/L范围内,3种农药溶液的质量浓度与对应的色谱峰面积线性关系良好,相关系数均大于0.999。以3倍信噪比(3S/N)计算检出限,结果见表2。

表2 3种农药的线性范围、线性方程、相关系数与检出限
2.7精密度试验
2.7.1日内精密度
取除虫脲、灭幼脲和杀铃脲3种脲类农药1.0 mg/L标准溶液,在1.3色谱条件下重复进样6次,记录各自的色谱峰面积,并计算6次测定结果的相对标准偏差作为日内精密度考察指标,测定结果见表3。由表3可知,除虫脲、灭幼脲和杀铃脲3种农药色谱峰面积的相对标准偏差分别为1.03%,1.31%,0.82%。
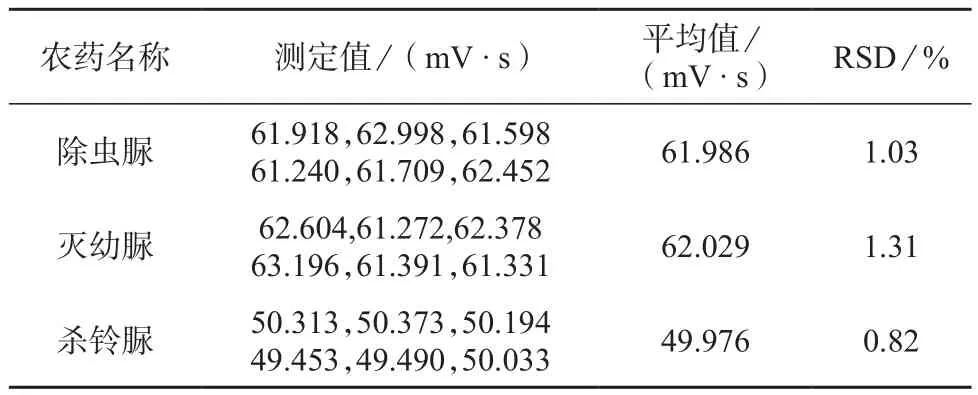
表3 日内精密度试验结果
2.7.2日间精密度
配制除虫脲、灭幼脲和杀铃脲3种脲类农药1.0 mg/L标准溶液,连续6 d进行色谱测定,记录各自的色谱峰面积,并计算6次测定结果的相对标准偏差作为日间精密度考察指标,测定结果见表4。由表4可知,3种农药色谱峰面积的相对标准偏差分别为1.43%,1.56%,1.06%。
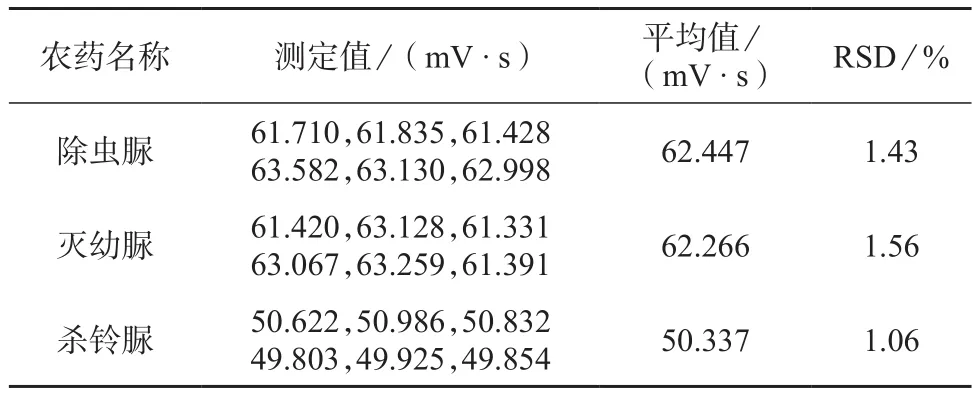
表4 日间精密度试验结果
2.8加标回收试验
选取黄瓜、白菜、番茄、芹菜和扁豆5种蔬菜为样品,分别添加0.10,0.80 mg/kg两个浓度水平,每个浓度做3次平行测定,结果见表5。由表5可知,3种脲类农药的平均回收率为88.7%~108%,满足技术要求。
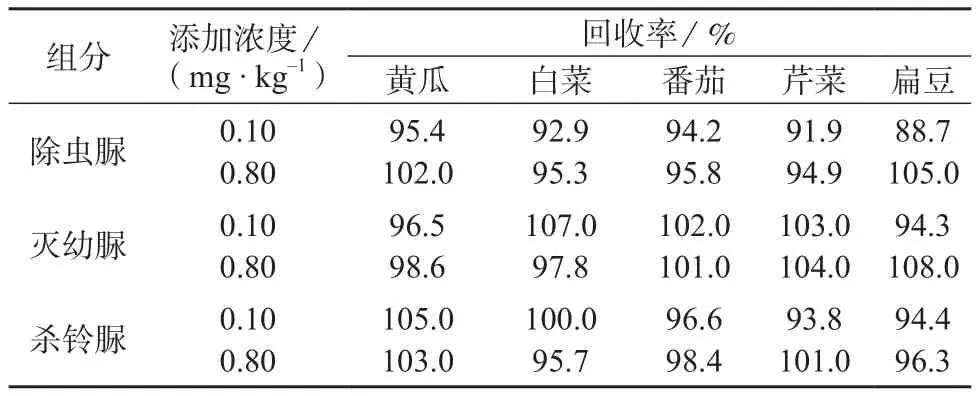
表5 3种农药的加标回收率
3 结语
采用高效液相色谱测定蔬菜中除虫脲、灭幼脲和杀铃脲残留量。蔬菜样品用乙腈直接提取,再用DisQuE分散固相萃取试剂盒净化,提取和净化同时进行,且样品提取液经二步净化,净化效果好;样品的处理过程非常简单,样品溶液不需要浓缩直接过滤即可上机测定,节省了试剂与处理时间;净化时使用已商品化的DisQuE分散固相萃取试剂盒,分散固相萃取剂不用称量,提高了方法的稳定性和重现性。实验结果表明,该方法简单、快速、准确,适合于蔬菜中除虫脲、灭幼脲和杀铃脲残留量的批量测定。
[1] 米娜,王唤,范志金,等.苯甲酰脲类杀虫剂研究进展[J].世界农药,2009,31(增刊Ⅱ)∶ 24-26.
[2] GB 2763-2014 食品安全国家标准食品中农药最大残留限量[S].
[3] 何红梅,吴俐勤,章虎,等.蔬菜中苯甲酰脲类药物残留的测定方法研究[J].分析化学,2006,34(10)∶ 1 379-1 383.
[4] 兰珊珊,刘宏程,黎其万,等.高效液相色谱法同时测定蔬菜和水果中8种农药残留[J].分析科学学报,2011,27(2)∶ 171-174.
[5] 骆冲,万凯,丁晨红,等. RP-HPLC法测定蔬菜、水果及食用菌中9种农药残留的研究[J].分析测试学报,2014,33(6)∶ 698-702.
[6] 丁慧瑛,谢文,周召千,等.蔬菜中11种苯甲酰脲类农药残留的液相色谱-串联质谱法测定[J].分析测试学报,2009,28(8)∶970-974.
[7] 王连珠,周昱,陈泳,等.果蔬中8种苯甲酰脲类农药残留量的液相色谱-串联质谱法测定[J].分析测试学报,2010,29(3)∶289-293.
[8] 艾连峰,王凤池,陈瑞春,等.高效液相色谱-串联质谱法测定水果中7种苯甲酰脲类杀虫药的残留量[J].理化检验:化学分册,2010,46(9)∶ 989-992.
[9] 韩笑,娄喜山,张莉,等.基质固相分散-超高效液相色谱-串联质谱法检测蔬菜中残留的苯甲酰脲类和双酰肼类杀虫剂[J].色谱,2010,28(4)∶ 341-347.
[10] 唐淑军,赖勇,梁幸,等. SPE-GC/MS同时测定蔬菜中除虫脲和灭幼脲残留[J].农药,2010,49(3)∶ 201-203.
[11] GB/T 5009.135-2003 植物性食品中灭幼脲残留量的测定[S].
[12] GB/T 5009.147-2003 植物性食品中除虫脲残留量的测定[S].
[13] NY/T 1720-2009 水果、蔬菜中杀铃脲等七种苯甲酰脲类农药残留量的测定高效液相色谱法[S].
我国首个水下观测网水质在线监测系统问世
此时此刻某个水源的水质情况如何?可以不需要原来的取样、化验、分析滞后的书面报告了,有关部门和关注水质情况的人们只要登录电脑,或打开手机APP就能实时得到有效数据。国内第一个水下观测网水质在线监测系统不久前通过鉴定。据悉,这项新技术打破了国际垄断,填补了国内空白。
据介绍,提供这项高新技术的是中天科技海缆有限公司四名博士组成的专家团队,他们联合浙江大学的专家教授经过较长时间的攻关,终于成功地应用于长江流域的水下观测水质在线监测。据郭朝阳博士介绍,这项系统技术应用起来十分方便,提供的监测数据具有实时、稳定、连续、可靠的优越。
由于世界性水危机,地表水和地下水都遭到了不同程度的污染,水质日益恶化,于是人们对水质监测的神经特别敏感。一项水质报告显示,中国29个重点城市中,只有15个城市中的20项饮用水指标全部合格,约占抽检城市的52%;而14个城市存在一项或多项指标不合格。
据了解,长期以来,我国对水质监测方式停留在传统取样和浮标监测,实时性和可靠性低,而且不能够真正达到原位监测的目的,较为先进的监测系统基本都依赖进口。而中天科技海缆研发的水下观测网集成多种声学、图像、物理、化学、生物等传感观测设备,布设在重要水源底部,进行长期连续、实时、原位观测,并能将原始数据和解算后的参数信息发送至各种信息终端,对饮用水安全和水环境保护有重要的民生价值。
中天科技海缆总经理薛建凌表示,开发具有民生和经济价值的水下观测网水质在线监测系统,对饮用水安全进行全方位的检测和预警,不仅具有重要的社会意义,也为公司提供了新的利润增长点,并能够带动海光缆,海工器件等配套产品的生产和销售,具有良好的市场前景。
该项目组织者杨华勇博士表示,这一系统的研制成功,有效提高监测参数的原位性、实时性和可靠性,同时也为其它应用场合,包括海洋观测、水质水文研究等提供了基础研制条件,将为我国饮用水源监测在内的环保领域的发展提供有力的保障。
(仪器信息网)
Determination of Diflubenzuron, Chlorbenzuron and Triflumuron Residue in Vegetables by HPLC
Guo Aihua, Li Kun, Li Min, Wang Wei, Guo Mengjing
(Xicheng District Center for Disease Control and Prevention, Beijing 100120, China)
HPLC method was established for determination of diflubenzuron, chlorbenzuron and triflumuron residue in vegetables. The samples were extracted with acetonitrile and purified by DisQuE dispersive solid-phase extraction kit,and then, it was separated on a C18column (250 mm×4.6 mm, 5 µm) with mobile phase of acetonitrile-water(68∶32) solution, diode array was used as a detector to collect signals, the quantification was determined by external standard method. There was a linear relationship between chromatographic peak area and concentration for diflubenzuron, chlorbenzuron and triflumuron at the range of 0.02-1.0 mg/L, the detection limit of diflubenzuron and chlorbenzuron was 0.010 mg/kg,the detection limit of triflumuron was 0.015 mg/kg. The inner-day RSD of peak area for the standard solution of diflubenzuron, chlorbenzuron and triflumuron were 1.03%, 1.31%, 0.82%(n=6), respectively. The intra-day RSD of peak area for the standard solution of diflubenzuron, chlorbenzuron and triflumuron were 1.43%, 1.56%, 1.06%(n=6), respectively. The range of recovery rate were 88.7%-108.0%. The method was simple, rapid, accurate and suitable for determination of diflubenzuron, chlorbenzuron and triflumuron residue in vegetables.
vegetables; diflubenzuron; chlorbenzuron; triflumuron; HPLC
O657.7
A
1008-6145(2016)03-0061-04
10.3969/j.issn.1008-6145.2016.03.016
联系人:郭爱华;E-mail∶ gah_yjx@163.com
2016-03-22
