不良环境对溶藻弧菌胱硫醚-β-合成酶活力及抗氧化系统的影响
2016-11-12陈树河常云胜刘晖晖
陈树河,常云胜,刘晖晖,周 维,丁 燏
(广东海洋大学水产学院 // 广东省水产经济动物病原生物学及流行病学重点实验室,广东 湛江 524088)
不良环境对溶藻弧菌胱硫醚-β-合成酶活力及抗氧化系统的影响
陈树河,常云胜,刘晖晖,周 维,丁 燏
(广东海洋大学水产学院 // 广东省水产经济动物病原生物学及流行病学重点实验室,广东湛江524088)
研究非适宜的pH、温度和盐度条件,以及抗生素胁迫和添加外源H2S条件下溶藻弧菌胱硫醚-β-合成酶(cystathionine-β-synthase,CBS)、超氧化物歧化酶(superoxide dismutase,SOD)和过氧化物酶(peroxidase,POD)的活力及谷胱甘肽(glutathione,GSH)含量的变化,分析CBS与抗氧化系统的相关性,探讨不良环境对CBS活性及抗氧化系统的影响。结果表明,在非适宜温度、盐度及抗生素胁迫下,溶藻弧菌的CBS活力均高于对照组,差异有统计学意义(P<0.05)。在非适宜温度下,其SOD和POD的活力及GSH含量均有不同程度的提高(P<0.05)。在非适宜盐度下,GSH含量上调(P<0.05)。在红霉素和壮观霉素胁迫下,SOD和POD活力均上调(P<0.05),而庆大霉素和四环素胁迫则分别提高SOD、POD活力(P<0.05)。在非适宜pH条件下,低pH上调CBS、SOD和POD的活力及GSH含量 (P<0.05);高pH条件下CBS活力与对照组差异无统计学意义(P>0.05),SOD活力较对照组下降(P<0.05)。相关性分析发现,在不同温度、盐度条件下及抗生素胁迫下CBS活力与SOD、POD活力及GSH含量之间具有显著正相关(P<0.05),而在不同pH条件以及抗生素+NaHS处理后,CBS活力与SOD、POD活力及GSH含量之间的相关性无统计学意义(P>0.05)。溶藻弧菌可通过提高CBS活力以调节其抗氧化系统,从而抵御不良环境,而外源H2S则提高溶藻弧菌SOD活力和GSH水平以维持溶藻弧菌正常生理活动。
不良环境;溶藻弧菌;胱硫醚-β-合成酶;抗氧化系统
(Staphylococcus aureus)及大肠杆菌(Escherichia coli)
的 SOD活力,上调细菌抗氧化能力。因此推测,内源性H2S亦能提高POD活力及GSH含量,以进一步强化抗氧化系统。微生物胱硫醚-β-合成酶(cystathionine-β-synthase,CBS)是一种H2S合成酶,可通过酶促反应合成内源性H2S,故CBS的活力与H2S的生物合成量正相关。
溶藻弧菌(Vibrio alginolyticus)为人鱼共患病原菌[7-8],严重威胁着人类的健康和水产养殖业的发展。当前在水产养殖上使用的抗生素[9]和消毒剂[10]等均可引起弧菌的氧化应激反应,导致细菌产生过量活性氧自由基(Reactive oxygen species,ROS),从而加强其杀菌效果。然而,溶藻弧菌的抗氧化系统能清除过量ROS,以保持其胞内氧化和抗氧化的稳态。目前在溶藻弧菌中仅发现cbs这一硫化氢合成酶基因,可以推测,该硫化氢合成酶基因在调节抗氧化系统中起不可替代作用。故此,本研究在不同 pH、温度和盐度以及抗生素胁迫条件下测定CBS、SOD和POD的活力及GSH含量,探讨CBS对不同外界条件的响应及其与抗氧化系统的关系,同时添加外源 H2S补充物(NaHS),进一步确定H2S对溶藻弧菌抗氧化系统的调控作用。
1 材料与方法
1.1材料
1.1.1菌株溶藻弧菌(Vibrio alginolyticus HY9901)分离自患病红笛鲷的伤口处,经分子生物学鉴定后由广东省水产经济动物病原生物学及流行病学重点实验室保种。
1.1.2主要药品及试剂盒红霉素(erythromycin)、四环素(tracyclin)、庆大霉素(gentamicin)、壮观霉素(spectinomycin)及NaHS(纯度≥98%)购自广州威佳生物有限公司,SOD、CAT和GSH试剂盒购自南京建成有限公司,微生物胱硫醚-β-合成酶(CBS)ELISA试剂盒购自上海将来生物公司。
1.2方法
1.2.1NaSH及4种抗生素母液的配制NaSH母液:称取0.336 36g NaSH,溶于20 mL灭菌双蒸水,配成300.0 mmol/L的母液,密封保存,现配现用。
红霉素母液:称取0.01g红霉素,溶解于12.5 mL无水乙醇,配制成 800.0μg/mL母液,用0.22μm滤膜过滤,分装于- 20℃处保存。
四环素母液:称取0.01g四环素,溶解于100.0 mL灭菌双蒸水,配制成100.0μg/mL的母液,用孔径0.22μm的滤膜过滤,分装于- 20℃处保存。
庆大霉素母液:称取0.016g庆大霉素,溶解于10 mL灭菌双蒸水,配制成1 600.0μg/mL的母液,用0.22μm滤膜过滤,分装于- 20℃处保存。
壮观霉素母液:称取0.064g壮观霉素,溶解于10 mL灭菌双蒸水,配制成 6 400.0μg/mL母液,用0.22μm滤膜过滤,分装于- 20℃处保存。
1.2.2实验方案
1.2.2.1不同pH条件的设置将盐度为20的TSB培养基分别用HCl或NaOH调pH至5.5、7.2(对照)及10.0。溶藻弧菌经活化后,取1 mL溶藻弧菌接种于29 mL的TSB培养基中,于 28℃、200r/min条件下培养至D(600 nm)值达0.5后,离心收集菌体。经磷酸缓冲液PBS洗涤2次后,收集菌体,重悬于PBS,用超声波破碎菌体至澄清,按照试剂盒说明书检测CBS、SOD和POD的活力及GSH含量。每个pH梯度设置3个平行。
1.2.2.2不同温度条件的设置将盐度为 20、pH为7.2的TSB培养基以1.2.2.1方法接种溶藻弧菌,分别置于 15、28(对照)、37℃的摇床中培养至D(600 nm)值达0.5,离心收集菌体。参照1.2.2.1的方法收集菌体、超声波破碎细胞并用试剂盒检测各相关指标。每个温度梯度设置3个平行。
1.2.2.3不同盐度条件的设置将pH为7.2的TSB培养基分别用NaCl调盐度至5.0、10.0、20.0(对照)、80.0和100.0,以1.2.2.1的方法接种溶藻弧菌、培养、收集菌体、超声波破碎细胞,用试剂盒检测各相关指标。每个盐度梯度设置3个平行。
1.2.2.4抗生素胁迫及添加外源 H2S补充物(NaHS)的设置将溶藻弧菌接种于盐度为20.0、pH为7.2的TSB培养基中,置于28℃的摇床中培养至D(600 nm)值达0.5后,分装30 mL菌液至10个灭菌离心管中,其中4管分别加入红霉素、四环素、庆大霉素、壮观霉素母液,4管分别加入红霉素+NaSH、四环素+NaSH、庆大霉素+NaSH、壮观霉素+NaSH,使抗生素浓度达 1/2 MIC[11],NaSH终浓度为3.0 mmol/L,1管仅添加终浓度3.0 mmol/L的NaSH(阴性对照),以仅有菌液的离心管为空白对照组。每处理组设置3个平行组。各组继续培养2h后,参照1.2.2.1方法收集菌体、超声波破碎细胞,用试剂盒检测各相关指标。
1.2.3数据处理与分析所得数据用SPSS 17.0 软件进行单因素方差分析(one-way ANOVA )后,以平均值±标准差表示。若组间存在显著性差异,则通过Duncan法进行多重比较检验,P<0.05时差异有统计学意义。用SPSS 17.0 软件分析CBS活力与SOD和POD活力及GSH含量间的相关性,P<0.05表示相关性有统计学意义。
2 结 果
2.1pH条件对溶藻弧菌的CBS活力及其抗氧化系统的影响
由表1可知,在pH 5.5和pH 10.0条件下,单位菌体中CBS活力平均值均有所提高,在pH 5.5条件下,CBS活性与对照组差异有统计学意义(P<0.05)。在pH 5.5~10.0范围内,SOD的活力随着pH上升而下降(P<0.05);POD活力,pH为5.5和10.0与对照组差异无统计学意义,但两组间差异有统计学意义(P<0.05)。GSH的含量在pH 5.5条件大于其他pH条件下的两组(P<0.05),pH 10.0组与对照组差异无统计学意义(P>0.05)。

表1 pH对溶藻弧菌CBS活性及其抗氧化系统的影响Table 1 Effects of different pH on CBS enzyme activity and antioxidant system of Vibrio alginolyticus
2.2温度条件对溶藻弧菌的CBS活力及其抗氧化系统的影响
由表2可知,CBS的活力在15℃和37℃条件下高于28℃时的水平(P<0.05)。而SOD和POD活力及GSH水平在15~37℃范围内呈先减少后增加趋势,且在15℃和37℃条件下,该2种酶活力和GSH水平均高于在28℃时,差异有统计学意义(P<0.05)。与高温条件相比,低温条件更能大幅上调菌体中CBS、SOD和POD活力及GSH水平。

表2 温度对溶藻弧菌CBS活性及其抗氧化系统的影响Table 2 Effects of different temperature on CBS enzyme activity and antioxidant system of Vibrio alginolyticus
2.3盐度条件对溶藻弧菌 CBS活力及其抗氧化系
统的影响
由表3可知,高盐组CBS活力,SOD和POD的活力高于盐度 20对照组,差异有统计学意义(P<0.05),而低盐组该3个指标与对照组差异无统计学意义(P > 0.05)。高盐组与低盐组GSH水平均高于对照组,差异有统计学意义(P<0.05)。
2.4抗生素胁迫及添加外源 H2S对溶藻弧菌的CBS活力及其抗氧化系统的影响
由表4可知,与空白对照组相比,4种抗生素胁迫均可上调CBS活力(P<0.05)。同时,红霉素、庆大霉素及壮观霉素胁迫均提高 SOD活力(P< 0.05),但四环素胁迫并不能引起溶藻弧菌SOD活力上升(P>0.05)。此外,红霉素、四环素、壮观霉素胁迫下 POD活力提高(P<0.05),但经庆大霉素胁迫后 POD活力与空白对照组差异无统计学意义(P>0.05)。分析发现,各抗生素胁迫组 GSH含量与空白对照组差异无统计学意义(P>0.05)。
表4可见,添加NaHS后,各抗生素组CBS活力与其未添加 NaHS组的差异无统计学意义(P>0.05);各抗生素组SOD活力较其未添加NaHS组提高(P<0.05),GSH含量亦较其未添加NaHS组升高(P<0.05);红霉素、庆大霉素组的POD活力较其未添加NaHS组上升(P<0.05),四环素、壮观霉素组 POD活力较其未添加 NaHS组下降(P<0.05);阴性对照组CBS、SOD和POD活力及GSH含量水平较空白对照组提高,差异有统计学意义(P<0.05)。
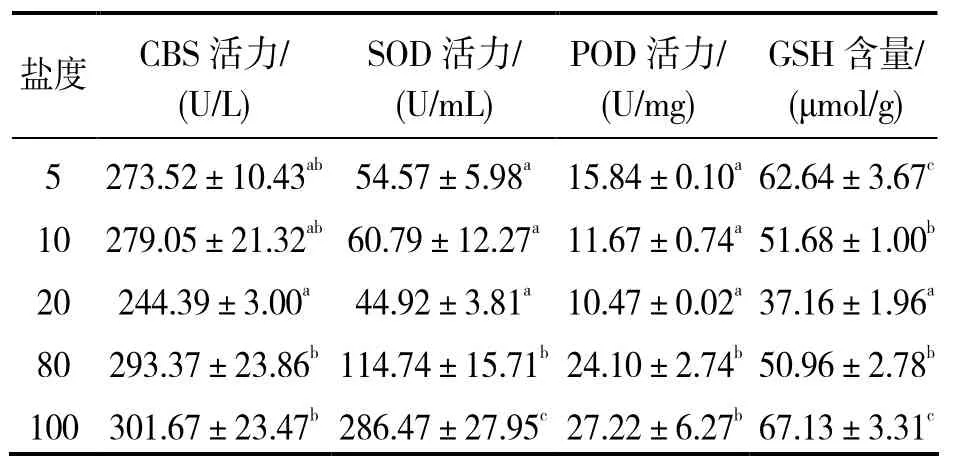
表3 盐度对溶藻弧菌CBS活性及其抗氧化系统的的影响Table 3 Effects of different salinity on CBS enzyme activity and antioxidant system of Vibrio alginolyticus

表4 外源H2S对溶藻弧菌CBS活力及其抗氧化系统的影响Table 4 Effects of exogenous H2S on CBS enzyme activity and antioxidant system of Vibrio alginolyticus
2.5CBS活力与SOD、POD活力及GSH含量的相关性分析
由表5可知,在不同pH条件下,CBS的活力与SOD活力(r = 0.419,P>0.05)和POD活力(r = 0.471,P>0.05)达中等强度的正相关,与GSH含量的相关性(r = 0.656,P>0.05)达到强正相关,但相关性无统计学意义。而在不同温度条件下,CBS的活力与SOD活力(r = 0.819,P<0.01)、POD活力(r = 0.822,P<0.01)及GSH含量(r = 0.871,P<0.01)均达到极强正相关。同时,在不同盐度条件下,CBS的活力与SOD活力(r = 0.539,P<0.05)、POD活力(r = 0.552,P<0.05)及GSH含量(r = 0.549,P<0.05)的相关性均达显著的中等程度正相关。相似地,在抗生素胁迫下,CBS的活力与SOD活力(r = 0.762,P<0.01)、POD活力(r = 0.612,P<0.05)及GSH含量(r = 0.727,P<0.01)之间呈显著的强相关。然而,经外源H2S补充物处理后,CBS的活力与 SOD活力(r = - 0.281,P>0.05)、POD活力(r = - 0.155,P>0.05)及GSH含量(r = - 0.076,P>0.05)之间呈极弱的负相关。

表5 CBS活力与SOD、POD活力及GSH含量的相关性分析Table 5 Coefficients between CBS activity and SOD,POD activity or GSH content
3 讨 论
3.1pH对溶藻弧菌CBS活力及抗氧化系统的影响
pH条件会影响生物细胞的生理活动,在非适宜pH环境下可显著增加细胞内ROS[12],甚至引发细胞DNA的损伤[13],最终导致细胞死亡。溶藻弧菌生长的适宜pH为6~9[14],最适pH为7.2[11],超出此pH范围会对溶藻弧菌生长造成不利影响。本研究中,低pH和高pH均可提高溶藻弧菌CBS活力,表明在非适宜pH条件下,溶藻弧菌通过提高CBS活力而增加H2S生物合成量,从而调节其抗氧化系统,以消除过量的ROS。但在高pH条件下,POD活力和GSH含量较最适pH时并无显著变化,且SOD活力显著下降。有研究指出,非适宜pH可影响抗氧化相关酶的活性[15]。据此推测,高pH可能抑制了谷胱甘肽还原酶(Glutathione reductase,GR)活力,使GSH生成量维持在低水平,同时高pH亦显著抑制SOD、POD的活力,抵消了H2S上调抗氧化系统的效果。
3.2温度对溶藻弧菌CBS活力及抗氧化系统的影响
非适宜温度往往会引发机体产生应激反应,导致细胞内 ROS不断积累。而生物膜上的脂质物质被 ROS攻击后产生丙二醛(Malondialdehyde,MDA)等有害氧化产物[16],并影响细胞膜上磷脂分子的排布、细胞周质的流动性,也使蛋白质等大分子物质的结构出现异常[17-21],对细胞的功能和完整性造成伤害[22],使细胞正常生理代谢出现障碍。溶藻弧菌的适宜生长温度为17~ 35℃[23],最适生长温度为 28℃[11],超出范围会对其造成一定程度的不利影响,甚至使其进入活的非可培养(viable but non-culturable,VBNC)状态[24]。本研究中,非适宜温度下(15、37℃)的CBS活力较最适温度(28℃)时显著上升,SOD和POD活力及GSH水平亦较最适温度时显著上调,表明在低温和高温环境下,溶藻弧菌清除 ROS的能力提高,并通过上调CBS活力以增加H2S的生物合成,从而提高SOD和POD的活力及GSH含量水平,以对抗非适宜温度所致的胞内氧化应激反应。
3.3盐度对溶藻弧菌CBS活力及抗氧化系统的影响
溶藻弧菌生长的盐度范围为20~80,其最适盐度为 20~30[25],超出该范围,溶藻弧菌主动从环境中摄盐或排盐,以维持内环境的离子平衡,这需要消耗细胞内储存的能量以完成渗透压的主动调节,进一步导致 ROS的增加[26-27];而在极端盐度下Na+/-K+-ATP酶蛋白结构会受到暂时性或不可逆的破坏[28],使得细胞无法完成调节渗透压的生理过程,最终导致细胞死亡。本研究中,CBS、SOD和POD的活力及GSH水平在20.0的盐度条件下最低。在低于或高于20.0的盐度条件下,随着CBS的活力提高,SOD和POD的活力及GSH含量水平亦有不同程度的上调,表明溶藻弧菌在低盐和高盐的条件下,通过提高CBS活力而上调抗氧化系统中的抗氧化酶活力和非酶抗氧化物含量,从而对抗由非适宜盐度所造成的环境压力。此外有研究表明,内源性H2S还具有调节离子通道的作用[29],因此猜测溶藻弧菌可通过提高CBS的酶活以增加H2S的生物合成,从而调节Na+/-K+-ATP酶蛋白活力,这间接地增强其抵抗非适宜盐度的能力。
3.4抗生素胁迫及添加NaHS对溶藻弧菌CBS活力及抗氧化系统的影响
抗生素的杀菌机制因种类而异,多数抗生素均可干扰微生物的电子传递链,使细胞内产生过量的ROS,影响细胞正常生理功能[30]。因此,微生物的抗氧化系统在其对抗抗生素毒害过程中发挥重要作用。本研究中,在4种抗生素胁迫下,溶藻弧菌CBS活力显著上升,SOD和POD的活力及GSH水平亦有不同程度的上调。这说明溶藻弧菌在遭受抗生素胁迫后,细胞内 ROS大量累积,需通过上调SOD和POD活力及GSH含量而清除过量的ROS。因此,溶藻弧菌通过提高CBS活力而促进H2S的生物合成,从而上调抗氧化系统中的抗氧化酶活力和非酶抗氧化物的含量,以抵抗抗生素胁迫。
有报道指出,H2S可调节生物细胞的抗氧化系统,以对抗农药的毒害,有助于生物细胞的存活[31]。H2S在环境胁迫下可保持呼吸链复合体Ⅱ的活性[32],对维持细胞内电子传递链的完整性至关重要。本研究表明,在抗生素胁迫下添加外源H2S补充物NaHS后,溶藻弧菌SOD活力及GSH含量较空白对照组及抗生素胁迫组显著提高,但CBS活力较抗生素胁迫组差异不明显,且经四环素+NaHS、壮观霉素+NaHS处理后,溶藻弧菌POD较四环素、壮观霉素胁迫组降低。其原因可能是,在遭受抗生素胁迫时,溶藻弧菌为维持机体正常生理活动,菌体会上调CBS活力以促进H2S生成,从而抵御不良环境。而添加NaHS后,溶藻弧菌毋需上调CBS活力以增加H2S的生物合成,甚至下调其活力而减少能量消耗。而H2S作为还原性气体,可能与ROS及SOD歧化产物直接反应,进而使菌体内H2O2等过氧化物含量下降,使POD的活力维持在低水平,但这需作进一步研究。此外,本研究发现,外源性H2S并不对溶藻弧菌CBS有调节作用,而是直接提高SOD活力及GSH含量水平,以清除胞内过量的ROS,但具体作用机制尚需进一步研究。
3.5CBS活力与SOD、POD活力及GSH含量间的相关性
本研究表明,在不同pH条件下,溶藻弧菌的CBS活力与SOD、POD活力及GSH含量之间有一定相关性,但不显著。而在不同温度、盐度及抗生素胁迫条件下,CBS活力与SOD、POD活力及GSH含量间的相关性均极其显著,这进一步说明溶藻弧菌可通过上调H2S含量以提高其抗氧化系统的相关指标,从而抵抗不良环境。然而,添加外源H2S补充物NaHS后,CBS活力与SOD、POD活力及GSH含量之间呈极微弱的负相关,表明在该条件下SOD、POD活力及GSH含量的显著提高与CBS活力并无显著关联,而与外源H2S有直接的关系。
综上所述,溶藻弧菌可通过提高其CBS活力以促进内源性 H2S的生成,从而上调抗氧化系统中SOD和POD的活力及GSH含量水平,为其抵御各种不良环境提供有效的生存策略。此外,本研究亦证实了外源性H2S在溶藻弧菌中对抗氧化系统的调节作用,但其具体机制用待深入研究。
[1]DING Y,LIU Y,JIAN J C,et al.Molecular cloning and expression analysis of glutathione reductase gene in Chlamydomonas sp.ICE-L from Antarctica [J].Marine Genomics,2012,5:59-64.
[2]付瑞燕,陈坚,李寅.谷胱甘肽/谷胱甘肽过氧化物酶系统在微生物细胞抗氧胁迫系统中的作用[J].生物工程学报,2007,23 (5):771-774.
[3]CASTELLANO I,MARO A D,RUOCCO M R,et al.Psychrophilic superoxide dismutase from Pseudoalteromonas haloplanktis:biochemical characterization and identification of a highly reactive cysteine residue[J].Biochimie,2006,88(10):1377-1389.
[4]BARLOY-HUBLER F,CHERON A,HELLEGOUARCH A,et al.Smc01944,a secreted peroxidase induced by oxidative stresses in Sinorhizobium meliloti 1021 [J].Microbiology,2004,150(3):657-664.
[5]CARMEL-HAREL O,STORZ G.Roles of the glutathione-and thioredoxin-dependent reduction systems in the Escherichia coli and Saccharomyces cerevisiae responses to oxidative stress [J].Annual Reviews in Microbiology,2000,54(1):439-461.
[6]SHATALIN K,SHATALINA E,MIRONOV A,et al.H2S:A universal defense against antibiotics in bacteria [J].Science,2011,334:986-989.
[7]ARDIÇ N,OZYURT M.Case report:Otitis due to Vibrio alginolyticus [J].Mikrobiyoloji Bülteni,2004,38(1/2):145-148.
[8]LIU P C,LIN J Y,HSIAO P T,et al.Isolation and characterization of pathogenic Vibrio alginolyticus from diseased cobia Rachycentron canadum[J].Journal of Basic Microbiology,2004,44(1):23-28.
[9]AL-OTHRUBI S M Y,CHEAH Y K,MIRHOSSEINI H,et al.Antibiotic resistance of Vibrio parahaemolyticus Isolated from cockles and shrimp sea food marketed in Selangor,Malaysia[J].Clinical Microbiology,2014,3(3):1-7.
[10]AIASSA V,BARNES A I,ALBESA I.Resistance to ciprofloxacin by enhancement of antioxidant defenses in biofilm and planktonic Proteus mirabilis[J].Biochemical and Biophysical Research Communications,2010,393:84-88.
[11]郑玉琦.溶藻弧菌耐四种抗生素的蛋白质组学研究[D].湛江:广东海洋大学,2011.
[12]LIU W H,AU D W T,ANDERSON D M,et al.Effects of nutrients,salinity,pH and light:dark cycle on the production of reactive oxygen species in the alga Chattonella marina [J].Journal of Experimental Marine Biology and Ecology,2007,346(1/2):76-86.
[13]ZHOU J,WANG W N,MA G Z,et al.Gene expression of ferritin in tissue of the Pacific white shrimp,Litopenaeus vannamei after exposure to pH stress[J].Aquaculture,2008,275(1-4):356-360.
[14]钱荣华.溶藻弧菌主要毒力相关基因的克隆、表达及其免疫原性研究[D].杭州:浙江大学,2007.
[15]文春根,张丽红,胡宝庆,等.pH 对背角无齿蚌(Anodonta oodiana) 5 种免疫因子的影响[J].南昌大学学报 ( 理科版 ),2009,33(2):173-176.
[16]张桐,徐奇友,许红,等.不同温度下不同蛋白水平对镜鲤(Cyprinus carpio L.)非特异性免疫的影响[J].东北农业大学学报,2010,41 (12):80-85.
[17]CHINNUSAMY V,ZHU J,ZHU J K.Cold stress regulation of gene expression in plants[J].Trends in Plant Science,2007,12(10):444-451.
[18]KRASENSKY J,JONAK C.Drought,salt,and temperature stress-induced metabolic rearrangements and regulatory networks[J].Journal of Experimental Botany,2012,63(4):1593-1608.
[19]MCCLUNG C R,DAVIS S J.Ambient thermometers in plants:from physiological outputs towards mechanisms of thermal sensing[J].Current Biology,2010,20(24):R1086-R1092.
[20]RUELLAND E,ZACHOWSKI A.How plants sense temperature [J].Environmental and Experimental Botany,2010,69(3):225-232.
[21]STROM A R,KAASEN I.Trehalose metabolism in Escherichia coli:stress protection and stress regulation of gene expression [J].Molecular Microbiology,1993,8(2):205-210.
[22]WINSTON G W.Oxidants and antioxidants in aquatic animals [J].Comparative Biochemistry and Physiology Part C:Comparative Pharmacology,1991,100(1):173-176.
[23]HÖRMANSDORFER S,WENTGES H,NEUGEBAUR-BÜCHLER K,et al.Isolation of Vibrio alginolyticus from seawater aquaria [J].International Journal of Hygiene and Environmental Health,2000,203(2):169-175.
[24]DU M,CHEN J,ZHANG X,et al.Characerization and resuscitation of viable but nonculturable Vibrio alginolyticus VIB283 [J].Archives of Microbiology,2007,188(3):283-288.
[25]周泽军.溶藻弧菌Ⅲ型分泌系统分子伴侣护航蛋白VscO的功能研究[D].湛江:广东海洋大学,2013.
[26]YE L,JIANG S,ZHU X,et al.Effects of salinity on growth and energy budget of juvenile Penaeus monodon[J].Aquaculture,2009,290(1):140-144.
[27]PILLAI B R,DIWAN A D.Effects of acutesalinity stress on oxygen consumption and ammonia excretion rates of the marine shrimp Metapenaeus monoceros [J].Journal of Crustacean Biology,2002,22(1):45-52.
[28]孙鹏,彭士明,尹飞,等.盐度对条石鲷幼鱼Na+/-K+-ATP酶活力的影响[J].水产学报,2010,38(8):1204-1209.
[29]LI L,ROSE P,MOORE P K.Hydrogen sulfide and cell signaling[J].Annu Rev Pharmacol Toxicol,2011,51:169-187.
[30]MOLS M,ABEE T.Primary and secondary oxidative stress in Bacillus[J].Environmental Microbiology,2011,13(6):1387-1394.
[31]QABAZARD B,LI L,GRUBER J,et al.Hydrogen sulfide is an endogenous regulator of aging in Caenorhabditis elegans [J].Antioxidants & Redox Signaling,2014,20(16):2621-2630.
[32]ELROD J W,CALVERT J W,MORRISON J,et al.Hydrogen sulfide attenuates myocardial ischemiareperfusion injury by preservation of mitochondrial function [J].Proceedings of the National Academy of Sciences,2007,104 (39):15560-15565.
(责任编辑:刘庆颖)
Influence on Cystathionine-β-Synthase and Antioxidant System of Vibrio alginolyticus under Adverse Environment
CHEN Shu-he,CHANG Yun-sheng,LIU Hui-hui,ZHOU Wei,DING Yu
(Fisheries College,Guangdong Ocean University // Guangdong Provincial Key Laboratory of Pathogenic Biology and Epidemiology for Aquatic Economic Animals,Zhanjiang 524088,China)
The influences on the activity of cystathionine-β-synthase (CBS),superoxide dismutase(SOD),peroxidase (POD),and content of glutathione (GSH) of Vibrio alginolyticus under the conditions of unsuitable pH,temperature,salinity or antibiotic stress and exogenous hydrogen sulfidedonor NaHS were studied,and the correlation between CBS and antioxidant system was analyzed.The result shows that the activity of CBS was improved significantly under the unsuitable temperature and antibiotic stress than controls(P<0.05).The activity of SOD,POD and the content ofGSH were also upregulated on the condition of unsuitable temperature (P<0.05).Under the stress of erythromycin and spectinomycin,the activity of SOD and POD were upregulated (P<0.05),and gentamicin and tracyclin could also improve the activity of SOD and POD (P<0.05),respectively.Under the condition of unsuitable pH,low pH not only improved the vitality of CBS but also upregulated SOD,POD activity and GSH content(P<0.05),whereas the vitality of CBS did not show significant difference to the control and SOD activity down-regulated (P<0.05) under high pH.On the condition of unsuitable salinity,low and high salinity could also improve GSH content,while the activity of CBS was increased only in the treatment of unsuitable salinity (P<0.05).After the treatment of antibiotics+NaHS,CBS activity were not improved significantly (P>0.05),while SOD activity and GSH content were upregulated (P<0.05).Correlation analysis indicated that there was positive correlation between CBS activity and SOD,POD activity or GSH content under different temperature,salinity and antibiotic stress(P<0.05),whereas CBS activity and SOD,POD activity or GSH content under the condition of different pH and antibiotics+NaHS were not significantly correlative (P>0.05).In conclusion,improved CBS can help V.alginolyticus to resist the adverse environmental by adjusting antioxidant system.Exogenous hydrogen sulfide can directly improve the vitality of SOD and GSH content of V.alginolyticus to maintain its normal physiological activities.
adverse environment; Vibrio alginolyticu; cystathionine-β-synthase; antioxidant system对微生物而言,非适宜的 pH、温度和盐度及抗生素胁迫等不良环境条件均可导致细胞产生过量的活性氧自由基(Reactive oxygen species,ROS),从而对其生长繁殖造成不良影响。研究发现,抗氧化系统(Antioxidant system)在微生物对抗不良环境过程中发挥着关键作用[1-2]。抗氧化系统由抗氧化酶与非酶抗氧化物两部分组成,其中以超氧化物歧化酶(Superoxide dismutase,SOD)[3]和过氧化物酶(Peroxidase,POD)[4]为代表的抗氧化酶和在非酶抗氧化物中扮演重要角色的谷胱甘肽(Glutathione,GSH)[5]在抗氧化过程中的作用备受关注。在微生物中,SOD可将超氧化物歧化成氧气和过氧化氢,发挥解毒作用。POD可以过氧化氢等过氧化物为底物生成水,该作用过程与过氧化氢酶(Catalase,CAT)相似。GSH不具有酶活性,但可与含亲电中心的化合物反应而起清除自由基作用。可见,微生物通过抗氧化系统中的抗氧化酶和非酶抗氧化物提高抵抗不良环境的能力,以利于自身的生长、繁殖和扩散。目前,对抗氧化系统调节的研究较多,然而与抗氧化系统中H2S调节机制的相关报道还相对有限。Shatalin等[6]研究发现,内源性H2S可提高炭疽杆菌(Bacillus anthracis)、绿脓假单胞菌(Pseudomonas aeruginosa)、金黄色葡萄球菌
Q559
A
1673-9159(2016)04-0066-07
10.3969/j.issn.1673-9159.2016.04.011
2016-05-04
广东省自然科学基金 (2014A030313604);广东海洋大学“创新强校工程”2013年省奖补资金支持建设项目——高校重大科研项目培育计划(第3类)(Q14196(2013050207));广东省教育厅高等学校高层次人才项目“谷胱甘肽及其合成酶系在哈氏弧菌耐药中的作用机制研究”。
陈树河,男,硕士研究生,研究方向为海洋生物学。E-mail:cshgdou@163.com
丁燏(1971-),男,博士,教授,研究方向为海洋微生物与水产病害,E-mail:dingy@gdou.edu.cn
