光谱质量和光子照度对酸化环境中珊瑚代谢的影响
2016-11-12廖宝林肖宝华杨小东谢子强
廖宝林,肖宝华,2,杨小东,谢子强
(1.广东海洋大学深圳研究院,广东 深圳 518108,2.广东海洋大学,广东 湛江 524088,3.深圳市碧海蓝天海洋科技有限公司,广东 深圳,518108)
光谱质量和光子照度对酸化环境中珊瑚代谢的影响
廖宝林1,肖宝华1,2,杨小东1,谢子强3
(1.广东海洋大学深圳研究院,广东 深圳 518108,2.广东海洋大学,广东 湛江 524088,3.深圳市碧海蓝天海洋科技有限公司,广东 深圳,518108)
以霜鹿角珊瑚(Acropora pruinosa)、稀杯盔形珊瑚(Galaxea astreata)、盾形陀螺珊瑚(Turbinaria peltata)为研究对象,研究光照对酸化环境中的珊瑚钙化的调节作用。结果表明,光照条件下,随着pH降低,光照钙化率(GL)下降,且光子照度越低钙化率越低;酸化环境中,不同光谱低光强(LL)条件下GL、GL/GD(暗环境钙化率)比值小于高光强(HL)环境,GL变化率大于HL环境,稀杯盔形珊瑚尤为明显,酸化对石珊瑚GL的影响在高光强环境(HL)中受抑制。酸化环境中霜鹿角珊瑚总光合作用效率(PG)在 HL条件下降低速率明显小于LL,稀杯盔形珊瑚和盾形陀螺珊瑚则无差异,光子照度对酸化环境中不同珊瑚的 PG调节效果不同;GL和 PG、GL变化率和PG变化率间的线性相关性显示HL加强了PG,且可能加强GL,由于PG可能受限于pCO2,且HL条件下,酸化减缓了pCO2对PG的抑制作用。低光子照度下珊瑚对酸化环境比较敏感。
造礁石珊瑚;光谱;光子照度;酸化;光合作用效率;钙化率
工业革命之后,大气CO2量在过去650 000 a从280 mg/L上升到2009年的387 mg/L,其中约1/3溶于表层海水[1],并形成碳酸改变了维持 pH稳定的碳酸盐/碳酸氢盐缓冲系,碳酸根离子浓度减低,仅1个世纪,霰石饱和度从4.6降至4.0[2-4],若大气CO2危机继续降低[4],最终将引起海水酸化。海洋酸化(OA)降低石珊瑚的钙化率[5]。近几十年整个珊瑚礁系统中珊瑚生长呈下降趋势,引起了珊瑚礁的溶解和生态系统的变化[6-8]。预计世纪 CO2排放继续升高,pH降低或海洋酸化(OA)对未来珊瑚礁生长和功能将起灾难性破坏[9]。目前,关于pCO2(pH)或酸化对珊瑚礁生物化学和生态学过程的机制研究较多[10],但这一机制作用过程同时受到温度[11]、光照、可利用的有机营养盐、无机营养盐[12-13]等其他环境因子影响,各因子间的相互作用共同影响珊瑚礁生长速率和生产力[14]。珊瑚钙化和光合作用是光依赖性的,两种机制紧密相关联[15]。光对钙化与光合作用过程的影响效果极为相似[16],可使珊瑚对海水温度、盐度等更加敏感[17-18],但将来径流变化、海平面上升[19]、大气变化[20]无疑将改变珊瑚礁光环境,进而有可能改变礁环境。因此,在研究石珊瑚钙化过程中同时考虑光环境和海水酸化两种影响因子,将能更好了解未来珊瑚生长趋势。
本研究以霜鹿角珊瑚、丛生盔形珊瑚、盾形陀螺珊瑚为研究对象,以当前徐闻珊瑚礁区海水 pH 7.95~7.99为基础,模拟碱化和酸化环境,以3种光谱光照各自亚饱和和饱和钙化率光子照度为干扰条件,通过双因子实验来检验光对酸化环境中 3种珊瑚代谢的调节作用。
1 材料与方法
1.1实验材料采集与暂养
霜鹿角珊瑚(Acropora pruinosa)、稀杯盔形珊瑚(Galaxea astreata)、盾形陀螺珊瑚(Turbinaria peltata)来徐闻珊瑚礁国家级自然保护区,自2015年3月份采集后立即浸水转运至浸水转运养殖池内暂养,暂养海水直接从珊瑚礁区引入,经冷暖机稳定水温26℃,每天换水1次,换水量30%,水处理维生系统循环水流速度4 t/h,保持水体稳定。养殖池左右两侧配备两组造浪泵,间歇式运转造浪。
1.2仪器设备
1.2.1工具
KeibaPL-726S剪切钳;阿隆发Gel-10胶水;4cm × 4cm陶瓷底座;微孔0.45 µm滤膜过滤;1 000 mL具塞三角瓶。
1.2.2设备单个尺寸 1 200mm × 600mm × 600mm珊瑚养殖缸2个;T5HO 2 × 80 W灯具,T5海水蓝 25000K、T5 绿色 10000K、T5高效红13000K灯管;海利-冷水机 HC-1000BH 1HP;托普云农-TP-PH-1光合有效辐射传感器;梅特勒-托利多便携式 pH计 FG2;荧光法溶氧 RDO电极(Thermo Scientific Orion RDO®)。
1.3实验方法
1.2.1单枝实验珊瑚移植待整株珊瑚暂养 48h恢复正常生长状态后,将整株珊瑚截肢为高度 2cm,形状规则、含有完整螅体的单枝实验珊瑚,3种珊瑚共126株。将单枝实验珊瑚粘附在陶瓷底座上,集中暂养,确保破碎组织得到完全恢复,暂养条件同上。于养殖缸进行光处理研究结束后,所有单枝实验珊瑚移植至自然海域生长。
1.2.2双因子实验采用 0.04 mol/L NaHCO3,0.024 mol/L Na2CO3,0.056 mol/L NaOH,0.1 mol/L HCl溶液调节设置8.05、8.00、7.95、7.90、7.85、7.80 6个pH梯度。提供光谱波峰范围430~460 nm、530~560 nm、610~640 nm的光照(对应灯管为T5海水蓝 25000K、T5 绿色10000K、T5高效红13000K,灯具为T5HO 2 × 80 W),根据前期光照研究分析结果(图1),每种光谱设置亚饱和、饱和钙化率光子照度 (定义为低光子照度VS高光子照度;LL vs.HL),3种光谱都分别取值 120和240 µmol·m-2·s-1。
共设置 1个暗处理对照组和 6个光照实验组(表1),每个光照实验组包括一种光谱、一种光子照度、3种珊瑚、6个pH梯度。均在玻璃缸内置同一高度、45°倾斜悬挂54只内盛800 mL新鲜过滤海水的具塞三角瓶,从暂养池内随机选取三种单枝珊瑚各 18株平均分配并平铺于具塞三角瓶底,每种珊瑚、每个pH梯度3个重复,7组实验共使用126株单枝珊瑚。所有玻璃槽内水位浸没至具塞三角瓶表面500mL刻度线,三角瓶和玻璃槽内水温通过冷暖机保持在26~26.5℃。
每组实验周期为 4h,实验前后采用碱性异常技术[21]快速检测每一只瓶内水体总碱度[c(A),µmol·L-1]和溶解氧量[c(O2),µmol·L-1]。通过测定的c(A)和c(O2)变化分析珊瑚代谢过程[22],包括光照条件下的钙化率(GL,mol·cm-2·h-1);暗环境条件下的钙化率(GD,mol·cm-2·h-1);净光合作用效率(PN,mg·cm-2·h-1);暗呼吸作用效率(R,mg·cm-2·h-1);总光合作用效率(PG= PN+R,mg·cm-2·h-1)。

表1 实验设计Table.1 Design of testing

图1 不同光谱、光子照度下霜鹿角珊瑚、稀杯盔形珊瑚、盾形陀螺珊瑚钙化率Fig.1 Calcification rates in the light(GL,mol·cm-2·h-1)for nubbins grown under different light wavelength and intensity for Acropora pruinosa,Galaxea astreata and Turbinaria peltata.
1.3数据分析
采用SPSS 22.0 for Windows统计软件进行数据统计分析,以α = 0.05和α = 0.01作为差异显著水平,描述性统计值采用平均值±标准误(M±S.D)表示。单因素方差和多重比较(Duncan)分析不同光谱、光子照度对酸化环境中珊瑚GL、PG、GL变化率、PG变化率的影响;多因素方差分析珊瑚种类、光谱特征、光子照度对酸化环境中GL和PG变化率的影响,其中将GL转化为GL变化率[GL(pH7.95)-GL(pH7.85))/ GL(pH7.95)],GD、PG相似处理;相关分析和回归分析酸化环境中GL与PG、PN、GD、R之间的相关关系。
2 结果与分析
波长430~460 nm、530~560 nm、610~640 nm光谱不饱和光子照度(LL)和饱和光子照度(HL)条件下,随着pH降低,霜鹿角珊瑚、稀杯盔形珊瑚、盾形陀螺珊GL、PG变化率差异显著(P<0.05)。碱性环境中(pH8.05~8.00)pH降低0.5个单位,3种珊瑚GL和PG变化率都较小,LL条件下,GL变化率盾形陀螺珊瑚较高,霜鹿角珊瑚较低;HL条件下,GL、PG变化率霜鹿角珊瑚较高,盾形陀螺珊瑚较低。在酸性环境中(pH7.95~7.80),随着pH值的降低,GL、PG变化率都较高,当pH低于7.90时,每降低0.5个单位,变化率进一步增大。总体来说,随着pH降低,GL、PG降低的速率在HL时低于LL(图2~图4)。

图2 不同波长光谱、光子照度对酸化环境中霜鹿角珊瑚代谢率变化的调节作用Fig.2 Percent change of metabolic rates with decreasing pH(ocean acidification)for Acropora pruinosa nubbins under different light wavelength and intensity
在pH8.05~7.90之间,随着pH降低,GL变化率逐步降低,但在HL条件下降低幅度较小。在430~460 nm光谱HL条件下,霜鹿角珊瑚、稀杯盔形珊瑚、盾形陀螺珊瑚GL降低比例分别为4.7~8.8%、1.5~7.5%、1.9~11.1%,而在LL条件下分别为4.2~17.4%、2.5~17.3%、2.5~16.2%;在530~ 560 nm光谱HL条件下,GL降低比例分别为3.4~9.1%、2.1~8.3%、1.9~11.2%,在LL条件下分别为3.9~16.6%、1.5~17.0%、1.1-21.6%;在610~640 nm光谱HL条件下,GL降低比例分别为0.9~13.6%、2.1~4.7%、1.3~6.3%,在LL条件下分别为3.2~20.7%、4.9~11.2%、1.2~17.0%。这种酸化环境中,不同光谱LL条件下GL变化率大于HL,说明酸化不严重时,高光强对酸化环境中珊瑚钙化过程作用效果明显,GL降低速率减缓,尤其是稀杯盔形珊瑚表现更为明显(图2~图4)。
同样地,随着pH降低,PG也逐步降低。在430~460 nm光谱HL条件下,霜鹿角珊瑚、稀杯盔形珊瑚、盾形陀螺珊瑚 PG降低比率分别为 2.9%~21.0%、5.1%~27.6%、13.5%~20.9%,而在LL条件下分别为 0.4%~13.4%、0.9%~20.1%、5.3%~13.6%;在530~560 nm光谱HL条件下,PG降低比例分别为7.2%~21.8%、4.3%~19.6%、12.2%~24.7%,在LL条件下分别为8.9%~21.0%、0.8%~3.9%、4.2%~26.5%;在610~640 nm光谱HL条件下,PG降低比例分别为 6.9%~15.6%、4.5%~12.2%、10.3%~33.9%,在LL条件下分别为9.7%~22.8%、4.1%~12.3%、8.7%~15.0%。这种酸化环境中,不同光谱HL和LL条件下PG变化率无显著差异,说明光子照度HL或LL条件下,酸化对珊瑚光合作用效率影响效果相似(图 2~图4)。
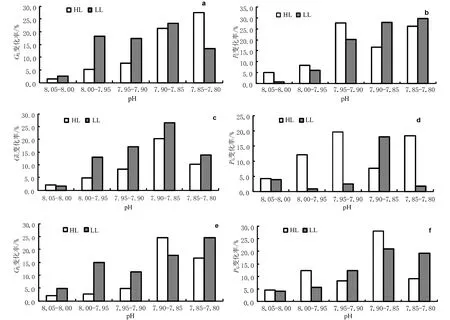
图3 不同波长光谱、光子照度对酸化环境中稀杯盔形珊瑚代谢率变化的调节作用Fig.3 Percent change of metabolic rates with decreasing pH(ocean acidification)for Galaxea astreata nubbins under different light wavelength and intensity
pH7.90~7.80之间,随着pH降低,GL降低速率进一步加快。霜鹿角珊瑚GL在HL条件下降低速率明显小于LL,稀杯盔形珊瑚和盾形陀螺珊瑚GL在HL和LL条件下降低速率差异不显著,说明酸化严重的环境中,GL是否受光子照度调节是具有石珊瑚种类特异性的。同样地,PG降低速率也进一步加快。霜鹿角珊瑚PG在HL条件下降低速率明显小于LL,稀杯盔形珊瑚和盾形陀螺珊瑚PG在HL和LL条件下降低速率差异不显著,说明酸化严重的环境中,PG是否受光子照度调节也是具有石珊瑚种类特异性的。这种酸化环境中,不同光谱HL和LL条件下PG变化率无显著差异,说明光子照度HL或LL条件下,酸化对珊瑚光合作用效率影响效果相似(图2~图4)。

图4 不同波长光谱、光子照度对酸化环境中盾形陀螺珊瑚代谢率变化的调节作用Fig.4 Percent change of metabolic rates with decreasing pH(ocean acidification)for Turbinaria peltata nubbins under different light wavelength and intensity
GD变化率类似于光照条件下的GL,随着酸化作用加强而降低,而且 GD降低速率不断升高,从pH8.0的到7.80,3种珊瑚GD降低速率都近似于10倍(图5)。GL/GD比值随着酸化作用加强而增大,pH8.05~7.90之间,GL/GD增大较慢,当pH小于7.90,GL/GD升高速率加快。不同波长光谱、同一pH条件下,3种珊瑚GL/GD比值无显著性差异,说明光谱特性对酸化环境中珊瑚的钙化过程没有影响;但不同光子照度条件下GL/GD比值显著性差异( p<0.05),GL/GD比值在HL条件下明显高于LL条件,霜鹿角珊瑚、稀杯盔形珊瑚、盾形陀螺珊瑚GL/GD比值在HL条件下变化范围分别为7.2~19.0、8.1~11.0、6.6~10.6,在LL条件下变化范围分别为 3.8~5.9、4.4~5.3、3.5~5.3(图 6)。相对于LL,HL条件下的、GL变化率降低,GD不受光照调节,使GL/GD比值在HL条件下大于LL,说明光子照度对酸化环境中珊瑚的钙化过程具有调节作用。

图5 pH降低过程中霜鹿角珊瑚、稀杯盔形珊瑚和盾形陀螺珊瑚暗环境钙化率(GD)变化Fig.5 Percent change of dark Calcification rates with decreased pH(from 8.05 to 7.80)for Acropora pruinosa ,Galaxea astreata and Turbinaria peltata

图6 不同波长光谱、光子照度对酸化环境中3种珊瑚GL与GD比值的影响Fig.6 Variation of ratio of light-dependant calcification rates:dark Calcification rates with ocean acidification under different light wavelength and intensity
从表2可以看出,珊瑚种类、光谱、光子照度、pH各自对GL、PG变化率的主效应是极显著的,种类和波长、种类和光子照度,光谱和光子照度,光子照度和pH两两间对GL、PG变化率的交互效应是显著的,种类、光谱和光子照度三者对 GL、PG变化率的交互效应是显著的,种类、光谱、pH三者间和种类 、光谱、光子照度、pH四者间对PG变化率的交互效应也是显著的。

表2 多因子方差分析珊瑚种类、光谱波长、光子照度、pH对GL和PG降低的影响Table 2 Summary of Multivariate Variance Analysis examining for the influence of species,light spectral,light intensities and pH upon % loss of calcification(GLand PG)with ocean acidification

续表2 (Continued)
从图7-a可以看出,在不同光谱、光子照度、酸化条件下,3种珊瑚GL和PG间具有紧密的相关性。霜鹿角珊瑚(PG=2.771×GL+1.2,r2=0.863,n=36,P<0.05)、稀杯盔形珊瑚(PG=2.592×GL+2.364,r2=0.827,n=36,P<0.05)、盾形陀螺珊瑚(PG=2.727×GL+1.708,r2=0.783,n=36,P<0.05)。GL和PG间的线性正相关性说明HL加强了总光合作用效率,进而可能加强了珊瑚钙化率,珊瑚钙化作用效率受限于总光合作用效率,但后者受限于其它因素。
从图7-b可以看出,酸化环境中,不同光谱条件下霜鹿角珊瑚、稀杯盔形珊瑚GL和PG变化率间具有一定的线性正相关性,霜鹿角珊瑚(r2=0.521,n=30,P<0.05)、稀杯盔形珊瑚(r2=0.516,n=30,P<0.05),而盾形陀螺珊瑚 GL和 PG变化率间不具有线性正相关性(r2=0.015,n=30,P>0.05)。说明酸化环境中HL因减缓了光合作用效率降低速率,进而可能减缓了珊瑚钙化作用效率的降低。
3 讨论
研究表明酸化影响珊瑚早期发育包括精子的移动[23]、受精[24]、幼虫的变态附着[25]、共生藻的进入[26]、附着变态发育后的钙化与生长[27]。本研究中,酸化时,3种珊瑚GL、PG、GD同步降低,尽管降低的速率不同,而且HL条件下,GL与PG、GL变化率与 PG变化率间存在线性相关性,说明酸化可能通过引起新陈代谢能量抑制来降低钙化率或生长率。当光子照度小于最大钙化率光饱和度时,酸化对GL和PG影响最强。其中HL条件下,海水中pCO2浓度可能起重要作用,使排除对 PG的限制[28],从而通过光加强钙化机制(LEC)促进 GL升高。这里需要指出,酸化引起的 GL变化不同于日常钙化(GL和GD通过昼夜的累计比重计算得到),只是一个用来衡量酸化对珊瑚生长影响的标准[29]。因为,一个针对过去酸化实验的代谢结果统计分析发现,酸化对珊瑚生长的影响通过浮重测量的结果小于GL的测量[30]。
酸化环境中光子照度引起 LEC作用,反过来GL将补偿溶解从而增加钙化率。然而,关于 LEC的调节过程仍有较多争议[31]。LEC的具体调节机制仍有多种说法,如光合作用加强了钙化过程中产生质子的中和能力[32],提供ATP能量用于钙化作用代谢的消耗[33]。通常OH-的释放源于虫黄藻内HCO3-与 H+转化为 CO2,使钙化空间便于 CO2扩散和CaCO3沉淀。根据这种机制,光合作用饱和光子照度条件下,酸化影响LEC这一过程的前提是pCO2能够成为限制因子[34]。
因与共生藻共生的霜鹿角珊瑚、稀杯盔形珊瑚、盾形陀螺珊瑚本身更加依赖于通过光合作用机制来满足各自的新陈代谢需求,而不是呼吸作用,在HL环境下最容易受pCO2限制,因此OA反而对此影响较小。本研究中HL对酸化环境中的珊瑚钙化率具有促进作用,但不同石珊瑚种类 GL受光子照度调节效果有差异,以稀杯盔形珊瑚表现尤为明显,霜鹿角珊瑚GL在HL条件下降低速率也明显小于 LL,尽管稀杯盔形珊瑚和盾形陀螺珊瑚 GL在HL和LL条件下降低速率差异不显著。其它研究也表明有些依赖于高光合效率的珊瑚种类,如鹿角珊瑚科、滨珊瑚科珊瑚,在类似OA的处理过程中具有一个较宽的GL和PG变化范围[35]。实际上这些种类的GL和PG变化差异性与其对钙化液体pH与外部环境 pH或Ω的调节作用的敏感性有关,包括随着海水H+上升,从珊瑚体内到周围海水H+流动减缓[36],或者不依赖于光合作用产生能量,但也不可能依赖于呼吸作用[37]。不论哪种情况,钙化过程对于外部环境pH变化的敏感性是不同的。尤其是那些对于外部环境pH变化不敏感的珊瑚种类,如滨珊瑚[37]。
大气pCO2上升,OA(海洋pCO2上升)通常伴随海洋温度的上升[38-39]。然而,未来珊瑚礁的光环境受物理稳定性变化(岩层、水流、云层)和陆海相互作用(淡水径流引起的沉积物、富营养化[40-41],也面临着险峻。本研究结果表明光对OA引起的石珊瑚钙化率下降有调节作用,尤其是稀杯盔形珊瑚,因此对于准确推断未来珊瑚礁对于环境改变的适应性是非常重要的。生活在深水区珊瑚,因进入海底的光线较弱,可利用光的减少,增加了珊瑚礁珊瑚抵抗类似的光-温度压力的难度,如那些快速生长型的较敏感的珊瑚种类,尤其是鹿角珊瑚科[42]。因此,低光照条件下生长的这些种类,正如我们研究中观察到的,对酸化敏感性的加强,可能会降低这些潜在的阻力。或者,在抑制OA的影响中,要想光起到更加积极的作用,这就不可避免的需要珊瑚种类有能力适应高光(HL)环境、面对更直接的压力情况,如温度异常、富营养化等。
研究结果表明,光对OA环境中珊瑚的影响具有珊瑚种属特异性(specific-specific),因此OA和光照将可能成为驱动未来石珊瑚种群分布扩散的关键因子之一。因此,对珊瑚礁资源变化趋势预测研究中,需要进一步探讨光在珊瑚生长和分布过程中扮演的潜在角色,解释光对海洋酸化趋势下的珊瑚生长钙化、多样性的缓解机制或作用。同样,还需要进一步模拟未来水下光环境变化条件,研究珊瑚礁生态系统模型,并作出更多分析,这有利于未来礁对气候变化的准确预测。
[1]SABINE C.L,FEELY R.A,GRUBER N,et al.The oceanic sink for anthropogenic CO2[J].Science,2004,305(5682):367-371.
[2]FEELY R.A,SABINE C.L,LEE K,et al.Impact of anthropogenic CO2on the CaCO3system in the oceans[J].Science,2004,305:362-366.
[3]ORR J.C,FABRY V.J,AUMONT O,et al.Anthropogenic ocean acidification over the twenty-first century and its impact on calcifying organisms[J].Nature,2005,437(7059):681-686.
[4]KLEYPAS J A,FEELY R A,FABRY V J,et al.Impacts of ocean acidification on coral reefs and other marine calcifiers:a guide for future research[R].NSF,NOAA,2006..
[5]CHAN N C S,CONNOLLY S R.Sensitivity of coral calcification to ocean acidification:a meta-analysis[J].Glob.Change Biol,2013,19(1):282-290.
[6]ANDERSSON A J,KUFFNER I B,MACKENZIE F T,et al.Net loss of CaCO3from a subtropical calcifying community due to seawater acidification:mesocosm-scale experimental evidence[J].Biogeosciences,2009(8):1811-1823.
[7]KROEKER K J,MICHELI F,GAMBI M C.Ocean acidification causes ecosystem shifts via altered competitive interactions[J].Nature climate change,2012,3(2):156-159.
[8]DE'ATH G,LOUGH J M,FABRICIUS K E.Declining coral calcification on the Great Barrier Reef[J].Science,2009,323:116-119.
[9]HOEGH-GULDBERG O,MUMBY P J,HOOTEN A J,et al.Coral reefs under rapid climate change and ocean acidification[J].Science,2007,318:1737-1742.
[10]PANDOLFI J M,CONNOLLY S R,MARSHALL D J,et al.Prejecting coral reef futures under global warming and ocean acidification[J].Science,2011,333:418-422.
[11]ANTHONY K R N,KLINE D I,DIAZ-PULIDO G,et al.Ocean acidification causes bleaching and productivity loss in coral reef builders[J].Proc Natl Acad Sci USA,2008,105(45):17442-17446
[12]EDMUNDS P J.Zooplanktivory ameliorates the effects of ocean acidification on the reef coral Porites spp.[J].Limnol Oceanogr,2011 56 (6):2402-2410.
[13]HOLCOMB M,COHEN A L,MCCORKLE D C.An investigation of the calcification response of the scleractinian coral Astrangia poculata to elevated ρCO2and the effects of nutrients,zooxanthellae and gender[J].Biogeosciences,2012,9:29-39.
[14]HOEGH-GULDBERG O,BRUNO J F.The impact of climate change on the world's marine ecosystems[J].Science,2010,238:1523-1528.
[15]Gattuso J P,Allemand D,Frankignoulle M.Photosynthesis and Calcification at Cellular,Organismal and Community Levels in Coral Reefs:A Review on Interactions and Control by Carbonate Chemistry[J].Integrative and Comparative Biology,1999(1):160-183.
[16]MARUBINI F,BARNETT H,LANGDON C,et al.Dependence of calcification on light and carbonate ion concentration for the hermatypic coral Porites compressa[J].Marine Ecology Progress Series,2001,220:153-162.
[17]DUNNE R P,BROWN B E.The influence of solar radiation on bleaching of shallow water reef corals in the Andaman Sea,1993-1998[J].Coral Reefs,2001,20:201-210.
[18]ANTHONY K R N,KLINE D I,DIAZ-PULIDO S,et al.Ocean acidification causes bleaching and productivity loss in coral reef builders[J].Proc Natl Acad Sci USA,2008,105(45):17442-17446.
[19]BAKER A.C,GLYNN P.W,RIEGL B.Climate change and coral reef bleaching:An ecological assessment of long-term impacts,recovery trends and future outlook[J].Estuarine,Coastal and Shelf Science,2008,80(4):435-471.
[20]WILD C,HOEGH-GULDBERG B O,NAUMANN M S,et al.Climate change impedes scleractinian corals as primary reef ecosystem engineers[J].Marine and Freshwater Research,2013(2):205.
[21]SMITH S,KINSEY D.Calcification and organic carbon metabolism as indicated by carbon dioxide[R]//Stoddart D,Johannes R.Coral reefs:Research methods.Monographs on oceanographic methodology,Pari:Unesco,1978:469-484.
[22]SUGGETT D J,DONG L F,LAWSON T,et al.Light availability determines susceptibility of reef building corals to ocean acidification[J].Coral Reefs.2012,32:327-337.
[23]MORITA M,SUWA R,IGUCHI A,et al.Ocean acidification reduces sperm flagellar motility in broadcast spawning reef invertebrates[J].Zygote,2010,18(2):103-107.
[24]ALBRIGHT R,MASON B,MILLER M,et al.Ocean acidification compromises recruitment success of the threatened Caribbean coral Acropora palmata[J].Proceedings of the National Academy of Sciences,2010,107(47):20400-20404.
[25]NAKAMURA M,OHKI S,SUZUKI A,et al.Coral Larvae under Ocean Acidification:Survival,Metabolism,and Metamorphosis[J].PLoS ONE,2011,6(1):e14521.
[26]SUWA R,NAKAMURA M,MORITA M,et al.Effects of acidified seawater on early life stages of scleractinian corals (Genus Acropora)[J].Fish Sci,2009,76(1):93-99.
[27]ALBRIGHT R,LANGDON C.Ocean acidification impacts multiple early life history processes of the Caribbean coral Porites astreoides[J].Global Change Biology,2011,17(7):2478-2487.
[28]MUSCATINE L,PORTER J W,KAPLAN I R.Resource partitioning by reef corals as determined from stable isotope composition[J].Marine Biology,1989,100(2):185-193.
[29]ANTHONY K R,KLINE D I,DIAZ-PULIDO G,et al.Ocean acidification causes bleaching and productivity loss in coral reef builders[J].Proc Natl Acad Sci USA,2008,105(45):17442-17446.
[30]CHAN N C,CONNOLLY S R.Sensitivity of coral calcification to ocean acidification:a meta-analysis[J].Glob Chang Biol,2013,19(1):282-290.
[31]ALLEMAND D,TAMBUTTE´ E ´ ,ZOCCOLA D,et al.Coral Calcification,Cells to Reefs[J].Coral Reefs:An Ecosystem in Transition,2010:119-150.
[32]MOYA A,TAMBUTTE S,BERTUCCI A,et al.Carbonic anhydrase in the scleractinian coral Stylophora pistillata:characterization,localization,and role in biomineralization[J].J Biol Chem,2008,283(37):25475-25484.
[33] COLOMBO-PALLOTTA M F,Rodríguez-Román A,Iglesias-Prieto R.Calcification in bleached and unbleached Montastraea faveolata:evaluating the role of oxygen and glycerol[J].Coral Reefs,2010,29(4):899-907.
[34]BRADING P,WARNER M E,DAVEY P,et al.Differential effects of ocean acidification on growth and photosynthesis among phylotypes of Symbiodinium(Dinophyceae) [J].Limnol Oceanogr,2011,56(3):927-938.
[35]HERFORT L,THAKE B,TAUBNER I.Bicarbonate stimulation ofcalcification and photosynthesis in two hermatypic corals[J].J Phycol,2008,44(1):91-98.
[36]JOKIEL P L.Ocean acidification and control of reef coral calcification by boundary layer limitation of proton flux[J].Bms ,2011,87(3):639-657.
[37]EDMUNDS P J.Effect of ρCO2on the growth,respiration,and photophysiology of massive Porites spp.in Moorea.French Polynesia[J].Marine Biology,2012,159:2149-2160.
[38]HOEGH-GULDBERG O,BRUNO J F.The impact of climate change on the world's marine ecosystems[J].Science,2010,238:1523-1528.
[39]HOEGH-GULDBERG O,MUMBY P J,HOOTEN A J,et al.Coral reefs under rapid climate change and ocean acidification[J].Science,2007,318:1737-1742.
[40]BAKER A C,GLYNN P W,RIEGL B.Climate change and coral reef bleaching:An ecological assessment of long-term impacts,recovery trends and future outlook[J].Estuarine,Coastal and Shelf Science,2008,80(4):435-471.
[41]WILD C,HOEGH-GULDBERG O,NAUMANN M S,et al.Climate change impedes scleractinian corals as primary reef ecosystem engineers[J].Marine and Freshwater Research,2013(2):205.
[42]WEST J M,SALM R V.Resistance and Resilience to Coral Bleaching:Implications for Coral Reef ConservationandManagement[J].Conservation Biology,2003,17(4):956-967
(责任编辑:陈庄)
Role of Light Intensity and Spectral Quality in the OA-induced Metabolic Responses of Coral
XIAO Bao-hua1,2,LIAO Bao-Lin2,YANG Xiao-Dong2,XIE Zi-Qiang2,
(2.Guangdong Ocean University,Zhanjiang 524088,China; 1.Shenzhen Research Institute of Guangdong Ocean University,Shenzhen 518108,China;Shenzhen Ocean Hyaline Marine Science and Technology Co.Ltd,Shenzhen 518108,China)
We employed a multifactorial growth experiment to determine how light intensity and OA together modify the calcification of Acropora pruinosa,Galaxea astreata and Turbinaria peltata.It was found that decreased pH(OA)-induced losses of calcification in the light (GL) especially under low-light growth conditions.The influence of light intensity upon gross photosynthesis(PG)onses is coral species specific.Under light-limited growth conditions GL,GL/ GDwith OA was lower than that growth under high-light and with different spectral quality,but the change of GL with OA was higher than that of under high-lightcondition,in particular for Galaxea astreata.Those results suggested that high-light growth conditions dampened the impact of OA upon GL.OA-induced change of PGon light-saturated growth(LL)was significantly smaller than LL for Acropora pruinosa,and did not show a significant differences between high light(HL)and low light(LL)for Galaxea astreata,Turbinaria peltata.The reciprocal OA-induced change of GLwith PGand change of GLwith PGare consistent withthe notion that PGis enhanced by HL and GLis enhanced by PG,which is fundamentally limited by pCO2availability (and hence relieved by OA) under HL.In total,this study suggests that lower light availability will potentially increase the susceptibility of key coral species to OA.
reef-building corals;light spectrum;light intensity;ocean acidification;photosynthetic efficiency;calcification rates
S917.4
A
1673-9159(2016)04-0055-011
10.3969/j.issn.1673-9159.2016.04.010
2016-06-06
广东省公益研究与能力建设专项 (K15216);广东省海洋渔业科技推广专项(A201308E02);大鹏新区产业发展专项(DPKJ201500080)
廖宝林(1984—),男,硕士,工程师,主要从事海洋生态学研究。 E-mail:13590010881@163.com
肖宝华(1978—),男,助理研究员,硕士,主要从事水产养殖及海洋生态学研究。电话:0759-2396216,E-mail:gdouxxhpaper@126.com
