高密度CO2杀菌和钝酶及其在食品加工中应用的研究进展
2016-11-12刘书成郭明慧刘蒙娜邓倩琳
刘书成,郭明慧,刘 媛,刘蒙娜,邓倩琳
(广东海洋大学食品科技学院//广东省水产品加工与安全重点实验室//广东省海洋食品工程技术研发中心//广东普通高校水产品深加工重点实验室,广东 湛江 524088)
高密度CO2杀菌和钝酶及其在食品加工中应用的研究进展
刘书成,郭明慧,刘媛,刘蒙娜,邓倩琳
(广东海洋大学食品科技学院//广东省水产品加工与安全重点实验室//广东省海洋食品工程技术研发中心//广东普通高校水产品深加工重点实验室,广东 湛江 524088)
总结近10年来国内外在高密度CO2( Dense phase carbon dioxide,DPCD ) 技术的基础研究和应用研究领域的相关工作。基础研究领域主要包括DPCD与食品体系的相平衡、DPCD杀灭微生物营养体和芽孢的效果与机制、DPCD钝酶的效果与机制等,应用研究领域主要包括DPCD在液体(果蔬汁、啤酒、牛奶)和固体食品(鲜切果蔬、肉制品、海洋食品)加工中应用。提出DPCD技术未来发展可能需要解决的问题。
高密度CO2;杀菌;钝酶;液体食品;固体食品
高密度 CO2(Dense phase carbon dioxide,DPCD)是一项非常有前景的食品非热加工技术,它是指将食品放置在间歇、半连续或者连续处理的设备中,通过与加压CO2或者超临界CO2(通常温度< 60℃,压强<50 MPa)接触一定时间,利用压强场下CO2的分子效应实现杀灭微生物和钝酶以及蛋白质变性等目的,从而使食品得以长期保藏或直接食用。DPCD技术与超临界CO2萃取技术是不完全相同的。在超临界CO2萃取过程中,CO2作为溶剂萃取物料中有效成分;而在DPCD处理过程中,CO2作为溶质溶于水再作用于食品。DPCD主要指超临界状态的CO2,但有时也包括亚临界气态或液态CO2。与传统的热加工相比,由于DPCD处理过程中无氧、温度低,能更好保留食品的热敏性成分如维生素、生物活性成分等。与超高压(100~1000 Mpa)相比,DPCD处理压强更低、能耗低、成本低、容易操作与控制等。虽然DPCD设备和运行成本高于传统热加工,但是其成本远低于其他非热加工技术(超高压等)。笔者对近10年来国内外研究者在DPCD技术的基础研究和应用研究方面所做的工作进行综述,以期为该技术的研究与产品开发提供参考。
1 高密度CO2技术基础研究领域
DPCD的基础理论一直是研究的热点领域,它对于指导设备和工艺的设计与研发以及在生产中应用具有重要的意义。DPCD技术基础研究领域主要有:DPCD与食品体系的相平衡、DPCD杀菌效果和模型与机制、DPCD杀灭芽孢的效果和机制、DPCD钝酶效果和模型与机制等。
1.1高密度CO2与食品体系的相平衡
准确的相平衡数据,特别是CO2在食品体系中的溶解度,对于设计和优化工艺和设备是至关重要的。根据现有文献,可将CO2相平衡的研究分为4个方面:1)大气中CO2的捕集和封存。研究CO2与吸附剂之间的相平衡。2)超临界 CO2中的化学反应和酶催化反应(包括功能材料的制备)。研究CO2与反应物和产物之间的相平衡。3)超临界CO2萃取生物活性物质。研究生物活性物质与CO2(共溶剂)的相平衡。4)DPCD的杀菌和钝酶。研究DPCD与食品体系的相平衡。前3个方面的研究文献比较多,而专门研究CO2与食品体系相平衡的文献比较缺乏,这主要是因为食品是一个比较复杂的体系。
有研究者以纯水和含有离子的模式水溶液体系,从理论上建立高压下CO2的溶解度预测模型和热动力学模型,获得了大量的理论基础数据,为研究DPCD与食品体系的相平衡提供了参考。Diamond等[1]研究了CO2在-1.5~100℃和0.1~100 MPa下在纯水中的溶解度和热力学模型,Portier等[2]研究了CO2在0~300℃和0.1~30 MPa下在纯水和NaCl水溶液中的溶解度,Duan等[3]研究了 CO2在 0~260℃和0~200 MPa下在0~4.5 mol/L的Na+、K+、Ca2+、Mg2+、Cl-、SO42等离子溶液中的溶解度,Zhao等[4]研究了CO2在50、100、150℃和15 MPa下在NaCl水溶液中的溶解度,Tang等[5]研究了CO2在35、55、95、135℃和 0~40MPa下在含有碳酸氢盐溶液中的溶解度,Pereira等[6]研究了高温高压对CO2与水体系相平衡密度和界面张力的影响,Deering等[7]研究了CO2在45~96℃和0~35 MPa下溶于水的部分摩尔体积,Efika等[8]研究了在20~177℃和0~64 MPa下CO2与水的饱和密度相行为。
以真实的食品体系为对象,研究高压下CO2与食品体系相平衡的文献是非常少的,仅有的几篇文献主要是建立和预测CO2在不同液体食品中的溶解度模型。Tomasula等[9]研究CO2在牛奶中的溶解度,Calix等[10]研究了CO2在40℃和7.58、15.86 MPa下在橙汁、苹果汁和模型液体食品中的溶解度,Ferrentino等[11]研究了 CO2在35、60℃和 7.5、15 MPa下在苹果汁中的溶解度和热力学模型,Ferrentino 等[12]研究了CO2在35、40、50℃和7.5、15 MPa下在纯水和磷酸二氢钠(质量分数0.24%、2.4%、4.8%)的食品溶液中的溶解度,iplap等[13]研究了CO2在西红柿浆中的溶解度。Ferrentino 等[14]研究了CO2在25、35、40℃和8、12MPa下在纯水和椰子水溶液中的溶解动力学,Spilimbergo等[15]从理论上分析了压强下CO2的液气相平衡热力学、CO2-水相体系的热力学 (电解质和非电解质模型)、固气相平衡热力学,Giovanna Ferrentino等[16]综述了测量CO2溶解度试验装置的设计和CO2在水和复杂溶液中的溶解度。
这些基础研究数据为研究DPCD杀菌和钝酶机理以及优化处理工艺参数奠定了重要的理论基础。CO2在不同食品体系中的溶解度和相平衡参数是设计DPCD杀菌和钝酶过程的重要依据。因此还需要进一步加强研究DPCD在各种食品体系中的溶解度和相平衡。
1.2高密度 CO2杀灭微生物营养体的效果和模型及其机制
1.2.1高密度CO2杀灭微生物营养体的效果与影响因素一般情况下,DPCD在<30 MPa和<60℃的条件下处理2.5~240min,微生物营养体数量可降低1~9-log[17-18]。影响DPCD杀灭微生物营养体效果的因素主要有:CO2物理状态和浓度、处理温度和压强及时间、加压和卸压速率、循环加压、是否搅拌、体系水分含量、微生物类型、起始微生物数量、微生物培养条件和生长阶段、DPCD系统类型、与其他杀菌技术联合等[17-21]。
CO2物理状态:DPCD包括了液体CO2、亚临界气态CO2、超临界CO2。超临界CO2既具有液体的密度和溶解度,又具有气体粘度和扩散性,还具有低的表面张力,能改变细胞壁和细胞膜的组成,使CO2快速扩散和渗透通过细胞壁和细胞膜进入细胞质[3]。因此,超临界状态的CO2比其他状态的CO2更容易杀灭微生物[17-18]。另外,当溶解在体系中的CO2达到饱和时,对微生物的杀灭效果最好,因为浓度决定了CO2在微生物细胞中的渗透性[17-18]。
处理压强、温度和时间:压强和温度的变化能够改变CO2的物理状态。随着处理压强增加,CO2的溶解度增加,加强了细胞和CO2之间的接触,促进CO2渗透到细胞内,从而提高杀灭效果[22-27]。升高温度会使CO2粘度下降和扩散性增加,有利于其扩散到细胞内,破坏细胞膜的完整性;但是温度不能过高于临界点,因为温度太高,CO2的密度和溶解能力下降很快,降低了CO2从细胞中提取脂溶性物质的能力[26-27]。增加处理时间能增加DPCD对微生物营养体的杀灭效果,主要是因为延长了DPCD与微生物营养体的接触时间[27]。
加压和卸压速率:快速加压和卸压可以使CO2在细胞内外快速转移,萃取细胞内物质,爆破和机械性的破坏细胞结构。快速加压,进入细胞内的CO2可使细胞迅速膨胀,膨胀到一定程度会发生机械性破裂;接着再快速卸压,细胞会像气球一样发生机械性的破碎[22-24]。循环加压和卸压也可以提使细胞膜破裂和通透性增加,加强传质,从而提高杀菌效果[23-24]。
搅拌:在DPCD处理过程中进行搅拌,可以增加CO2向悬浮液中转移和溶解速率,增加CO2与微生物营养体的接触,使CO2更容易渗透细胞膜[26]。
体系水分含量:体系水分含量越高,DPCD对微生物营养体的杀灭效果越好。细胞吸收的水分也能使细胞壁和细胞膜溶胀,使CO2更容易渗透,加强其杀灭效果[27]。
微生物种类:一般来说,革兰氏阳性菌比革兰氏阴性菌更耐高压,因为它们的细胞壁组成存在差异。耐压微生物的细胞壁可以阻挡CO2的渗透或可能承受足够大的压强。在相同处理条件下,DPCD对初始微生物数量少的样品的杀菌效果要好于初始微生物数量多的[25]。
微生物培养体系和生长阶段:当微生物营养体在低于最适温度、低于或高于最适pH下生长时,更容易被DPCD杀灭[17-21]。一般来说,幼体细胞比成熟细胞对DPCD更敏感;稳定期的细胞比对数期的细胞更耐受DPCD[28]。微生物细胞在DPCD处理过程中会受损伤,有些损伤的微生物细胞再进行培养又可以修复再生长,而有些微生物细胞则不可以修复,这主要与DPCD条件和培养介质有关[17-21]。
DPCD处理系统的类型:能快速使CO2在溶液中溶解并达到饱和的处理系统能更加有效杀灭微生物[17-21]。在相同条件下,连续式DPCD处理系统比间歇式DPCD处理系统杀菌更有效,所需时间更短;半连续DPCD处理系统也比间歇式DPCD处理系统杀菌更有效[17-21]。这是因为连续的DPCD处理系统可以使更多的 CO2溶解于溶液中。Kobayashi等使用微泡CO2设备也比传统的间歇式处理设备提高了杀菌效果[29-33]。
虽然DPCD对微生物营养体具有较好的杀灭效果,但很难达到完全灭菌,一方面是因为影响DPCD杀菌效果的因素较多,另一方面是因为DPCD能够诱导微生物营养体形成亚致死状态[34-35]和活的不可培养状态[36-39],在合适的条件下这些微生物营养体又可以复苏生长,从而影响杀菌效果。尤其是微生物营养体的亚致死状态和活的不可培养状态,它们容易造成过高估计杀菌率,使得产品在后期贮藏过程中提前发生腐败变质。因此,应重视DPCD杀菌过程中这两种状态的研究,以采取有效措施提高杀菌率。
1.2.2高密度CO2杀灭微生物营养体的模型文献报道的DPCD微生物营养体的杀灭模型可分为三种类型:(1)线性模型;(2)两段式模型; (3)三段式模型[40]。对于线性模型,通常采用一级动力学进行拟合。对于两段式模型,可以将曲线上的两个阶段分别采用一级动力学进行拟合。虽然一级动力学线性模型对两段式的快速阶段拟合度较高,但由于其并不能模拟完整的杀灭动力学曲线,故存在明显缺陷。当曲线呈现两段式或三段式模型时,需要采用非线性模型进行拟合。非线性模型主要有Gompertz模型、修正Gompertz模型、修正Multihi模型、Xiong模型、修正Peleg模型等[41]。另外,除了线性模型和非线性模型外,还有学者应用到多项式模型[42],它是通过确定多个相关参数的值来使曲线或响应面更好地贴近数值。DPCD杀灭微生物营养体模型的类型可能与试验数据的多少有关。当试验数据足够多时,曲线表现出凹的形状;当试验数据较少时,其曲线可能表现为两段式或线性[40]。曲线的形状还与处理时间和间隔有关[41]。
1.2.3高密度 CO2杀灭微生物营养体的机制从1951年首次报道压强下CO2可以杀灭微生物开始,不断有研究者提出关于DPCD对微生物营养体杀灭机制的各种假说。2007年Garcia-Gonzalez等总结了DPCD杀灭微生物营养体机制,主要概括为7个方面[17]:1) 细胞外pH值的降低。压强下CO2溶解于液体食品或者高水分含量的固体食品中形成H2CO3,电离后生成HCO3-、CO32-、H+,降低了细胞外pH值,抑制微生物营养体生长。2) 细胞膜受损。CO2是非极性溶剂,当CO2与微生物细胞接触时,CO2会集聚在亲脂性(磷脂)内层上,集聚到一定量时会由于脂质流失而造成细胞膜结构和功能的紊乱,增加细胞膜的流动性和渗透性;也有研究者认为HCO3-作用于极性磷脂的头部基团和细胞膜表面的蛋白,改变了细胞膜的最佳表面电荷密度,从而改变了细胞膜的功能。3)细胞内pH值的降低。由于增加了细胞膜的通透性,压强下CO2很容易渗透入微生物细胞内,在细胞质里累积到一定量,会产生大量H+,细胞不能及时排出H+,细胞内pH值就会降低。细胞内外pH值的剧烈变化,使其难以维持酸碱平衡,活力严重受损。4) pH值降低能钝化与细胞代谢相关的关键酶。5) CO2分子和HCO3-对代谢的直接抑制。HCO3-浓度是调节细胞内酶活性的重要因子。CO2和HCO3-都是细胞内羧基化反应的底物,CO2还是脱羧反应的产物。羧基化反应对糖异生和氨基酸和核酸的生物合成都非常重要。溶解的 CO2可以抑制脱羧反应。6) 细胞内电解质平衡被破坏。CO2进入细胞内,溶解于水中生成的HCO3-和CO32-离子,可能使细胞和细胞膜上的无机离子(如Ca2+、Mg2+等)发生沉淀,而这些离子对于维持细胞与周围环境的渗透关系是非常重要的,从而对细胞体积产生严重的影响。7) 细胞及细胞膜中脂类被萃取。DPCD作为一种非极性溶剂,能够萃取细胞和细胞膜中的脂质成分,改变生物膜结构和扰乱其平衡。这7种DPCD杀灭微生物营养体的机制一般不会连续发生,也不是单独发生,而是同时发生在一个非常复杂而又相互关联的过程中。
这7种DPCD杀灭微生物营养体的机制主要从细胞水平进行分析。虽然它们能够解释大部分DPCD杀灭微生物营养体的试验现象,但是当时这些杀菌机理大多数都仅仅是假说,缺乏相关的试验证据。自 2007年后,有很多研究者从不同的角度设计试验来验证和完善DPCD杀灭微生物营养体的机制。周先汉等证实了DPCD的pH降低酸化杀菌机制[43]。Spilimbergo、Garcia-Gonzalez、Li、Yao、Tamburini、Liu、廖红梅等通过试验观察到了DPCD造成微生物细胞壁和细胞膜损伤、渗透性增加,同时造成细胞内蛋白质、核酸、离子等的泄漏,改变了细胞内外电解质的平衡等[44-50]。Li等证实了DPCD钝化了与微生物代谢相关的酶类[46]。周先汉和Tamburini等通过试验观察到了DPCD萃取出了微生物细胞膜上的脂类成分,从而改变了细胞膜的渗透性[51-52]。
另外,还有研究者从分子水平研究了DPCD对微生物营养体的杀灭机制。DPCD杀菌的分子机制是建立在细胞水平的研究基础上,主要是DPCD会造成微生物细胞内蛋白质变性与酶失活,影响到参与细胞形成、能量代谢即作为调控因子的蛋白质的合成与表达,从而抑制细胞的代谢活动而致死微生物。Kim等用DPCD在10 MPa和35℃处理鼠伤寒沙门氏菌10min,可溶性蛋白急剧减少,不可溶性蛋白大大增加,认为这是DPCD诱导蛋白质变性造成的[53]。Kim等[54]用DPCD在40℃和10 MPa处理血清型鼠伤寒沙门氏菌30min,部分蛋白质发生差异表达,等电点迁移到 pI7~9区域。饶伟丽等[55]从蛋白质组角度研究发现DPCD在杀灭大肠杆菌过程中可显著降低菌体碱溶性(pH8.0)蛋白的溶解性,并使其分子量构成发生显著变化;在 37℃和 10~50 MPa处理大肠杆菌菌体蛋白30min,蛋白二级结构中α螺旋和转角逐渐向β折叠转化。廖红梅等用DPCD处理大肠杆菌,采用SDS-PAGE电泳分析发现胞内蛋白质在处理前后,蛋白质种类未发生变化,但是含量显著减少,这主要是因为蛋白质流失到胞外;采用Native-PAGE电泳分析发现胞内蛋白质在处理后,蛋白质种类发生了显著变化,说明一些蛋白质发生了变性;通过蛋白质组学方法分析鉴定了一些参与能量代谢、细胞生存与增殖、细胞结构、DNA复制、膜修复以及作为全局胁迫调节子适应胁迫条件的蛋白质发生了显著差异表达[56]。王莹莹等采用蛋白质组学的方法研究DPCD对大肠杆菌菌体蛋白的影响,双向电泳分析发现 46个蛋白质有较大差异,经鉴定认为3个蛋白质参与形成细胞骨架,9个蛋白质参与细胞新陈代谢,4个蛋白质与DNA密切相关;DPCD处理还使大肠杆菌细胞内 31 000~20 000 Da蛋白质的α-螺旋含量显著降低,而且α-螺旋有向β-折叠和无规则卷曲转变的趋势;43 000~31 000 Da的蛋白质β-折叠含量显著增加。这说明DPCD处理诱导了一些细胞内关键性蛋白质和酶发生了变性失活,导致细胞死亡[57]。杨扬等采用转录组学与蛋白质组学技术、结合生物信息学筛选到了DPCD杀灭大肠杆菌过程中发挥关键作用的蛋白质,其中 3个蛋白质可能与大肠杆菌的DPCD耐受性提高有关,还有7个蛋白质在保护细胞抵御DPCD胁迫中发挥重要作用,这些蛋白质主要与细胞结构、细胞代谢、DNA损伤修复、热应激等密切相关;另外,通过全基因组测序确定大肠杆菌突变菌株有4个基因可能与其 DPCD 抗性相关[58]。总体分析来看,DPCD能诱导微生物细胞内蛋白质发生变性,但是具有选择性,而并不能使所有蛋白质发生变性。至于DPCD能诱导哪些蛋白质变性,与DPCD处理强度和微生物种类有关。DPCD对与微生物代谢相关酶类的影响,与对与微生物相关的蛋白质影响的结果类似,也具有选择性,而且也与微生物种类和DPCD处理强度有关[58]。廖红梅等检测到大肠杆菌经DPCD处理后大肠杆菌胞内的碱性磷酸酶、亮氨酸芳基酰胺酶、β-半乳糖苷酶活性显著降低,酸性磷脂酶和萘酚-AS-BI-磷酸水解酶活性降低较少,而对其他酶无显著影响。廖红梅等检测大肠杆菌经 DPCD处理后细胞悬浮液在260nm(核酸特征吸收峰)的吸光度显著增加,主要是细胞结构被破坏,核酸泄露到细胞外所致[56]。Liao等研究发现大肠杆菌经DPCD处理后,细胞内DNA含量显著下降,随着处理强度增加而显著降低;细胞内大多数双链DNA发生部分解旋,说明其发生了变性,但是DNA并没有降解,即一级结构不受影响[59]。
廖红梅等从细胞水平和分子水平上对DPCD杀菌微生物营养体的机制进行总结,归纳为四点[20]:(1) CO2溶于细胞外的水环境中,降低胞外pH值;(2) 溶解的CO2接触细胞,改变细胞膜组成,使细胞膜受损,导致细胞膜流动性降低、渗透性增大,CO2渗透入细胞内,细胞内物质泄漏到细胞外;(3)进入细胞内的CO2,降低胞内pH值,使胞内部分蛋白质发生变性和钝化胞内相关酶类,酶活性下降影响蛋白质合成及功能表达;(4) 进入细胞内的CO2使细胞内DNA解链变性,从而影响参与细胞组成、能量代谢、生长和增殖以及作为协调因子的蛋白质表达差异,进一步会影响细胞的活性及代谢,如外膜蛋白下调导致膜受损、饥饿诱导的DNA结合蛋白上调导致DNA 变性、压强应激蛋白保护DNA 不断裂;DPCD还可能钝化与 DNA 相关的酶,从而可能影响DNA 的合成和复制。这些不同的过程可能同时发生也可能循序渐进地发生。
1.3高密度CO2对微生物芽孢的杀灭效果和机制
1.3.1高密度CO2对微生物芽孢的杀灭效果和影响因素由于微生物芽孢具有特殊的结构,使其对高温、紫外线、干燥、电离辐射和很多有毒的化学物质都有很强的抗性[60]。能否杀灭芽孢是衡量各种杀菌手段和保证食品安全的最重要指标。在温和(20-40℃和<30MPa)的条件下单独使用DPCD是很难完全杀灭芽孢的[17,61]。影响DPCD杀灭微生物芽孢的因素与影响DPCD杀灭微生物营养体的因素是一致的,这里不再详细综述。如:CO2物理状态、处理压强和温度及时间、处理介质的pH值、水分含量、循环加压和处理系统等[62]。超临界状态的CO2比高压气态和液体CO2对芽孢具有更好的杀灭效果;提高处理压强和温度以及延长处理时间、循环加压和卸压、微泡CO2处理系统等都可以提高杀灭芽孢的效果;低pH值(pH<4)和高水分含量的介质有利于DPCD杀灭芽孢[62]。
为了提高 DPCD技术对微生物芽孢的杀灭效果,很多研究者尝试将DPCD与其他技术联合使用。目前,已经报道的有:DPCD与热处理联合、DPCD与低pH值联合、DPCD与脉冲电场联合、DPCD与超高压联合、DPCD与抗菌剂联合等技术。一般情况下,采用DPCD和热处理联合在5~30MPa和35~95℃处理20~2880min,可使芽孢数量下降0.5~7-log[62];采用DPCD与低pH值联合在5~10 MPa、30~70、pH值2.5~4处理30~120min,可使芽孢数量下降 4~8-log[62];采用 DPCD和抗菌剂联合在8~30 MPa和35~80℃处理15~240min,可使芽孢数量下降 1~6-log[62]。Watanabe等发现在 30MPa下75~95℃范围内对嗜热脂肪地芽孢杆菌芽孢的杀灭效果要显著好于35~65℃范围的,30 MPa和95℃处理120min对嗜热脂肪地芽孢杆菌芽孢的杀灭效果好于热处理的(95℃/120min)和高压处理的(95℃ / 30 MPa / 120min)[63-64]。Rao等[65]用DPCD与高温热处理相结合在6.5~25 MPa和82、86、91℃处理0~120min,枯草芽孢杆菌芽孢下降了 7-log。Spilimbergo等[66]用脉冲电场(20 pulses / 25 kV/cm)和SC-CO2(20 MPa / 40℃)处理24h 对蜡样芽胞杆菌芽孢具有较好的杀灭效果,经脉冲电场处理的芽孢结构被压缩,容易受到SC-CO2的破坏。近年来,利用DPCD与抗菌剂联合杀灭微生物芽孢的研究比较多,用到的抗菌剂主要有过氧化氢、叔丁基过氧化氢、乙醇、醋酸、过氧乙酸、辛酸、甲酸、植物精油等。这些抗菌剂很多是用于环境消毒的,而不能用于食品杀菌。Zhang等[67]利用 DPCD(40~80℃/10.3~27.5 MPa)与200×10-6H2O2联合处理短小芽胞杆菌芽孢,具有非常好杀灭效果,60℃和27.5 MPa处理4h,芽孢数量下降了6.28-log,而将H2O2换成添加70%的乙醇,没有明显杀灭芽孢的作用。Park等在100 mL DPCD处理设备中加入2~10 mL的乙醇在10 MPa和60℃处理60~90min,蜡样芽胞杆菌生物膜中的芽孢被完全杀灭,而单独用DPCD处理120min对其没有杀灭效果[68]。Park等用乙醇作为共溶剂在10 MPa和40℃处理45min,含有107CFU/ml的草酸青霉菌芽孢被完全杀灭[69]。Casas等用0.02%牛至(oregano)精油与DPCD联合在10 MPa和80℃处理红辣椒30min,包括芽孢在内的所有微生物杀灭 99.5%[70]。Setlow等利用DPCD与过氧乙酸联合作用对枯草芽孢杆菌芽孢具有很好的杀灭效果[71]。
1.3.2高密度CO2杀灭微生物芽孢的机制微生物营养体和微生物芽孢的结构具有很大的差异,因此,DPCD对它们的杀灭机制是不同的。有研究者基于 DPCD杀灭微生物芽孢的动力学,提出了DPCD杀灭微生物芽孢的可能机制:芽孢首先被DPCD激活和萌发,而后被DPCD杀灭[63,72-75]。然而,不清楚DPCD是如何诱导芽孢激活和萌发的。还有研究者通过观察DPCD处理前后芽孢的微观形态结构,提出了另外一个DPCD杀灭微生物芽孢的可能机制:DPCD处理使芽孢结构被破坏而致死[61,66-67,76-78]。Rao等[62]对现有的DPCD杀灭微生物芽孢的机制进行总结,见图1(稍有修改)。
1.4高密度CO2钝酶效果和动力学及其机制
1.4.1高密度CO2钝酶效果及其影响因素DPCD能钝化大多数使食品品质劣变的酶类,其主要有蛋白酶、淀粉酶、脂肪酶、果胶甲酯酶、多酚氧化酶、果胶酶、脂肪氧合酶、过氧化物酶等。一般情况下,DPCD在< 30 MPa和< 60℃的条件下处理 10~60min,可使各种酶的残留活性降低至20%左右,有的甚至可以100%被钝化[79-80]。影响DPCD钝酶的因素主要有:CO2物理状态、处理压强和温度及时间、处理介质及其初始pH值、食品成分、联合处理方式,循环加压和卸压、DPCD处理设备类型等[79-80]。一般来说,超临界状态的CO2比气态和液态CO2对酶具有更好的钝化效果,主要是因为超临界CO2同时具有液体和气体的特殊性质能增强与酶分子的相互作用,导致酶失活[79-80]。随着DPCD处理压强和温度的升高,主要改变了CO2的物理状态和密度,从而使酶失活[81-89]。延长处理时间,增加了酶与DPCD的接触时间,从而增加钝酶效果[81-89]。酶对酸性环境比对碱性环境更为敏感。DPCD处理会降低介质的pH值,这可能是导致酶失活的原因之一。食品中的成分如糖、盐等能保护酶,可能会降低DPCD对酶的钝化效果。水分活度对DPCD钝酶效果也有显著影响,水分含量高,有利于CO2溶解形成碳酸,降低介质的pH值,从而钝化酶类。采用微泡处理也可以提高钝酶效果[82-83]。对于一些耐受DPCD的酶类,可以采用联合处理的方式,例如DPCD与超高压联合、DPCD与脉冲电场联合、DPCD与超声波联合等。另外,循环进行升压/卸压处理也可以提高对酶的钝化效果。这些影响因素的作用原理与之前对杀菌影响有类似之处,这里不再详述。
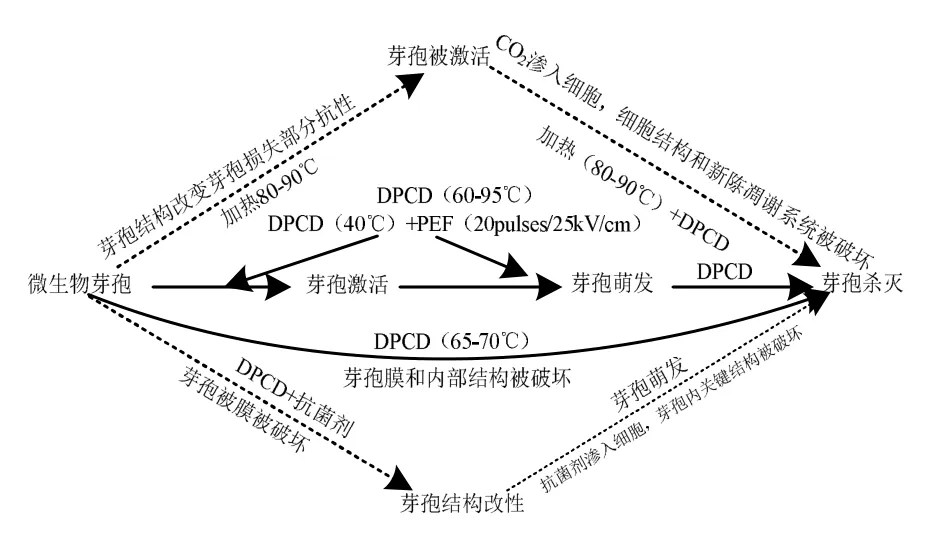
图1 DPCD杀灭芽孢的可能机制[62]Fig.1 Possible mechanism of inactivation spores by DPCD
1.4.2高密度CO2钝酶动力学动力学参数是描述钝化速率常数与压强和温度改变的关系,是设计和优化加工食品的参考依据。对现有的文献进行分析可知,DPCD钝酶动力学可分为3类[79-80]:一是一级动力学,二是分段式动力学,三是部分转化式动力学。一般情况下,先用一级动力学模型拟合DPCD钝酶动力学。在一级动力学模型中,酶活是随时间线性降低的。对于不符合一级动力学模型的数据可以进一步利用分段式动力学模型进行拟合,该模型将DPCD钝酶过程分为两个阶段(快速钝化期和稳定钝化期),两个阶段也分别符合一级动力学模型。还有一种部分转化式动力学模型。该动力学模型主要考虑到在温热和高压处理中,只有不稳定部分酶被钝化,随着处理时间延长,稳定部分的酶活性依然不变;采用更剧烈的温度或者压强条件可导致酶快速失活,之后失活速度下降。该模型可用于分析等温-等压钝化数据。部分转化式模型通常用于一种组分被钝化而另一组分保持非零值的常数。
1.4.3高密度 CO2钝酶机制在超高压钝酶研究中,有研究者认为200 MPa以下的压强对酶活性无直接影响,而DPCD处理压强一般小于50 MPa,这说明超高压和DPCD的钝酶机制可能存在本质性的差异。关于DPCD钝酶机制,HU等[80]提出了两种可能机制:第一,DPCD引起的pH值降低效应。因为 CO2溶于水能形成碳酸,并进一步解离出HCO3-、CO32-、H+,从而降低处理介质的pH值。升高压强和温度会增加CO2的溶解度,促进处理介质的酸化,加强CO2与酶分子的相互作用。有些酶对介质pH值的变化比较敏感,因此介质pH值降低可能是DPCD钝化该类酶的主要机制之一;但是,有些酶对介质pH值的变化不敏感,因此DPCD钝酶可能存在另外的机制。第二,CO2的分子效应。CO2与酶分子能形成复合物,降低酶活。精氨酸在低pH值下与CO2接触,可形成重碳酸盐复合物,过量的CO2还能与蛋白质表面的氨基酸残基形成共价的氨基甲酸盐。这些氨基甲酸盐可引起组氨酸和赖氨酸残基之间的电荷转移,从而造成酶失活。因此,有学者提出碱性氨基酸(精氨酸、赖氨酸和组氨酸)可能是 CO2与酶蛋白质的结合位点[90-94]。还有研究认为,一些酶能被CO2解离,DPCD的压强效应引起蛋白质主链结构变化、亚基解聚,导致失活[95-96]。CO2还能与酶活性中心的疏水区相互作用导致酶失活。随着压强升高,CO2密度增加,CO2发挥其疏水的功能改变了蛋白质与分子相互作用的平衡,使蛋白质疏水基团暴露于亲水环境中[96-97]。CO2的表面张力为零,可以轻松穿过比其大的分子,破坏酶分子的活性中心。压强下CO2还具有萃取作用,除去维持酶分子结构稳定的必要水分子,改变溶剂和酶分子之间水平衡,导致酶失活[98-99]。DPCD钝酶很难说是某一种效应引起的,可能是CO2的多种作用共同引起的。目前关于DPCD钝酶机制还有很多争论,有些还缺乏试验证据,还有待于进一步深入研究和讨论。
2 高密度CO2技术在食品加工中的应用
DPCD已被确认为是一种非常有效的非热杀菌和钝酶技术,已在液体食品(果汁、啤酒、牛奶等)和固体食品(鲜切果蔬、肉制品、海产品等)加工领域有着广泛的应用研究,也有开展DPCD在其他领域(例如制备纳米材料、医疗灭菌、废水处理等)中的应用研究。
2.1高密度CO2在液体食品加工中的应用
传统的果蔬汁加工中采用热杀菌和钝酶,但是果蔬汁含有很多对热敏感的营养物质(如维生素、色素等),热处理不仅使热敏性营养物质丧失,而且会严重影响其感官品质等理化特性。国内外已有大量的研究表明:DPCD对果汁的杀菌和钝酶效果是比较好的;与未处理的新鲜果汁相比,DPCD处理的果汁除了维生素C会稍有损失之外,其感官品质和营养品质等理化特性无显著变化;但与热处理相比,DPCD对果汁感官品质和营养品质等理化特性的影响是比较小的。QULE等[100]用 DPCD在25 MPa和40℃处理鲜榨橙汁(pH3.7)90min后,在4℃下贮藏 56 d,未发现有微生物的生长,而且橙汁的感官和理化特性与鲜榨果汁无显著差异,仅仅维生素 C损失 12%,而热杀菌损失 46%。LIAO等[101]用DPCD在45 MPa和52℃处理苹果汁30min,大肠杆菌数量下降了7.66-log。Ferrentino等[102]用DPCD在16 MPa和60℃处理苹果汁40min,其菌落总数下降了5-log,而在4℃下贮藏14 d,pH值、糖度和色泽等品质与鲜榨果汁无显著差异。NIU等[103]用DPCD在20 MPa和20~65℃处理苹果汁20min,多酚氧化酶被完全钝化,果胶甲酯酶被钝化61.4%,在4℃下贮藏7 d,色泽、浊度等品质无显著变化。Bae等[78]用DPCD在10 MPa和65℃处理苹果汁40min或在8 MPa和70℃处理苹果汁30min,Alicyclobacillus acidoterrestris芽孢被完全杀灭,但是对果汁的pH和糖度等品质没有影响。廖红梅等[104-105]用DPCD在30 MPa和40℃处理梨汁60min,细菌菌落总数的残存率降低了2.66-log,残存酶活为19%,且在4℃条件下贮藏56 d也能较好抑制多酚氧化酶 酶活和保持其品质特性。周林燕等[106]用 DPCD在 30 MPa和 55℃处理桃汁 10~40min,与未处理的相比,桃汁的pH值、糖度和酚类物质含量无显著变化,色泽稍有变暗,抗氧化活性提高。LIU等[107-109]用DPCD在30 MPa和50℃处理西瓜汁30min,可使多酚氧化酶残留酶活降至4.2%,过氧化物酶残存酶活降至40%左右;菌落总数降低至26 CFU/mL,达到了GB19297-2003《果蔬汁饮料卫生标准》的要求(≤100 CFU/mL);番茄红素含量略有下降,总酚含量无显著变化,而对风味成分的影响较小;在4℃贮藏30 d,对西瓜汁的风味影响较小。CHEN等[110-111]用DPCD在35 MPa和55℃处理哈密瓜汁60min,微生物全部被杀灭;多酚氧化酶、过氧化物酶和脂肪氧合酶的残留酶活分别降至25.26%、38.46%和0.02%;对哈密瓜汁的香气影响较小;在4℃贮藏28 d,风味仍然与新鲜的哈密瓜汁接近,但是维生素C有所损失,但是损失的量小于未处理的。Cappelletti和De等[112-113]用DPCD在12MPa和40℃处理椰子水30min,菌落总数下降了7-log,但降低了挥发成分含量,其他感官品质则与未处理的无显著差异,显著好于热处理的(90℃ 1min)。
啤酒在热杀菌过程中容易产生不良风味。Dagan等[114]采用连续的DPCD处理系统(27.6 MPa / 21℃ / 5%CO2/ 5min)对啤酒进行处理,结果发现啤酒的风味、泡沫及其稳定性、杀菌效果都显著好于热处理的(74℃ 30 s)。因此,采用DPCD对啤酒进行冷杀菌既能保证啤酒的新鲜,又不改变啤酒颜色和风味,避免了不良风味的产生。
DPCD还可有效地杀灭牛奶中的致病菌和腐败菌。Erkmen等[115]用100 bar / 30℃处理牛乳360min,大肠杆菌下降了94.7%,同样的条件处理脱脂乳,其大肠杆菌下降了99.36%。廖红梅等[116]在20 MPa / 37℃下用DPCD处理牛初乳30min,较好地实现了杀菌,牛初乳色泽变亮,但是粒度增大,粘度和pH值降低,对其悬浮稳定性和口感造成一定影响。钟葵等[117]在30 MPa /50℃处理牛奶70min,牛奶中菌落总数降低了5.082个数量级,实现了较好的杀菌效果。姚春艳等[118]研究发现,DPCD对牛乳中微生物具有较好的杀灭效果;DPCD能钝化牛乳中的蛋白酶,抑制蛋白质在贮藏过程中的分解,短时加压的抑制效果好,但温度对抑制效果影响较小;但DPCD处理可能使脂肪酶活性增加,导致原料乳脂肪在贮藏过程中的分解程度变大。
2.2高密度CO2在固体食品加工中的应用
与液体食品相比,DPCD技术要应用到固体食品加工中要困难一些。主要是因为固体食品不能连续加工,CO2在固体食品中溶解和扩散较慢(尤其是含水量少的),还可能对质构和品质产生不良影响。目前,DPCD技术应用的固体食品主要有鲜切果蔬、肉与肉制品、海洋食品等。
鲜切果蔬是一种受快节奏生活的城市人欢迎的方便食品,就是去除水果蔬菜的不可食部分,经清洗、修整、切割等后,进行简单包装,供消费者、餐饮业立即食用或使用,具有新鲜、方便、可百分百食用的特点。但是如何保证鲜切果蔬在加工和贮藏过程中的食用安全,保持产品品质和延长货架期?近年来,很多研究者逐步将DPCD技术应用到鲜切果蔬加工中。Ferrentino等[119]以DPCD对接种在鲜切胡萝卜片上的大肠杆菌的杀灭效果为基础,建立了一个Weibull模型用于预测DPCD对鲜切胡萝卜片的杀菌效果。Spilimbergo等[120]在12 MPa和40℃下用DPCD处理胡萝卜片15min,有效地杀灭了胡萝卜片中存在的微生物,在4℃可贮藏28 d,活性成分变化较小,但是质构发生显著变化。BI等[121]在5 MPa和20℃下用DPCD处理胡萝卜片20min,细菌总数下降了1.86-log,酵母和霉菌下降了 1.25-log,过氧化物酶、多酚氧化酶、果胶甲酯酶的残留活性在处理 15min时达到最低,虽然DPCD对胡萝卜的硬度(损失仅7.9%)影响较小,但会造成细胞膜损伤。Ferrentino等[122]在12 MPa和45℃下DPCD处理鲜切椰肉15min,微生物数量下降了4-log,椰肉的硬度虽然不受影响,但是其微观结构遭到了破坏。Valverde等[123]研究发现,虽然DPCD能抑制梨片中酵母活性,并对pH值和糖度无影响,但是使梨片软化和表面发黑。因此,Valverde认为DPCD可能适用于对硬度较低的果蔬进行低温杀菌处理。张华等[124-126]用18 MPa和30℃的DPCD处理鲜切莲藕片30min,实现了对鲜切莲藕片的有效杀菌,钝化多酚氧化酶和过氧化物酶等酶活性,并能较好的保护了鲜切莲藕片的色泽和品质。以上文献研究表明:DPCD虽然对鲜切果蔬具有良好的杀菌和钝酶效果,但对质构会产生一定影响。因此,DPCD应用于鲜切果蔬加工,还需要深入开展适合的果蔬产品、优化操作参数、合理评价品质等方面研究。
肉制品和海产品是人类食物蛋白质的重要来源,食用前的杀菌处理一直是加工处理的重要环节。有研究表明,DPCD 能够杀灭肉制品和海产品中的致病菌和腐败菌。关于DPCD对肉制品杀菌的研究主要涉及的材料有猪肉[127-130]、鸡肉[131-132]和牛肉[133-135]等,杀菌对象主要是致病菌。关于DPCD对海产品杀菌的研究主要涉及的材料有对虾[136-137]和牡蛎[138-139]等,杀菌对象主要是腐败菌和致病菌等。笔者曾对该部分的内容做过综述[140],这里不再详述。与液体食品相比,DPCD 对肉制品和海产品的杀菌处理强度要大,主要是因为CO2在固体食品中不易渗透。虽然DPCD对肉制品和海产品具有较好的杀菌效果,但是不可避免对其品质会产生一些影响,例如降低其pH值、持水力下降造成汁液损失、使红色肉类呈现煮熟的外观等等。但是相对于热处理来讲,DPCD对肉制品和海产品的品质影响要小很多。另外,利用DPCD能诱导蛋白质变性的特点,还可将其用于改善蛋白质的功能特性[141]和制备凝胶制品[142-144],例如肉丸、肉肠等。
3 高密度CO2技术尚待解决的问题
一项新的技术要应用于食品工业化生产,不仅要保障食品安全,还要保障食品品质,并使其具有一定的货架期,同时还要考虑生产的经济性。虽然目前已经有大量的文献研究表明DPCD具有很好的杀菌和钝酶效果,在食品保鲜和加工中具有巨大的应用潜力,但是目前尚有许多问题有待解决:1)DPCD对于不同微生物的杀灭效果有差异,不能达到完全灭菌的效果,尤其是对芽孢的杀灭效果较差。虽然很多研究者已经阐述了DPCD的杀菌机制,解释了部分实验现象,但是如何提高DPCD的杀菌效果,还需要进一步阐明DPCD的杀菌靶点;另外要重视DPCD处理后微生物亚致死和不可培养状态的研究,阐明其机制,以期提供合理措施提高杀菌效果。2) DPCD对不同酶的钝化效果也存在差异,对有的酶(如多酚氧化酶)可以完全钝化,有的酶(如果胶甲酯酶)则不能完全钝化,对有的酶(如脂肪酶)甚至有激活的作用。研究者也提出了DPCD钝酶的一些机制,但是DPCD对钝酶的选择性机制还不清楚,尚待深入研究,为DPCD在不同领域中的应用提供参考。3)DPCD与不同类型食品之间相平衡的研究还非常缺乏,需要特别加强深入研究,以期准确预测CO2在不同食品中的溶解度以及处理的工艺参数(压强、温度和处理时间等)。4)目前关于DPCD研究的重点在杀菌和钝酶方面,而对于处理前后产品的品质变化、产品包装方式、贮藏方式、贮藏过程的品质变化与货架期等的研究还相对较少,这是作为技术应用和产品开发必须的一个环节,需要加强研究。5) 通过积累大量的基础研究,选择适合于DPCD处理的食品;6)对于不同类型的食品(如液体食品和固体食品),可能需要的DPCD设备有所差异,因此需要针对食品类型研发专用的DPCD研究和工业化生产设备,并研发设备清洗和消毒技术;7)合理评估DPCD技术的经济性等。相信随着科学研究的深入和发展,这些问题都将逐步得到解决,逐步推广DPCD加工技术在为食品加工业领域中的应用。
[1]DIAMOND L W,AKINFIEV N N.Solubility of CO2in water from -1.5 to 100℃and from 0.1 to 100 MPa:evaluation of literature data and thermodynamic modeling[J].Fluid phase equilibria,2003,208(1):265-290.
[2]PORTIER S,ROCHELLE C.Modelling CO2solubility in pure water and NaCl-type waters from 0 to 300℃ and from 1 to 300 bar:Application to the utsira formation at sleipner[J].Chemical Geology,2005,217(3):187-199.
[3]DUAN Z,SUN R.An improved model calculating CO2solubility in pure water and aqueous NaCl solutions from 273 to 533 K and from 0 to 2000 bar[J].Chemical geology,2003,193(3):257-271.
[4]ZHAO H,FEDKIN M V,Dilmore R M,et al.Carbon dioxide solubility in aqueous solutions of sodium chloride at geological conditions:Experimental results at 323.15,373.15,and 423.15 K and 150 bar and modeling up to 573.15 K and 2000 bar[J].Geochimica et Cosmochimica Acta,2015,149(1):165-189.
[5]TANG Y,BIAN X,DU Z,et al.Measurement and prediction model of carbon dioxide solubility in aqueous solutions containing bicarbonate anion[J].Fluid Phase Equilibria,2015,386(1):56-64.
[6]PEREIRA L M,CHAPOY A,BURGASS R,et al.Study of the impact of high temperatures and pressures on the equilibrium densities and interfacial tension of the carbon dioxide/water system[J].The Journal of Chemical Thermodynamics,2016,93(1):404-415.
[7]DEERING C E,CAIRNS E C,Mcisaac J D,et al.The partial molar volumes for water dissolved in high-pressure carbon dioxide from T =(318.28 to 369.40)K and pressures to P = 35MPa[J].The Journal of Chemical Thermodynamics,2016,93(1):337-346.
[8]EFIKA E C,HOBALLAH R,LI X,et al.Saturated phase densities of(CO2+ H2O)at temperatures from(293 to 450)K and pressures up to 64 MPa[J].The Journal of Chemical Thermodynamics,2016,93(1):347-359.
[9]TOMASULA P M,BOSWELL R T.Measurement of the solubility of carbon dioxide in milk at high pressures[J].The Journal of Supercritical Fluids,1999,16(1):21-26.
[10]CALIX T F,FERRENTINO G,BALABAN M O.Measurement of high-pressure carbon dioxide solubility in orange juice,apple juice,and model liquid foods[J].Journal of Food Science,2008,73(9):439-445.
[11]FERRENTINO G,BARLETTA D,DONSÌ F,et al.Experimentalmeasurementsandthermodynamic modeling of CO2solubility at high pressure in model apple juices[J].Industrial & Engineering Chemistry Research,2010,49(6):2992-3000.
[12]FERRENTINO G,BARLETTA D,BALABAN M O,et al.Measurement and prediction of CO2solubility in sodium phosphate monobasic solutions for food treatment with high pressure carbon dioxide[J].The Journal of Supercritical Fluids,2010,52(1):142-150.
[13]LIPLAP P,RENNIE T J,RAGHAVAN G V.Measurement of CO2solubility in tomato slurry using manometricmethod[J].AppliedEngineering in Agriculture,2014,30(1):59-67.
[14]FERRENTINO G,SCHUSTER J,BRAEUER A,et al.In situ Raman quantification of the dissolution kinetics of carbon dioxide in liquid solutions during a dense phase and ultrasound treatment for the inactivation of Saccharomycescerevisiae[J].TheJournalof Supercritical Fluids,2016,111(1):104-111.
[15]SPILIMBERGO S,KIKIC I.Thermodynamics of solutions of CO2with effects of pressure and temperature.In Dense Phase Carbon Dioxide:Food and Pharmaceutical Applications[M].Edited by Murat O B & Giovanna F,A John Wiley & Sons,Ltd,2012.
[16]GIOVANNA F,THELMA C,MASSIMO P,et al.ExperimentalMeasurementofCarbonDioxide Solubility.In Dense Phase Carbon Dioxide:Food and Pharmaceutical Applications[M].Edited by Murat O B & Giovanna F,A John Wiley & Sons,Ltd.,2012.
[17]GARCIA-GONZALEZ L,GEERAERD A H,SPILIMBERGO S,et al.High pressure carbon dioxide inactivation of microorganisms in foods:The past,the present and the future[J].International Journal of Food Microbiology,2007,117(1):1-28.
[18]OSMAN E.Effects of dense phase carbon dioxide on vegetative cells[M]//Dense Phase Carbon Dioxide:Food and Pharmaceutical Applications.Murat O B,Giovanna F.New Jersey:A John Wiley & Sons,Ltd,2012.
[19]DAMAR S,BALABAN M O.Review of dense phase CO2technology:microbial and enzyme inactivation,and effects on food quality[J].Journal of Food Science,2006,71(1):1-11.
[20]廖红梅,廖小军,胡小松.高压二氧化碳杀菌机理研究进展[J].食品工业科技,2012,33(19):387-390.
[21]廖红梅,廖小军,胡小松,等.影响DPCD技术杀菌效果的因素与杀菌机理分析[J].食品与发酵工业,2007,33(1):96-99.
[22]CUPPINI M,ZENI J,BARBOSA J,et al.Inactivation of Staphylococcus aureus in raw salmon with supercritical CO2using experimental design[J].Food Science and Technology(Campinas),2016,https://dx.doi.org/10.1590/1678-457X.0038.
[23]SOARES D,LERIN L A,CANSIAN R L,et al.InactivationofListeriamonocytogenesusing supercritical carbon dioxide in a high-pressure variable-volume reactor[J].Food control,2013,31(2):514-518.
[24]SILVA J M,RIGO A A,DALMOLIN I A,et al.Effect of pressure,depressurization rate and pressure cycling on the inactivation of Escherichia coli by supercritical carbon dioxide[J].Food Control,2013,29(1):76-81.
[25]GARCIA-GONZALEZ L,GEERAERD A H,ELST K,et al.Influence of type of microorganism,food ingredients and food properties on high-pressure carbon dioxide inactivation of microorganisms[J].International Journal of Food Microbiology,2009,129(3):253-263.
[26]GARCIA-GONZALEZ L,GEERAERD A H,ELST K,et al.Inactivation of naturally occurring microorganisms in liquid whole egg using high pressure carbon dioxide processing as an alternative to heat pasteurization[J].The Journal of Supercritical Fluids,2009,51(1):74-82.
[27]CALVO L,TORRES E.Microbial inactivation of paprika using high-pressure CO2[J].The Journal of Supercritical Fluids,2010,52(1):134-141.
[28]ORTUÑO C,MARTÍNEZ-PASTOR M T,MULET A,et al.Supercritical carbon dioxide inactivation ofEscherichia coli and Saccharomyces cerevisiae in different growth stages[J].The Journal of Supercritical Fluids,2012,63(1):8-15.
[29]KOBAYASHI F,HAYATA Y,IKEURA H,et al.Inactivation of Escherichia coli by CO2microbubbles at a lower pressure and near room temperature[J].Transactions of the ASABE,2009,52(5):1621-1626.
[30]KOBAYASHI F,HAYATA Y,IKEURA H,et al.Inactivation of Saccharomyces cerevisiae by CO2microbubbles at a lower pressure and near ambient temperature[J].Transactions of the ASABE,2010,53(4):1217-1222.
[31]KOBAYASHI F,IKEURA H,ODAKE S,et al.Inactivation of Lactobacillus fructivorans suspended in various buffer solutions by low-pressure CO2microbubbles[J].LWT-Food Science and Technology,2012,48(2):330-333.
[32]KOBAYASHI F,SUGAWARA D,TAKATOMI T,et al.InactivationofLactobacillusfructivoransin physiological saline and unpasteurised sake using CO2microbubbles at ambient temperature and low pressure[J].International Journal of Food Science & Technology,2012,47(6):1151-1157.
[33]KOBAYASHI F,ODAKE S,MIURA T,et al.Pasteurization and changes of casein and free amino acid contents of bovine milk by low-pressure CO2microbubbles[J].LWT-Food Science and Technology,2016,71:221-226.
[34]YUK H G,GeVEKE D J.Nonthermal inactivation and sublethal injury of Lactobacillus plantarum in apple cider by a pilot plant scale continuous supercritical carbon dioxide system[J].Food Microbiology,2011,28(3):377-383.
[35]BI X F,WANG Y T,ZHAO F,et a1.Sublethal injury and recovery of Eschedchia coli O157:H7 by high pressure carbon dioxide[J].Food Control,2015,50(1):705-713.
[36]LIAO H,ZHANG L,HU X,et al.Effect of high pressure CO2and mild heat processing on natural microorganisms in apple juice[J].International Journal of Food Microbiology,2010,137(1):81-87.
[37]LI H,DENG L,CHEN Y,et al.Inactivation,morphology,interior structure and enzymatic activity of high pressure CO2-treated Saccharomyces cerevisiae[J].Innovative Food Science & Emerging Technologies,2012,14(1):99-106.
[38]SPILIMBERGO S,FOLADORI P,MANTOAN D,et al.High-pressure CO2inactivation and induced damage on Saccharomyces cerevisiae evaluated by flow cytometry[J].Process Biochemistry,2010,45(5):647-654.
[39]ZHAO F,BI X,HAO Y,et al.Induction of viable but nonculturable Escherichia coli O157:H7 by high pressure CO2and its characteristics[J].PloS one,2013,8(4):e62388.
[40]XIONG R,XIE G,EDMONDSON A E,et al.A mathematical model for bacterial inactivation[J].International Journal of Food Microbiology,1999,46(1):45-55
[41]廖红梅,成玉梁,廖小军,等.预测微生物学在高压二氧化碳杀菌动力学的应用进展[J].食品工业科技,2012,33(13):366-372.
[42]GUNES G,BLUM LK,HOTCHKISS JH.Inactivation of Escherichia coli(ATCC 4157)in apple cider by dense phase carbon dioxide[J].Journal of Food Protection,2006,69(1):12-16
[43]周先汉,宋俊骅,曾庆梅,等.高压CO2酸化杀菌机理的研究[J].食品科学,2010,31(11):11-14.
[44]SPILIMBERGO S,MANTOAN D,QUARANTA A,et al.Real-time monitoring of cell membrane modification during supercritical CO2pasteurization[J].The Journal of Supercritical Fluids,2009,48(1):93-97.
[45]GARCIA-GONZALEZ L,GEERAERD A H,MAST J,et al.Membrane permeabilization and cellular death of Escherichia coli,Listeria monocytogenes and Saccharomyces cerevisiae as induced by high pressure carbon dioxide treatment[J].Food Microbiology,2010,27(4):541-549.
[46]LI H,DENG L,CHEN Y,et al.Inactivation,morphology,interior structure and enzymatic activity of high pressure CO2-treated Saccharomyces cerevisiae[J].Innovative Food Science & Emerging Technologies,2012,14(1):99-106.
[47]LI J,WANG A,ZHU F,et al.Membrane damage induced by supercritical carbon dioxide in Rhodotorula mucilaginosa[J].Indian Journal of Microbiology,2013,53(3):352-358.
[48]YAO C,LI X,BI W,et al.Relationship betweenmembrane damage,leakage of intracellular compounds,and inactivation of Escherichia coli treated by pressurized CO2[J].Journal of Basic Microbiology,2014,54(8):858-865.
[49]TAMBURINI S,BALLARINI A,FERRENTINO G,et al.Comparison of quantitative PCR and flow cytometry as cellular viability methods to study bacterial membrane permeabilization following supercritical CO2treatment[J].Microbiology,2013,159(6):1056-1066.
[50]LIU S,ZHANG L,JI H,et al.Sterilizing effect of dense phase carbon dioxide on dominant spoilage bacteria from shrimp and its mechanism[J].Transactions of the Chinese Society of Agricultural Engineering,2013,29(14):284-292.
[51]周先汉,程丽梅,曾庆梅,等.超临界CO2杀菌过程中萃取机制研究[J].食品科学,2010,31(17):14-17.
[52]TAMBURINi S,ANESI A,FERRENTINO G,et al.Supercritical CO2induces marked changes in membrane phospholipids composition in Escherichia coli K12[J].The Journal of Membrane Biology,2014,247(6):469-477.
[53]KIM S R,RHEE M S,KIM B C,et al.Modeling of the inactivation of Salmonella typhimurium by supercritical carbondioxideinphysiologicalsalineand phosphate-buffered saline[J].Journal of Microbiology Methods,2007,70(1):132-141.
[54]KIM S R,KIM H T,PARK H J,et al.Fatty acid profiling and proteomic analysis of Salmonella enterica serotype Typhimurium inactivated with supercritical carbon dioxide[J].International Journal of Food Microbiology,2009,134(3):190-195.
[55]饶伟丽,张德权,李淑荣,等.超临界CO2杀灭大肠杆菌过程中菌体蛋白的变化[J].核农学报,2009,23(3):471-476.
[56]廖红梅.高压二氧化碳对苹果汁中微生物的杀菌效果及对大肠杆菌结构、蛋白质和DNA 的影响[D].北京:中国农业大学,2010.
[57]王莹莹.高密度CO2对大肠杆菌膜渗透性及蛋白质的影响[D].北京:中国农业科学院,2011.
[58]杨扬.高密度二氧化碳致死大肠杆菌过程中关键蛋白质的研究[D].北京:中国农业科学院,2014.
[59]LIAO H,ZHANG F,HU X,et al.Effects of high-pressure carbon dioxide on proteins and DNA in Escherichia coli[J].Microbiology,2011,157(3):709-720.
[60]SETLOW P.Spores of Bacillus subtilis:their resistance to and killing by radiation,heat and chemicals[J].Journal of Applied Microbiology,2006,101(3):514-525.
[61]PERRUT M.Sterilization and virus inactivation by supercritical fluids(a review)[J].The Journal of Supercritical Fluids,2012,66(1):359-371.
[62]RAO L,BI X F,ZHAO F,et al.Effect of high-pressure CO2processing on bacterial spores[J].Critical Reviews in Food Science and Nutrition,2016,56(11):1808-1825.
[63] WATANABE T,FURUKAWA S,HIRATA J,et al.Inactivation of Geobacillus stearothermophilus spores by high pressure carbon dioxide treatment[J].Applied and Environmental Microbiology,2003,69(12):7124-7129.
[64]WATANABE T,FURUKAWA S,TAI T,et al.High pressure carbon dioxide decreases the heat tolerance of the bacterial spores[J].Food Science and Technology Research,2003,9(4):342-344.
[65]RAO L,XU Z,WANG Y,et al.Inactivation of Bacillus subtilis spores by high pressure CO2with high temperature[J].InternationalJournalofFood Microbiology,2015,205(1):73-80.
[66]SPILIMBERGO S,DEHGHANI F,BERTUCCO A,et al.Inactivation of bacteria and spores by pulse electric field and high pressure CO2at low temperature[J].Biotechnology and Bioengineering,2003,82(1):118-125.
[67]ZHANG J,DALAL N,MATTHEWS M A,et al.Supercritical carbon dioxide and hydrogen peroxide cause mild changes in spore structures associated with high killing rate[J].Journal of Microbiological Methods,2007,70(3):442-451.
[68]PARK H S,CHOI H J,KIM M D,et al.Addition of ethanol to supercritical carbon dioxide enhances the inactivation of bacterial spores in the biofilm of Bacillus cereus[J].International journal of food microbiology,2013,166(2):207-212.
[69]PARK H S,KIM K H.Enhancement of supercritical CO2inactivation of spores of Penicillium oxalicum by ethanol cosolvent[J].Journal of Microbiology and Biotechnology,2013,23(6):833-836.
[70]CASAS J,TELLO J,GATTO F,et al.Microbialinactivation of paprika using oregano essential oil combined with high-pressure CO2[J].The Journal of Supercritical Fluids,2016,doi:10.1016/j.supflu.2016,04,012.
[71]SETLOW B,KORZA G,BLATT K M,et al.Mechanism of Bacillus subtilis spore inactivation by and resistance to supercritical CO2plus peracetic acid[J].Journal of Applied Microbiology,2016,120(1):57-69.
[72]BALLESTRA P,CUQ J L.Influence of pressurized carbon dioxide on the thermal inactivation of bacterial and fungal spores.LWT-Food Science and Technology,1998,31(1):84-88.
[73]SPILIMBERGO S,ELVASSORE N,BERTUCCO A.Microbial inactivation by high-pressure[J].The Journal of Supercritical Fluids,2002,22(1):55-63.
[74]SPILIMBERGO S,BERTUCCO A,LAURO F M,et al.Inactivation of Bacillus subtilis spores by supercritical CO2treatment.Innovative Food Science & Emerging Technologies,2003,4(2):161-165.
[75]FURUKAWA S,WATANABE T,TAI T,et al.Effect of high pressure gaseous carbon dioxide on the germination of bacterial spores[J].International Journal of Food Microbiology,2004,91(2):209-213.
[76]ZHANG J,BURROWS S,GLEASON C,et al.Sterilizing Bacillus pumilus spores using supercritical carbon dioxide[J].Journal of Microbiology methods,2006,66(3):479-485.
[77]ZHANG J,DALAL N,GLEASON C,et al.On the mechanisms of deactivation of Bacillus atrophaeus spores using supercritical carbon dioxide[J].The Journal of Supercritical Fluids,2006,38(2):268-273.
[78]BAE Y Y,LEE H J,KIM S A,et al.Inactivation of Alicyclobacillus acidoterrestris spores in apple juice by supercritical carbon dioxide[J].International Journal of Food Microbiology,2009,136(1):95-100.
[79]WIMMER Z,ZAREVÚCKA M.A review on the effects of supercritical carbon dioxide on enzyme activity[J].International Journal of Molecular Sciences,2010,11(1):233-253.
[80]HU W,ZHOU L,XU Z,et al.Enzyme inactivation in food processing using high pressure carbon dioxide technology[J].Critical Reviews in Food Science and Nutrition,2013,53(2):145-161.
[81]MANZOCCO L,IGNAT A,VALOPPI F,et al.Inactivation of mushroom polyphenoloxidase in model systems exposed to high-pressure carbon dioxide[J].The Journal of Supercritical Fluids,2016,107(1):669-675.
[82]KOBAYASHI F,IKEURA H,ODAKE S,et al.Inactivation kinetics of polyphenol oxidase using a two-stage method with low pressurized carbon dioxide microbubbles[J].Journal of Food Engineering,2013,114(2):215-220.
[83]KOBAYASHI F,IKEURA H,ODAKE S,et al.Inactivation of enzymes and Lactobacillus fructivorans in unpasteurized sake by a two-stage method with low-pressure CO2microbubbles and quality of the treated sake[J].Innovative Food Science & Emerging Technologies,2013,18(1):108-114.
[84]GIACOMO G D,TAGLIERI L,SCIMIA F,et al.Effect of supercritical carbon dioxide on the enzymes inactivationinsingle-strengthcarrotjuice[J].International Journal of Food Science and Nutrition Engineering,2014,4(4):106-111.
[85]MELGOSA R,SANZ M T,GARCÍA-SOLAESA Ángela,et al.Enzymatic activity and conformational and morphological studies of four commercial lipases treated with supercritical carbon dioxide[J].The Journal of Supercritical Fluids,2015,97(1):51-62.
[86]LIU Y,HU X S,ZHAO X Y,et al.Inactivation of polyphenol oxidase from watermelon juice by high pressure carbon dioxide treatment[J].Journal of Food Science and Technology,2013,50(2):317-324.
[87]LEITGEB M,COLNIK M,PRIMOZIC M,et al.Activity of cellulase and α-amylase from Hortaea werneckii after cell treatment with supercritical carbon dioxide[J].The Journal of Supercritical Fluids,2013,78(1):143-148.
[88]MARSZAŁEK K,SKĄPSKA S,WOZNIAK,et al.Application of supercritical carbon dioxide for the preservation of strawberry juice:Microbial and physicochemical quality,enzymatic activity and the degradation kinetics of anthocyanins during storage[J].Innovative Food Science & Emerging Technologies,2015,32(1):101-109.
[89]IFTIKHAR T,WAGNER M E,RIZVI S S H.Enhanced inactivation of pectin methyl esterase in orange juice using modified supercritical carbon dioxide treatment[J].International Journal of Food Science & Technology,2013,49(3):804-810.
[90]WEDER J K P,BOKOR M V,HEGARTY M P.Effect of supercritical carbon dioxide on arginine[J].Food Chemistry,1992,44(4):281-290.
[91]FRICKS A T,SOUZA D P B,OESTREICHER E G,et al.Evaluation of radish(Raphanus sativus L.)peroxidase activity after high-pressure treatment with carbon dioxide[J].The Journal of Supercritical Fluids,2006,38(3):347-353.
[92]KAMAT S V,BECKMAN E J,RUSSELL A J.Enzyme activity in supercritical fluids[J].Critical Reviews in Biotechnology,1995,15(1):41-71.
[93]KAMAT S V,CRITCHLEY G,BECKMAN E J,et al.Biocatalytic synthesis of acrylates in organic solvents and supercritical fluids:III.Does carbon dioxide covalently modify enzymes[J].Biotechnology and Bioengineering,1995,46(6):610-620.
[94]CUNDARI T R,WILSON A K,DRUMMOND M L,et al.CO2-formatics:how do proteins bind carbon dioxide?[J].Journal of Chemical Information and Modeling,2009,49(9):2111-2115.
[95]MÜLLER K,LÜDEMANN H D,JAENICKE R.Pressure-dependent deactivation and reactivation of dimeric enzymes[J].Naturwissenschaften,1981,68(10):524-525.
[96]YOSHIMURA T,SHIMODA M,ISHIKAWA H,et al.Inactivation kinetics of enzymes by using continuous treatment with microbubbles of supercritical carbon dioxide[J].Journal of Food Science,2001,66(5):694-697.
[97]TSOU C L.Location of the active sites of some enzymes in limited and flexible molecular regions[J].Trends in Biochemical Sciences,1986,11(10):427-429.
[98]ZAKS A,KLIBANOV A M.Enzymatic catalysis in nonaqueoussolvents[J].JournalofBiological Chemistry,1988,263(7):3194-3201.
[99]KNEZ Ž,HABULIN M.Compressed gases as alternative enzymatic-reaction solvents:a short review[J].The Journal of Supercritical Fluids,2002,23(1):29-42.
[100]OULÉ K M,DICKMAN M,ARUL J.Properties of orange juice with supercritical carbon dioxide treatment[J].International Journal of Food Properties,2013,16(8):1693-1710.
[101]LIAO H,HU X,LIAO X,et al.Inactivation of Escherichia coli inoculated into cloudy apple juice exposed to dense phase carbon dioxide[J].International Journal of Food Microbiology,2007,118(2):126-131.
[102]FERRENTINO G,BRUNO M,FERRARI G,et al.Microbial inactivation and shelf life of apple juice treated with high pressure carbon dioxide[J].Journal of Biological Engineering,2009,3(1):1-9.
[103]NIU S,XU Z,FANG Y,et al.Comparative study on cloudy apple juice qualities from apple slices treated by high pressure carbon dioxide and mild heat[J].Innovative Food Science & Emerging Technologies.2010,11(1):91-97.
[104]廖红梅,丁占生,钟葵,等.高压二氧化碳对鲜榨梨汁贮藏稳定性的影响研究[J].食品工业科技,2013,34(23):131-133.
[105]廖红梅,丁占生,钟葵,等.高压二氧化碳对鲜榨梨汁杀菌效果及动力学研究[J].食品工业科技,2013,34(24):83-87.
[106]周林燕,王永涛,刘凤霞,等.高压CO2处理保持非还原桃汁的品质[J].农业工程学报,2013,29(23):262-267.
[107]LIU Y,HU X S,ZHAO X Y,et al.Inactivation of polyphenol oxidase from watermelon juice by high pressure carbon dioxide treatment[J].Journal of Food Science and Technology,2013,50(2):317-324.
[108]刘野,张超,赵晓燕,等.高压二氧化碳抑制西瓜汁褐变的试验[J].农业工程学报,2010,26(8):373-378.
[109]刘野,赵晓燕,邹磊,等.高压二氧化碳对鲜榨西瓜汁杀菌效果和风味的影响[J].食品科学,2012,33(3):82-88.
[110]CHEN J,ZHANG J,FENG Z,et al.Influence of thermal and dense-phase carbon dioxide pasteurization on physicochemical properties and flavor compounds in Hami melon juice[J].Journal of Agricultural and Food Chemistry,2009,57(13):5805-5808.
[111]CHEN J,ZHANG J,SONG L,et al.Changes in microorganism,enzyme,aroma of hami melon(Cucumis melo L.)juice treated with dense phase carbon dioxide and stored at 4℃[J].Innovative Food Science & Emerging Technologies,2010,11(4):623-629.
[112]CAPPELLETTI M,FERRENTINO G,ENDRIZZI I,et al.High pressure carbon dioxide pasteurization ofcoconut water:a sport drink with high nutritional and sensory quality[J].Journal of Food Engineering,2015,145(1):73-81.
[113]MARCHI F D,APREA E,ENDRIZZI I,et al.Effects of Pasteurization on Volatile Compounds and Sensory Properties of Coconut ( Cocos nucifera,L.)Water:Thermal vs.High-Pressure Carbon Dioxide Pasteurization[J].Food & Bioprocess Technology,2015,8(7):1-12.,APREA E,ENDRIZZI I,et al.Effects of pasteurization on volatile compounds and sensory properties of coconut (Cocos nucifera L.)water:Thermalvs.high-pressurecarbondioxide pasteurization[J].Food and Bioprocess Technology,2015,8(7):1393-1404.
[113] Marchi F D,Aprea E,Endrizzi I,et al.Effects of pasteurization on volatile compounds and sensory propertiesofcoconut(Cocosnucifera L.)water:Thermal vs.high-pressure carbon dioxide pasteurization[J].FoodandBioprocess Technology,2015,8(7):1-12.
[114]DAGAN G F,BALABAN M O.Pasteurization of beer by a continuous dense-phase CO2system[J].Journal of Food Science,2006,71(3):E164-E169.
[115]ERKMEN O.Effects of high-pressure carbon dioxide on Escherichia coli in nutrient broth and milk[J].International Journal of Food Microbiology,2001,65(1):131-135.
[116]廖红梅,周林燕,廖小军,等.高密度二氧化碳对牛初乳的杀菌效果及对理化性质影响[J].农业工程学报,2009,25(4):260-264.
[117]钟葵,黄文,廖小军,等.高密度二氧化碳技术对牛奶杀菌效果动力学分析[J].化工学报,2010,61(1):146-151.
[118]姚春艳.加压CO2杀菌机理初探及对乳中酶和细菌活性的影响[D].哈尔滨:东北农业大学,2013.
[119]FERRENTINO G,CALLIARI N,BERTUCCO A,
et al.Validation of a mathematical model for predicting high pressure carbon dioxide inactivation kinetics of Escherichia coli spiked on fresh cut carrot[J].The Journal of Supercritical Fluids,2014,85(1):17-23.
[120]SPILIMBERGO S,KOMES D,VOJVODIC A,et al.High pressure carbon dioxide pasteurization of fresh-cut carrot[J].The Journal of Supercritical Fluids,2013,79(1):92-100.
[121]BI X,WU J,ZHANG Y,et al.High pressure carbon dioxide treatment for fresh-cut carrot slices[J].Innovative Food Science & Emerging Technologies.2011,12(3):298-304.
[122]FERRENTINO G,BALZAN S,DORIGATO A,et al.Effect of supercritical carbon dioxide pasteurization on natural microbiota,texture,and microstructure of fresh-cut coconut[J].Journal of Food Science,2012,77(5):137-143.
[123]VALVERDE M T,MARÍN-INIESTA F,CALVO L.Inactivation of Saccharomyces cerevisiae in conference pear with high pressure carbon dioxide and effects on pear quality[J].Journal of Food Engineering,2010,98(4):421-428.
[124]张华,董月强,李青,等.高密度二氧化碳技术对鲜切莲藕褐变相关酶活的影响[J].食品工业科技,2013,34(22):290-293.
[125]张华,董月强,李星科,等.高密度二氧化碳技术对鲜切莲藕酶活性的影响[J].食品与机械,2013,29(1):170-172.
[126]张华,董月强,袁博,等.高密度二氧化碳技术对鲜切莲藕贮藏品质的影响[J].食品工业,2014,35(3):76-79.
[127]CHOI Y M,BAE Y Y,KIM K H,et al.Effects of supercritical carbon dioxide treatment against generic Escherichia coli,Listeria monocytogenes,Salmonella typhimurium,and E.coli O157:H7 in marinades and marinated pork [J].Meat Science,2009,82(4):419-424.
[128]CHOI YM,KIM O Y,KIM K H,et al.Combined effect of organic acids and supercritical carbon dioxide treatments against nonpathogenic Escherichia coli,Listeria monocytogenes,Salmonella typhimurium and E.coli O157:H7 in fresh pork [J].Letters in Applied Microbiology,2009,49(4):510-515.
[129]孙源源,张德权,李春红,等.肉馅高密度CO2杀菌效果和杀菌动力学研究[J].核农学报,2009,23(6):1014-1020.
[130]闫文杰,崔建云,戴瑞彤,等.高密度二氧化碳处理对冷却猪肉品质及理化性质的影响[J].农业工程学报,2010,26(7):346-350.
[131]WEI C I,BALABAN M O,FERNANDO S Y,et al.Bacterial effect of high pressure CO2treatment on foods spiked with Listeria or Salmonella [J].Journal ofFood Protection,1991,54(3):189-193.
[132]饶伟丽,刘琳,张德权,等.高密度CO2对生鲜调理鸡肉杀菌动力学模型构建[J].食品工业科技,2013,34(11):320-324.
[133]SIRISEE U,HSIEH F,HUFF H E,et al.Microbial safety of supercritical carbon dioxide processes[J].Journal of Food Processing and Preservation,1998,22(5):387-403
[134]ERKMEN O.Antimicrobial effects of pressurised carbon dioxide on Brochothrix thermosphacta in broth and foods[J].Journal of the Science of Food and Agriculture,2000,80(9):1365-1370.
[135]姚中峰,李兴民,刘洁洁,等.高压二氧化碳处理对牛通脊颜色和肌红蛋白的影响[J].食品工业科技,2012,33(4):142-145.
[136]JI H W,ZHANG L,LIU S C,et al.Optimization of microbial inactivation of shrimp by dense phase carbon dioxide[J].InternationalJournalofFood Microbiology,2012,156(1):44-49.
[137]ZHANG L,LIU S C,JI H W,et al.Inactivation of polyphenol oxidase from Pacific white shrimp by dense phase carbon dioxide [J].Innovative Food Science & Emerging Technologies,2011,12(4):635-641.
[138]MEUJO D F,KEVIN D A,PENG J,et al.Reducing oyster-associated bacteria levels using supercritical fluid CO2as an agent of warm pasteurization [J].International Journal of Food Microbiology,2010,138(1-2):63-70.
[139]张良,刘书成,章超桦,等.神经网络优化牡蛎的高密度CO2杀菌工艺[J].农业工程学报,2011,27(12):369-373.
[140] 陈亚励,屈小娟,郭明慧,等.高密度CO2在肉制品和水产品加工中的应用[J].现代食品科技,2014,30 (9):304-311.
[141]XU D,YUAN F,JIANG J,et al.Structural and conformational modification of whey proteins induced by supercritical carbon dioxide [J].Innovative Food Science & Emerging Technologies,2011,12(1):32-37.
[142]屈小娟,刘书成,吉宏武,等.高密度CO2诱导制备虾糜凝胶的特性[J].农业工程学报,2012,28(20):282-287.
[143]曲亚琳,张德权,饶伟丽,等.高密度CO2对羊肉糜凝胶特性的影响[J].核农学报,2010,24(6):1226-1231.
[144]郭明慧,邓倩琳,刘书成,等.高密度CO2对凡纳滨对虾肌球蛋白疏水性的影响[J].广东海洋大学学报,2016,36(1):73-78.
(责任编辑:陈庄)
Review on Inactivation of Microorganisms and Enzyme by Dense Phase Carbon Dioxide and the Application
LIU Shu-cheng,GUO Ming-hui,LIU Yuan,LIU Meng-na,DENG Qian-lin
(College of Food Science and Technology,Guangdong Ocean University//Guangdong Provincial Key Laboratory of Aquatic Products Processing and Safety//Guangdong Provincial Seafood Engineering Technology Research Center//Key Laboratory of Advanced Processing of Aquatic Products of Guangdong Higher Education Institution,Zhanjiang 524088,China)
Dense phase carbon dioxide(DPCD)is one of the very promising food non-thermal processing technologies,which was mainly used to inactivate microorganism and enzyme in food.The paper reviews the progress of last decade made in the basic research and application research of DPCD technology at home and abroad.The basic research fields of DPCD technology include phase equilibrium between DPCD and food system,effect and mechanism of inactivation microbial vegetative and spore by DPCD,effect and mechanism of inactivation enzyme by DPCD.The application research fields of DPCD technology include liquid food(fruit and vegetable juice,beer,milk)and solid food (fresh cut fruit and vegetable,meat,seafood) processing.Finally,some problems to be solved are discussed on the development of DPCD technology in future.The reviews will provide the reference for the research and application of DPCD in food processing.
Dense phase carbon dioxide;Inactivation microorganisms;Inactivation enzyme;Liquid food;Solid food
TS254.4
A
1673-9159(2016)04-0101-16
10.3969/j.issn.1673-9159.2016.04.017
2016-04-15
国家自然科学基金(31371801);广东省科技计划项目(2015A020209158);现代农业产业技术体系专项基金(CARS-47)
刘书成(1977-),男,教授,研究方向为水产品非热加工技术基础理论与应用。Email:Lsc771017@163.com
