长效/短效GnRH激动剂长方案分别用于卵泡期/黄体期的临床效果比较
2016-11-11胡琳莉代玮孙莹璞
胡琳莉,代玮,孙莹璞
(郑州大学第一附属医院生殖医学中心,郑州 450000)
长效/短效GnRH激动剂长方案分别用于卵泡期/黄体期的临床效果比较
胡琳莉,代玮,孙莹璞*
(郑州大学第一附属医院生殖医学中心,郑州450000)
目的比较卵泡期长效促性腺激素释放激素激动剂(GnRH-a)长方案和黄体期短效GnRH-a长方案在体外受精-胚胎移植中的治疗结局。方法回顾性分析2015年5月~2016年2月在本院行体外受精-胚胎移植的患者5 197例,其中A组:卵泡期长效GnRH-a长方案2 395例,B组:短效GnRH-a长方案2 802例,比较两种方案的临床特征及结局。结果两组间bFSH[(7.01±2.33 vs.7.20±2.34)U/L]、周期数(1.31±0.43 vs.1.12±0.41)、rFSH总量[(1 672.55±521.84)vs.(1 829.33±741.08)U]、HMG总量[(938.59±909.14) vs.(207.38±364.85)U]、促性腺激素(Gn)天数[(13.89±2.48) vs.(11.64±1.84)d]、HCG日E2[(13 033±7 909)vs. (18 267±10 277)pmol/L]、P[(3.14±1.87)vs. (2.82±1.49)nmol/L]、LH[(1.05±1.51) vs.(1.55±0.85)U/L]、内膜厚度[(12.11±2.49) vs.(11.75±2.38)mm]、≥16 mm卵泡数[(5.77±2.53) vs.(7.01±3.21)个],14~16 mm卵泡数[(2.92±2.26vs.2.75±2.21)个]、12~13 mm卵泡数[(2.92±2.29) vs.(2.1±1.91)个]、MⅡ卵泡数[(10.36±6.24) vs.(10.88±6.54)个]、2PN受精率(64.21% vs.67.22%)、优质胚胎率(67.66%vs.74.05%)、着床率(45.34% vs.37.68%)、临床妊娠率(63.72% vs.52.67%)、流产率(8.41% vs.11.55%)、宫外孕率(1.52% vs.3.30%)差异具有统计学意义(P<0.05),BMI、全胚冷冻率、取消率、获卵数、平均移植胚胎数、多胎率无显著性差异(P>0.05);按年龄分层分析后,各年龄组中A组着床率(年龄<35岁组:49.98% vs.42.94%;年龄35~40岁组:38.57% vs.27.85%);及妊娠率(年龄<35岁组:70.00% vs.59.38%;年龄35~40岁组:57.14% vs.42.24%);均显著高于B组(P<0.05)。结论与黄体期短效长方案相比,卵泡期长效GnRH-a长方案能显著提高着床率及临床妊娠率。
促性腺激素释放激素激动剂;长方案;体外受精-胚胎移植
Methods:The data of 5 197 IVF/ICSI cycles from May 2015 to Feb. 2016 were retrospectively analyzed. The cycles were divided into two groups:the patients in group A were used long-acting GnRH-a long protocol in follicular phase (n=2 395),and the patients in group B were used short-acting GnRH-a long protocol in mid-luteal phase (n=2 802). The clinical characters and outcomes were compared.
Results:There were significant differences in amount of bFSH [(7.01±2.33) vs. (7.2±2.34)U/L],number of cycles (1.31±0.43 vs. 1.12±0.41),total dose of rFSH [(1 672.55±521.84) vs. (1 829.33±741.08) U],HMG [(938.59±909.14)vs. (207.38±364.85) U],gondotropin days (13.89±2.48 vs. 11.64±1.84);on HCG day,E2[(13 033±7 909) vs. (18 267±10 277) pmol/L],LH [(1.05±1.51) vs. (1.55±0.85) U/L],progesterone [(3.14±1.87) vs. (2.82±1.49) nmol/L],endometrial thickness [(12.11±2.49) vs. (11.75±2.38) mm],number of follicles≥16 mm (5.77±2.53 vs. 7.01±3.21),number of follicles with 14-16 mm (2.92±2.26 vs. 2.75±2.21),number of follicles with 12-13 mm (2.92±2.29 vs.2.10±1.91),number of MⅡ follicles (10.36±6.24 vs. 10.88±6.54);2PN fertility rate (64.21% vs. 67.22%),high quality embryo rate (67.66% vs. 74.05%),implantation rate (45.34% vs. 37.68%),clinical pregnancy rate (63.72% vs. 52.67%),miscarriage rate (8.41% vs. 11.55%),ectopic pregnancy rate (1.52% vs. 3.30%) (allP<0.05). There were no significant differences in BMI,embryo frozen rate,cancel cycle rate,number of retrieved oocytes,number of embryo transferred,multiple pregnancy rate (P>0.05). After adjusted by age,the implantation rate (age<35 group:49.98% vs. 42.94%,35-40 group:38.57% vs. 27.85%)and clinical pregnancy rate (age<35 group:70% vs. 59.38%,35-40 group:57.14% vs.42.24%)in group A were still significantly higher than those group B (allP<0.05).
Conclusions:Administration of long-acting GnRH-a protocol in early follicular phase can improve implantation rate and clinical pregnancy rate compared with administration of short-acting GnRH-a protocol in the mid-luteal phase.
(JReprodMed2016,25(10):919-925)
自1978年世界第一例试管婴儿诞生以来,体外受精-胚胎移植技术(IVF-ET)的发展已有近40年历史。1984年,Porter等[1]首次报道促性腺激素释放激素激动剂(gonadotropin releasing hormone agonist,GnRH-a)应用于IVF-ET的控制性促排卵(controlled ovarian hyperstimulation,COH)获得成功,自此之后GnRH-a降调节已成为促排卵的主流方向。经过不断探索,短效GnRH-a长方案能达到稳定的妊娠率已成为国内大部分中心的首选方案,而长效GnRH-a能改善盆腔微环境、子宫内膜容受性,主要应用于子宫内膜异位症人群。对于普通人群,卵泡期长效GnRH-a长方案与短效GnRH-a长方案的临床应用适应人群仍存在争议,本文通过回顾性分析卵泡期长效GnRH-a长方案与短效GnRH-a长方案在临床应用中的特征及治疗结局,探讨二者在临床的应用价值。
材料与方法
一、研究对象及分组
1.研究对象:回顾性分析2015年5月~2016年2月期间在我中心接受IVF/ICSI助孕所有患者临床资料,共5 197例取卵患者。
2.分组:A组:卵泡期长效GnRH-a长方案2 395例,B组:短效GnRH-a长方案2 802例。再将A、B组的患者根据不同年龄段分为<35岁组,35~40岁组,≥40岁组。
二、促排卵方案
1. 降调方案:A组:月经第2~3天 给予长效促性腺激素激动剂(达菲林,博福-益普生,法国)3.75 mg降调节。30~42 d后达到降调标准(无>10 mm卵巢囊肿;E2<183 pmol/L,LH<3 U/L),应用促性腺激素(Gn)进行COH。B组:黄体中期短效GnRH-a 0.1 mg/d×10后改为0.05 mg/d,降调14~18 d达到降调标准后应用Gn进行COH。
2.促排卵:两种方案均根据卵泡大小及雌激素水平调整Gn剂量。
3.HCG日标准:当1个主导卵泡直径≥20 mm,3个卵泡直径≥17 mm,或2/3卵泡直径≥16 mm时使用艾泽250 μg(默克雪兰诺,意大利)和人绒毛膜促性腺激素(HCG)2 000 IU,注射后37 h在阴道超声引导下穿刺采卵,取卵当天行阴道给药黄体酮凝胶(雪诺同,默克雪兰诺,瑞士)行黄体支持,移植35 d超声下见孕囊为临床妊娠。
三、统计学方法
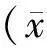
结 果
一、两组临床一般情况及助孕结局的比较
A、B两组间bFSH、周期数、rFSH总量、HMG总量、Gn天数、HCG日E2、孕酮(P)、LH、内膜厚度、≥16 mm,14~16 mm、12~13 mm卵泡数目、MⅡ、2PN受精率、优质胚胎率、着床率、临床妊娠率、流产率、宫外孕率差异有统计学意义(P<0.05)(表1)。
二、将患者按年龄分组比较
年龄<35岁组,两组bFSH、平均周期数、rFSH总量、HMG总量、Gn天数、HCG日E2、P、LH、内膜厚度、≥16 mm、12~13 mm卵泡数目、MⅡ、2PN、优质胚胎率、着床率、临床妊娠率、宫外孕率均有差异(P<0.05);
年龄35~40岁组,两组BMI、平均周期数、rFSH总量、HMG总量、Gn天数、HCG日E2、LH、≥16 mm、14~16 mm个数、12~13 mm卵泡数目、优质胚胎率、着床率、临床妊娠率均有差异(P<0.05);
在年龄≥40岁组,两组bFSH、平均周期数、rFSH总量、HMG总量、Gn天数、HCG日LH、12~13 mm卵泡数目、获卵(OPU)数、MⅡ均有差异(P<0.05)(表2、3)。
三、可能影响妊娠结局相关因素分析
采用多因素logistic回归方程分析将可能影响妊娠结局的各因素,矫正了各种混杂因素后,结论为:年龄、AFC、周期数、方案、2PN数、移植胚胎数为影响妊娠结局的独立因素(表4)。

表1 A、B组临床特征及助孕结局比较[(x-±s),n(%)]
注:与A组相比,※P<0.05

表2 A、B两组各年龄段组临床特征比较[(x-±s),n(%)]
注:与A组相比,※P<0.05

表3 A、B两组各年龄段组促排卵结局的比较[(x-±s),n(%)]
注:与A组相比,※P<0.05

表4 妊娠相关因素分析
讨 论
1984年,GnRH-a 首次应用于IVF的COH治疗中进行垂体降调节[1],降调节后可增加卵泡募集,抑制内源性黄体生成素峰,避免卵泡过早黄素化,最终获得高质量卵母细胞,提高临床妊娠率。自此,GnRH-a应用于垂体降调已有30年历史。长方案是指开始促排卵前至少给予2周GnRH-a直至HCG日[2],降调时间分为卵泡期降调及黄体期降调。众多学者对开始降调的时间进行了大量的研究,结果显示临床治疗结局无显著性差异,但多中心随机对照研究显示黄体期长方案可显著提高活产[3],因此黄体期长方案成为临床常用方案。Ron-EI等[4]发现与卵泡期降调相比,黄体期降调更快,获卵数、取消率和妊娠率两组间无显著性差异,但卵泡期组成熟卵数和优胚率显著增加。一项回顾性研究中表明,卵泡期3.75 mg GnRH-a降调并延长降调时间比黄体期期1.25 mg GnRH-a降调能获得更高的着床率及活产率[5]。同时也有许多学者比较长效GnRH-a与短效GnRH-a的作用效果,两者虽降调模式不同,但二者均能有效的抑制垂体[6]。但大样本荟萃分析表明,长效GnRH-a对垂体抑制作用较深,增加Gn的用药时间和剂量[7],本研究结果与其一致。
本研究回顾性分析比较卵泡期长效GnRH-a长方案与黄体期短效GnRH-a长方案,卵泡期长效GnRH-a长方案HCG日雌激素、LH水平均较低,但孕酮高于长方案组。在经典的两细胞两性腺激素学说中,在卵泡黄素化之前LH通过促进孕激素转化为雄激素,然后在颗粒细胞中转化为雌激素。因此可能卵泡期长效GnRH-a长方案中LH的过度抑制造成了FSH与LH的失衡,LH的相对不足,使孕激素在LH作用下转化为雄激素,进而在颗粒细胞中代谢为雌激素过程减弱,造成了卵泡期长效GnRH-a长方案组孕激素较高,雌激素较低的现象。Smitz等[8]在比较HP-HMG和重组FSH促排卵的患者中P增高的研究中发现,应用重组FSH促排卵者中P增高发生率显著增加,从而认为P增高的发生与过低的LH相关,本研究结果与其一致。通过对HCG日卵泡大小分布情况,我们发现卵泡期长效GnRH-a长方案组中小卵泡多于长方案组,卵泡生长较不均匀。卵泡的生长、发育、成熟需要一定水平的LH,而长效达菲林对LH的强度抑制,造成卵泡期长效GnRH-a长方案中卵泡生长不同步,优质胚胎率低于短效长方案,与宋娟等[9]结果相一致。
胚胎的质量与内膜容受性是影响试管婴儿成功率的两大主要因素。虽然卵泡期长效GnRH-a长方案的获卵数、平均移植胚胎数目与黄体期短效长方案组无差异,并且优质胚胎率低于黄体期长方案,但是着床率及临床妊娠率要显著升高,可能与子宫内膜容受性的改变有关。黄体期长方案的高雌激素水平虽然不影响卵母细胞质量及受精率,但可能加速子宫内膜着床窗的关闭[10],影响内膜容受性降低着床率[11]。Edwards[12]认为,经过一段自然或人为的绝经后,子宫内膜的一些腺体经过一个阶段的休息,会增加内膜容受性,而提高妊娠率。Chen等[13]将内膜厚度分组分析后,发现随着内膜厚度增加,妊娠率随之增加。我们的研究发现,卵泡期长效GnRH-a长方案组延长子宫内膜静止的时间,并且HCG日内膜厚度要高于长方案组,提示卵泡期长效GnRH-a长方案组可能通过改善内膜容受性而改善了着床率。并且卵泡期长效GnRH-a长方案组流产率、宫外孕率比短效长方案组有下降趋势,特别是在年龄<35岁患者中宫外孕率显著降低。
为进一步研究比较在不同年龄组中两个方案的优劣,我们将患者年龄分层分析,在各年龄组中,与长方案组比较,虽然卵泡期长效GnRH-a长方案组既往周期数较高,优质胚胎率较低,但着床率及临床妊娠率仍在<40岁以下组别中显著增高。进一步行多因素logistic回归分析,矫正年龄、基础卵泡、周期数等混杂因素后,方案的选择仍然是影响妊娠结局的独立因素。因此我们推测,卵泡期长效GnRH-a长方案早卵泡期降调模式,可能通过延长降调时间,达到较长时间的闭经、降低雌激素水平,改善内膜容受性,而改善妊娠结局,与已有研究[5]结论一致。在卵巢正常反应[14]、反复失败患者[15]等中,均亦有研究报道卵泡期长效GnRH-a长方案能提高临床妊娠率。
除此之外,卵泡期长效GnRH-a长方案组单次注射GnRH-a,接受性较好,无需特殊预处理,且FSH用量显著低于长方案组,虽然HMG用量高于长方案组,但从促排卵药物经济花费考虑,卵泡期长效GnRH-a长方案患者经济负担较小。因此,卵泡期长效GnRH-a长方案能够达到较好的着床率及临床妊娠率,是临床较好的促排卵方案之一。
[1]Porter RN,Smith W,Craft IL,et al. Induction of ovulation for in-vitro fertilisation using buserelin and gonadotropins[J].Lancet,1984,2:1284-1285.
[2]Siristatidis CS,Gibreel A,Basios G,et al. Gonadotrophin-releasing hormone agonist protocols for pituitary suppression in assisted reproduction. [DB]. The Cochrane database of systematic reviews 2015,11:CD006919.
[3]Urbancsek J,Witthaus E,et al. Midluteal buserelin is superior to early fllicular phase buserelin in combined gnadotropin-releasing hormone analog and gonadotropin stimulation in vitro fertilization[J].Fertil Steril,1996,65:966-971.
[4]Ron-EI R,Herman A,Golan A,et al.The comparison of early follicular and midluteal administration of long-acting gonadotropin-releasing hormone agonist[J]. Fertil Steril.1990,54:233-237.
[5]Ren J,Sha A,Han D,et al. Does prolonged pituitary down-regulation with gonadotropin-releasing hormone agonist improve the live-birth rate in in vitro fertilization treatment? [J]. Fertil Steril 2014,102:75-81.
[6]刘景瑜,孙海翔. 长效和短效促性腺激素释放激素激动剂在垂体降调中的应用[J]. 生殖医学杂志,2011,(S1):26-28.
[7]Albuquerque LE,Tso LO,Saconato H,et al. Depot versus daily administration of gonadotrophin-releasing hormone agonist protocols for pituitary down regulation in assisted reproduction cycles[DB]. Cochrane Database Syst Rev,2013,1:CD002808.
[8]Smitz J,Andersen AN,Devroey P,et al. Endocrine profile in serum and follicular fluid differs after ovarian stimulation with HP-hMG or recombinant FSH in IVF patients[J]. Hum Reprod,2007,22:676-687.
[9]宋娟,龚斐,罗克利,等. GnRH激动剂长效剂型和短效剂型在长方案中的应用比较[J]. 生殖与避孕,2015,35:389-392,424.
[10]Ma WG,Song H,Das SK,et al. Estrogen is a critical determinant that specifies the duration of the window of uterine receptivity for implantation[J]. Proc Natl Acad Sci USA,2003,100:2963-2968.
[11]Chen QJ,Sun XX,Li L,et al. Effects of ovarian high response on implantation and pregnancy outcome during controlled ovarian hyperstimulation (with GnRH agonist and rFSH)[J]. Acta Obstet Gynecol Scand,2007,86:849-854.
[12]Edwards RG. Clinical approaches to increasing uterine receptivity during human implantation[J]. Hum Reprod,1995,10(Suppl 2):60-66.
[13]Chen SL,Wu FR,Luo C,et al. Combined analysis of endometrial thickness and pattern in predicting outcome of in vitro fertilization and embryo transfer:a retrospective cohort study[J]. Reprod Biol Endocrinol,2010,8:1-7.
[14]聂玲,伍琼芳,张寅,等. 超长方案在卵巢储备良好前次IVF/ICSI-ET失败患者中的应用分析[J]. 现代妇产科进展,2011,23:470-472.
[15]杨硕,李蓉,甄秀梅,等. 促性腺激素释放激素激动剂超长方案在反复体外受精失败患者治疗中的应用[J]. 中华临床医师杂志(电子版),2012,6:152-154.
[编辑:谷炤]
Comparison of clinical outcomes between long-acting GnRH-a long protocol in follicular phase and short-acting GnRH-a long protocol in luteal phase
HU Lin-li,DAI Wei,SUN Ying-pu*
ReproductiveMedicalCenter,TheFirstAffiliatedHospitalOfZhengzhouUniversity,Zhengzhou450000
Objective:To compare clinical outcomes between long-acting GnRH agonist (GnRH-a) long protocol used in follicular phase and short-acting GnRH-a long protocol used in luteal phase for ovarian stimulation in IVF/ICSI cycles.
GnRH agonist;Long protocol;IVF-ET
10.3969/j.issn.1004-3845.2016.10.013
2016-06-26;
2016-08-20
胡琳莉,女,安徽人,副教授,生殖医学专业.(*
