选择性雌激素受体调节剂所致绝经前子宫内膜增厚98例分析
2016-11-11张国瑞于昕徐雅莉王甜甜郎景和
张国瑞,于昕*,徐雅莉,王甜甜,郎景和
(中国医学科学院 北京协和医学院 北京协和医院1.妇产科;2.乳腺外科,北京 100730)
选择性雌激素受体调节剂所致绝经前子宫内膜增厚98例分析
张国瑞1,于昕1*,徐雅莉2,王甜甜1,郎景和1
(中国医学科学院北京协和医学院北京协和医院1.妇产科;2.乳腺外科,北京100730)
目的探究以不同内膜厚度作为界值诊断选择性雌激素受体调节剂(SERM)所致子宫内膜病变的效果,以及分析SERM所致子宫内膜病变的可能危险因素。方法回顾性分析2001年5月至2016年5月98例口服SERM的绝经前乳腺癌患者因超声发现子宫内膜增厚行诊断性刮宫术或宫腔镜下子宫内膜活检术患者的临床资料。结果98例患者中,4例(4.08%)出现子宫内膜增生性病变。以术前超声提示的内膜厚度≥10 mm作为诊断标准,诊断的灵敏度为100%,特异度为28.72%,阳性预测值为5.63%,阴性预测值为100%;以≥15 mm作为诊断标准,诊断的灵敏度为75%,特异度为68.08%,阳性预测值为9.09%,阴性预测值为98.46%。卡方分析提示年龄、用药时间、药物种类、停经史和症状等因素与内膜增生性病变无显著关联(P>0.05)。结论绝经前乳腺癌患者应用SERM后可能导致子宫内膜厚度增加,但子宫内膜增生性病变风险并没有明显增加,提示患者可减轻用药期间因子宫内膜增厚而产生的顾虑;经阴道超声检查仍是首选的筛查手段,当内膜厚度≥15 mm或内膜厚度≥10 mm伴有其它危险因素时建议进一步处理。
选择性雌激素受体调节剂;子宫内膜增厚;子宫内膜增生性病变;经阴道超声检查
Methods:The clinical data of 98 premenopausal patients who received SERM therapy and underwent diagnostic curettage surgery or hysteroscopic endometrial biopsy due to endometrial thickening found by ultrasound from May 2001 to May 2016 were retrospectively analyzed.
Results:Among 98 patients,4 (4.08%)had endometrial hyperplasia. When endometrial thickness revealed equal to or greater than 10 mm by ultrasonography was chosen as the cutoff value,the diagnostic sensitivity was 100%,the specificity 28.72%,the positive predictive value 5.63%,and negative predictive value 100%. When15 mm endometrial thickness was chosen as the cutoff value,the sensitivity was 75%,the specificity 68.08%,the positive predictive value 9.09%,and negative predictive value 98.46%. Chi square analysis indicated that age,duration and types of SERM,menopause duration and symptoms had no significant correlation with hyperplasia lesion(P>0.05).
Conclusions:Administration of SERM may increase endometrial thickness,but do not significantly increase the risk of endometrial proliferative lesions in premenopausal patients. It is redundant for patients to be excessively anxious due to the endometrium thickening during administration of SERM. Transvaginal ultrasonography is still the preferred screening tool. Further examinations are recommended when endometrial thickness is≥15 mm or≥10 mm and accompanied by other risk factors.
(JReprodMed2016,25(10):937-942)
乳腺癌是我国女性发病率最高的恶性肿瘤,是女性恶性肿瘤所致死亡的重要原因之一[1]。70%左右乳腺癌患者的癌细胞呈现雌激素受体(ER)或孕激素受体(PR)阳性[2],美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)推荐术后服用选择性雌激素受体调节剂(selective estrogen receptor modulator,SERM)作为绝经前 ER和/或 PR阳性的乳腺癌患者的首选辅助内分泌治疗。SERM制剂的抗雌激素作用可以降低雌激素受体阳性乳腺癌的复发率及死亡率,但其弱的雌激素样作用也可能导致子宫内膜发生一系列病变,包括增殖、增生、息肉形成,甚至发生子宫内膜癌。为及早发现可能出现的内膜病变,临床上建议患者定期接受妇科检查。但是,目前诊断SERM治疗后患者发生子宫内膜病变的子宫内膜厚度界值尚不明确,对于接受宫腔镜或诊断性刮宫检查的适应证,目前也无统一意见。因此,本研究目的是探究以不同内膜厚度作为界值诊断SERM治疗绝经前患者子宫内膜病变的效果,以及分析SERM治疗患者发生子宫内膜病变可能的危险因素。
对象与方法
一、研究对象
北京协和医院2001年5月至2016年5月,口服SERM制剂的绝经前女性因超声发现子宫内膜增厚行诊断性刮宫术或宫腔镜下子宫内膜活检术的98例患者全部纳入本研究。
纳入标准为:(1)患者于口服SERM制剂过程中经阴道B超(TVS)发现内膜增厚;(2)口服SERM制剂前患者未绝经;(3)治疗期间接受诊断性刮宫术或宫腔镜下子宫内膜活检术者。
因NCCN指南建议绝经前ER和/或PR阳性的乳腺癌患者首选SERM类药物(他莫昔芬或托瑞米芬)进行辅助内分泌治疗,而对于绝经后女性首选芳香化酶抑制剂治疗,因此,本研究仅纳入绝经前患者。
二、诊疗回顾
所有患者于乳腺癌根治术后辅助化疗后序贯口服SERM类药物治疗,治疗期间每半年至每年行TVS检查评估内膜厚度,如出现子宫内膜持续增厚、停经伴子宫内膜增厚或异常阴道出血伴子宫内膜增厚上述一种情况,临床予以诊断性刮宫术或宫腔镜下子宫内膜活检术,术后内膜组织常规送病理检查。
三、分组及观察指标
比较TVS提示的不同内膜厚度作为内膜增生性病变诊断界值的效果。根据患者年龄、SERM种类、SERM用药时间、停经情况、症状分组,比较各组患者中内膜增生性病变的发生情况有无差异。
四、统计学分析
采用SPSS 18.0软件进行统计分析,采用卡方分析或Fisher精确检验法比较不同组别间子宫内膜增生性病变的发生率有无差别,双侧P<0.05为差异有统计学意义。
结 果
一、患者一般资料
98例患者平均年龄(45.84±5.25)岁(28~56)岁,40岁及以下患者14例,41~45岁患者33例,46~50岁患者30例,50岁以上患者21例;本研究中患者乳腺癌病理类型多样,其中浸润性导管癌74例、浸润性小叶癌7例、导管内癌14例、小叶原位癌2例,粘液癌1例;所有患者乳腺癌组织雌激素受体和/或孕激素受体阳性,具体为:ER阳性/PR阳性74例,ER阳性/PR阴性16例,ER阴性/PR阳性8例。
本组患者中SERM治疗情况及内膜病变情况如表1所示。诊刮前SERM平均治疗时间(29.78±20.25)月,范围3~77月。75例(76.5%)患者在诊刮前无临床症状,7例(7.1%)患者表现为月经量或时限异常,16例(16.3%)患者表现为异常阴道出血。诊刮前超声提示子宫内膜平均厚度为(13.04±5.02)mm,范围5~27 mm。所有患者中,72例直接行诊断性刮宫,26例行宫腔镜内膜活检或诊刮。诊刮后子宫内膜病理示萎缩性内膜18例、增殖期内膜27例、分泌期内膜19例、子宫内膜息肉30例、单纯性增生2例、复杂性增生1例、不典型增生1例。
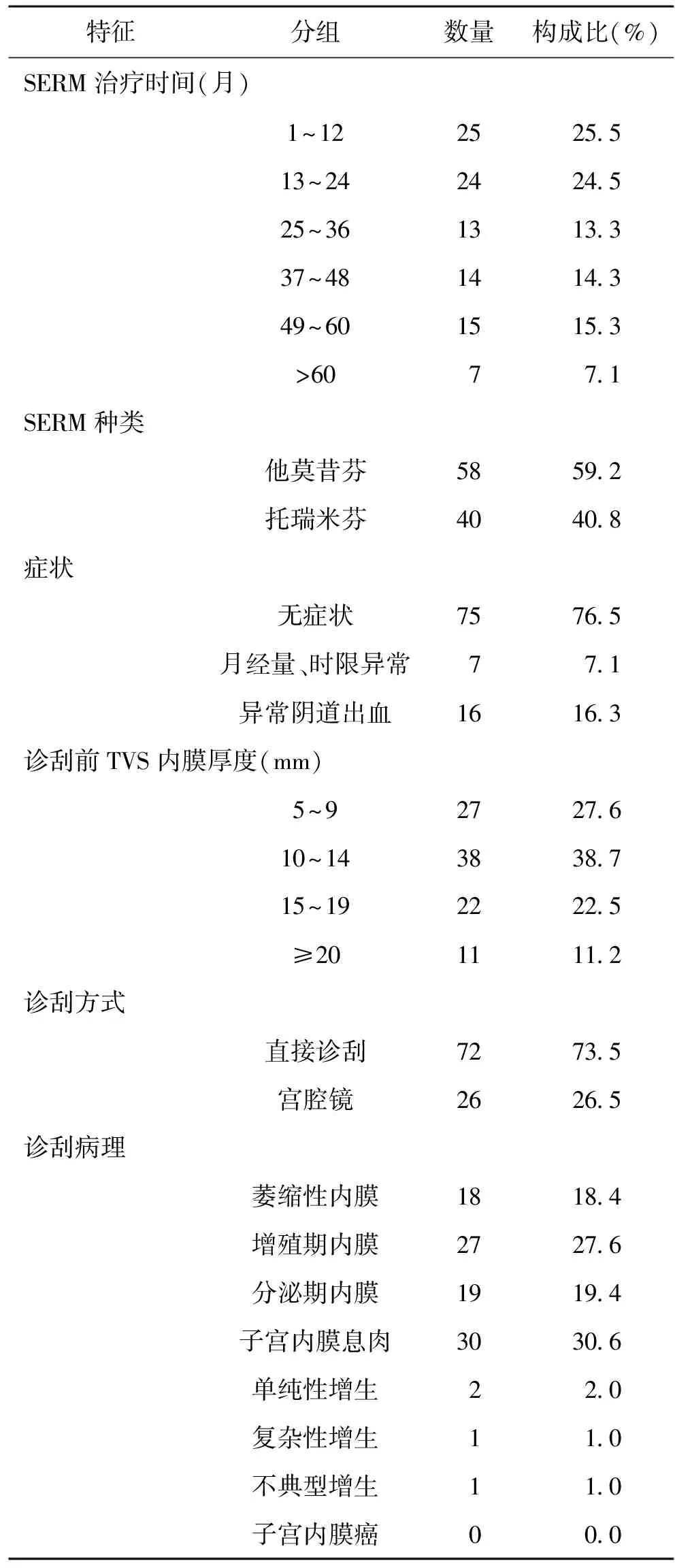
表1 患者SERM治疗及内膜病变情况
二、不同内膜厚度诊断增生性内膜病变的效率
口服SERM制剂的患者诊刮或内膜活检术后病理结果显示,4例(4.08%)发生内膜增生性病变(包括单纯性增生、复杂性增生和不典型增生),其余94例(95.92%)无内膜增生性病变(表现为萎缩性内膜、增殖期内膜、分泌期内膜、子宫内膜息肉)。4例子宫内膜增生性病变患者TVS发现的内膜厚度分别为12 mm、15 mm、22 mm和25 mm,均>10 mm。
根据术前TVS监测的内膜厚度标准诊断增生性内膜病变的效率如表2所示。(1)以≥10 mm作为诊断标准:灵敏度为100%,特异度为28.72%,阳性预测值为5.63%,阴性预测值为100%。(2)以≥20 mm作为诊断标准:灵敏度为50%,漏诊率为50%。采用内膜厚度≥20 mm为诊断标准时,有约半数的子宫内膜增生性病变的患者漏诊,因此不建议采用20 mm为诊断标准。(3) 以≥15 mm作为诊断标准,灵敏度为75%,特异度为68.08%,阳性预测值为9.09%,阴性预测值为98.46%。
三、增生性内膜病变的可能危险因素
为探讨不同因素对绝经前女性口服SERM类制剂发生增生性内膜病变的危险程度,本研究分析了不同因素对内膜病变的影响(表3)。卡方分析提示患者年龄(P=0.677)、SERM用药时间(P=0.247)、SERM种类(P=0.643)、诊刮前停经时间(P=0.845)和患者症状(P=0.334)与增生性内膜病变无明显相关。
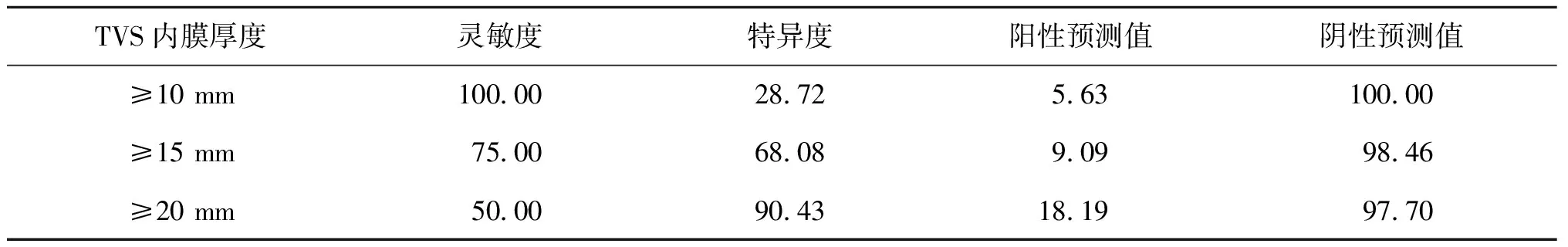
表2 以TVS不同内膜厚度诊断增生性内膜病变的效率(%)
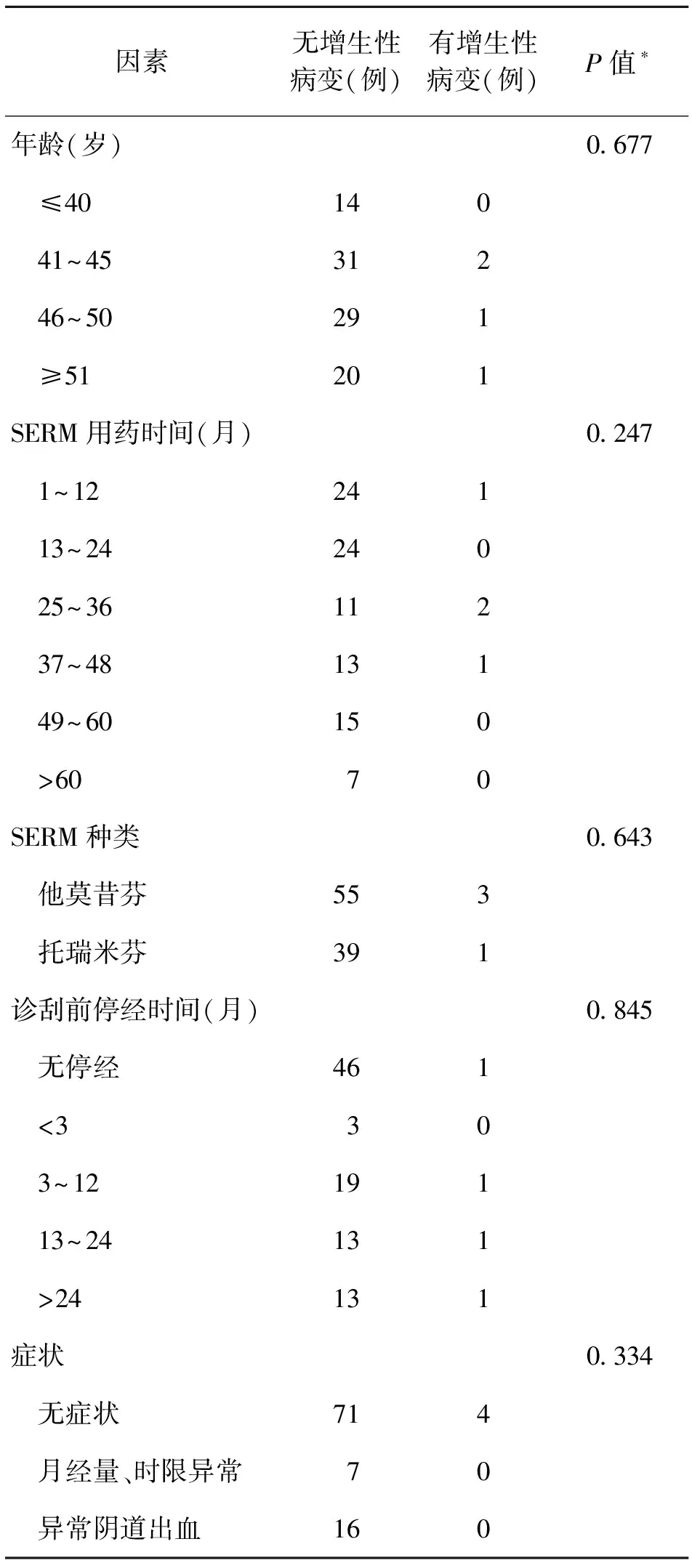
表3 不同因素对增生性内膜病变的影响
注:*采用卡方分析或Fisher精确检验
讨 论
不同组织中雌激素受体的种类不同,而SERM制剂对不同种类的雌激素受体产生不同的作用。SERM制剂在乳腺组织起抗雌激素作用,而在子宫内膜组织起类雌激素样作用[3]。SERM制剂对子宫内膜的类雌激素样作用可使内膜发生增生性病变,甚至子宫内膜癌。绝经前患者服用SERM制剂子宫内膜增厚的发生率升高[4],但子宫内膜增生性病变的发生率并未明显升高。Iqbal等[5]发现小于50岁的患者服用他莫昔芬后患子宫内膜癌的相对危险度(relative risk,RR)为1.19,而大于50岁的患者RR值为3.32。少数文献[6]报告口服SERM制剂也是苗勒氏管肿瘤的危险因素。因SERM制剂在乳腺癌辅助内分泌治疗中给患者带来的获益明显大于SERM制剂致使子宫内膜癌及癌前病变的风险,NCCN建议SERM制剂广泛应用于绝经前患者初发乳腺癌、转移性乳腺癌的辅助治疗中,常选用他莫昔芬10 mg bid或托瑞米芬60 mg qd。但是,在应用SERM制剂的同时,应注意监测发生子宫内膜病变的风险,每半年至一年行妇科检查及子宫内膜超声检查。
经阴道超声检查是绝经后患者子宫内膜病变的有效筛查方法,采用内膜厚度5 mm作为临界值,诊断的阴性预测值高。但是,在绝经前女性服用SERM制剂过程中内膜病变的筛查方面,TVS的应用尚有争议[7]。Bertelli等[8]分析164例服用他莫昔芬但无临床症状的患者,发现子宫内膜增厚≥5 mm与子宫内膜非典型增生并无明确相关性。而更多的学者则通过设定不同内膜厚度界值,评价TVS在口服SERM制剂患者子宫内膜病变诊断过程中的作用。Fung等[9]总结了304例他莫昔芬治疗患者,其中32%的患者出现子宫内膜增厚,6例出现子宫内膜非典型增生,以内膜厚度9 mm作为界值,诊断子宫内膜非典型增生性的灵敏度为63.3%,阳性预测值为43.3%。Saccardi等[10]的研究显示,以内膜厚度5 mm作为界值,诊断内膜非典型增生的灵敏度为100%,特异度为15%,阴性预测值为100%;而以内膜厚度10 mm作为界值,诊断的灵敏度为84%,特异度为69%,阴性预测值为99%。因此,TVS仍是SERM制剂治疗过程中监测子宫内膜病变的首选检查方法[11]。
本研究的结果显示,以内膜厚度10 mm作为界值,诊断子宫内膜增生性病变的阴性预测值为100%,当超声提示内膜厚度小于10 mm时,发生增生性内膜病变的几率较小,因此内膜厚度小于10 mm是安全的;而以内膜厚度15 mm作为界值,与以10 mm为诊断标准相比较,灵敏度稍降低,漏诊率稍增加,但阳性预测值明显升高,诊断效率更优;以15 mm为诊断标准,能筛查出大多数子宫内膜增生性病变的患者,仅有少数(1例)漏诊,但明显降低了需接受进一步诊断的患者总数;内膜厚度介于10~14 mm的患者,有发生内膜增生性病变的可能,但可能性较低,本研究中38例内膜厚度介于10~14 mm的患者,仅1例发生增生性病变,因此可综合患者情况决定下一步诊治手段。综上所述,我们建议,对于TVS发现的内膜厚度小于10 mm的患者,继续随诊;对于内膜厚度大于15 mm的患者,建议行进一步检查;对于内膜厚度介于10~14 mm的患者,综合分析患者有无其它危险因素,决定行进一步检查或继续随诊。
SERM制剂可使子宫内膜发生多种病理改变,包括子宫内膜息肉、子宫内膜增生、子宫内膜癌和子宫内膜囊性萎缩等[12]。本研究中子宫内膜息肉30例、子宫内膜增生4例。这些病变在TVS检查时呈现伴或不伴囊样结构的子宫内膜增厚,通过TVS影像难以鉴别,因此TVS诊断应用SERM过程中发生子宫内膜增生性病变的特异性较低。
因TVS诊断应用SERM过程中发生的子宫内膜增生性病变的效果并不十分满意,学者们在积极寻找其它的替代或联合诊断方法。宫腔镜可直视下观察子宫内膜的病变情况,并可在可疑病灶处取病理检查。Saccardi等[10]研究发现宫腔镜诊断他莫昔芬治疗中子宫内膜非典型增生的灵敏度为83%,特异度为99%,阴性预测值为99%,诊断效果满意。Gao等[13]也发现宫腔镜的灵敏度为100%,特异度为98.1%,阳性预测值为100%,阴性预测值为97.8%。宫腔镜下应用SERM制剂后内膜呈现五种形态[14]:萎缩、囊性变、高度血管化、子宫内膜息肉和可疑恶性病变。另外,Lubian等[15]在绝经后应用他莫昔芬的患者比较了孕激素撤退实验(progesterone challenge test,PCT)和TVS(内膜厚度10 mm为诊断界值)的诊断效率,醋酸甲羟孕酮5 mg q12 h连续口服10 d,观察有无撤退性出血作为PCT的结果,发现在诊断包括增殖期内膜、子宫内膜息肉、子宫内膜增生和子宫内膜癌方面,PCT的阳性预测值为100%,明显优于TVS,但在诊断子宫内膜非典型增生和子宫内膜癌方面,PCT的阴性预测值为100%,阳性预测值为24%,并不优于TVS。我们建议对于TVS可疑内膜病变的患者,可行宫腔镜检查或直接诊断性刮宫,及早发现潜在的病变。
目前关于SERM制剂导致子宫内膜增生性病变的危险因素的研究较少。Aebi等[3]发现他莫昔芬所致的子宫肿瘤与患者开始应用他莫昔芬时的年龄有关。55岁以上患者患子宫肿瘤的机会高达3.8%,明显高于对照组1.1%。Lindahl等[16]发现随着他莫昔芬的应用时间延长,子宫内膜的厚度逐渐增加,每月约增加0.09 mm,同时发生子宫内膜非典型增生或子宫内膜癌的风险可能也逐渐增加。而本研究的数据显示,患者年龄、应用SERM制剂的时间、SERM制剂的种类、患者诊刮前停经时间、有无临床症状等因素与子宫内膜增生性病变的发生无明显相关,因本研究纳入病例数量有限,SERM制剂导致子宫内膜增生性病变的危险因素尚需更多研究证实。
绝经前乳腺癌患者应用SERM后子宫内膜厚度增加,但子宫内膜增生性病变的风险没有明显增加,SERM制剂是安全的,患者无需因服用SERM期间内膜增厚而过分焦虑。TVS仍是首选的筛查手段。建议内膜厚度10 mm以下时继续随诊观察,15 mm及以上时行进一步的检查,而当内膜厚度介于10~14 mm时,综合分析后决定。对于TVS可疑病变患者,可进一步行宫腔镜检查或诊断性刮宫。SERM制剂导致子宫内膜增生性病变的危险因素尚不明确。
[1]Chen W,Zheng R,Baade PD,et al. Cancer statistics in China,2015[J]. CA Cancer J Clin,2016,66:115-132.
[2]Collins LC,Botero ML,Schnitt SJ. Bimodal frequency distribution of estrogen receptor immunohistochemical staining results in breast cancer:an analysis of 825 cases[J]. Am J Clin Pathol,2005,123:16-20.
[3]Aebi S,Davidson T,Gruber G,et al. Primary breast cancer:ESMO Clinical Practice Guidelines for diagnosis,treatment and follow-up[J]. Ann Oncol,2011,22(Suppl 6):12-24.
[4]Palva T,Ranta H,Koivisto AM,et al. A double-blind placebo-controlled study to evaluate endometrial safety and gynaecological symptoms in women treated for up to 5 years with tamoxifen or placebo-a substudy for IBIS I Breast Cancer Prevention Trial[J]. Eur J Cancer,2013,49:45-51.
[5]Iqbal J,Ginsburg OM,Wijeratne TD,et al. Endometrial cancer and venous thromboembolism in women under age 50 who take tamoxifen for prevention of breast cancer:a systematic review[J]. Cancer Treat Rev,2012,38:318-328.
[6]Wickerham DL,Fisher B,Wolmark N,et al. Association of tamoxifen and uterine sarcoma[J]. J Clin Oncol,2002,20:2758-2760.
[7]Bezircioglu I,Baloglu A,Tarhan MO,et al. Evaluation of endometrium by transvaginal ultrasonography and Doppler in tamoxifen-treated women with breast cancer[J]. Eur J Gynaecol Oncol,2012,33:295-299.
[8]Bertelli G,Venturini M,Del Mastro L,et al. Tamoxifen and the endometrium:findings of pelvic ultrasound examination and endometrial biopsy in asymptomatic breast cancer patients[J]. Breast Cancer Res Treat,1998,47:41-46.
[9]Fung MF,Reid A,Faught W,et al. Prospective longitudinal study of ultrasound screening for endometrial abnormalities in women with breast cancer receiving tamoxifen[J]. Gynecol Oncol,2003,91:154-159.
[10]Saccardi C,Gizzo S,Patrelli TS,et al. Endometrial surveillance in tamoxifen users:role,timing and accuracy of hysteroscopic investigation:observational longitudinal cohort study[J]. Endocr Relat Cancer,2013,20:455-462.
[11]Neri F,Maggino T. Surveillance of endometrial pathologies,especially for endometrial cancer,of breast cancer patients under tamoxifen treatment[J]. Eur J Gynaecol Oncol,2009,30:357-360.
[12]Polin SA,Ascher SM. The effect of tamoxifen on the genital tract[J]. Cancer Imaging,2008,8:135-145.
[13]Gao WL,Zhang LP,Feng LM. Comparative study of transvaginal ultrasonographic and diagnostic hysteroscopic findings in postmenopausal breast cancer patients treated with tamoxifen[J]. Chin Med J,2011,124:2335-2339.
[14]Perez-Medina T,Salazar FJ,San-Frutos L,et al. Hysteroscopic dynamic assessment of the endometrium in patients treated with long-term tamoxifen[J]. J Minim Invasive Gynecol,2011,18:349-354.
[15]Lubian Lopez DM,Fernandez YG,Rodriguez BR,et al. Value of the progesterone test in screening for endometrial pathology in asymptomatic postmenopausal women receiving treatment with tamoxifen[J]. Menopause,2010,17:487-493.
[16]Lindahl B,Andolf E,Ingvar C,et al. Adjuvant tamoxifen in breast cancer patients affects the endometrium by time,an effect remaining years after end of treatment and results in an increased frequency of endometrial carcinoma[J]. Anticancer Res,2008,28(2B):1259-1262.
[编辑:罗宏志]
Endometrial thickening in 98 patients received selective estrogen receptor modulators therapy
ZHANG Guo-rui1,YU Xin1*,XU Ya-li2,WANG Tian-tian1,LANG Jing-he1
1.DepartmentofObstetrics&Gynecology2.DepartmentofBreastSurgery,PekingUnionMedicalCollegeHospital,PekingUnionMedicalCollege/ChineseAcademyofMedicalSciences,Beijing100730
Objective:To evaluate the diagnostic efficiency of different endometrial thickness as the cutoff value for diagnosing uterine endometrial lesions caused by treatment of selective estrogen receptor modulators (SERM),and analyze the possible risk factors of SERM induced endometrial lesions.
Selective estrogen receptor modulator;Endometrial thickness;Endometrial hyperplasia;Transvaginal sonography
10.3969/j.issn.1004-3845.2016.10.016
2016-06-29;
2016-07-16
张国瑞,男,山东人,博士,妇产科学专业.(*
