白及原生质体的分离与纯化
2016-11-10徐德林储士润郑明辉
徐德林 张 林 储士润 韦 欣 钱 刚 郑明辉
(1.遵义医学院细胞生物学教研室,遵义563000; 2.遵义医学院医学与科技学院,遵义563000; 3.遵义医学院寄生虫教研室,遵义563000)
白及原生质体的分离与纯化
徐德林1张 林1储士润1韦 欣2钱 刚1郑明辉3*
(1.遵义医学院细胞生物学教研室,遵义563000;2.遵义医学院医学与科技学院,遵义563000;3.遵义医学院寄生虫教研室,遵义563000)
为建立起白及原生质体分离纯化的技术体系,以白及组培苗叶片为材料,经不同方式预处理后,用不同浓度的纤维素酶、果胶酶、离析酶和甘露醇组合进行酶解,将释放出来的原生质体用过滤和离心的方法进行纯化,最后用荧光素双醋酸酯(FDA)法对纯化的原生质体进行活力率测定,以期系统建立起酶解法从叶片中分离纯化出白及原生质体的技术流程。结果发现在低温黑暗+0.75 mol·L-1甘露醇条件下对叶片进行预处理、酶液组合为1.5%纤维素酶Cellulase R-10+0.4%果胶酶Pectolyase Y-23+0.5%离析酶Macerozyme R-10+0.75 mol·L-1甘露醇、酶解液pH值保持在5.8、摇床转速120 r·min-1、酶解4 h时,得到的原生质体产量最大,达4.72×106个·g-1,活力率也达90.4%。本研究构建了用白及叶片分离和纯化原生质体的技术流程,为白及遗传资源的拓展和遗传改良奠定了一定的物质和技术基础。
白及;原生质体;分离;纯化;技术体系
白及(Bletillastriata)为兰科(Orchidaceae)白及属(Bletilla)多年生草本植物,是兰科中既有药用价值又有观赏价值的中药材。随着白及用途的不断增加,亟需开展种质资源的保护与拓展以及优良品系选育的研究。由于其自身的生物学特性[1]、生态环境破坏以及人类的过度采挖等原因,白及野生资源已日渐枯竭[2],具备优良中药性状的株系更是稀缺,致使白及已被我国列为珍稀濒危的中药物种,还被国际贸易公约(CITES)附录二收录而加以保护[3]。虽然一些学者试图利用传统的遗传改良技术来分离、纯化白及的优良株系[4],但是由于耗时长、成本投入高等缺点而阻碍了对优良株系选择的进程。应用生物工程技术拓展白及的遗传资源,从中筛选出中药性状优良的植株品系,不仅利于白及的遗传改良、基因工程等研究,且对白及的规模化生产与高效开发利用更有价值。
原生质体是遗传资源拓展的良好材料,是遗传转化的理想受体,也是研究细胞壁、细胞膜功能、信息传递及植物激素作用机理的理想材料。利用原生质体融合技术能有效克服远缘杂交不亲和,培育出具有优良性状的新株系,因而植物原生质在植物遗传改良应用研究与生物学的基础理论研究中应用广泛。该技术同样广泛应用于兰科植物中的大花蕙兰[5]、金钗石斛[6]等中草药植物的研究与新品系创制中,然而笔者目前在国内外文献上未见该技术在白及方面应用的研究报道。
本研究利用组织培养获得的幼苗为研究材料,通过酶解法分离出原生质体,并对其进行纯化与活力率检测,探索出适合白及原生质体分离和纯化的步骤与方法,以期为后续原生质体培养、细胞器分离和功能验证、细胞杂交和遗传转化等相关研究奠定试验基础。
1 材料与方法
1.1 试验材料
本试验组织培养试验材料系为成熟未开裂的白及蒴果,于2013年采自贵州省遵义市正安县,并由遵义医学院钱刚教授进行鉴定。
1.2 试验方法
根据前期研究结果,用白及蒴果组培出苗,以组培苗的叶片为材料,选取嫩绿而饱满的幼苗叶片,经过黑暗低温和甘露醇的预处理后(预处理方式见1.2.1),在超净工作台中将其剪碎成为1 mm长宽左右的片段,放入培养皿中,将配制好的酶解液倒入培养皿中,并震荡摇晃使酶液与叶片充分混匀。依据每克叶片碎片添加10 mL酶解液的比例来确定酶解液的使用量(酶解液配方筛选试验见1.2.2)。在培养皿中使叶片与酶解液充分接触后用封口膜进行培养皿的封口,置于恒温摇床上震荡和酶解(摇床转速和酶解时间试验设计分别见1.2.3和1.2.4)。选用甘露醇作为保持原生质体活力的渗透压调节剂[7],设置7个浓度梯度,比较分析不同浓度下原生质体的活力率(见1.2.5)。酶解过程中,每间隔1 h吸取10微升的酶解液到血细胞计数板上,将计数板放置在倒置显微镜下统计酶解释放出来的原生质体数量和活力率(原生质体纯化、计数与活力率测定见1.2.6)。待计数的原生质体数量不再增加时,用移液枪轻轻吹打混匀原生质体与叶片酶解混合液,离心、清洗终止酶解。
1.2.1 酶解前叶片的不同预处理方式
对组培苗叶片进行3种方式预处理,探索这3种预处理方式对原生质体产量的影响。这3种方式为低温黑暗、甘露醇浸没、低温黑暗+甘露醇浸没。其中,低温黑暗预处理为置于4℃冰箱中避光保存12、24或48 h,甘露醇预处理为剪取叶片放入0.75 mol·L-1甘露醇溶液中浸泡1 h,低温黑暗+甘露醇预处理为进行黑暗低温保存12、24或48 h后再进行甘露醇浸泡1 h,预处理后的叶片置于酶解液中进行原生质体的分离。
1.2.2 酶解液配方筛选试验
取经过黑暗低温培养24 h+0.75 mol·L-1甘露醇浸泡1 h预处理后的组培苗叶片来探索不同配比的酶解液对原生质体产量的影响。用不同浓度的纤维素酶、果胶酶、离析酶组合成不同配比的酶解液进行叶片的消化和原生质体的分离,酶解液的pH值为5.8、甘露醇浓度为0.75 mol·L-1,酶解4 h。
1.2.3 不同酶解时间处理
将预处理后的叶片置于1.2.2鉴定出的最佳酶解液配方进行消化酶解,在摇床转速为120 r·min-1的条件下,进行2、4、6、8和10 h等5种不同时间的酶解,探索不同酶解时间对结果的影响。
1.2.4 摇床不同转速处理
用最佳酶解液对预处理叶片进行酶解,在酶解时间为4 h的条件下,对比分析摇床转速分别为60、90、120、150 r·min-1时分离出的原生质体产量与活力率的差异。
1.2.5 不同甘露醇浓度处理
取上述最佳条件下分离的活力率为91.2%的原生质体,均分成若干份,分别加入浓度为0.3、0.45、0.55、0.6、0.75、0.85和0.9 mol·L-1的甘露醇,48 h后对原生质离活力率进行统计。
上述预处理、酶液组合、酶解时间、转速和甘露糖试验中,每个处理均进行5次重复,通过对最终获得的原生质体的产量与活力率进行统计分析来评价不同处理对结果的影响。
1.2.6 原生质体的纯化、计数与活力率测定
通过过滤和离心的方法纯化原生质体。将终止酶解的酶解液混合液用200目的细胞筛过滤来初步纯化,滤除组织残片与杂质。收集滤液于2 mL离心管中,在离心机转速500 r·min-1下离心5 min,离心后丢弃上清液,在原生质体沉淀物中加入原生质体清洗液(MES 1.0 mL+KCl 2.5 mL+Mannitol 5.0 mL+BSA 1.0 mL+CaCl2400 μL+ddH2O 100 μL/10 mL),轻轻吹打混匀,300 r·min-1离心3 min后丢弃上清液,再加入清洗液如此反复清洗3~5次,即得到较为纯净的原生质体。
用血细胞计数板计数获取的原生质体数量。将填满原生质体混悬液计数室的计数板置于倒置显微镜下计数,计算中央大方格中25个中方格内原生质体数量,连续计数3次,以每克叶片酶解分离得到原生质体的个数(个/g)来表示产量。
1 mL悬浮液中原生质体数=1个中央大方格悬浮液(0.1 mm3)中的细胞数×10×1 000
(1)
用荧光素双醋酸酯(FDA)染色法来测定原生质体的活力率[8]。在明光视野下观察计数原生质体总量,在荧光显微镜下计数能发出黄绿色荧光的原生质体数,用有活力的原生质体占全部观察原生质体的百分比(原生质体活力率)来衡量获取样品中原生质体的活力,即:
原生质体活力率=被染色的原生质体数/原生质体总数×100%
(2)
每个样品的原生质体活力率进行计数3次,取平均值作为该样品的最终活力率数据。
1.3 数据统计分析
2 结果与分析
2.1 不同预处理方式对原生质体分离的影响
经过预处理的原生质体的产量与活力率均显著提高。由表1可知,与对照组相比,无论是经单独的低温黑暗预处理还是单独的甘露醇浸没预处理,或者是二者联合的预处理,原生质体产量与活力率均有显著提高。而其中先经低温黑暗预处理后再对叶片进行甘露醇预处理,获得的原生质体产量与活力率均达最大值,分别为4.68×106个·g-1和93%,故该种方式为最佳预处理方式。
表1不同预处理方式对原生质体分离的影响
Table1Effectofpretreatmentontheyieldandvitalityofprotoplasts
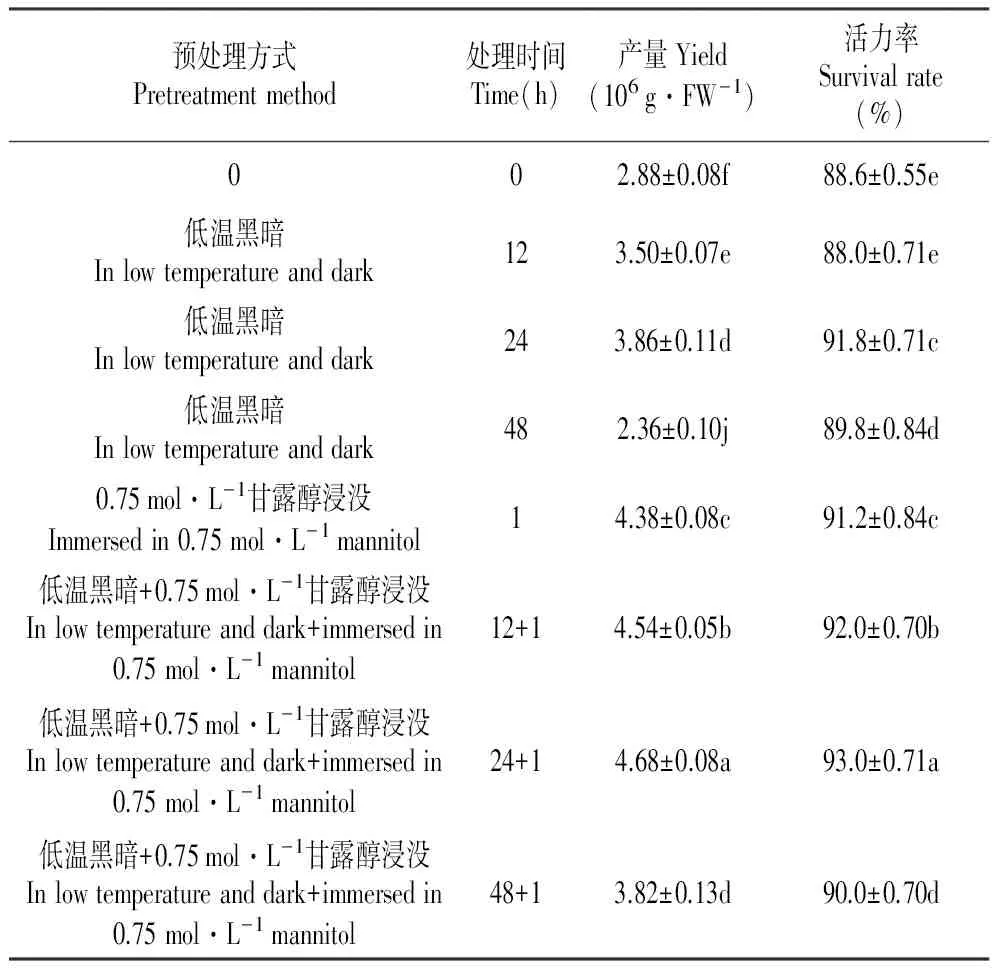
预处理方式Pretreatmentmethod处理时间Time(h)产量Yield(106g·FW-1)活力率Survivalrate(%)002.88±0.08f88.6±0.55e低温黑暗Inlowtemperatureanddark123.50±0.07e88.0±0.71e低温黑暗Inlowtemperatureanddark243.86±0.11d91.8±0.71c低温黑暗Inlowtemperatureanddark482.36±0.10j89.8±0.84d0.75mol·L-1甘露醇浸没Immersedin0.75mol·L-1mannitol14.38±0.08c91.2±0.84c低温黑暗+0.75mol·L-1甘露醇浸没Inlowtemperatureanddark+immersedin0.75mol·L-1mannitol12+14.54±0.05b92.0±0.70b低温黑暗+0.75mol·L-1甘露醇浸没Inlowtemperatureanddark+immersedin0.75mol·L-1mannitol24+14.68±0.08a93.0±0.71a低温黑暗+0.75mol·L-1甘露醇浸没Inlowtemperatureanddark+immersedin0.75mol·L-1mannitol48+13.82±0.13d90.0±0.70d
注:同列相同小写字母代表差异不显著;不同小写字母表示差异显著(P<0.05) 下同。
Note: FW refers to the weight of fresh leaf. Different lowercase letters indicate significant difference at 0.05 levels respectively.The same as below.
2.2 不同酶液组合对原生质体分离的影响
不同的酶液组合对原生质体的产量与活力率有显著影响(表2)。结果显示,Cellulase R-10与Pectolyase Y-23单独消化叶片均不能得到原生质体,而当二者组合时,均能获得原生质体,二者组合时原生质体产量可达3.26×106个·g-1、活力率达91.2%,进一步在酶解液中添加0.5%的Macerozyme R-10后原生质体产量能显著提高,达4.64×106个·g-1,活力率也达最大值为91.6%,故1.5% Cellulase R-10+0.4% Pectolyase Y-23+0.5% Macerozyme R-10为最佳酶解液组合。此外,从表2还可以看出,当果胶酶Pectolyase Y-23的添加量为0.4%时,随着纤维素酶Cellulase R-10和离析酶Macerozyme R-10的添加量的不同,产生的白及原生质体的产量有显著差异(差异显著性从a~e),而活力率的显著性变化幅度不太大(差异显著性从a~c),说明原生质体的产量受纤维素酶Cellulase R-10和离析酶Macerozyme R-10浓度变化的影响十分显著,而活力率对纤维素酶Cellulase R-10和离析酶Macerozyme R-10的浓度变化则没有这么敏感。
表2不同酶液组合对原生质体分离的影响
Table2Effectsofenzymecomponentontheyieldandvitalityofprotoplasts

纤维素酶CellulaseR⁃10(%)果胶酶PectolyaseY⁃23(%)离析酶MacerozymeR⁃10(%)产量Yield(106g·FW-1)活力率Survivalrate(%)00.400—1.0000—1.00.402.36±0.11e90.2±0.84b1.50.403.26±0.11c91.2±1.30ab2.00.402.98±0.13d89.4±1.14ab1.00.40.5%3.94±0.12b90.6±0.55ab1.50.40.5%4.64±0.10a91.6±1.14a2.00.40.5%3.28±0.08c88.4±0.89c
2.3 不同酶解时间对原生质体分离的影响
酶解的时间对原生质体产量与活力率的影响较大,过高的酶解时间易致原生质体破裂,而过低的酶解时间影响其产量。本研究对酶解时间进行了2、4、6、8和10 h筛选,由表3可见,酶解时间越短,其原生质体活力率越高,酶解6 h后其产量与活力率均开始显著下降。在酶解4 h时,原生质体的产量达最大值,为4.72×106个·g-1。在该酶解时间下,尽管原生质体的活力率(90.4%)比酶解2 h时(91.8%)有所下降,但差异并不显著,而原生质体产量却比酶解2 h时的2.54×106个·g-1提高了86%,说明4 h是最佳酶解时间。
2.4 不同摇床转速对原生质体分离的影响
由于失去了细胞壁的保护,原生质体对剪切力更加敏感,因而转速大小与时间长短的选择对获取的原生质体质量有较大影响。本试验也证实不同的摇床转速下分离获取的原生质体产量和质量有明显差异。如表4所示,在摇床转速为120 r·min-1时其原生质体产量达最大值,为47.0×106个·g-1而活力率也高达90.2%,因此120 r·min-1为酶解分离阶段的最佳摇床转速。
表3不同酶解时间对原生质体产量与活力率的影响
Table3Effectsofdissolvingtimeofenzymesontheyieldandvitalityofprotoplasts

酶解时间Enzymedissolvedtime(h)产量Yield(106g·FW-1)活力率Survivalrate(%)22.54±0.10c91.8±0.83a44.72±0.08a90.4±1.34a63.32±0.08b88.6±1.14b82.26±0.11d86.8±1.30c101.16±0.11e84.8±1.64d
表4不同摇床转速对原生质体产量与活力率的影响
Table4Effectsofrevolvingspeedontheyieldandvitalityofprotoplasts

转速Revolvingspeed(RPM)产量Yield(106g·FW-1)活力率Survivalrate(%)602.74±0.10d91.4±0.89a903.30±0.07b90.4±1.14a1204.70±0.08a90.2±0.84a1503.04±0.13c82.8±1.30b
2.5 不同甘露醇浓度对原生质体分离的影响
甘露醇为分离原生质体时理想的渗透压调节剂,适宜的浓度对原生质体稳定分离与活力率具有重要影响。本试验对适宜白及原生质的甘露醇浓度进行了比较分析(表5),发现当甘露醇浓度从0.3 mol·L-1上升至0.75 mol·L-1时原生质体的活力率也逐步升高,在甘露醇浓度为0.75 mol·L-1时活力率达最高,为68.8%,但当甘露醇浓度继续升高后原生质体的活力率即开始逐渐降低。故适合白及原生质体保存的甘露醇最佳浓度为0.75 mol·L-1。
表5不同甘露醇浓度速对原生质体活力率影响
Table5Effectsofmannitolconcentrationonthevitalityofprotoplasts

甘露醇Mannitol(mol·L-1)活力率Survivalrate(%)0.3029.8±1.64f0.4536.4±1.14d0.5551.8±1.30c0.6064.0±1.00b0.7568.8±1.64a0.8533.2±1.79e0.9023.6±1.51j
2.6 原生质体的纯化与活力率测定
为获得纯化和高活力率的白及原生质体,本研究在前人研究基础[9]上采用过滤和离心法相结合的方法,对酶解获得的原生质体纯化流程进行了优化,得到了较为纯净和高活力率的原生质体(图1)。
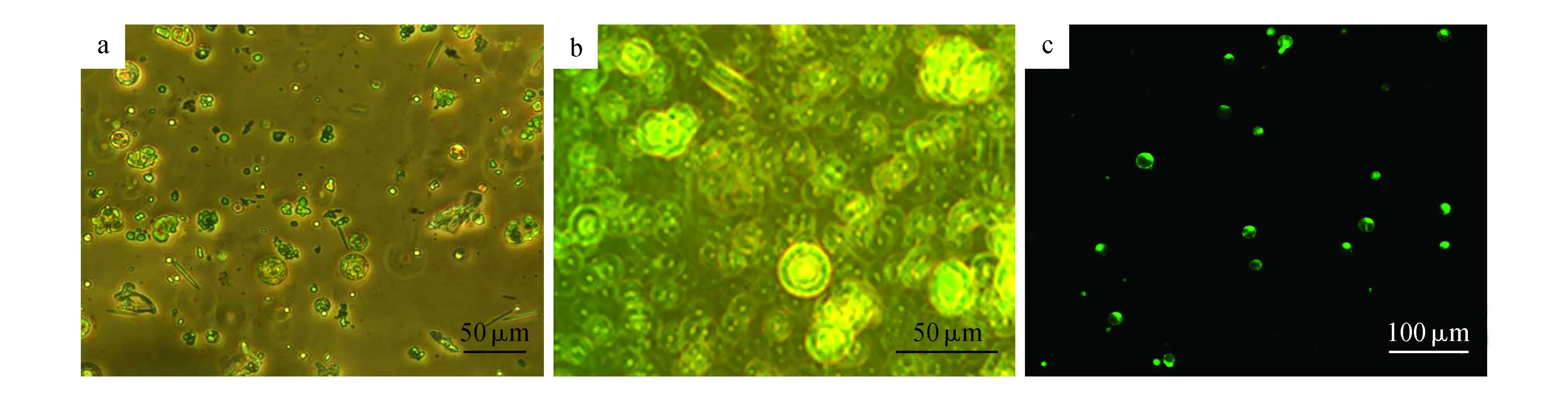
图1 酶解分离的白及原生质体 a.纯化前的原生质体;b.纯化后的原生质体;c.FDA染色后观察到的原生质体Fig.1 The protoplasts of Blettila striata isolated from this study a.The newly isolated protoplast; b.The purified protoplasts; c.The FDA-dyed protoplasts
3 讨论
原生质体分离的产量与活力率是原生体培养的基础与关键因素。其中酶解液种类与浓度组合、酶解时间、预处理方式选择、渗透压稳定剂浓度等对原生质体的分离产量与活力率有直接影响[10~11]。本试验对影响白及原生质体分离的不同因素进行了多水平的对比分析和条件优选。
较多的报道认为进行原生质分离前,对材料进行预处理能提高其产量与活力率。较为常用的预处理方法有低温处理[12]、黑暗培养处理、甘露醇处理等。本研究对低温黑暗、甘露醇、低温黑暗+甘露醇预处理进行了比较研究,发现无论材料经过哪种预处理,原生质体分离后其产量与活力率均明显提高(表1)。黑暗环境使叶片不能进行光合作用,加速叶片能量与物质消耗,使得叶片萎蔫;萎蔫使叶片失水,细胞质壁分离,酶液更加容易接触细胞壁与果胶质成分,使得原生质体更易分离,而萎蔫过度则会使细胞死亡,从而降低原生质体产量[13]。因此本试验低温黑暗预处理>24 h后产量明显降低。在不同预处理条件中,低温+黑暗培养+甘露醇预处理的材料获得白及原生质体产量与活力率均为最高(表1),表明不同因素之间在预处理时具有相互促进作用,采用多种因素组合进行预处理,效果显著优于单一因素。本试验结果表明多因素组合进行预处理能显著提高白及原生质体分离产量与活力率。
植物细胞壁中含有纤维素、半纤维素、果胶质与蛋白等,因而在采用纤维素酶与果胶酶,以酶解法来分解原生质体。在药用植物中纤维素酶与果胶酶的配合使用尤为常见,主要用来分解细胞中纤维素与果胶质成分。本研究发现,纤维素酶与果胶酶配合能对白及原生质体分离的分离效果好(表2),与非洲紫罗兰[14]、狗头草[15]、金钗石斛[6]研究结果一致;然而加入离析酶后能显著提高分离原生质体的产量与活力率,表明离析酶配合纤维素酶与果胶酶能更好的原生质体分离效果,该研究结果与石牌广藿香[9]、拟南芥[11]等结果相一致。由于纤维素酶对原生质体分离影响最大,本试验对纤维素酶浓度进行了对比,从表2结果可见,无论是否添加离析酶,纤维素酶浓度为1.5%时分离原生质的产量与活力率值最高,表明过高或过低浓度均不适宜白及原生质体的分离。
对原生质体酶解时,必须选择合适的酶解时间,酶解时间的长短对原生质体的产量与活力率具有直接影响。表3可见,酶解时间越短,其活力率越高,表明酶解液时间越久,对原生质体破坏越大,故在合适的酶解条件下,尽量选取较短的酶解时间进行原生质体分离。本试验结果白及原生质体分离在4 h时,可获得产量高、活力强原生质体,这与松茸[16]等的酶解时间一致。
摇床转速为物理因素,其他植物中原生质分离研究时对物理因素影响方面研究报道相对较少。本试验对不同摇床转速进行了筛选,如表4可见,相同酶解时间下摇床转速对原生质体产量与活力率影响有显著差别,在摇床转速为60 r·min-1时产量为2.74×106个·g-1,转速120 r·min-1时产量高达4.70×106个·g-1,原生质体活力率90.2%,但大于120 r·min-1其产量降低,活力率也明显降低。
原生质体由于无细胞壁的保护,对渗透压较为敏感,适宜的渗透压能持久保持其活力,渗透压过低可使原生质体发生破裂,过高渗透压会对原生质体照成挤压,影响其活力率与产量[10]。不同植物对渗透压稳定剂的适宜浓度不同,本试验对渗透压稳定剂甘露醇浓度进行了对比,如表5所示,原生质体保存48 h后,甘露醇浓度为0.75 mol·L-1时原生质体活力率最高,因此甘露醇0.75 mol·L-1为白及原生质体适宜渗透压调节剂甘露醇最佳浓度值。
4 结论
本试验对白及叶片分离获取原生质体技术流程进行了探索和条件优化。材料选取上原生质体分离纯化以白及幼嫩叶片组织,经过低温+黑暗培养+0.75 mol·L-1Mannitol条件下的预处理,在酶液组合为0.75 mol·L-1Mannitol+1.5% Cellulase R-10+0.4% Pectolyase Y-23+0.5% Macerozyme R-10、酶解液pH值为5.8,分离时摇床转速为120 r·min-1,酶解4 h得到的原生质体产量最大,可达4.72×106个·g-1,活力率可以达到90.4%。
1.Lesar H,Hlebec B,eranic N,et al.Acclimatization of terrestrial orchidBletillastriataRchb.f.(Orchidaceae) propagated under invitroconditions[J].Acta Agriculturae Slovenica,2012,99(1):69-75.
2.Chung M Y,Lopez-pujol J,Chung M G.Low genetic diversity in marginal populations ofBletillastriata(Orchidaceae) in southern Korea:insights into population history and implications for conservation[J].Biochemical Systematics and Ecology,2013,46:88-96.
3.陆峻波,刘亚辉,杨永红,等.从文献分析看我国白芨研究进展[J].云南农业大学学报,2011,26(2):288-292.
Lu J B,Liu Y H,Yang Y H,et al.The analysis ofBletillaRchb.f. research development review from literatures in China[J].Journal of Yunnan Agricultural University,2011,26(2):288-292.
4.李伟平,何良艳,丁志山.白及的应用及资源现状[J].中华中医药学刊,2012,30(1):158-160.
Li W P,He L Y,Ding Z S.Application and resources current situation of commonBletillatuber[J].Chinese Archives of Traditional Chinese Medicine,2012,30(1):158-160.
5.许传俊,陈益辉,李爱贞,等.大花蕙兰原生质体分离纯化[J].亚热带植物科学,2014,43(3):212-215.
Xu C J,Chen Y H,Li A Z,et al.Optimization conditions ofCymbidiumhybridumprotoplast isolation[J].Subtropical Plant Science,2014,43(3):212-215.
6.刘运权,张翠焕,闻真珍,等.金钗石斛类原球茎原生质体的分离[J].热带生物学报,2010,1(3):215-219.
Liu Y Q,Zhang C H ,Wen Z Z,et al.Isolation of the protoplast fromDendrobiumnobileLindl PLBs[J].Journal of Tropical Organisms,2010,1(3):215-219.
7.张宁,李威,顾钊宇,等.‘富士’苹果花粉原生质体分离初探[J].园艺学报,2015,42(6):1167-1174.
Zhang N,Li W,Gu Z Y,et al.Preliminary study on the isolation of mature pollen protoplasts in ‘Fuji’ apple[J].Acta Horticulturae Sinica,2015,42(6):1167-1174.
8.Lei R,Qiao W J,Hu F,et al.A simple and effective method to encapsulate tobacco mesophyll protoplasts to maintain cell viability[J].Methods X,2015,2:24-32.
9.莫小路,曾庆钱,黄珊珊,等.石牌广藿香原生质体的分离及培养研究[J].广西植物,2013,32(5):669-673.
Mo X L,Zeng Q Q,Huang S S,et al.The protoplasts isolation and culture ofPogostemoncablincv.shipaiensis[J].Guihaia,2013,32(5):669-673.
10.陶茸,师尚礼,李玉珠,等.‘陇东’紫花苜蓿原生质体最佳分离条件[J].植物生理学报,2011,47(5):495-500.
Tao R,Shi S L,Li Y Z,et al.Study on protoplasts isolation conditions ofMedicagosativaL.cv.‘Longdong’[J].Plant Physiology Journal,2011,47(5):495-500.
11.Schapire A L,Lois L M.A Simplified and rapid method for the isolation and transfection ofArabidopsisleaf mesophyll protoplasts for large-scale applications[J].Methods in Molecular Biology,2015,1363:79-88.
12.Guo J J,Morrell-falvey J L,Labbe J L,et al.Highly efficient isolation ofPopulusmesophyll protoplasts and its application in transient expression assays[J].PLoS One,2012,7(9):e44908.
13.罗丽华,严虹羽,林尤河,等.预处理条件对石斛兰叶片原生质体分离的影响[J].南方园艺,2010,21(3):10-12.
Luo L H,Yan H Y,Lin Y H,et al.Impact of pretreatment conditions on the protoplast isolation ofDendrobiumleaf[J].Southern Horticulture,2010,21(3):10-12.
14.陈鑫,李骏,余汝媛,等.非洲紫罗兰原生质体的制备及不同组分培养基对细胞增殖的影响[J].广东药学院学报,2012,28(5):497-501.
Chen X,Li J,Yu R Y,et al.Preparation ofSaintpauliaionanthaprotoplast and effect of different cultures on cell growth[J].Journal of Guangdong Pharmaceutical University,2012,28(5):497-501.
15.齐向英,陈宗礼,薛皓,等.狗头枣叶片原生质体分离研究[J].中国野生植物资源,2013,32(3):40-43.
Qi X Y,Chen Z L,Xue H,et al.Study on leaf protoplast isolation in Goutouzao[J].Chinese Wild Plant Resources,2013,32(3):40-43.
16.张丽,郭成金.松茸原生质体制备、再生条件优化及释放方式观察[J].浙江农业学报,2014,26(4):941-947.
Zhang L,Guo C J.Optimizing conditions of protoplast preparation and regeneration ofTricholomamatsutakeand its release modes[J].Acta Agriculturae Zhejiangensis,2014,26(4):941-947.
Natural Science Foundation of China(31560079);The Modernization and Industrialization Project of TCM in Guizhou Province(QKH-ZY[2013]3002);The Cooperation Program of Guizhou Province(QKH-LH[2014]7549);College Students’ Innovative Training Project of China in 2015(201513653003);The 15851# Talent Projects of Zunyi City in 2014(201424)
introduction: XU De-Lin(1981—),male,Ph.D. Mainly engaged in the Genetic Breeding of Traditional Chinese Medicinal Herbs.
date:2016-04-15
AProtocolfortheIsolationandPurificationofProtoplastfromBletillastriataLeaves
XU De-Lin1ZHANG Lin1CHU Shi-Run1WEI Xin2QIAN Gang1ZHENG Ming-Hui3*
(1.Department of Cell Biology,Zunyi Medical University,Zunyi 563000;2.Medicine and Technology School,Zunyi Medical University,Zunyi 563000;3.Department of Parasite,Zunyi Medical University,Zunyi 563000)
To construct a protocol of isolation and purification of protoplasts from the seedling leaves ofBletillastriata. After a series of pretreating assay, the leaves were enzymatic hydrolyzed with mixed solution of mannitol, Cellulase R-10, Pectolyase Y-23 and Macerozyme R-10 for certain hours. Then the newly released protoplasts were purified through filtration and centrifugalization. Finally, the harvest protoplastswere detected in the survival rate by means of fluorescein diacetate (FDA). The preprocessing of seedlings living in dark field for 12 h and the leaves were immersed in 0.75 mol·L-1mannitol for 1 h was the most effective way for protoplasts isolation. The enzymes mixture of 0.75 mol·L-1mannitol+1.5% Cellulase R-10+0.4% Pectolyase Y-23+0.5% Macerozyme R-10 was the optimism composition of enzyme solution. The pH of 5.8 and 4 h enzyme dissolve with the revolving speed of 120 r·min-1at room temperature was the best environmental condition. Under this optimal condition, abundant of 4.72×106protoplasts with survival rate of 90.4% could be harvested from each gram leaf. This study gave a necessary help for protoplasts culture, cell fusion and genetic transformation ofB.striata.
Bletillastriata;protoplast;isolation;purification;protocol
国家自然科学基金(31560079);贵州省中药现代化科技产业研究开发专项(黔科合ZY字[2013]3002号);贵州省科技厅2014年联合基金(黔科合LH字[2014]7549号);2015年国家大学生创新训练计划项目(201513653003);遵义市2014年度“15851”人才工程(201424)
徐德林(1981—),男,博士,主要从事中药材遗传育种研究。
* 通信作者:E-mail:ivying0209@hotmail.com
2016-04-15
* Corresponding author:E-mail:ivying0209@hotmail.com
Q945.4
A
10.7525/j.issn.1673-5102.2016.05.023
