裸花紫珠嫩枝扦插生根影响因子研究
2016-11-10刘式超周再知张金浩梁坤南马华明黄桂华
刘式超 周再知 张金浩 梁坤南 马华明 黄桂华
(中国林业科学研究院热带林业研究所,广州 510520)
裸花紫珠嫩枝扦插生根影响因子研究
刘式超 周再知*张金浩 梁坤南 马华明 黄桂华
(中国林业科学研究院热带林业研究所,广州 510520)
以2年生实生苗的嫩枝为试材,从基质、插条部位、留叶方式、扦插季节、外源激素种类及浓度5个方面对裸花紫珠的扦插生根因子进行了系统研究。测定插穗的生根率、偏根率、生根数量及最大根长,采用隶属函数值对扦插生根效果进行综合评价。结果表明:(1)8个基质处理中,以泥炭∶蛭石∶河沙按2∶1∶1体积比混合的基质扦插效果最好,生根率74%,平均生根数5.4条;(2)插条中、上部制取的插穗扦插效果优于下部,且中部插穗的生根质量最佳;(3)插穗留叶处理的生根率显著高于不留叶处理,留两片半叶(1/2叶)时,生根率可达64%;(4)秋季(9月)为扦插最适宜季节,生根数量和最大根长均显著高于春季(4月)和夏季(7月);(5)4个浓度下,IBA处理的生根质量均高于IAA和NAA处理,其中IBA(1 000、1 500 mg·L-1)处理的扦插效果较好,而高浓度NAA(2 000、2 500 mg·L-1)处理明显不利于生根。
裸花紫珠;药用植物;嫩枝扦插;生根;影响因子
裸花紫珠(CallicarpanudifloraHook.et Arn.)为马鞭草科(Verbenaceae)紫珠属(Callicarpa)植物,多年生常绿灌木或小乔木,主要分布在热带和亚热带,如东南亚(马来半岛、新加坡、越南等)和澳大利亚北部,少数分布于美洲的热带地区[1]。我国主要分布在海南、广西、广东等省区[2],是海南省特有的珍稀药材之一。裸花紫珠俗称“海南黑药”,其地上部位尤其枝、叶中含多种有效活性成分如黄酮、酚类化合物和萜类化合物等,在止血抗炎、消肿镇痛、驱风祛湿、抗肿瘤等方面具良好功效[3~5]。
近年来,裸花紫珠的药用和商业价值日益凸显,市场需求量急升,但长期以来市场供应主要以野生资源为主,乱采滥挖致使资源日趋匮乏。因裸花紫珠具有种子不宜储藏和出苗率低等问题[6],无性繁殖便成为加速其繁殖的主要技术手段。扦插繁殖被认为是无性繁殖中应用前景最广的方法之一,相对组培、嫁接、压条等方法而言,具有易操作、繁殖稳定及成本低等优点[7~8]。目前,国内外有关裸花紫珠扦插繁殖的报道寥寥无几,诸多影响其扦插生根的因素尚未开展研究。一直以来,采穗母树年龄、采穗部位、插穗木质化程度、扦插基质、插穗的制备、保留叶方式、扦插季节的选择、消毒措施、外源激素的种类及浓度选择和环境控制技术等为扦插生根研究的重点[9~11],本研究尝试开展不同扦插基质、插条部位、留叶方式、扦插季节和外源激素的种类及浓度5个方面的试验,以期寻找影响裸花紫珠扦插繁殖的主要因子及最佳扦插条件,为裸花紫珠的扦插繁殖提供实用技术,实现有效地保护其野生资源和加速其发展的目的。
1 材料和方法
1.1 试验地点
试验于中国林业科学研究院热带林业研究所实验楼温室内进行,室内温度21~33℃,湿度在70%以上。
1.2 试验材料
采集海南五指山裸花紫珠种子,播种育苗;以2年生实生苗的嫩枝为扦插材料,直径范围3~4 mm;育苗容器使用口径50 mm×50 mm、底部15 mm×15 mm、深度80 mm(50孔)的轻质育苗盘。
1.3 试验方法
1.3.1 不同基质处理扦插试验
设8个处理即100%河沙(T1),100%蛭石(T2),河沙∶蛭石=1∶1(T3),河沙∶泥炭土=1∶1(T4),泥炭∶蛭石∶河沙=1∶1∶1(T5),泥炭∶蛭石∶河沙=2∶1∶1(T6),泥炭∶蛭石∶河沙=1∶2∶1(T7),泥炭∶蛭石∶河沙=1∶1∶2(T8),T3~T8均为体积比。选取裸花紫珠2年生实生苗的嫩枝中段,用1 000 mg·L-1IBA处理插穗,速蘸15 s后立即进行扦插。采用随机区组设计,每处理100株插穗,3次重复。
1.3.2 不同插条部位扦插试验
设3个处理,分别以2年生实生苗的穗条上部(带芽的顶稍部)、中部和下部(基部)为插穗,使用泥炭∶蛭石∶河沙=1∶1∶1作基质,用1 000 mg·L-1IBA处理插穗,速蘸15 s后扦插。采用随机区组设计,每处理100株插穗,3次重复。
1.3.3 不同留叶方式扦插试验
设4个处理,即不留叶、留1片半叶、留2片半叶、留2片全叶,选取2年生实生苗的嫩枝中段,使用泥炭∶蛭石∶河沙=1∶1∶1作基质,用1 000 mg·L-1IBA处理插穗,速蘸15 s后扦插。采用随机区组设计,每处理100株插穗,3次重复。
1.3.4 不同季节扦插试验
设3个处理,分别于春季(4月)、夏季(7月)、秋季(9月)进行试验,选取2年生实生苗的嫩枝中段,使用泥炭∶蛭石∶河沙=1∶1∶1作基质。用1 000 mg·L-1IBA处理插穗,速蘸15 s后扦插。采用随机区组设计,每处理100株插穗,3次重复。
1.3.5 不同外源激素及浓度处理扦插试验
外源激素为IAA(吲哚乙酸)、IBA(吲哚丁酸)、NAA(萘乙酸),每种设4个浓度水平即1 000、1 500、2 000和2 500 mg·L-1,以清水为对照,共13个处理。选取2年生实生苗的嫩枝中段,使用泥炭∶蛭石∶河沙=1∶1∶1作基质,所有处理均速蘸15 s后扦插。采用随机区组设计,每处理100株插穗,3次重复。
以上5个试验同时开展,基质均先用0.5%高锰酸钾溶液全面消毒,然后装入已消毒的育苗盘,用清水浇透。将采摘的穗条截成长度9~11 cm,上端平口,下端斜切口的插穗,然后用0.1%高锰酸钾溶液消毒1~2 min,经蒸馏水洗净后直接扦插。扦插完毕即浇水并喷洒50%多菌灵可湿性粉剂200倍液;苗床上搭盖塑料薄膜拱棚,保持扦插环境湿度。
1.4 数据分析
扦插后,每隔2~3 d定期观察插穗切口及形态变化,持续观察40 d,记录主要生根进程;扦插后第80 d,去除插穗根部的土壤,洗净,露出不定根,调查各处理插穗的生根率、生根数量、最大根长及偏根率。使用中晶i-800扫描仪对不定根根系进行扫描,用Rhizotron 2009软件统计平均根长、表面积、根径、根体积和投影面积。
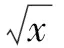
2 结果与分析
2.1 不同基质处理对裸花紫珠扦插生根的影响
表1可以看出,T6(泥炭∶蛭石∶河沙=2∶1∶1)的插穗在生根率和生根数量上均高于其他7个处理,隶属函数值最大;T1(100%河沙)在生根率和生根数量上均低于其他处理,偏根比例最高,隶属函数值最低。最佳处理T6与最差处理T1相比,生根率提高了68.8%,偏根率下降了24%,生根数量提高了68.8%,最大根长提高了26.1%。与河沙和蛭石两种单一基质(T1、T2)相比,两者的混合基质(T3),在插穗的生根率和最大根长上均有显著提高。仅从生根率来看,基质处理的生根效果为三种基质混合(T5、T6、T7、T8)>两种基质混合(T3、T4)>单一基质(T1、T2)。
2.2不同插条部位制穗对裸花紫珠扦插生根的影响
插条上、中部的插穗,在生根率、生根数量和最大根长上显著高于下部插穗,且偏根率显著低于下部插穗(表2)。上部插穗的生根率最高,比下部插穗高出30.6%;中部插穗的生根数量最多,比下部插穗高出70.0%;上部的最大根长约为下部的1.5倍。3部位插穗的隶属函数值高低顺序为中部>上部>下部,表明中部插穗的综合生根效果最好。

表1 不同基质处理的生根指标及隶属函数值
注:表中同列的相同小写字母表示处理间差异不显著,反之差异显著(P<0.05);隶属函数值为生根率、偏根率、生根数及最大根长各隶属函数值之和;±后数值为标准误。下同。
Note:The same letter in difference column indicates no significantly different according to Duncan’s test,otherwise significantly different(P<0.05);The SFV equals to a sum of subordinate function values of the four rooting index;The figures after ± are standard errors. The same as below.

表2 不同部位插穗的生根指标及隶属函数值
2.3 留叶方式对裸花紫珠扦插生根的影响
表3表明,留2片1/2叶的插穗,在生根率、生根数量上显著高于其他处理,在偏根率上显著低于其他处理;而不留叶处理的生根率、生根数量、最大根长均为最低。留2片1/2叶与不留叶相比,生根率提高了32.0%,生根数量提高了54.3%,最大根长提高了25.6%。随留叶数量和留叶面积的升高,插穗的最大根长随之升高,留2片完整叶时,插穗的最大根长达到最大,比不留叶提高了57.9%。从隶属函数值上看,留2片1/2叶的插穗,综合生根效果最佳。
2.4 扦插季节对裸花紫珠插穗生根的影响
表4可知,秋季扦插的插穗,在生根率、生根数量和最大根长上均高于春季和夏季,且偏根率最低;夏季的生根率和生根数量最低,偏根率最高。秋季与夏季相比,生根率提高了26.4%,生根数量提高了40.5%,最大根长提高了20.2%,偏根率降低了24.4%。从4个生根指标和隶属函数值来看,秋季扦插最利于生根。

表3 不同留叶方式插穗的生根指标及隶属函数值
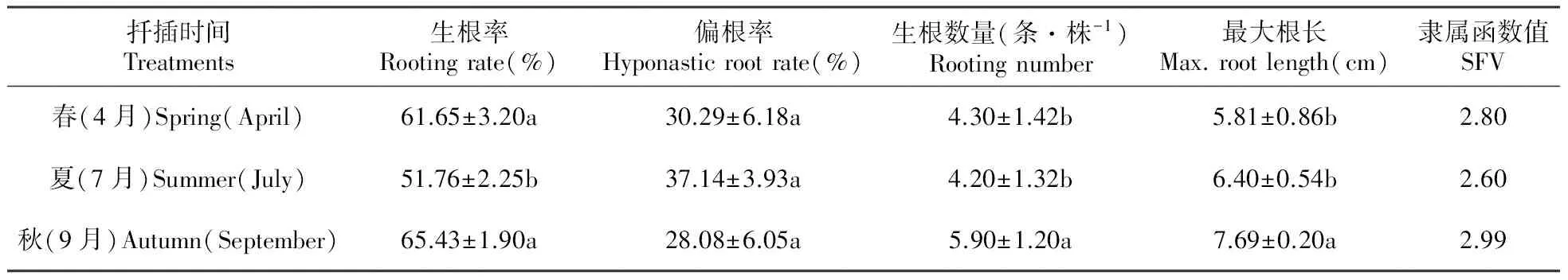
表4 不同扦插季节插穗的生根指标及隶属函数值
2.5不同外源激素及浓度处理对裸花紫珠扦插生根的影响
表5可知,IBA、IAA和NAA处理的生根率均随浓度的升高而下降;4个浓度水平上,3种激素的生根率顺序均为IBA>IAA>NAA。13个处理中,1 500 mg·L-1IBA处理的生根率最高,比对照高40.4%,其次为1 000 mg·L-1IBA,比对照高28.2%。NAA处理的生根率整体偏低,且随浓度的提高而下降;与清水相比,2 000、2 500 mg·L-1NAA插穗的生根率分别下降了4.4%和10.2%。在偏根率上,2 000 mg·L-1IAA插穗最低,其次为1 500 mg·L-1IBA,分别比对照下降了29.6%和24.2%。在生根数量上,4个浓度的IBA处理全部高于其他所有处理;在1 000、1 500和2 000 mg·L-1三个浓度水平上,3种激素的生根数量一致为IBA>NAA>IAA;2 000 mg·L-1IBA插穗的生根数量最多,比对照高21.3%。4个IBA处理的最大根长均显著高于对照,4个NAA处理的最大根长均低于对照。由此可见,IBA处理的插穗在生根率、偏根率、生根数量和最大根长上均有明显优势。
如表6所示,4个浓度水平上,IBA的平均根长均高于IAA和NAA,其中1 500 mg·L-1IBA插穗最高,比对照提高13.7%。高浓度的IAA(2 000,2 500 mg·L-1)和低浓度的NAA(1 000,1 500 mg·L-1)处理的平均根长均低于对照,其中1 500 mg·L-1NAA处理最低,比对照低6.1%。13个处理中,2 000 mg·L-1IBA插穗的不定根表面积最大,比对照高24.9%;3种激素的平均不定根表面积高低关系为IBA>NAA>IAA。在平均根径指标上,13个处理的差异不显著,最高处理为2 000 mg·L-1IBA。1 000 mg·L-1IBA的不定根投影面积最大,比对照提高了33.1%;3种激素的平均投影面积高低顺序为IBA>IAA>NAA。在不定根体积上,1 500 mg·L-1IBA处理最高,比对照提高了30.5%;3种激素的平均根体积高低顺序为IBA>IAA>NAA。由此可见,IBA在不定根性状的5个指标上仍然表现出显著优势,从隶属函数值来看,1 500 mg·L-1IBA的生根质量和不定根性状最佳,综合生根效果最好。
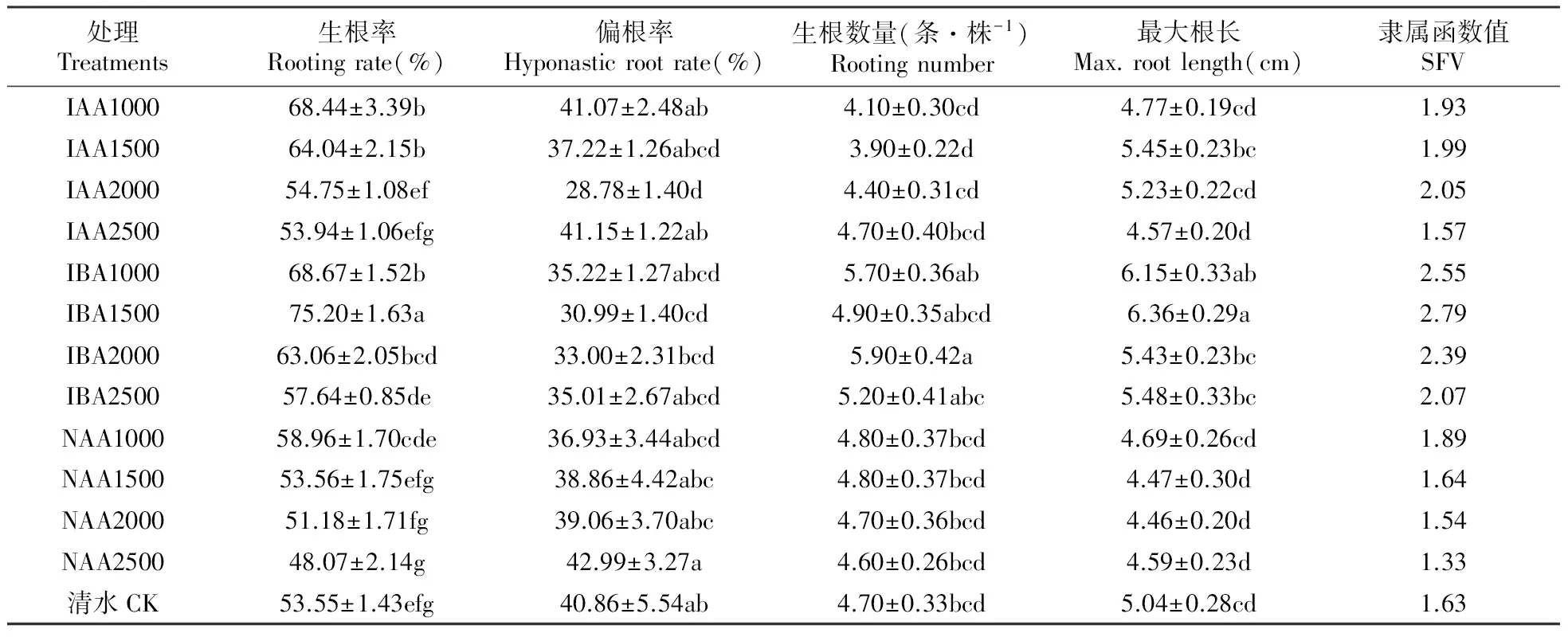
表5 不同外源激素及浓度处理的生根指标及隶属函数值

表6 不同外源激素及浓度处理的不定根性状对比
2.6 不同外源激素处理的生根进程
扦插第5 d,1 500 mg·L-1IBA处理的插穗,皮孔最先出现膨大开裂的现象,其他激素处理稍晚。扦插12 d后,大部分插穗的基部斜切口附近膨大开裂,切口处颜色变深并出现少量白色絮状的愈伤组织(图1A);此时,除NAA处理外,IAA和IBA插穗的基部均有白色芽状不定根出现,而且地上开始出现幼嫩新叶。扦插15 d后,NAA处理的插穗皮孔处,刚刚出现上述芽状不定根;此时,IBA和IAA插穗地上部分的新叶生长迅速(图1B)。扦插20 d后,1 000、1 500 mg·L-1IBA和1 000 mg·L-1IAA插穗的基部愈伤组织不定根已经形成,并开始伸长,比对照提前2~3 d(图1C);NAA处理的插穗皮部刚刚开始有不定根出现,并开始伸长。扦插30 d后,各处理插穗的不定根继续伸长,生根数量基本稳定(图1D)。观察生根进程表明,裸花紫珠插穗以皮部生根为主,属皮部生根型。

图1 裸花紫珠扦插生根进程 A.扦插12 d,1 500 mg·L-1 IBA插穗的皮孔最早开始膨大,基部斜切口出现愈伤组织;B.扦插15 d,1 500 mg·L-1 IBA(上)和1 000 mg·L-1 IAA(下)处理下插穗的基部愈伤组织出现白色芽状不定根,地上部分的新叶生长迅速;C.扦插20 d,1 500 mg·L-1 IBA插穗的不定根开始伸长;D.扦插30 d,1 000 mg·L-1 IAA(上)、1 000 mg·L-1 NAA(中)和1 500 mg·L-1 IBA(下)处理的插穗不定根继续伸长,生根数量基本稳定Fig.1 The rooting process of C.nudiflora cuttings A.Twelve days of cutting,lenticels of 1 500 mg·L-1 IBA cuttings first began to inflate and the base of incision appeared callus;B. Fifteen days of cutting,1 500 mg·L-1 IBA cuttings (above) and 1 000 mg·L-1 IAA cuttings (below) produced some white adventitious buds from the callus on the base,and the new leaves of cuttings above the ground grew rapidly;C. Twenty days of cutting,adventitious roots of 1 500 mg·L-1 IBA cuttings began to stretch;D. Thirty days of cutting,adventitious roots of 1 000 mg·L-1 IAA (above),1 000 mg·L-1 NAA (middle) and 1 500 mg·L-1 IBA (below) cuttings continued to stretch,and the rooting number remained stable
3 讨论
基质决定了插穗的生根环境,其理化性质如矿质营养、水分保持能力、保温能力和通气状况等直接影响生根的难易和生根质量[13]。本研究采用的三种基质在理化性质上各具优点:泥炭吸附性好,能为插穗提供充足的水分和营养物质;蛭石保温能力良好,保证了生根过程中相关酶促生理反应的进行;河沙通透性好,利于通气和排出水分。研究表明使用混合基质能提高插穗的成活率和生根率[14~15],将特性差异互补的基质混合使用能改善生根环境和生根质量,试验结果也表明三种基质混合的处理在4个生根指标上优于单一基质和两种基质混合的处理。试验过程中发现未生根插穗基本已无生命特征,死亡原因以萎蔫居多,少数由发霉引起;另一方面,混合基质中的泥炭比例提高后,插穗的生根率也有一定程度的提高,这说明裸花紫珠插穗生根时需要从外界吸收较多水分,同时也反映了插穗自身保水能力不强。
唐燕[16]指出为方便裸花紫珠穗条的保存,储存前要除净枝条的叶片。本试验是采摘插条后立即制穗扦插,结果表明留叶插穗在生根率、生根数量和最大根长三指标上明显优于不留叶插穗。在实际扦插繁育时,应尽可能做到现取现用,过久地保存枝条会使得叶片萎蔫,枝条生命力下降。Cameron[17]通过示踪元素法对新叶和老叶中光合作用产物的分配进行了研究,发现根生长发育的75%养分源于老叶,叶片是植物生根过程中内源激素与碳水化合物的重要来源,不留叶插穗通常生根率较低甚至不能生根[18~19]。适宜的留叶面积利于插穗从老叶中汲取养分,但留叶面积过大使得插穗的蒸腾作用增强,引起水分失衡[20]。
同一枝条的上部(芽梢部)、中部和下部(基部)在成熟度、木质化程度、插穗粗度和营养成分含量等方面存在着差异,试验结果显示上部插穗生根率最高,中部次之,下部最低。许多研究[21~22]表明使用嫩枝扦插生根率更高,插穗更易存活。木质程度高的插穗多取自枝条基部,易受顶端优势的抑制,制成插穗后,生长素的来源被切断;而木质化程度较低的顶部和中部依然积累了较多生长素,仍能产生并运输到插穗基部[23]。插条中部的插穗木质化程度最为适中,水分和养分消耗低于嫩枝,具良好的稳定性,更利于植物扦插生根,这一结果也和唐燕[20]报道一致。
不定根的形成是植物外在条件和内在条件共同作用的结果,外在条件包括合适的温度、湿度、空气、水分和光照等,内在条件则指的是植物激素、氧化酶和营养物质等[24]。外源激素能改变插穗生根的内在条件:促进合成某些特殊的酶并提高这些酶活性,使根原基顺利发生和发育[25];使营养物质向插穗下切口附近集中,促进愈伤组织的形成[26]。试验发现三种激素的生根率呈现随浓度升高而降低的趋势,且位于相同浓度水平时,生根率一致表现为IBA>IAA>NAA。IBA被认为由IAA转化而来,因其降解速度慢,稳定性好,不易被光照和氧化酶分解,而更利于生根[27];NAA被证明具有促进插穗生根和不定根伸长的作用,但高浓度处理会降低苗木成活率[28]。张浪等[29]比较了ABT6号、ABT7号和ABD三种生根粉对裸花紫珠插穗生根的影响,认为800 mg·L-1ABT7号能显著提高插穗的成活率和生根率,生根率高达94.6%,处理方法为低浓度浸泡法。本试验设置的外源激素浓度范围为1 000~2 500 mg·L-1,浓度水平整体偏高,不宜长时间浸泡,预实验发现速蘸15 s即可达到较好效果,为统一5个试验的影响因素,故全部采用速蘸15 s的办法。本研究共涉及5个不同的生根因子,影响穗条扦插生根的各因子之间,往往还存在一定的交互作用;此外,NAA由于整体浓度偏高导致生根效果较差,适度降低浓度水平能否促进插穗生根都未在本文探讨,这些问题尚需进一步的研究。
综上所述,5个单因素试验结果表明:裸花紫珠嫩枝采用泥炭∶蛭石∶河沙=2∶1∶1(体积比)混合基质生根效果最好;插条上、中部制取的插穗扦插效果优于下部;留叶处理的生根率显著高于不留叶处理,留2片半叶(1/2叶)时生根效果最佳;秋季为扦插最适宜季节;4个浓度下,IBA处理的隶属函数值均高于IAA和NAA处理,其中1 000 mg·L-1IBA和1 500 mg·L-1IBA处理的扦插效果较好,高浓度NAA(2 000、2 500 mg·L-1)处理不利于生根。
1.广东省植物研究所.海南植物志第四卷[M].北京:科学出版社,1977.
Plant Institute of Guangdong Province.Flora Hainanica Tome Ⅳ[M].Beijing:Science Press,1977.
2.中国科学院中国植物志编辑委员会.中国植物志:第六十五卷,第一分册[M].北京:科学出版社,1982:37-38.
Delectis Florae Reipublicae Popularis Sinicae Agendae Academiae Sinicae Edita.Flora Reipublicae Popularis Sinicae Tomus 65(1)[M].Beijing:Science Press,1982:37-38.
3.蔡金平,董琳,关薇薇,等.裸花紫珠的研究进展[J].现代药物与临床,2012,27(1):60-64.
Cai J P,Dong L,Guan W W,et al.Research progress ofCallicarpanudiflora[J].Drugs and Clinic,2012,27(1):60-64.
4.谷陟欣,刘宇婧,颜冬兰,等.裸花紫珠、大叶紫珠和广东紫珠的研究进展[J].中国医药导报,2011,8(29):11-12,81.
Gu Z X,Liu Y J,Yan D L,et al.The research progress ofCallicarpanudifloraHook.et Arn.,CallicarpamacrophllaVahl.andCallicarpakwangtungensisChun.[J].China Medical Herald,2011,8(29):11-12,81.
5.梁纪军,徐凯,李留法,等.裸花紫珠总黄酮的抗炎、止血作用研究[J].现代中西医结合杂志,2009,18(26):3161-3162.
Liang J J,Xu K,Li L F,et al.Study of total flavonoids ofCallicarpanudifloraon anti-inflammatory and hemostasis effects[J].Modern Journal of Integrated Traditional Chinese and Western Medicine,2009,18(26):3161-3162.
6.黄秋银,蓝祖栽,潘春柳,等.裸花紫珠种子萌发影响因素研究[J].安徽农业科学,2009,37(25):12006-12007.
Huang Q Y,Lan Z Z,Pan C L,et al.Study on the effects of different factors on the germination ofCallicarpanudifloraseed[J].Journal of Anhui Agriculture Science,2009,37(25):12006-12007.
7.郭素娟.林木扦插生根的解剖学及生理学研究进展[J].北京林业大学学报,1997,19(4):64-69.
Guo S J.Progress of study on rooting anatomy and physiology of forest tree cuttings[J].Journal of Beijing Forestry University,1997,19(4):64-69.
8.兰彦平,顾万春.林木无性繁殖研究进展[J].世界林业研究,2002,15(6):7-13.
Lan Y P,Gu W C.Research advances in vegetative propagation of trees[J].World Forestry Research,2002,15(6):7-13.
9.Tarragó J,Sansberro P,Filip R,et al.Effect of leaf retention and flavonoids on rooting ofIlexparaguariensiscuttings[J].Scientia Horticulturae,2005,103(4):479-488.
10.Blythe E K.Hardwood cutting propagation of confederate Rose using auxin and wounding treatments[J].Hort Technology,2012,22(4):476-478.
11.韦记青,蒋运生,唐辉,等.珍稀濒危植物金花茶扦插繁殖技术研究[J].广西师范大学学报:自然科学版,2010,28(3):70-74.
Wei J Q,Jiang Y S,Tang H,et al.Cutting techniques ofCamellianitidissima[J].Journal of Guangxi Normal University:Natural Science Edition,2010,28(3):70-74.
12.孙敬爽,郑红娟,贾桂霞,等.不同基质、生长调节剂、插穗规格和代谢调节剂对‘蓝星’扦插生根的影响[J].北京林业大学学报,2008,30(1):67-73.
Sun J S,Zheng H J,Jia G X,et al.Effects of different substrates,growth regulators,grades of cuttings and metabolism regulator Oil cutting propagation ofJuniperussquamata‘Blue Star’[J].Journal of Beijing Forestry University,2008,30(1):67-73.
13.King A R,Arnold M A,Welsh D F,et al.Substrates,wounding,and growth regulator concentrations alter adventitious rooting of Baldcypress cuttings[J].Hortscience,2011,46(10):1387-1393.
14.Osman A R,El-Naggar H M.Rooting ofJatrophacurcasL.andEuphorbiatirucallicuttings in response to IBA and planting media in North Egypt:a potential source for tomorrow’s oil,biodiesel and biofuels[J].Asian Journal of Crop Science,2014,6(3):186-201.
15.卢志鹏,汪天.不同基质对红叶石楠插穗生根的影响[J].安徽农业科学,2010,38(26):14366-14367.
Lu Z P,Wang T.Effects of different substrates on rooting of cuttingsPhotiniaserrulata[J].Journal of Anhui Agriculture Science,2010,38(26):14366-14367.
16.Cameron R J,Rook D A.Rooting stem cuttings of radiata pine:environmental and physiological aspects[J].New Zealand Journal of Forestry Science,1974,4(2):291-298.
17.Atangana A R,Khasa D P.Preliminary survey of clonal variation in rooting ofAllanblackiafloribundaleafy stem cuttings[J].Canadian Journal of Forest Research,2008,38(1):10-15.
18.Malik N S A,Perez J L,Kunta M.The effect of leaf presence on the rooting of stem cutting of bitter melon and on changes in polyamine levels[J].Agricultural Sciences,2012,3(7):936-940.
19.Akinyele A O.Effects of growth hormones,rooting media and leaf size on juvenile stem cuttings ofBuchholziacoriaceaEngler[J].Annals of Forest Research,2010,53(2):127-133.
20.唐燕.裸花紫珠扦插繁育技术[J].农技服务,2012,29(9):1026.
Tang Y.Cutting propagation techniques ofCallicarpanudiflora[J].Agricultural Technical Services,2012,29(9):1026.
21.敖红,王崑,冯玉龙.长白落叶松插穗的内源激素水平及其与扦插生根的关系[J].植物研究,2002,22(2):190-195.
Ao H,Wang K,Feng Y L.Endogenous hormones levels in cuttings ofLarixolgensisand their relations to rooting[J].Bulletin of Botanical Research,2002,22(2):190-195.
22.陈伟,施季森,方镇坤,等.西南桦不同种源扦插生根能力比较[J].南京林业大学学报:自然科学版,2004,28(4):29-33.
Chen W,Shi J S,Fang Z K,et al.A study on the rooting ability of cutting from southwestern birch provenances[J].Journal of Nanjing Forestry University:Natural Sciences Edition,2004,28(4):29-33.
23.王传永,章镇,於虹,等.木质化程度对兔眼蓝浆果不同品种插条扦插生根的影响[J].植物资源与环境学报,2005,14(3):26-32.
Wang C Y,Zhang Z,Yu H,et al.Effects of lignification levels of cuttings from different cultivars ofVacciniumasheion the rooting capacity[J].Journal of Plant Resources and Environment,2005,14(3):26-32.
24.麻文俊,张守攻,王军辉,等.日本落叶松扦插生根期内源激素和营养物质及酚酸含量变化特征[J].西北植物学报,2013,33(1):109-115.
Ma W J,Zhang S G,Wang J H,et al.Endogenous hormones,nutritive material and phenolic acid variation in cuttings of Japanese Larch during rooting[J].Acta Botanica Boreali-Occidentalia Sinica,2013,33(1):109-115.
25.黄卓烈,李明,詹福建,等.不同生长素处理对桉树无性系插条氧化酶活性影响的比较研究[J].林业科学,2002,38(4):46-52.
Huang Z L,Li M,Zhan F J,et al.Study on the comparison of the chances of oxidase activities inEucalyptuscuttingstreated with different auxins[J].Scientia Silvae Sinicae,2002,38(4):46-52.
26.胡勐鸿,欧阳芳群,贾子瑞,等.欧洲云杉扦插生根影响因子研究与生根力优良单株选择[J].林业科学,2014,50(2):42-49.
Hu M H,Ooyang Q F,Jia Z R,et al.Factors affecting rooting ofPiceaabiesshoot cuttings and individual selection with high rooting ability[J].Scientia Silvae Sinicae,2014,50(2):42-49.
27.Ludwig-müller J.Auxin conjugates:their role for plant development and in the evolution of land plants[J].Journal of Experimental Botany,2011,62(6):1757-1773.
28.郭伦发,林春蕊,何金祥,等.NAA对金花茶扦插成活率的影响[J].福建林业科技,2008,35(3):106-109.
Guo L F,Lin C R,He J X,et al.The effects of NAA on the survival rate ofCamellianitidissimacutting[J].Journal of Fujian Forestry Science and Technology,2008,35(3):106-109.
29.张浪,姜殿强,翁春雨,等.海南黎药裸花紫株扦插育苗技术研究[J].中国农学通报,2013,29(13):197-200.
Zhang L,Jiang D Q,Weng C Y,et al.Study on the cutting technology ofCallicarpanudiflora,A medical plant used by the Li people in Hainan[J].Chinese Agricultural Science Bulletin,2013,29(13):197-200.
Key Project in the National Science & Technology Pillar Program during the Twelfth Five-year Plan Period(2012BAD22B0504)
introduction:LIU Shi-Chao(1990—),male,master student,Mainly engaged in the study of cultivation of medicinal plant resources.
date:2016-03-18
RootingImpactFactorsofCallicarpanudifloraSoftwoodCuttings
LIU Shi-Chao ZHOU Zai-Zhi*ZHANG Jin-Hao LIANG Kun-Nan MA Hua-Ming HUANG Gui-Hua
(Research Institute of Tropical Forestry,Chinese Academy of Forestry,Guangzhou 510520)
With two-year softwood cuttings, five experiments were conducted to study the effects of substrate, cutting portion, style of keeping leaves, cutting season, different types and contents of exogenous hormones on rooting ofCallicarpanudifloracuttings. Rooting rate, hyponastic rate, rooting number and the maximum root length were measured, and a subordinate function value was used to comprehensively evaluate the rooting quality. The optimum substrate among the eight treatments was peat soil∶vermiculite∶river sand=2∶1∶1 in volume ratio, and the rooting rate and average rooting number were 74% and 5.4, respectively. The upper and middle portion of cutting were more easily for rooting than the bottom portion, but the middle portion was ranked the best. Cuttings with leaves significantly produced a higher rooting rate with comparison of leaves off. Cuttings with a pair of half leaf got the maximum rooting rate of 64%. Autumn(mainly in September) was the optimal season for cutting and its rooting number and maximum root length were significantly higher than that of spring(April) and summer(July). The cutting effect of IBA treatments within four concentration levels were all superior to that of IAA and NAA treatments. Cuttings treated with IBA(1 000,1 500 mg·L-1) showed better rooting quality significantly, while cuttings treated with high concentration levels of NAA(2 000,2 500 mg·L-1) were obviously not conducive to root.
Callicarpanudiflora;medicinal plant;softwood cutting;rooting;impact factors
“十二五”国家科技支撑计划项目(2012BAD22B0504)
刘式超(1990—),男,硕士研究生,主要从事药用植物资源培育研究。
* 通信作者:E-mail:zzzhou@ritf.ac.cn
2016-03-18
* Corresponding author:E-mail:zzzhou@ritf.ac.cn
Q949.777.5
A
10.7525/j.issn.1673-5102.2016.05.015
