潜水位和邻体对长白山哈泥泥炭地3种苔藓的影响
2016-11-10谷晓楠卜兆君葛佳丽刘莎莎郭震宇丁继昭
谷晓楠 卜兆君* 葛佳丽 刘莎莎 蒋 涛 卢 孟,2 郭震宇 丁继昭
(1.东北师范大学泥炭沼泽研究所/国家环境保护湿地生态与植被恢复重点实验室,长春 130024; 2.武汉大学城市设计学院,武汉 430072)
潜水位和邻体对长白山哈泥泥炭地3种苔藓的影响
谷晓楠1卜兆君1*葛佳丽1刘莎莎1蒋 涛1卢 孟1,2郭震宇1丁继昭1
(1.东北师范大学泥炭沼泽研究所/国家环境保护湿地生态与植被恢复重点实验室,长春 130024;2.武汉大学城市设计学院,武汉 430072)
我国东北泥炭地大多存在直叶金发藓优势度增加的现象,其内在机制尚不清楚。以大泥炭藓、中位泥炭藓和直叶金发藓为材料,在哈泥泥炭地选取潜水位差异明显的两个生境,人工构建苔藓群落,研究潜水位和邻体对3种苔藓形态及生化指标的影响。结果表明:潜水位降低抑制两种泥炭藓的高增长和中位泥炭藓的可溶性糖含量,增加两者分枝生产和N含量,而直叶金发藓除生物量受到抑制,分枝生产受到促进外,其他指标均无响应;在混合群中,两种泥炭藓相互促进彼此的高增长和生物量生产,直叶金发藓抑制大泥炭藓的分枝生产和中位泥炭藓的C含量,但两种邻体对直叶金发藓的各项指标影响甚微。研究表明,直叶金发藓尽管未对泥炭藓产生直接的竞争效应,但是凭借其良好的耐旱能力,仍能在气候变暖以及人为干扰导致的潜水位下降的背景下,获得竞争优势,实现种群的扩展。
泥炭藓;直叶金发藓;潜水位;可溶糖含量
作为积累泥炭的湿地生态系统,泥炭地在全球总面积约为400 km2[1],其中,北方气候区是全球泥炭地的主要分布区,蕴含地球陆地土壤碳总量的30%[2],在全球碳循环中发挥重要作用。通常,泥炭藓(Sphagnum)是许多北方和温带泥炭地的优势植物成分,因没有根,植物体直接暴露于环境中,易受环境变化的影响,整个泥炭地亦是脆弱的湿地生态系统。有研究表明北方泥炭地的植被在过去的半个世纪里已经发生了急剧的变化[3~4]。我国东北长白山、大小兴安岭山地是泥炭地的重要分布区,自上世纪六十年代,排水改造等人为原因导致原始泥炭地发生演替[5]。该演替常以泥炭藓盖度下降而直叶金发藓(Polytrichumstrictum)及沼泽皱缩藓(Aulacomniumpalustre)盖度增加为特征[6~7]。
当前全球变暖和氮沉降等环境变化正从根本上改变北方泥炭地的环境特征,通过直接影响泥炭藓的生长而影响泥炭地生态系统过程[8~9],导致许多没有强烈人为干扰的泥炭地也表现出了泥炭藓的减少以及其他种苔藓例如直叶金发藓的增加。作为全球泥炭地的主要分布区,北方和亚北极将比其他地区的气候变暖更为迅速[10]。研究表明,全球变暖会导致地表蒸发的增加,从而引发全球干旱化的加剧[11],泥炭地水位下降,导致了泥炭藓的干旱压力[12],对泥炭地优势植物泥炭藓的生存构成威胁[13~14]。最新研究表明泥炭藓能够在短期内对干旱胁迫做出响应,除降低生物量生产、高增长和增加侧枝生产外,藓丘种能通过增加HCP来提高持水能力[13~14]。潜水位被大多数学者认为是决定泥炭地苔藓植物生长及分布最重要的环境因素[15],潜水位下降抑制许多泥炭藓属植物的生长[15~17],但可能对直叶金发藓影响不大[18]。
环境变化除了能直接影响苔藓植物的生理特征,还可以通过改变植物间竞争关系从而进一步改变物种组成[19]。本研究以两种泥炭藓和直叶金发藓为实验材料,通过在两种潜水位条件下构建苔藓群落,研究泥炭藓和直叶金发藓对潜水位变化和邻体效应的形态和生化响应,尝试对比分析潜水位下降和植物相互作用对泥炭地植被演替的贡献。
1 材料与方法
1.1 研究区概况
研究地位于长白山西侧龙岗山脉中部的哈泥泥炭地(42°13′N,126°31′E),面积为1 678 hm2,为迄今为止东北区面积最大的近原始泥炭地。该地属中温带大陆性山地季风气候,气温常年偏低,年均气温2.5~3.6℃,全年活动积温为2 600℃左右,年降水量在757~930 mm,降水集中在夏季,土壤为泥炭土[20]。泥炭地植物群落多样,按乔木优势度高低可大体划分为有林和开阔地两种主要生境。本研究在开阔地生境进行,维管植物以小灌木狭叶杜香(Ledumangustum)、甸杜(Chamaedaphnecalyculata)、草本植物毛苔草(Carexlasiocarpa)、东方羊胡子草(Eriophorumpolystachion)为主[7];苔藓植物以大泥炭藓为优势植物,习见苔藓植物有中位泥炭藓(S.magellanicum)、直叶金发藓(P.strictum)等[19~21]。
1.2 供试材料
2013年8月初,从哈泥泥炭地选择盖度大于90%的大泥炭藓(S.palustre)、中位泥炭藓和直叶金发藓藓丘,采集个体粗壮、大小相似的3种苔藓为样本,截取自头状枝以下6 cm作为实验材料,进行脱水处理(医用纱布包裹,蒸馏水中充分浸泡20分钟达到水分饱和后,经甩干桶甩干1分钟)后称重。设置单种群(分别称量大泥炭藓、中位泥炭藓各11.30 g,直叶金发藓9.00 g)、混合群(每2种苔藓质量减半,以1∶1比例混合)2个类型,以自然密度放置于高6.00 cm、顶部直径6.30 cm、底部直径4.50 cm的聚乙烯杯内。聚乙烯杯杯壁及杯底均匀密布孔隙,保证苔藓藓块与杯外的环境气体和水分交换[22]。另外,在每杯样品中设置标记株,即在每种苔藓供试材料中选择10株长6 cm,茎叶粗壮的个体,去除侧枝新芽后捆绑成束,以便精确测定实验样品的个体高度和侧枝新芽生产量的变化情况[19]。
1.3 试验设计
2013年8月初,在以大泥炭藓为优势苔藓物种的开阔地,遵循双因素裂区试验设计布置试验样品。主因素为潜水位,设置高(-25 cm)和低(-40 cm)两个水平;副因素为邻体,针对每一目标种而言,邻体分为三个水平(以Sp为例,邻体分别为Sp、Sm和Ps),5个区组重复,共计60个试验样品。将处理好的实验样品置入藓丘中,保持样品表面与藓丘表面平齐。
1.4 性状测量
实验选取形态指标高增长、生物量生产和生产,生化指标碳含量、氮含量和可溶性糖共计6项指标反映3种泥炭藓的生长变化。2014年8月中旬,经过一年的野外培养,将样品取回后实验室内进行处理,取出标记株,量测标记株中10株个体的高度,计算其均值,参照初始高度6 cm得到高增长;计数各标记株的分枝数,记为分枝生产;将所有样品个体进行截取处理,去除头状枝2 cm与底部4 cm后,保留中间部分,以70℃烘干24 h,称量其干重,计算生物量生产[23~24]。
另外,取每杯中切下的同种泥炭藓头状枝放70℃烘箱中烘干24 h后,与测重后的中间部分干样一起研磨成粉末,分别采用重铬酸钾—硫酸氧化法、凯式微量定氮法以及蒽酮比色法测定苔藓样品中的碳、氮及可溶性糖含量[25]。
1.5 统计分析
采用SPSS19.0软件,经双因素方差分析(Two-way ANOVA),分析潜水位、邻体以及潜水位和邻体的交互作用对3种苔藓6项指标的影响,采用Tukey检验进行多重比较。运用单因素方差分析(one-way ANOVA)分别分析高低2种潜水位条件下,不同邻体对植物形态生化特征的影响。显著性水平设定为α=0.05。
2 结果与分析
2.1 潜水位对3种苔藓生长特征的影响
大泥炭藓和中位泥炭藓高潜水位时高增长分别为2.45和3.18 cm,低潜水位时分别为1.38和2.14 cm,潜水位下降显著抑制了两种泥炭藓的高增长(均P<0.05,图1A)。潜水位下降促使二者的分枝生产分别从高潜水位时的2.33和2.60 g增加到低潜水位时的4.40和4.33 g(大泥炭藓P<0.05,中位泥炭藓P<0.01,图1C),且促使二者的N含量分别从高潜水位时的0.74%和0.86%增加到低潜水位时的1.25%和1.50%(均P<0.01,图1D)。
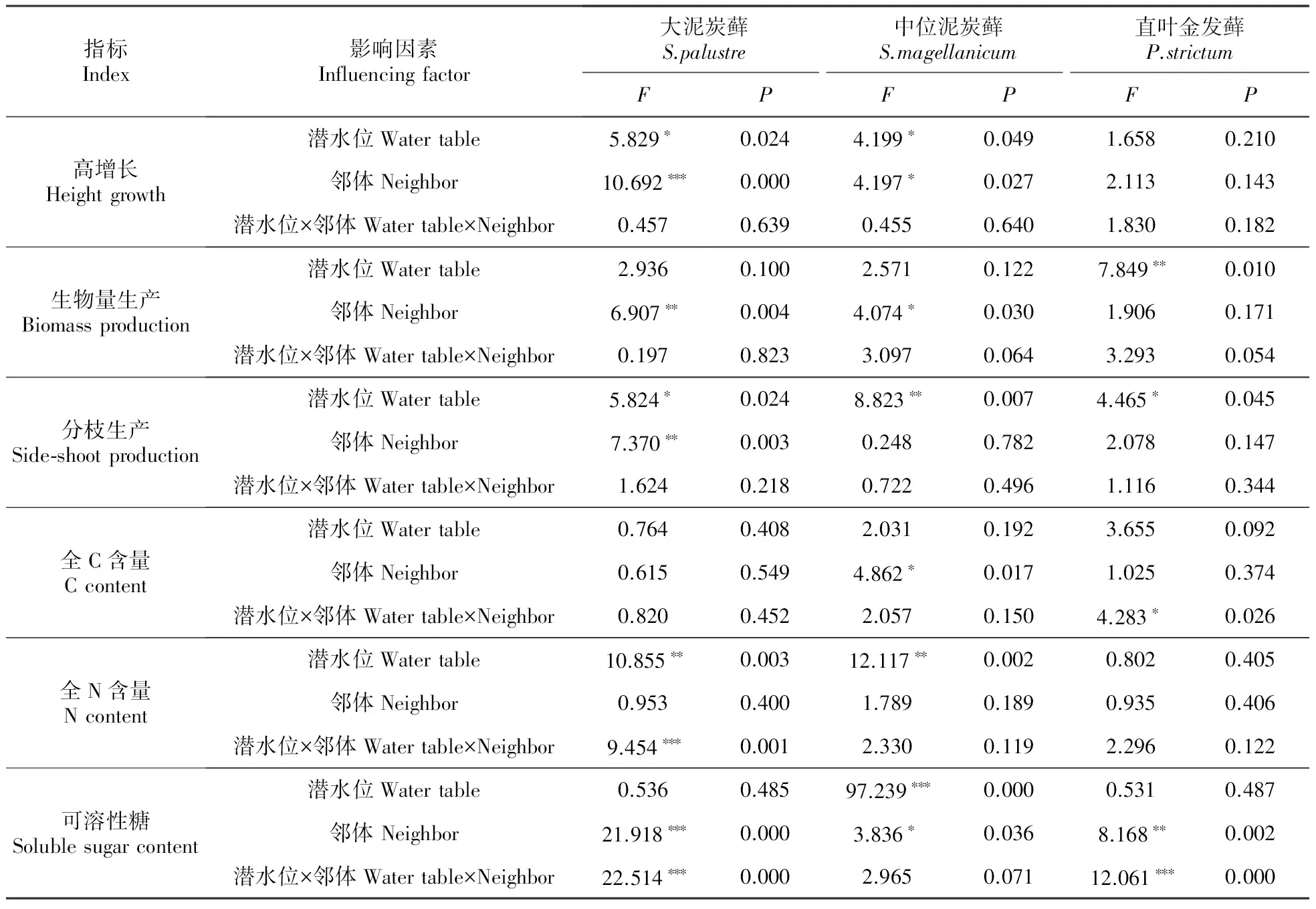
表1 潜水位和邻体对3种苔藓生长影响的双因素方差分析
*P<0.05;**P<0.01;***P<0.001

图1 水位对3种苔藓高增长、生物量生产、分枝生产、C含量、N含量和可溶性糖含量的影响 ns.无显著性差异 *P<0.05;**P<0.01;***P<0.001 下同。Fig.1 Main effects of water table on height growth,biomass production,side-shoot production,C content,N content and soluble sugar content of three mosses ns.Means no significant difference *P<0.05;**P<0.01;***P<0.001 The same as below.

图2 邻体对3种苔藓高增长、生物量生产、分枝生产、C含量、N含量和可溶性糖含量的影响 不同小写字母表示处理间差异具统计学意义(P<0.05)。Fig.2 Main effects of neighbor on height growth,biomass production,side-shoot production,C content,N content and soluble sugar content of three mosses Notes: Means not sharing an lower case letter differ significantly(P<0.05).
此外,中位泥炭藓的可溶性糖含量明显受到潜水位下降的抑制作用(P<0.001),从高潜水位时的0.48%减少到低潜水位时的0.13%(图1F)。直叶金发藓的生物量生产从高潜水位时的0.58 g减少到低潜水位时的0.43 g(P<0.01,图1B),分枝生产却从高潜水位时的0.9增加到低潜水位时的2.5(P<0.05,图1C),但C、N含量和可溶性糖含量对潜水位下降均无响应(图1:D~F)。
2.2 邻体对3种苔藓生长特征的影响
大泥炭藓和中位泥炭藓相互显著促进彼此的高增长、生物量生产及可溶性糖含量(均P<0.05,图2:A~B,F):大泥炭藓单种群及其与中位泥炭藓混合生长时高增长分别为1.44和3.32 cm、生物量生产分别为0.17和0.35 g、可溶性糖含量分别为0.15%和0.43%;中位泥炭藓单种群及其与大泥炭藓混合生长时高增长分别为2.24和3.70 cm、生物量生产为0.24和0.33 g、可溶性糖含量为0.30%和0.48%。大泥炭藓的分枝生产在单种群时为5.5 g,与中位泥炭藓和直叶金发藓混合生长时分别为3.1、1.5 g,明显受到两种邻体的抑制作用(P<0.05,图2C)。中位泥炭藓单种群全碳含量为43.58%,与直叶金发藓混合生长时为41.84%,邻体的负效应显著(P<0.05,图2D);除可溶性糖含量由单种群的0.24%显著降低到中位泥炭藓为邻体时的0.12%(P<0.05,图2F)以外,直叶金发藓的其余5项指标均未对邻体做出响应。
2.3潜水位与邻体对3种苔藓生长特征的交互作用
3种苔藓的形态指标均未受到潜水位和邻体的交互影响,但生化指标中,大泥炭藓的N含量、直叶金发藓的C含量及这两种苔藓的可溶性糖含量共同体现了潜水位与邻体对3种苔藓的交互作用(图3)。
高潜水位时,邻体未对大泥炭藓的N含量有显著影响,但随着潜水位的降低,直叶金发藓促进大泥炭藓N含量(P<0.05)的升高,而中位泥炭藓则对其产生抑制作用(P<0.01)。高潜水位时,中位泥炭藓和直叶金发藓均促进大泥炭藓可溶糖含量增高(均P<0.01),但潜水位降低后该效应消失。

图3 潜水位和邻体对大泥炭藓和直叶金发藓的C含量、N含量和可溶性糖含量的显著性交互作用 A~B.大泥炭藓;C~D.直叶金发藓Fig.3 Significant interactions between water table and neighbor on C content,N content and soluble sugar content of S.palustre and P.strictum A-B.S.palustre; C-D.P.strictum
尽管潜水位降低并未对直叶金发藓的C含量产生显著影响,但低潜水位时其受到大泥炭藓和中位泥炭藓的显著促进作用(P<0.01)。高潜水位时邻体对直叶金发藓的可溶糖含量无显著影响,潜水位下降后,两种泥炭藓邻体的出现导致直叶金发藓可溶性糖含量显著下降(P<0.001)。
3 讨论
3.1 不同属植物耐旱性的差异
除分枝生产和生物量生产外,潜水位变化对直叶金发藓的其他形态和生化指标均无影响,但对两种泥炭藓的多项指标影响明显。苔藓植物的水分主要来源于大气,金发藓属植物属于内导水型即具有发达的内部导水组织,能将藓丛基部的水分向上输送;而泥炭藓属植物属于外导水型即内部输导组织发育不好,植物体表面直接吸收水分和营养物质,依靠毛细管和透明细胞分别进行水分的传导和储存[26]。因此,直叶金发藓相较于泥炭藓来说具有更强的耐旱性而响应不甚明显,其可通过对干旱的强耐受性而在干旱环境中成为优势物种[18,27]。
中位泥炭藓通常被定义为丘坡种[17,28],较直叶金发藓和大泥炭藓而言,其生长需要更多的水分,而本实验设置的低潜水位对中位泥炭藓的胁迫影响(从可溶糖含量变化来看)要大于其他两种苔藓,进一步证实大泥炭藓和直叶金发藓的耐旱性要强于中位泥炭藓,由此可判断,3种苔藓的耐旱性以直叶金发藓最强,大泥炭藓次之,中位泥炭藓最弱。强耐旱性可能成为我国东北泥炭地潜水位下降背景下直叶金发藓优势度增加的重要原因[19]。
3.2 潜水位与植物可溶糖含量
很多研究表明[29~31],水分胁迫条件下,植物体内的小分子化合物可溶性糖作为一种渗透调节物质,其含量的增加可以降低植物体内的渗透势,有利于植物在干旱逆境中维持体内正常的所需水分,提高其抗逆适应性。本研究中,低潜水位时大泥炭藓和直叶金发藓可溶性糖含量无明显变化,而中位泥炭藓该指标却发生了反常变化,可溶性糖含量大大降低(图1F)。陈文佳等人[32]曾对干旱胁迫下细叶小羽藓(Haplocladiummicrophyllum)生化指标进行研究,发现随着干旱胁迫时间的加长,植物细胞膜透性增加以及分解代谢大于合成代谢导致可溶性糖等水溶性物质外渗、合成受阻,干旱后期含量降低。而吉进宝[33]对侧柏(Platycladusorientalis)幼苗的研究呈现同样趋势。本次野外移植实验放置时间长达一年,低潜水位时间过长可能导致中位泥炭藓细胞膜透性加大,可溶性糖外渗从而含量低于对照组。
3.3 植物的形态响应
与前人[34~35]研究相似,本次实验中,水位埋深增加显著抑制了3种苔藓植物的高增长,而对3种苔藓的分枝生产均有明显的促进作用。降低高度成为减少水分丧失的有效途径,而较多的侧枝生产量将增加种群密度、减少水分散失[36]。
实验中,中位泥炭藓和直叶金发藓作为邻体明显抑制了大泥炭藓的分枝生产,然而,两者结果相同但机制可能不同。同属植物中位泥炭藓因具有很强的持水能力可改善微环境,从而使大泥炭藓不必生产更多的分枝;而直叶金发藓因具强的竞争力和弱的持水能力[19],对大泥炭藓的分枝生产产生不利影响。
3.4 植物的相互促进作用
本研究发现一个非常有趣的现象,即大泥炭藓与中位泥炭藓高增长和生物量生产存在彼此相互促进作用,这在以往的植物相互作用研究尚鲜有报道。胁迫梯度假说认为,当植物在胁迫条件下,植物间的相互作用类型更趋向于促进作用[37]。按照该假说来看,植物的相互促进作用更容易在环境相对严酷的环境出现。在美国的莫哈维沙漠,一年生植物能够促进一种灌木的生长和繁殖,而该灌木可以提高该一年生植物的存活率生物量生产以及种子生产[38]。最近,有学者在地中海气候区的两种灌木间也发现相互促进现象。尽管同样存在竞争关系,两种灌木可通过改善水分条件、养分状况以及植食防御来促进对方[39]。本实验期内,监测数据显示,2014年生长季的5、6和7月的平均空气相对湿度为69.1%,大大低于往年如2013年,该年份三个月的平均值为79.2%,两种泥炭藓间的相互促进作用应与实验年份研究地的气候相对干旱有关。
3.5 植物相互作用与C含量
除抑制大泥炭藓生长外,直叶金发藓还抑制中位泥炭藓的C含量。苔藓植物的C含量是直接反应植物光合固碳能力的重要参数,其含量变化可能有两方面原因。一方面,直叶金发藓进行水分竞争,造成了中位泥炭藓因水分被抢夺而引起的光合固碳作用减弱,从而C含量降低;另一方面也可能是因为两种苔藓之间存在化感作用[40],中位泥炭藓分泌过多的含碳化感物质抵御邻体的威胁,例如多酚,从而导致其体内C含量的降低[41]。因实验建设在大泥炭藓平整藓丘上,大泥炭藓将更适应这里的环境条件,这可能是泥炭藓多项指标并未显著呈现出邻体直叶金发藓不利影响的原因。直叶金发藓作为邻体均未对两种泥炭藓的高增长和生物量生产产生竞争效应,这亦应与实验期的异常干旱有关,导致植物间的竞争效应下降,相比泥炭藓间的促进作用而言,进一步证明直叶金发藓具有较强的竞争能力。
3.6 水位和邻体的交互作用
水位和邻体的交互作用出现在大泥炭藓和直叶金发藓的生化指标而非形态指标上。其中,大泥炭藓和直叶金发藓在可溶糖含量指标上均表现出交互作用,泥炭藓和金发藓属植物分别属于外导水型和内导水型。大泥炭藓和直叶金发藓单种群的可溶糖含量并未随潜水位下降而变化,这可能是如前所述,有部分可溶糖含量出现外渗,使的本来增加的可溶糖含量维持在一个稳定的水平上。出现邻体后,在高潜水位条件下,大泥炭藓因竞争水分损失,通过可溶性糖含量升高来抵御干旱,但当潜水位下降后,大泥炭藓已不能通过提高可溶糖含量来抵御干旱。与之形成鲜明对比,直叶金发藓在高潜水位时候,邻体出现未能使其提高可溶糖含量,在低潜水位时,其可溶糖含量出现大幅下降。这表明,直叶金发藓主要通过与泥炭藓竞争水分而不是提高可溶糖含量来抵御干旱,这可能恰恰是直叶金发藓在干旱胁迫环境中存在潜在的竞争优势的原因。
1.Charman D.Peatlands and environmental change[M].Chichester:John Wiley & Sons,2002.
2.Rydin H,Jeglum J K.The biology of peatlands[M].Oxford:Oxford University Press,2006.
3.Gunnarsson U,Malmer N,Rydin H.Dynamics or constancy inSphagnumdominated mire ecosystems? A 40-year study[J].Ecography,2002,25(6):685-704.
4.Kapfer J,Grytnes J A,Gunnarsson U,et al.Fine-scale changes in vegetation composition in a boreal mire over 50 years[J].Journal of Ecology,2011,99(5):1179-1189.
5.柴岫.泥炭地学[M].北京:地质出版社,1990.
Chai X.Peatland science[M].Beijing:Geological Publishing House,1990.
6.郎惠卿,赵魁义,陈克林.中国湿地植被[M].北京:科学出版社,1999.
Lang H Q,Zhao K Y,Chen K L.Wetland vegetation in China[M].Beijing:Science Press,1999:200-212.
7.卜兆君,杨允菲,代丹,等.长白山泥炭沼泽桧叶金发藓种群的年龄结构与生长分析[J].应用生态学报,2005,16(1):44-48.
Bu Z J,Yang Y F,Dai D,et al.Age structure and growth pattern ofPolytrichumjuniperumpopulations in a mire of Changbai Mountains[J].Chinese Journal of Applied Ecology,2005,16(1):44-48.
8.Berendse F,van Breemen N,Rydin H,et al.Raised atmospheric CO2levels and increased N deposition cause shifts in plant species composition and production in Sphagnum bogs[J].Global Change Biology,2001,7(5):591-598.
9.Vasander H,Kettunen A.Carbon in boreal peatlands[M].//Wieder R K,Vitt D H.Boreal peatland ecosystems.Berlin Heidelberg:Springer,2006:165-194.
10.IPCC.Climate change 2007-the physical science basis:working group I contribution to the fourth assessment report of the IPCC[M].Cambridge:Cambridge University Press,2007.
11.Wetherald R T,Manabe S.Detectability of summer dryness caused by greenhouse warming[J].Climatic Change,1999,43(3):495-511.
12.Bragazza L.A climatic threshold triggers the die-off of peat mosses during an extreme heat wave[J].Global Change Biology,2008,14(11):2688-2695.
13.Bu Z J,Zheng X X,Rydin H,et al.Facilitation vs.competition:Does interspecific interaction affect drought responses inSphagnum?[J].Basic and Applied Ecology,2013,14(7):574-584.
14.葛佳丽,卜兆君,郑星星,等.三种泥炭藓对干旱及植物相互作用的形态响应[J].生态学杂志,2014,33(9):2363-2368.
Ge J L,Bu Z J,Zheng X X,et al.Morphological responses of threeSphagnumspecies to drought and interspecific interaction[J].Chinese Journal of Ecology,2014,33(09),2363-2368.
15.Mulligan R C,Gignac L D.Bryophyte community structure in a boreal poor fen:reciprocal transplants[J].Canadian Journal of Botany,2001,79(4):404-411.
16.Rydin H.Mechanisms of interactions amongSphagnumspecies along water-level gradients[J].Advances in Bryology,1993,5:153-185.
17.Robroek B J M,Limpens J,Breeuwer A,et al.Interspecific competition betweenSphagnummosses at different water tables[J].Functional Ecology,2007,21(4):805-812.
18.Wyatt R,Derda G S.Population biology of the Polytrichaceae[J].Advances in Bryology,1997,6:265-296.
19.Bu Z J,Rydin H,Chen X.Direct and interaction-mediated effects of environmental changes on peatland bryophytes[J].Oecologia,2011,166(2):555-563.
20.乔石英.长白山西麓哈尼泥炭沼泽初探[J].地理科学,1993,13(3):279-287,296.
Qiao S Y.A Perliminary Study on Hani Peat-Mire in The West Part of The ChangBai Mountain[J].Scientia Geographica Science,1993,13(03):279-287.
21.陈旭,卜兆君,王升忠,等.长白山哈泥泥炭地七种苔藓植物生态位[J].应用生态学报,2009,20(3):574-578.
Chen X,Bu Z J,Wang S Z,et al.Niches of seven bryophyte species in hani peat land of changbai mountains[J].The journal of applied ecology,2009,20(3),574-578.
22.孙强,卜兆君,王升忠,等.哈泥贫营养泥炭沼泽毛壁泥炭藓种群密度制约初探[J].湿地科学,2005,3(2):116-120.
Sun Q,Bu Z J,Wang S Z,et al.Preliminary Study on Density Dependence ofSphagnumimbricatumPopulation in Hani Oligotrophic Mire[J].Wetland Science,2005(02),116-120.
23.Lindholm T.Variation inSphagnumshoot numbers and shoot bulk density in hummocks of a raised bog.(Rahkamättäiden sammalikon rakenteesta ja tiheydestä Laaviosuon keidasrämeellä.)[J].Suo,1983,34(3):73-77.
24.马进泽,卜兆君,郑星星,等.遮阴对两种泥炭藓植物生长及相互作用的影响[J].应用生态学报,2012,23(2):357-362.
Ma J Z,Bu Z J,Zheng X X,et al.Effects of shading on twoSphagnumspecies growth and their interactions[J].Chinese Journal of Applied Ecology,2012,23(2):357-362.
25.中国土壤学会农业化学专业委员会.土壤农业化学常规分析方法[M].北京:科学出版社,1983:272-312.
Agricultural chemical Specialized Committee of China Soil Society.Conventional analytical method of Soil Agricultural Chemistry[M].Beijing:Science Press,1983:272-312.
26.吴玉环,黄国宏,高谦,等.苔藓植物对环境变化的响应及适应性研究进展[J].应用生态学报,2001,12(6):943-946.
Wu Y H,Huang G H,Gao Q,et al.Research advance in response and adaptation of bryophytes to environmental change[J].Chinese Journal of Applied Ecology,2001,12(06),943-946.
27.Callaghan T V,Collins N J,Callaghan C H.Photosynthesis,growth and reproduction ofHylocomiumsplendensandPolytrichumcommunein Swedish Lapland.Strategies of growth and population dynamics of tundra plants 4[J].Oikos,1978,31(1):73-88.
28.Andrus R E.Some aspects ofSphagnumecology[J].Canadian Journal of Botany,1986,64(2):416-426.
29.Gill P K,Sharma A D,Singh P,et al.Changes in germination,growth and soluble sugar contents ofSorghumbicolor(L.) Moench seeds under various abiotic stresses[J].Plant Growth Regulation,2003,40(2):157-162.
30.韩蕊莲,李丽霞,梁宗锁.干旱胁迫下沙棘叶片细胞膜透性与渗透调节物质研究[J].西北植物学报,2003,23(1):23-27.
Han R L,Li L X,Liang Z S.Seabuckthorn relative membrane conductivity and osmotic adjustment under drought stress[J].Acta Botanica Boreali-Occidentalia Sinica,2003,23(1):23-27.
31.赵江涛,李晓峰,李航,等.可溶性糖在高等植物代谢调节中的生理作用[J].安徽农业科学,2006,34(24):6423-6425,6427.
Zhao J T,Li X F,Li H,et al.Research on the Role of the Soluble Sugar in the Regulation of Physiological Metabolism in Higher Plant[J].Journal of Anhui Agri Sci,2006,34(24):6423-6425,6427.
32.陈文佳,张楠,杭璐璐,等.干旱胁迫与复水过程中遮光对细叶小羽藓的生理生化影响[J].应用生态学报,2013,24(1):57-62.
Chen W J,Zhang N,Hang L L,et al.Influence of shading during the processes of drought stress and re-watering on the physiological and biochemical characteristics ofHaplocladiummicrophyllum[J].Chinese Journal of Applied Ecology,2013,24(1):57-62.
33.吉增宝,王进鑫.干旱胁迫对侧柏幼树某些生理特性的影响[J].西北林学院学报,2009,24(6):6-9.
Ji Z B,Wang J X.The Effect of Drought Stress on Some Physiological Characters ofPlatycladusorientalis[J].Journal of Northwest Forestry University,2009,24(06):6-9.
34.Wagner D J,Titus J E.Comparative desiccation tolerance of twoSphagnummosses[J].Oecologia,1984,62(2):182-187.
35.Jauhiainen J,Silvola J.Photosynthesis ofSphagnumfuscumat long-term raised CO2concentrations[J].Annales Botanici Fennici,1999,36(1):11-19.
36.Pedersen B,Hanslin H M,Bakken S.Testing for positive density-dependent performance in four bryophyte species[J].Ecology,2001,82(1):70-88.
37.Bertness M D,Callaway R.Positive interactions in communities[J].Trends in Ecology & Evolution,1994,9(5):191-193.
38.Holzapfel C,Mahall B E.Bidirectional facilitation and interference between shrubs and annuals in the Mojave Desert[J].Ecology,1999,80(5):1747-1761.
39.Tirado R,Bråthen K A,Pugnaire F I.Mutual positive effects between shrubs in an arid ecosystem[J].Scientific Reports,2015,5:14710.
40.Ingerpuu N,Vellak K.Growth depends on neighbours:experiments with threeSphagnumL.species[J].Journal of Bryology,2013,35(1):27-32.
41.Verhoeven J T A,Liefveld W M.The ecological significance of organochemical compounds inSphagnum[J].Acta Botanica Neerlandica,1997,46(2):117-130.
Under the auspices of National Natural Science Foundation of China(No. 41371103,41471043);The Project of Jilin Province Department of Education(2014B048)
introduction:GU Xiao-Nan(1992—),female,master degree candidate,majors in wetland ecology and physical geography.
date:2016-02-26
EffectofWaterTableandNeighboronThreeMossesinHaniPeatlandinChangbaiMountains
GU Xiao-Nan1BU Zhao-Jun1*GE Jia-Li1LIU Sha-Sha1JIANG Tao1LU Meng1,2GUO Zhen-Yu1DING Ji-Zhao1
(1.State Environmental Protection Key Laboratory of Wetland Ecology and Vegetation Restoration,Institute for Peat and Mire Research,Northeast Normal University,Changchun 130024;2.School of Urban Design,Wuhan University,Wuhan 430072)
The dominance of non-Sphagnummosses such asPolytrichumstrictumhas increased in some peatlands of NE China while the mechanism is not clear. We performed a one-year experiment in Hani Peatland with three mosses,Sphagnumpalustre,S.magellanicumandP.strictumin two typical habitats with different water table depth. We tried to explore the effects of water table and neighbor on morphological traits including height increment, biomass production and side-shoot production and biochemical traits including carbon and nitrogen content and soluble sugar content. TwoSphagnummosses both responded to water table drawdown with the increasing of side-shoot production and nitrogen content but decreasing height increment.S.magellanicumalso responded with the decreasing of soluble sugar content. Except for the inhibitive effect on biomass production and the facilitation effect on side-shoot production, no other traits inP.strictumwere affected by water table drawdown. In mixed culture, twoSphagnumspecies mutually promoted their height increment and biomass production. Side-shoot production inS.palustreand carbon content inS.magellanicumwere negatively affected by neighborP.strictum, while neither neighbor had any effects onP.strictum. AlthoughP.strictumdid not have a direct competition effect on twoSphagnummosses, and by virtue of its good drought tolerance, it could still get the competitive advantage and realize population expansion in peatlands in the background of climate warming and water table drawdown resulted from disturbance by human beings.
Sphagnum;Polytrichumstrictum;water table;soluble sugar content
国家自然科学基金项目(41371103,41471043)资助;吉林省教育厅项目(2014B048)资助
谷晓楠(1992—),女,硕士研究生,主要从事湿地生态学与自然地理学研究。
* 通信作者:E-mail:buzhaojun@nenu.edu.cn
2016-02-26
* Corresponding author:E-mail:buzhaojun@nenu.edu.cn
Q914.84
A
10.7525/j.issn.1673-5102.2016.05.008
