新疆野生一枝蒿粗多糖对流感疫苗小鼠免疫增强效果的分析
2016-11-08张爱莲王丹阳赵淑述张富春
张爱莲,王丹阳,赵淑述,赵 兵,张富春
(新疆大学生命科学与技术学院 新疆生物资源与基因工程重点实验室,乌鲁木齐 830046)
新疆野生一枝蒿粗多糖对流感疫苗小鼠免疫增强效果的分析
张爱莲*,王丹阳,赵淑述,赵兵,张富春
(新疆大学生命科学与技术学院 新疆生物资源与基因工程重点实验室,乌鲁木齐 830046)
用新疆野生一枝蒿粗多糖(wildArtemisiarupestrisL.crude polysaccharides,WARCP)通过肌肉注射免疫小鼠,研究其作为流感病毒疫苗(influenza virus vaccine,IVV)的佐剂效果和节约流感疫苗抗原用量的作用。WARCP与不同剂量(0.05、0.1、0.5 μg)的IVV配伍,肌肉注射免疫小鼠,观察小鼠的生长状态,通过ELISA法检测血清中抗体IgG及IgG1、IgG2a的水平;MTT法检测脾淋巴细胞的增殖;流式细胞术检测细胞因子CD4+IL-4和CD8+IFN-γ以及CD4+CD25+Foxp3+Treg细胞的表达水平。结果表明WARCP对小鼠的生长状态没有显著的影响(P>0.05);WARCP能够显著提高不同剂量IVV特异性IgG及其IgG1、IgG2a的抗体水平(P<0.05);增强淋巴细胞的增殖(P<0.05);显著提高IL-4和IFN-γ的分泌水平(P<0.05);降低Treg细胞的表达水平(P<0.05);尤其可以提高低剂量IVV的体液和细胞免疫反应,至少减少抗原用量91%。因此,WARCP作为IVV的佐剂通过降低Treg细胞的水平,显著增强了IVV的免疫效果,尤其是Th1型的免疫反应,能够很好地节约抗原用量,具有良好的安全性。
流感疫苗;一枝蒿;多糖;节约抗原;肌肉免疫
流感是一种最常见的危害人类健康的传染病,尤其是在高危人群中,如儿童和老人。研制流感疫苗是针对预防流感最有效的一种方法,但是由于流感病毒表面的抗原频繁突变,在大流感流行的时候,流感疫苗往往不能够满足接种人群的用量。而使用疫苗佐剂可以显著增强流感疫苗免疫效果,减少流感疫苗的抗原用量,使更多的易感人群接种流感疫苗,达到迅速应对流感大流行的目的[1]。流感疫苗的佐剂虽然有铝佐剂和MF59,但是MF59或AS03仅在欧洲流感大流行时准予使用[2-3],目前人们使用的流感疫苗中并不含有佐剂,因此寻找安全有效的佐剂用于流感疫苗,降低抗原的用量,扩大流感流行时接种人群的数量仍然是流感疫苗研究的重要课题。
传统的中草药在人类疾病的治疗中有悠久的历史,大量的证据表明中草药具有很好的免疫调节作用,可以作为新型疫苗佐剂的候选资源[4]。多糖是中草药的主要成分,具有抗氧化、抗肿瘤、免疫调节等多种生物活性[5-6]。国内外研究者们从多种传统中草药中提取多糖成分研究其佐剂效果,如黄芪多糖、灵芝多糖、茯苓多糖、淫羊藿多糖等发现其具有很好的佐剂活性,达到增强免疫功能的作用而成为新型疫苗的候选佐剂[7-11]。
新疆野生一枝蒿(WARCP)主要含有多糖、黄酮等多种化合物[12],多糖为其主要活性成分之一。在前期的研究中发现WARCP与IVV配伍进行皮下免疫小鼠后,WARCP具有很好的佐剂效果[13]。结合实际应用中IVV多采用肌肉途径接种,为此本研究将WARCP作为IVV的新型疫苗佐剂,通过肌肉途径免疫小鼠,检测其免疫增强的效果和节约抗原用量的作用,评价WARCP作为IVV佐剂的可行性,为WARCP作为IVV佐剂的研制提供实验依据,并为后期研制禽流感以及其他病毒疫苗的佐剂奠定一定的基础。
1 材料与方法
1.1实验材料
新疆野生一枝蒿全草(市售)。季节性流感病毒裂解疫苗(2014/2015株流感病毒裂解疫苗,主要成分:A/加利福尼亚/7/2009(H1N1) pdm09-衍生株(NYMC X-179A)、A/德克萨斯/50/2012(H3N2)-衍生株(NYMC X-223A)、B/马萨诸塞/2/2012-衍生株(NYMC BX-51B)(血凝素含量均为30 μg·mL-1)(市售)。辣根过氧化物酶标记的山羊抗鼠的IgG、IgG1、IgG2a购自美国Southbiotech公司。刀豆蛋A(ConA)和脂多糖(LPS)为美国Sigma-Aldrich公司产品。噻唑蓝(MTT)为Amresco公司产品。N-四甲基联苯胺( TMB) 购自上海蓝季科技发展有限公司。流式抗体PE-CD3e、FITC-CD8a、APC-CD4、FITC-CD4、PE-IL-4、PE-IFN-γ、APC-CD25和PE-Foxp3、Fixation/Permeabilization Solution、Perm/Wash buffer、Golgi stop均购自美国BD公司。 Regulatory T Cell Staining Kit购自eBioscience公司。RPMI-1640培养基为Hyclone公司产品。其他试剂为国产分析纯。
1.2新疆野生一枝蒿粗多糖的制备
采用水提醇沉法提取新疆野生一枝蒿粗多糖[14]。用Sevag法对新疆野生一枝蒿粗多糖除蛋白质,得到除蛋白质的新疆野生一枝蒿粗多糖粉末[15]。蒽酮-硫酸法[16]测定新疆野生一枝蒿粗多糖中多糖的含量为30.94%[13]。
1.3实验动物与免疫
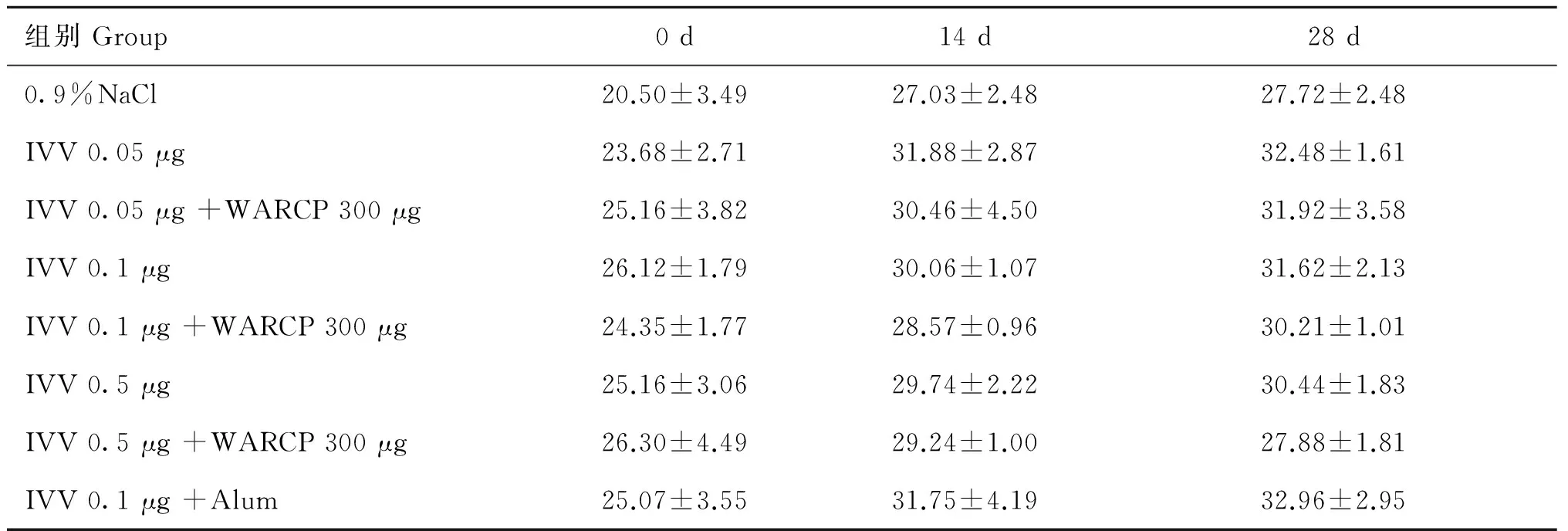
ICR小鼠,雌性,6~8周龄,18~22 g,购自新疆医科大学实验动物中心。40只小鼠随机分为8组(表1)。WARCP 300 μg分别与0.05、0.1、0.5 μg IVV配伍后免疫小鼠为试验组,以不同剂量的IVV单独免疫组为试验对照组,生理盐水免疫组为空白对照组,IVV与铝佐剂组为阳性对照组,于0 d和14 d分别进行肌肉免疫,体积为100 μL。免疫后不同时间点称取小鼠体重并观察小鼠的生长状态。
另取20只小鼠,设IVV 0.05 μg、IVV 0.05 μg+WARCP 300 μg、IVV 0.1 μg、IVV 0.1 μg+WARCP 300 μg 4组(n=5),分别于0 d和14 d进行皮下注射免疫,用于分析不同免疫途径对抗体滴度的影响。
1.4WARCP免疫后小鼠血清IgG及亚类抗体检测
初免后7、14、21 d进行小鼠眼眶采血,收集上清,用间接ELISA法测定血清中的抗体水平。简述如下:将0.125 μg·mL-1的2014/2015株流感病毒裂解疫苗加入96孔板中,4 ℃过夜;37 ℃封闭1 h;每孔加入1∶200稀释后的血清,37 ℃1 h;每孔分别加入1∶5 000稀释的HRP标记IgG、IgG1、IgG2a,37 ℃ 1 h;加入TMB底物避光显色10 min,终止反应后OD450/655 nm的条件下测定吸光度。
表1免疫小鼠分组表
Table 1The group of immunization

分组Groups动物Animals数量Number疫苗(或对照)Vaccine(orcontrol)1ICR小鼠50.9%NaCl2ICR小鼠5IVV(influenzavirusvaccine)0.05μg3ICR小鼠5IVV0.05μg+WARCP300μg4ICR小鼠5IVV0.1μg5ICR小鼠5IVV0.1μg+WARCP300μg6ICR小鼠5IVV0.5μg7ICR小鼠5IVV0.5μg+WARCP300μg8ICR小鼠5IVV0.1μg+Alum100μg
1.5WARCP免疫后小鼠淋巴细胞增殖的检测
小鼠二免后7 d,在无菌条件下制成脾细胞悬液,将5×106个·mL-1脾细胞悬液加入96孔板,分别加入3.5 μg·mL-1的ConA和5 μg·mL-1的LPS,设置3个复孔,于37 ℃培养箱中孵育48 h。每孔加入20 μL质量浓度为5 g·L-1的MTT溶液,继续孵育4 h,加入100 μL DMSO后用酶标仪检测OD570/630 nm条件下的吸光度,计算各组刺激指数(SI),SI=(各刺激孔的OD值-培养基OD值)/(未刺激孔的OD值-培养基OD值)。
1.6流式细胞术检测细胞因子CD4+IL-4、CD8+IFN-γ的表达
从小鼠分离得到的脾细胞,取2×106个细胞加入到24孔板里,加入IVV抗原0.6 μg,37 ℃培养箱孵育4 h。加入Golgi stop过夜培养后,收集细胞,用FITC-CD4进行细胞表面染,室温避光30 mins。每管加入150 μL Cytofix/Cytoperm(BD)重悬细胞,4 ℃,30 min;加入1 mL Perm/Wash buffer (BD),离心,弃上清。加入1 μL 的PE-IL-4和PE-IFN-γ;室温避光20 min。每个样用3 mL 1× Perm/Wash buffer (BD)洗,PBS重悬细胞,流式细胞术检测。
1.7流式细胞术检测CD4+CD25+Foxp3+Treg细胞的表达
制备小鼠二免后7 d的脾细胞悬液,细胞计数后将浓度调整为2×106个,用eBioscience 的Regulatory T Cell Staining Kit进行细胞染色,按照说明书进行,简述如下:细胞洗涤后,1 200 r·min-1离心7 min,各加入APC-CD4、FITC-CD25进行表面染色,避光室温 20 min。加固定破膜液120 μL,用1 mL 1× Wash buffer洗一次,各加1 μL PE-Foxp3,室温孵育20 min。每个样加入1 mL wash buffer,离心,弃上清。加入300 μL PBS重悬细胞,过铜网,流式上机检测,用FlowJo软件进行分析。
1.8统计学分析
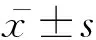
2 结 果
2.1WARCP对小鼠生长状况的影响
WARCP与IVV共免疫后,各组小鼠体重增长无显著差异 (P>0.05),见表2。表明以WARCP为IVV的佐剂对小鼠机体刺激性较小,对小鼠的生长并无显著影响。
2.2WARCP对IVV诱导小鼠IgG抗体滴度的影响
用间接ELISA法检测小鼠初免后不同时期血清中IgG的抗体滴度,结果如图1。随着免疫后时间的增加,各组抗体滴度水平也逐渐增加;随着流感单独免疫组IVV剂量的增加,低、中、高剂量组的IgG抗体滴度也逐渐增加;在加入了WARCP300 μg后,流感低剂量、中剂量组的抗体滴度均显著提高。其中,初免后14 d,低剂量IVV 0.05 μg+WARCP 300 μg与IVV 0.05 μg相比增加了2.5倍,其滴度比高剂量IVV单独免疫组还高。中剂量IVV 0.1 μg+WARCP 300 μg与IVV 0.1 μg相比增加了近1.7倍,其滴度与铝佐剂组相当。但高剂量IVV组加入WARCP300 μg后没有显著提高。
g
各组小鼠免疫后相同时间的体重无统计学差异(P>0.05)
No statistical difference between groups at the same time (P>0.05)
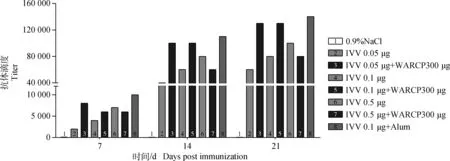
图1 间接ELISA检测初免后不同时期小鼠血清中IgG的抗体滴度Fig.1 Detection of IgG titer in serum of different times after immunization by indirect ELISA
比较小鼠肌肉免疫和皮下免疫后14 d的血清中IgG的抗体滴度,结果如图2,肌肉免疫的IVV单独免疫组IVV0.05 μg、IVV 0.1 μg的抗体滴度均比皮下免疫后的高至少2倍;WARCP300 μg与IVV0.05 μg、IVV 0.1 μg配伍后,两种免疫方式各组IgG抗体滴度均比IVV单独免疫组有显著增高,肌肉免疫后的滴度比皮下免疫后的高至少2倍。
2.3WARCP对IVV诱导小鼠抗体亚类的影响
用间接ELISA法检测小鼠初免后14 d血清中抗体亚类IgG1和IgG2a的水平,结果如图3,WARCP 300 μg和低、中剂量IVV0.05 μg、IVV0.1 μg配伍后的血清IgG1和IgG2a抗体水平均显著高于低、中剂量的IVV单独免疫组(P<0.05),其中,中剂量IVV 0.1 μg+WARCP 300 μg与对照组IVV 0.1 μg+Alum相比无显著差异(P>0.05);各
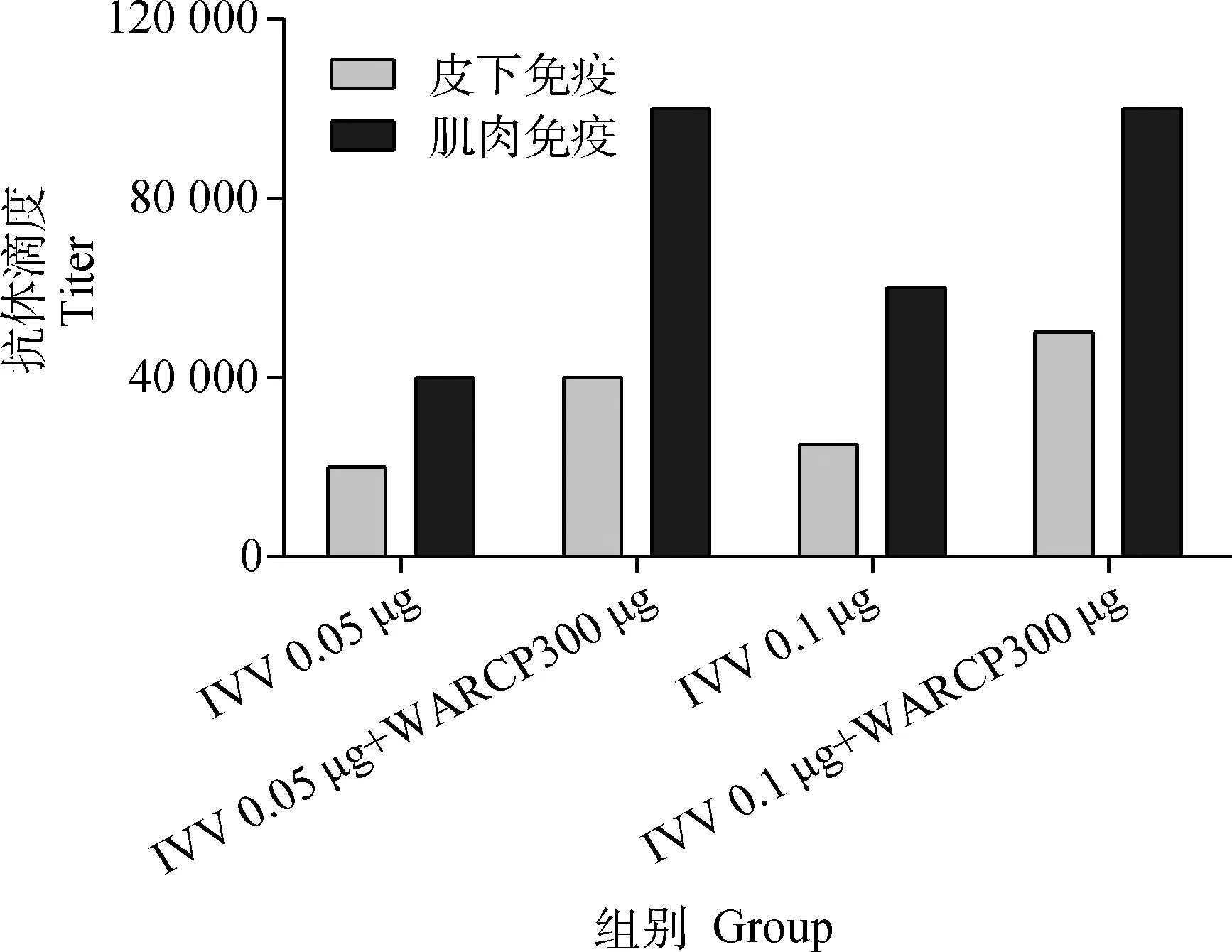
图2 间接ELISA检测不同免疫途径初免后14 d小鼠血清中IgG的抗体滴度Fig.2 Detection of IgG titer in serum of 14 d after immunization from different immune pathway by indirect ELISA
免疫组IgG1的抗体水平均高于IgG2a的抗体水平。但高剂量IVV组加入WARCP300 μg后的血清IgG1和IgG2a抗体水平均没有显著提高。
2.4WARCP对IVV诱导小鼠淋巴细胞增殖的影响
MTT法检测初免后21 d各组小鼠淋巴细胞的增殖情况,加入浓度为3.5 μg·mL-1的ConA和5 μg·mL-1的LPS刺激物后各组的刺激指数如图4:随着IVV 0.05 μg、IVV 0.1 μg、 IVV 0.5 μg剂量的不断增加,其刺激指数也不断升高。ConA和LPS诱导WARCP 300 μg配伍的IVV 低剂量、中剂量组淋巴细胞的增殖活性显著升高 (P<0.05),高剂量组无显著差异(P>0.05)。此外,中剂量IVV 0.1 μg + WARCP 300 μg与铝佐剂组相比无显著差异(P>0.05)。

与IVV单独免疫组相比较,*.P<0.05,**.P<0.01 Compared with IVV immunization group,*.P<0.05;**.P<0.01 图3 间接ELISA检测初免后14 d小鼠血清中抗体分型的水平Fig.3 Detection of antibody subclasses in serum by indirect ELISA in 14 d after first immunization
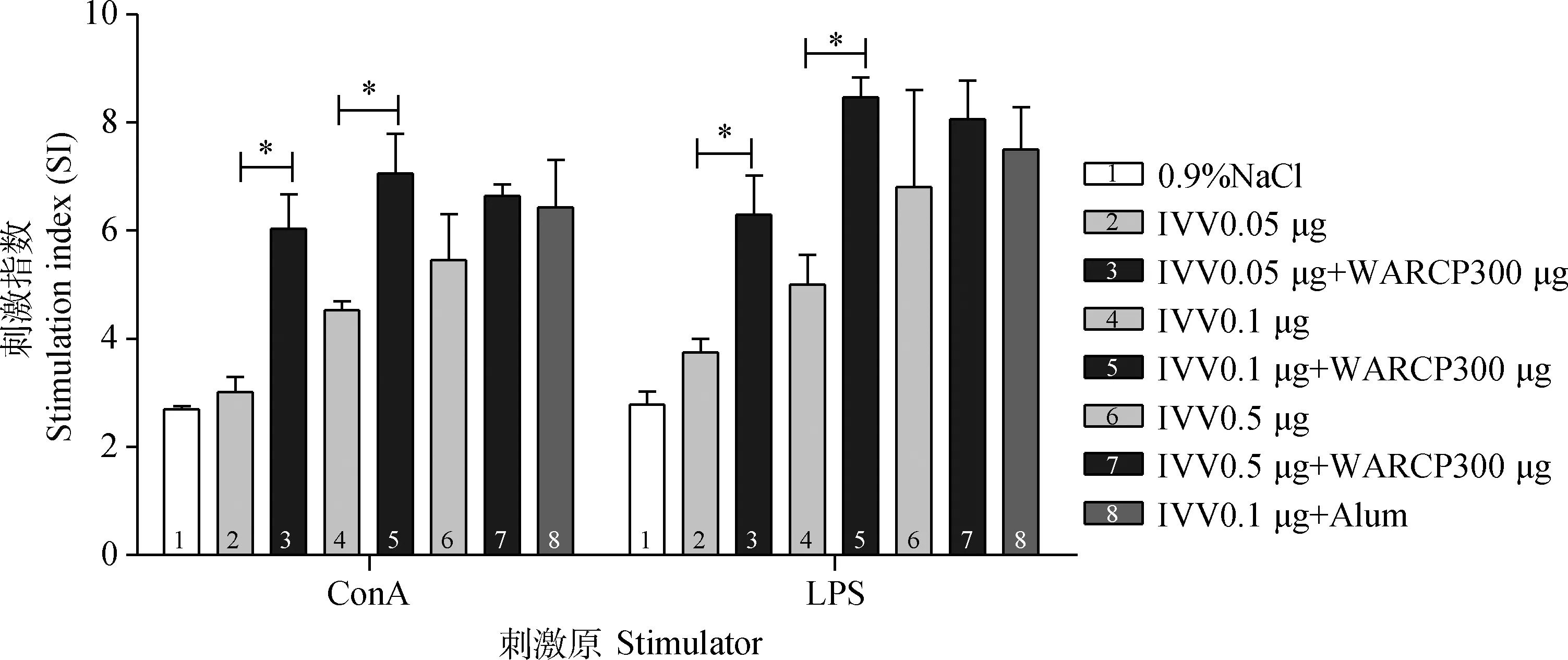
与IVV单独免疫组相比较,*.P<0.05,**.P<0.01Compared with IVV immunization group,*.P<0.05;**.P<0.01图4 MTT法检测初免后21 d小鼠脾中淋巴细胞的增殖Fig.4 Detection of splenocyte proliferation by MTT in 21 d after first immunization
2.5流式细胞术检测CD4+IL-4、CD8+IFN-γ的水平
流式细胞术检测初免后21 d各组小鼠的CD4+IL-4、CD8+IFN-γ的表达水平,结果如图5:随着单独免疫IVV 0.05 μg、IVV 0.1 μg、IVV 0.5 μg剂量的不断增加,CD4+IL-4、CD8+IFN-γ分泌水平也不断升高。WARCP 300 μg配伍的低剂量、中剂量组的CD4+IL-4、CD8+IFN-γ分泌水平显著高于低剂量、中剂量IVV单独免疫组(P<0.05),WARCP 300 μg配伍高剂量IVV组无显著差异(P>0.05)。中剂量IVV 0.1 μg+WARCP 300 μg与对照组IVV 0.1 μg+Alum相比CD4+IL-4、CD8+IFN-γ的分泌水平无显著差异(P>0.05)。
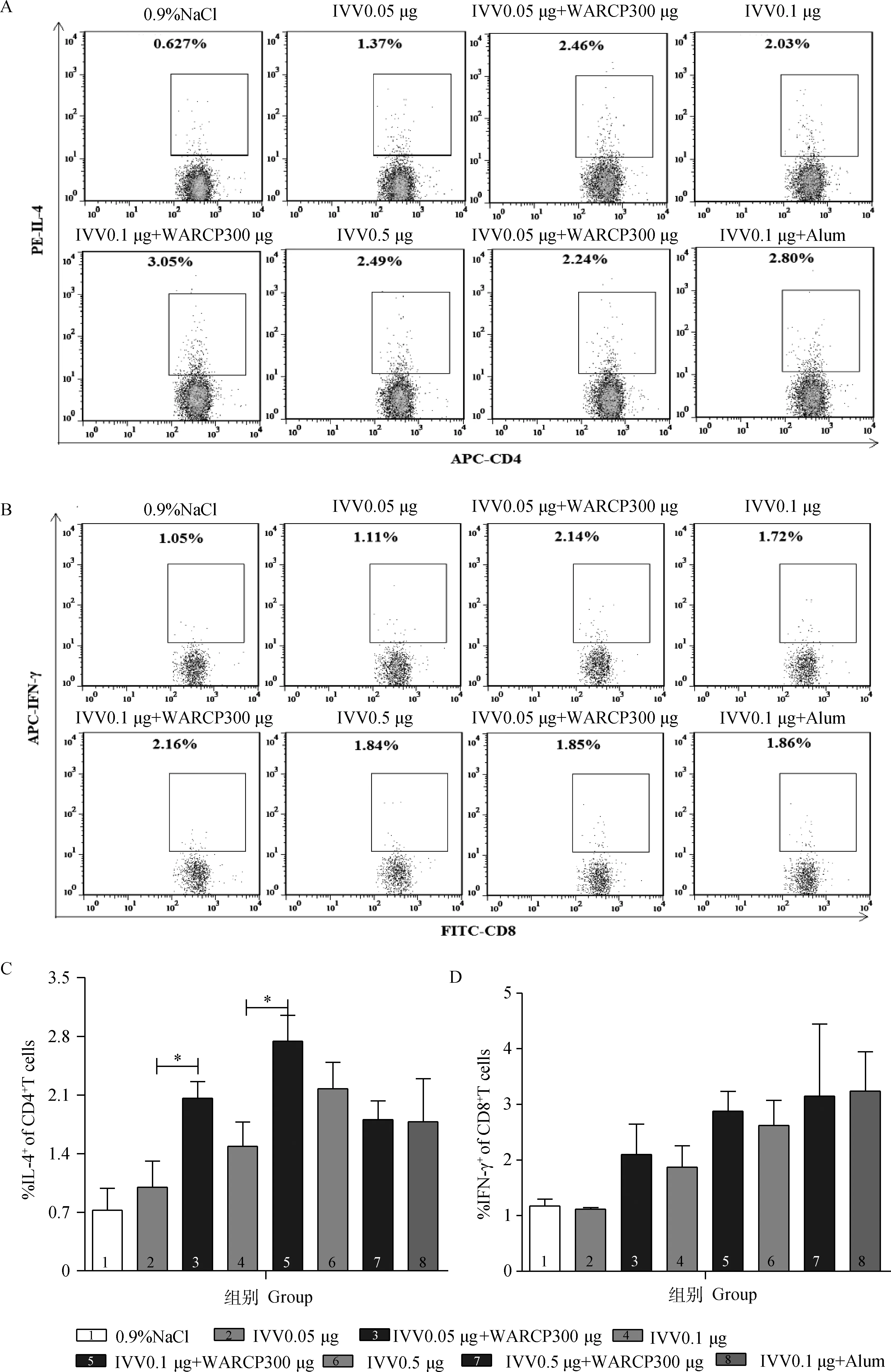
与IVV单独免疫组相比较,*.P<0.05,**.P<0.01Compared with IVV immunization group,*.P<0.05;**.P<0.01图5 WARCP对流感疫苗免疫后小鼠脾分泌CD4+IL-4、CD8+IFN-γ水平的影响Fig.5 The secretion level of CD4+IL-4,CD8+IFN-γ in the spleen of mice immunized with IVV mixed WARCP
2.6流式细胞术检测CD4+CD25+Foxp3+Treg细胞的表达
为了检测免疫后各组小鼠调节性T细胞的表达水平,用流式细胞术检测CD4+CD25+Foxp3+Treg细胞的表达,结果如图6:随着单独免疫组IVV0.05 μg、IVV 0.1 μg、IVV 0.5 μg剂量的不断增加,CD4+CD25+Foxp3+表达水平也不断降低。WARCP 300 μg配伍IVV低剂量、中剂量组的CD4+CD25+Foxp3+表达水平显著低于IVV低剂量、中剂量单独免疫组(P<0.05),WARCP 300 μg配伍IVV高剂量组无显著差异(P>0.05)。中剂量IVV 0.1 μg+WARCP 300 μg与对照组Alum相比CD4+CD25+Foxp3+表达水平无显著差异(P>0.05)。
与IVV单独免疫组相比较,*.P<0.05,**.P<0.01Compared with IVV immunization group,*.P<0.05;**.P<0.01图6 WARCP对流感疫苗免疫后小鼠CD4+CD25+Foxp3+Treg细胞百分比的影响Fig.6 The percentage of CD4+CD25+Foxp3+Treg cell in the spleen of mice immunized with IVV mixed WARCP
3 讨 论
随着现代分离技术的发展,越来越多的中草药组分被鉴定和分离出来,其中包括多糖、皂素、酚类化合物及类黄酮等,这些组分作为佐剂能促进激活抗原递呈细胞,促进细胞因子的合成,增强抗肿瘤和抗感染的免疫反应[17]。尤其是补益类中药的有效成分,能影响机体的免疫功能,很有希望开发成为新型疫苗佐剂。现代药理学研究表明,多糖类作为佐剂不仅可以通过激活T、B淋巴细胞等免疫细胞对机体的免疫系统进行调节,还可以通过激活补体,促进干扰素生成,诱生细胞因子等方式得以实现[18]。本研究旨在探讨WARCP作为IVV的佐剂,加强IVV的免疫效果和节约IVV抗原用量的作用。将一定剂量的WARCP与不同剂量的IVV配伍后免疫小鼠作为试验组,以不同剂量IVV单独免疫小鼠为无佐剂对照组,铝佐剂组作为阳性对照组,肌肉途径进行免疫,检测WARCP与IVV配伍后对小鼠免疫应答的增强效果。
研究发现,WARCP配伍IVV肌肉途径免疫小鼠后,各组小鼠体重均没有显著差异,也没有明显的过敏反应,表明WARCP并未对小鼠的生长状况产生影响,WARCP具有一定的安全性。合适的抗原剂量与合适多糖剂量配伍才会起到理想的免疫效果。IgG是血清免疫球蛋白的主要成分,其含量高低可以反映机体的防御能力[19]。抗体IgG滴度结果表明,WARCP可以显著提高IVV诱导产生的IgG抗体滴度,IVV低剂量组加入WARCP后与IVV高剂量单独组相比可减少抗原用量91%,WARCP显著增强了IVV激起的体液免疫应答水平,并节约抗原的用量,这表明通过本试验确定了合适的抗原剂量与多糖的剂量配伍,因此起到了很好的免疫增强效果[20-21]。为了比较不同的免疫途径对小鼠抗体水平的影响,对初免后14 d的IgG滴度进行了比较,结果发现肌肉途径免疫后各组的抗体滴度水平均比皮下免疫高至少2倍,说明肌肉免疫途径效果优于皮下免疫。
在小鼠体内,IgG1是依赖Th2途径免疫应答的特征性标志,而IgG2a是依赖Th1途径免疫应答的特征性标志[22]。初免后14 d小鼠血清抗体亚类IgG1和IgG2a的结果表明:WARCP配伍低、中、高剂量的IVV后均能同时提高流感低、中剂量IVV的IgG1和IgG2a的水平,说明WARCP作为IVV的佐剂能够同时促进Th1和Th2免疫反应,尤其可以提高Th1型的免疫反应。
淋巴细胞转化能力的高低可反映机体的免疫功能状态,常用淋巴细胞增殖指数反应机体细胞免疫能力[19]。本研究结果表明WARCP能显著性地提高ConA诱导的T淋巴细胞增殖和LPS诱导的B淋巴细胞增殖,WARCP与低剂量IVV配伍组的刺激指数和高剂量IVV单独免疫组无统计学差异,说明WARCP能够显著提高流感疫苗的细胞免疫水平。
在免疫应答识别和激活阶段,有多种细胞因子可刺激免疫活性细胞的增殖,IFN-γ主要由活化的T细胞和NK细胞产生,还可以激活CTL[18]。IL-4主要产生于活化T细胞和肥大细胞中,它可以刺激B淋巴细胞的增殖。本试验通过流式细胞术检测CD4+IL-4、CD8+IFN-γ的表达水平,结果发现,WARCP均能显著提高低、中剂量IVV的IL-4和IFN-γ表达水平,表明WARCP与IVV配伍后可以产生强烈的体液免疫和细胞免疫应答。
Foxp3对CD4+CD25+Treg细胞的发展和功能是至关重要的,起到免疫抑制的调节作用[23]。有研究发现川牛膝多糖作为佐剂通过抑制CD4+CD25+Foxp3+的表达来增强体液和细胞免疫反应[24]。本研究发现WARCP作为低、中剂量IVV的佐剂能显著降低CD4+CD25+Foxp3+Treg细胞的表达。这些结果表明,WARCP能够通过抑制Treg细胞的表达来增强免疫应答。
综上所述,新疆野生一枝蒿粗多糖通过肌肉途径免疫后可以增强特异性的体液免疫和细胞免疫反应,效果优于皮下免疫途径,尤其是激发了Th1型免疫反应并抑制了Treg细胞的表达,可以节约抗原用量91%。因此,新疆野生一枝蒿粗多糖可以为流感病毒疫苗新型免疫佐剂的研制及用于解决流感大暴发时流感疫苗供应短缺问题提供重要的研究参考。
[1]TETSUTANI K,ISHII K J.Adjuvants in influenza vaccines[J].Vaccine,2012,30(52):7658-7661.
[2]KHURANA S,VERMA N,YEWDELL J W,et al.MF59 adjuvant enhances diversity and affinity of antibody-mediated immune response to pandemic influenza vaccines[J].SciTranslMed,2011,3 (85):85-88.
[3]WALKER W T,FAUST S N.Monovalent inactivated split-virion AS03-adjuvanted pandemic influenza A (H1N1) vaccine[J].ExpertRevVaccines,2010,9(12):1385-1398.
[4]LV X H,LIU W,LI Z L,et al.Research progress on Chinese traditional medicine as vaccine adjuvants[J].JTraditChinMed,2008,6(2):64-67.
[5]LI J Y,LI J Y,ZHANG F C.The immunoregulatory effects of Chinese herbal medicine on the maturation and function of dendritic cells[J].JEthnopharmacol,2015,171(2):184-195.
[6]张宝柱.补益类中药所含多糖成分的免疫调节作用研究进展[J].中国中医药资讯,2011,3(9):41-42.
ZHANG B Z.Research progress on immunomodulatory effects of Chinese Herbal Polysaccharides composition[J].JournalofChinaTraditionalChineseMedicineInformation,2011,3(9):41-42.(in Chinese)
[7]CHEN H,JIAO H,CHENG Y,et al.Invitroandinvivoimmunomodulatory activity of Okra (AbelmoschusesculentusL.) polysaccharides[J].JMedFood,2016,19(3):253-265.
[8]ZHU F J,LIU X SUN Z H,et al.Immune-enhancing effects of taishan pinus massoniana pollen polysaccharides on DNA vaccine expressingBordetellaaviumompA[J].FrontMicrobiol,2016,66(7):1-8.
[9]董娜,李倩,张贵强,等.淫羊藿多糖对甲型H1N1流感病毒裂解疫苗的免疫佐剂作用[J].国际药学研究杂志,2013,40(1):63-68.
DONG N,LI Q,ZHANG G Q,et al.Adjuvant effect of Epimedium polysaccharide for H1N1 influenza viruses split vaccine[J].JournalofInternationalPharmaceuticalResearch,2013,40(1):63-68.(in Chinese)
[10]谢国秀,王芙艳,杨忠东,等.茯苓多糖对流感灭活疫苗的免疫增强作用[J].生命科学研究,2009,13(3):246-250.
XIE G X,WANG F Y,YANG Z D,et al.Enhanced immune effects of pachymaran on inactivated influenza virus vaccine[J].LifeScienceResearch,2009,13(3):246-250.(in Chinese)
[11]YI Y,ZHANG M W,LIAO S T,et al.Structural features and immunomodulatory activities of polysaccharides of longan pulp[J].CarbohydPolym,2012,87(1):636-643.
[12]GU D Y,ABDULLA R,AISA H A,et al.Characterization and identification of chemical compositions in the extract ofArtemisiarupestrisL.by liquid chromatography coupled to quadrupole time-of-flight tandem mass spectrometry[J].RapidCommunMassSp,2012,26(2):83-100.
[13]王丹阳,杨雨,张爱莲,等.新疆野生一枝蒿粗多糖作为流感病毒疫苗佐剂的免疫效果[J].中华微生物学与免疫学杂志,2016,36(6):230-234.
WANG D Y,YANG Y,ZHANG A L,et al.Efficacy of using Xinjiang wildArtemisiarupestrisL.crude polysaccharides as a immunologic adjuvant for influenza virus vaccine[J].ChineseJournalofMicrobiologyandImmunology,2016,36(6):230-234.(in Chinese)
[14]王如涛,吴绵斌,林建平,等.植物多糖分离提取技术的研究进展[J].中国生物工程志,2013,33(7):118-123.
WANG R T,WU M B,LIN J P,et al.Research progress on the extraction technology of plant polysaccharide[J].ChinaBiotechnology,2013,33(7):118-123.(in Chinese)
[15]刘玉佳,孔繁东,刘兆芳,等.桔梗多糖Sevag法除蛋白工艺的研究[J].中国调味品,2014,39(4):5-7.
LIU Y J,KONG F D,LIU Z F,et al.Research on technology of deproteinization from polysaccharide of platycodon grandiflorum by Sevag method[J].ChinaCondiment,2014,39(4):5-7.(in Chinese)
[16]DUBOIS M,GILLES K,HAMILTON J K,et al.A colorimetric method for the determination of sugars[J].Nature,1951,168(4265):167.
[17]LAI C Y,HUNG J T,LIN H H,et al.Immunomodulatory and adjuvant activities of a polysaccharide extract of Ganoderma luciduminvivoandinvitro[J].Vaccine,2010,28(31):4945-4954.
[18]JIANG M H,ZHU L,JIANG J G.Immunoregulatory actions of polysaccharides from Chinese herbal medicine[J].ExpertOpinTherTar,2010,14(12):1367-1402.
[19]董耀泽,李晓云,张晋强,等.复方中药对猪嗜血支原体感染预防作用的研究[J].畜牧兽医学报,2016,47(2):404-410.
DONG Y Z,LI X Y,ZHANG J Q,et al.Prophylactic effect of compound Chinese herbal medicine onMycoplasmasuisinfection[J].ActaVeterinariaetZootechnicaSinica,2016,47(2):404-410.(in Chinese)
[20]RUPP R,LUCKASEN G J,KIRSTEIN J L,et al.Safety and immunogenicity of different doses and schedules of a live attenuated tetravalent dengue vaccine (TDV) in healthy adults:A Phase 1b randomized study[J].Vaccine,2015,33(46):6351-6359.
[21]HONDA Y,SAADE F,PETROVSKY N.AdvaxTM,a polysaccharide adjuvant derived from delta inulin,provides improved influenza vaccine protection through broad-based enhancement of adaptive immune responses[J].Vaccine,2012,30(36):5373-5381.
[22]HUBER V C,MCKEON R M,BRACKIN M N,et al.Distinct contributions of vaccine induced immunoglobulin G1(IgG1) and IgG2aantibodies to protective immunity against influenza[J].ClinVaccineImmunol,2006,13(9):981-990.
[23]ZARAGOZA B,CHEN X,OPPENHEIM J J,et al.Suppressive activity of human regulatory T cells is maintained in the presence of TNF[J].NatMed,2016,22(1):16-17.
[24]FENG H,FAN J,DU X,et al.Sulfated Radix Cyathulae officinalis polysaccharides act as adjuvant via promoting the dendritic cell maturation and suppressing Treg frequency[J].ImmunolInvest,2015,44(3):288-308.
(编辑白永平)
The Analysis of Immune Enhancement Effect of Xinjiang WildArtemisiarupestrisL.Crude Polysaccharides on Influenza Viruses Vaccines in Mice
ZHANG Ai-lian*,WANG Dan-yang,ZHAO Shu-shu,ZHAO Bing,ZHANG Fu-chun
(XinjiangKeyLaboratoryofBiologicalResourcesandGeneticEngineering,CollegeofLifeScienceandTechnology,XinjiangUniversity,Urumqi830046,China)
The immune effects of Xinjiang WildArtemisiarupestrisL.crude polysaccharides (WARCP) as an adjuvant and sparing antigen on different doses of influenza virus vaccine (IVV) were explored.ICR mice were intramuscularly immunized respectively with different doses (0.05,0.1,0.5 μg) of the IVV alone or co-administered with 300 μg WARCP at 0 d and 14 d.The growth state of mice were observed,antibody level of IgG and IgG1,IgG2ain serum were tested by ELISA;splenocyte proliferations were tested by MTT;The expression levels of CD4+IL-4,CD8+IFN-γ and CD4+CD25+Foxp3+Treg cells were tested by flow cytometry.The results showed that no significant differences in the body weight were observed between mice from different groups (P>0.05);WARCP can significantly improve the antibody level of influenza-specific IgG and IgG1,IgG2a(P<0.05);WARCP can significantly promote lymphocyte proliferation,the secretion level of IL-4 and IFN-γ (P<0.05),and significantly reduce the level of expression of Treg cells (P<0.05);In particularly,it can enhance the humoral and cellular immunity responses of low-dose IVV,indicating an at least 91% reduction in vaccine dosage by adding WARCP as adjuvant.These results indicated that adding WARCP to IVV enhanced the immune efficacy of IVV by reducing the level of Treg cells,significantly promote Th1-type immune response particularly,it can be an adjuvant with the advantages of high safety and dose-sparing.
influenza virus vaccine;ArtemisiarupestrisL.;polysaccharides;antigen sparing;intramuscle immunity
10.11843/j.issn.0366-6964.2016.10.018
2016-05-16
自治区自然科学基金(201404061219)
张爱莲(1968-),女,山东东明人,副教授,博士,主要从事疫苗佐剂方面的研究,Tel:0991-5523400
张爱莲,副教授,E-mail:xjzal@163.com
S852.52
A
0366-6964(2016)10-2089-09
