一种新型火鸡疱疹病毒细菌人工染色体的构建与鉴定
2016-11-08王志胜许梦微乔永峰侯继波王继春
王志胜,刘 芳,许梦微,乔永峰,侯继波,王继春*
(1.江苏省农业科学院/ 国家兽用生物制品工程技术研究中心,南京 210014;2.南京农业大学动物医学院,南京 210095;3.江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
一种新型火鸡疱疹病毒细菌人工染色体的构建与鉴定
王志胜1,3,刘芳1,2,许梦微1,2,乔永峰1,3,侯继波1,3,王继春1,3*
(1.江苏省农业科学院/ 国家兽用生物制品工程技术研究中心,南京 210014;2.南京农业大学动物医学院,南京 210095;3.江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
拟构建一种新型火鸡疱疹病毒(HVT)全基因组细菌人工染色体(BAC),通过同源重组方法将mini-F载体插入HVT基因组的糖蛋白C(glycoprotein C,gC)基因的等位位点得到mini-F重组HVT,提取重组病毒的DNA转入大肠杆菌DH10B细胞,再转入GS1783细胞获得BAC,拯救病毒获得mini-F重组病毒和gC恢复病毒后,与亲本病毒(HVT FC126)比较生长动力学和对鸡马立克病的免疫效力。结果:获得数个BAC阳性克隆,取其中一个克隆(BACHVT-G)成功拯救出HVT mini-F重组病毒(HVTBAC-ΔgC),并成功获得了gC恢复毒株(HVTBAC-gC-R)。生长特性和免疫效力试验表明HVTBAC-gC-R与HVT FC126无显著差异,而HVTBAC-ΔgC增殖能力和免疫效力均明显下降。成功构建了HVT全基因组的感染性BAC;HVT的gC基因是一个非必需基因,但对病毒的增殖能力和免疫效力有重要影响。
火鸡疱疹病毒;细菌人工染色体;糖蛋白C;生长动力学;免疫效力
火鸡疱疹病毒(herpesvirus of turkey,HVT)属于甲型疱疹病毒亚科马立克病毒属,研究发现,在遗传学和血清学上,HVT与马立克病病毒(Marek’s disease virus,MDV)具有相关性[1],且HVT对鸡不致病,HVT FC126株被广泛用于预防鸡的马立克病(Marek’s disease,MD)[2]。
HVT 病毒颗粒大小约为160 nm,核衣壳呈二十面体,HVT基因组为双链 DNA,大小约为158 kb (GenBank:AF291866)[3]。HVT基因组大,有许多非必需基因和非编码区,能够容纳大片段外源基因序列的插入;HVT对鸡极为安全,不产生任何副反应;可以进行胚内接种或1日龄早期接种免疫;不但能避免母源抗体的干扰而且启动免疫快;病毒接种鸡后可以持续长达72周的病毒血症[4-5],因此,HVT是一种较理想的鸡用活疫苗载体。目前,国外已成功应用HVT构建了多种病毒载体活疫苗,其中包括表达鸡新城疫病毒(Newcastle disease,NDV)F抗原的HVT载体活疫苗,如Innovax®-ND-SB (MSD Animal Health)和Vectormune®HVT-NDV (Ceva),还有表达鸡传染性法氏囊病病毒(infectious bursal disease virus,IBDV)VP2抗原的HVT载体活疫苗,如 Vaxxitek®HVT+IBD (Merial) 和 Vectormune®HVT-IBD (Ceva)等,展现了HVT作为活疫苗载体的优良效果[6-12]。
构建疱疹病毒重组载体活疫苗的常用方法有同源重组或黏粒再生[13-14],筛选方法通常是通过LacZ 或GFP标记等[15]。然而,HVT基因组大,又具有较强的细胞结合性,使其在真核细胞中同源重组时转染效率较低,且重组毒株的筛选和纯化困难重重,通常难于获得完全纯化的重组病毒,严重影响重组活载体疫苗的构建。黏粒再生是将病毒基因组分成几个片段分别克隆后再通过共转染进行病毒拯救,虽然可以在原核系统中进行基因改造,但操作过程繁琐,病毒拯救效率低[13]。疱疹病毒的细菌人工染色体(bacterial artificial chromosome,BAC)及“enpassant”重组技术是近年来发展起来的一项新技术,能大大提高构建重组疱疹病毒的效率[16-18]。疱疹病毒BAC是将mini-F序列通过同源重组插入病毒基因组的非功能区或者非必需基因,再将含mini-F的重组病毒基因组导入大肠杆菌构建而成[19]。BAC可通过应用原核生物大量的基因操作工具进行基因改造,然后将重组子进行病毒拯救获得重组病毒,这项技术能大大提高对病毒进行基因工程改造的效率,而且细菌人工染色体进行单拷贝或低拷贝复制,不易发生变异[20-21]。由B.Tischer 等建立的基于Red 重组系统的“enpassant”技术与BAC 技术结合,使同源重组直接由载体菌(E.coliGS1783)表达的Red 酶系统来完成,重组的效率得到了更大地提高[22]。目前已在马立克病病毒和鸭瘟病毒等多个动物疱疹病毒株成功构建了BAC,大大加快了对相关病毒致病机制研究和活载体疫苗构建的步伐[21,23-25]。
已报道的HVT BAC的构建是将mini-F序列插入HVT基因组的US2区,虽然获得了具有感染性的克隆,但是mini-F重组病毒很不稳定,有些重组毒在传代后即失去增殖能力,而且从感染性克隆拯救获得的病毒的生长特性也不一致,有些病毒的增殖能力大大减弱,这些结果表明将mini-F 插入US2位点可能对HVT的正常复制有干扰作用[15,26]。本研究将mini-F 序列插入HVT基因组的gC基因位点,并替换敲除gC基因,以获得稳定的HVT BAC,为HVT活载体疫苗的构建和改进提供可靠的技术平台。
1 材料与方法
1.1材料
1.1.1质粒与细菌Mini-F质粒和GS1783菌株由柏林自由大学病毒研究所Nikolaus Osterriender教授惠赠,GS1783菌株的感受态细胞由本室自制。DH10B感受态细胞购自Invitrogen公司。Plasmid Mini Kit 和 Midi Kit购自 QIAGEN 公司。
1.1.2病毒与细胞HVT FC126病毒株来自中国兽医药品监察所(CVCC AV19),制备鸡胚成纤维细胞的SPF鸡胚购自北京梅里亚维通实验动物技术有限公司。马立克病病毒京-1株强毒株(CVCC AV86)来自中国兽医药品监察所,系由本室扩繁的全血病毒,液氮保存。
1.1.3生化试剂等限制性内切酶EcoRⅠ、Hind Ⅲ、SmaⅠ、ScaⅠ、BamHⅠ和PacⅠ及 ExTaqDNA 聚合酶均购自TaKaRa公司;DMEM培养基、胰酶及新生牛血清购自Sigma 公司;其他试剂均购自南京生工生物有限公司。
1.1.4实验动物SPF鸡是用购自北京梅里亚维通实验动物技术有限公司的SPF鸡胚在本单位孵化而得,试验鸡饲养于隔离环境中。
1.1.5PCR引物根据HVT FC126 株全长基因组序列(GenBank:AF291866),应用Vector NTI软件设计gC基因上、下游同源臂扩增的PCR引物和扩增含gC基因片段序列的PCR引物(表1),由南京金斯瑞生物科技有限公司合成。
表1PCR引物
Table 1PCR primers
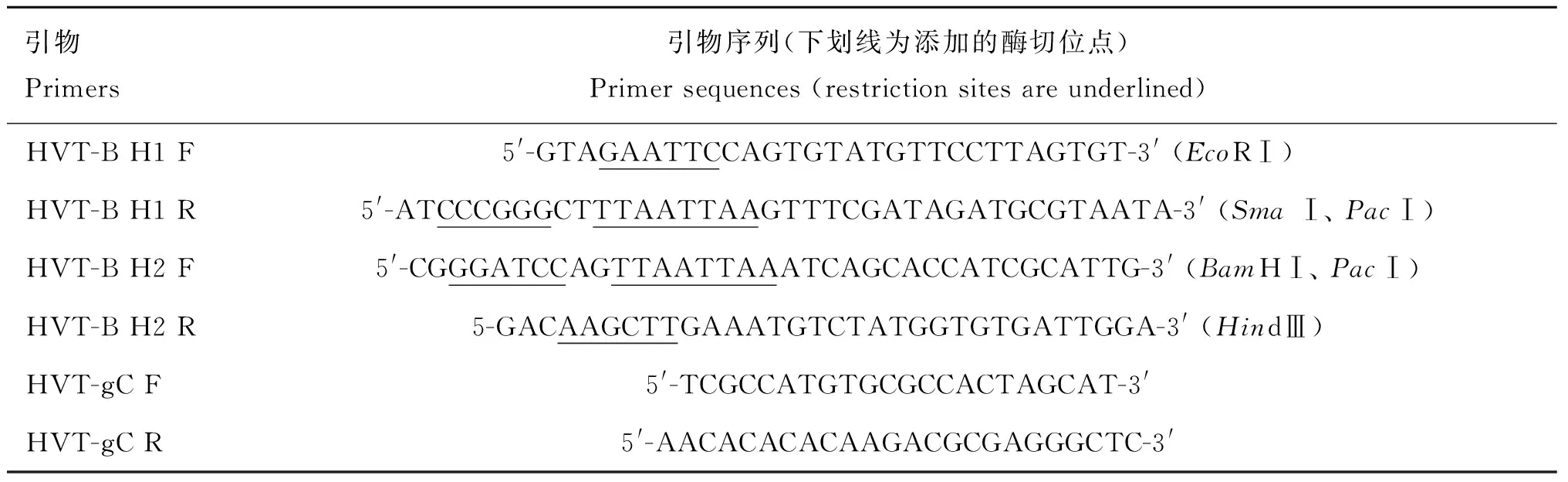
引物Primers引物序列(下划线为添加的酶切位点)Primersequences(restrictionsitesareunderlined)HVT-BH1F5'-GTAGAATTCCAGTGTATGTTCCTTAGTGT-3'(EcoRⅠ)HVT-BH1R5'-ATCCCGGGCTTTAATTAAGTTTCGATAGATGCGTAATA-3'(SmaⅠ、PacⅠ)HVT-BH2F5'-CGGGATCCAGTTAATTAAATCAGCACCATCGCATTG-3'(BamHⅠ、PacⅠ)HVT-BH2R5-GACAAGCTTGAAATGTCTATGGTGTGATTGGA-3'(HindⅢ)HVT-gCF5'-TCGCCATGTGCGCCACTAGCAT-3'HVT-gCR5'-AACACACACAAGACGCGAGGGCTC-3'
1.2方法
1.2.1转移载体pUC19(HVT)-H1-H2-miniF的构建及酶切验证参照文献所述方法[21],提取HVT FC126基因组DNA作为模板,应用特异性引物(表1),通过PCR反应扩增gC基因的上游同源臂H1和下游同源臂H2,再通过酶切连接将H1和H2先后连接到基础载体质粒pUC19上获得pUC19(HVT)-H1-H2;然后,再将mini-F酶切插入到pUC19(HVT)-H1-H2同源臂H1和H2之间的PacⅠ酶切位点处,获得gC位点的转移载体pUC19(HVT)-H1-H2-miniF。连接好的载体通过应用ScaⅠ和EcoRⅠ进行酶切鉴定,应用Vector NTI软件预测酶切后的片段应分别为10 165与3 775 bp大小的2条和7 507、5 095与1 338 bp的3条条带(图1A)。
1.2.2转移载体pUC19(HVT)-H1-H2-miniF和HVT DNA共转染CEF根据文献描述的方法[21],首先提取感染HVT后48~72 h细胞中病毒的DNA,取约1 μg HVT DNA与5~10 μg转移载体质粒pUC19(HVT)-H1-H2-miniF的DNA采用磷酸钙沉淀法共转染原代鸡胚成纤维细胞(chicken embryo fibroblast,CEF)。转染细胞传代培养,在波长为488 nm紫外光下观察,当出现发出绿色荧光的细胞病变蚀斑时,挑取绿色蚀斑传到新鲜制备的单层CEF上培养扩增重组病毒。
1.2.3Mini-F重组病毒HVT与亲本病毒HVT的分离与纯化Mini-F重组HVT经连续数次挑取绿斑再接种于6孔板CEF内纯化和扩繁后,收集6孔板内的细胞毒采取超声波裂解进行细胞破碎,破碎细胞病毒液10倍倍比稀释接种96孔新鲜制备的CEF平板上,筛选单孔出现单个绿斑的重组病毒,经再次接入CEF进行扩繁,同时加GPT进行加压培养,即接入前1 h细胞培养液换成GPT加压筛选培养液(含10%血清、1% S/P,350 μg·mL-1霉酚酸、80 μg·mL-1黄嘌呤和100 μg·mL-1次黄嘌呤的DMEM),每24 h换一次加压筛选培养液,以获得纯化的mini-F重组HVT。
1.2.4mini-F重组HVT DNA的转化及其筛选验证根据文献描述的方法[21],提取mini-F重组HVT细胞毒DNA,取约5 μg加到50 μL电转化感受态细胞E.coliDH10B中。轻轻混匀,冰浴 5 min 左右,吸入到规格为 0.1 cm经预冷的电转化杯中,应用美国哈佛仪器公司 ECM630 电转仪,电转化条件为 1 500 V、200 Ω、25 μF,电击完成后,加入到32 ℃预热的SOC培养基中,32 ℃、220 r· min-1振荡活化1 h,500 g 离心5 min,取细菌沉淀用150 μL LB重悬后均匀涂布于含30 μg·mL-1氯霉素的LB琼脂平板上,32 ℃培养48 h 以上。然后,挑取阳性BAC克隆单菌落接种于含有 30 μg·mL-1氯霉素的LB培养液中,32 ℃振荡培养过夜,提取DNA,应用限制性内切酶EcoRⅠ和BamHⅠ进行RFLP鉴定,将酶切图谱与应用Invitrogen软件预测的HVT FC126株的图谱进行对比分析。经鉴定正确后,再以上述相同方法将DNA通过电转化导入自制的E.coliGS1783中,再次挑取阳性BAC克隆后,采用Qiagen plasmid Midi Kit提取BAC质粒DNA后进行RFLP鉴定。
1.2.5HVT BAC的病毒拯救和gC恢复毒株的获得HVT BAC的病毒拯救参照文献方法进行[21],采用Qiagen plasmid Midi kit 按照说明书提取HVT BAC的 DNA,取约500 ng DNA按上述相同的磷酸钙沉淀法转染新鲜制备的单层CEF。次日将培养液换成含10%胎牛血清的培养液,培养48~72 h后用胰酶将细胞消化成单个细胞,传代到新鲜制备的CEF细胞平板板上,继续培养48~72 h后,在波长为488 nm紫外光激发下观察发出绿色荧光的病毒蚀斑。
gC恢复病毒的获得:应用HVT-B H1 F和HVT-B H2 R为引物,以HVT DNA为模板,PCR扩增带有上、下游同源臂和gC基因的DNA片段,取此DNA片段2~3 μg与约500 ng HVT BAC的DNA共转染CEF,转染后96 h取感染细胞接种到新鲜制备的单层 CEF上培养,24~48 h 后,用甲基纤维素培养基覆盖,观察在紫外光激发下不发出绿色荧光的病变蚀斑 (白斑),挑取白斑接种到新的CEF,如此重复多个循环直至纯化成功。提取纯化病毒 DNA为模板,用一对引物HVT-gC F和HVT-gC R(表1)进行PCR扩增,并对扩增片段进行序列测定,验证gC是否恢复成功。
1.2.6亲本毒株、BAC拯救毒株和gC恢复毒株体外生长特性的测定与比较病毒体外生长特性参照文献所述方法进行[21,26],将病毒按0.01 感染复数(multiplicity of infection,MOI)分别接种到生长24 h的单层原代CEF上培养。测定接种前和接种后6、12、24、36、48和72 h感染细胞经胰酶消化成单个细胞的病毒滴度。收集病毒时,首先去除细胞上清液,经PBS洗涤3次,用0.1%胰酶消化后再用2 mL DMEM 重悬细胞。对单个细胞的病毒滴度,取100 μL细胞悬液10倍倍比系列稀释至10-7,接种到新鲜制备的单层CEF上,培养72 h后计数蚀斑形成单位(plaque forming unit,PFU)。对细胞结合性病毒的滴度,将重悬细胞离心后,倾去上清,将沉淀用SPGA再次重悬后,经50 Hz 5 min超声裂解后接种CEF测定滴度,试验共重复3次,根据PFU计数结果绘制病毒生长曲线。
1.2.7亲本毒株、BAC拯救毒株和gC恢复毒株对MD保护性试验的比较将3种病毒分别以4 000 PFU接种1日龄SPF雏鸡20只,于接种后21 d,与对照鸡20只,腹腔注射马立克病病毒京-1株强毒株(CVCC AV86)0.2 mL,观察2个月,对病死鸡和存活鸡剖检观察病变,出现坐骨神经、臂神经丛等肿大,肝、肾、心、性腺、肺等脏器出现淋巴瘤的病理变化则判为马立克病阳性,按文献所述方法统计马立克病发病比例[15,26],比较3种病毒对MD的免疫保护效力。
2 结 果
2.1转移载体pUC19(HVT)-H1-H2-miniF的构建及其验证
通过特异性引物PCR扩增获得HVT FC126 gC上下同源臂并成功连接到pUC19载体质粒上获得pUC19(HVT)-H1-H2;然后将mini-F序列连接到pUC19(HVT)-H1-H2质粒上获得转移载体pUC19(HVT)-H1-H2-mini-F(图1A)。通过EcoR Ⅰ和ScaⅠ酶切验证符合理论预测结果(图1B)。
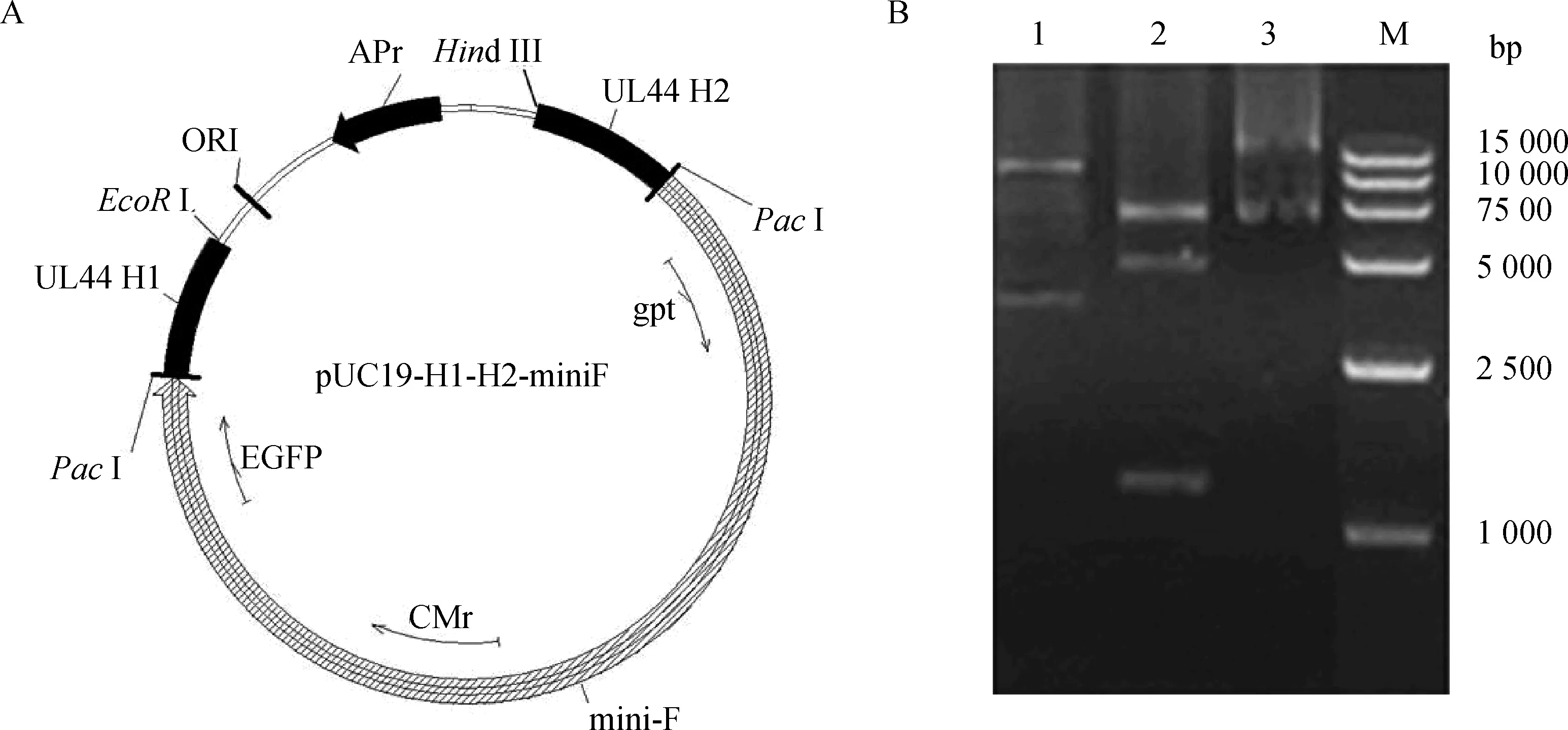
A.转移载体质粒pUC19(HVT)-H1-H2-miniF(13 940 bp)结构;B.转移载体质粒pUC19-H1-H2-miniF酶切验证图谱:其中泳道1为 限制性内切酶ScaⅠ酶切结果,条带大小分别为10 165、3 775 bp;泳道2为限制性内切酶EcoRⅠ酶切结果,条带大小分别为7 507、5 095、1 338 bp;泳道3为未酶切的pUC19(HVT)-H1-H2-miniF质粒DNA对照;M.15 000 bp DNA相对分子质量标准A.Predicted map of transferring vector pUC19(HVT)-H1-H2-miniF(13 940 bp);B.Gel map of pUC19(HVT)-H1-H2-miniF with restriction digestion:Lane 1 show fragments of 10 165 bp and 3 775 bp after digestion with ScaⅠ;Lane 2 show fragments of 7 507 bp,5 095 bp and 1 338 bp after digestion with EcoRⅠ;Lane 3 show the DNA of pUC19(HVT)-H1-H2-miniF without digestion;M.15 000 bp DNA marker图1 转移载体质粒pUC19(HVT)-H1-H2-miniF的构建与鉴定Fig.1 Construction and identification of transferring vector pUC19-H1-H2-miniF
2.2Mini-F重组HVT的获得与纯化
转移载体pUC19(HVT)-H1-H2-miniF和HVT病毒DNA共转染原代CEF后72 h盲传一代后再培养72 h后在紫外光激发下观察到发出绿色荧光的蚀斑(图2),连续2次挑取绿斑接种于6孔板CEF扩繁后,收集6孔板内的细胞毒采取超声波裂解进行细胞破碎,破碎细胞病毒液倍比稀释接种96孔新鲜制备的CEF平板上,筛选5个单孔出现单个绿斑的重组毒株,消化传代接入CEF扩繁,经过3轮GPT加压筛选后可见所有蚀斑在荧光显微镜下都发绿光,成功获得了含mini-F 的HVT重组病毒。
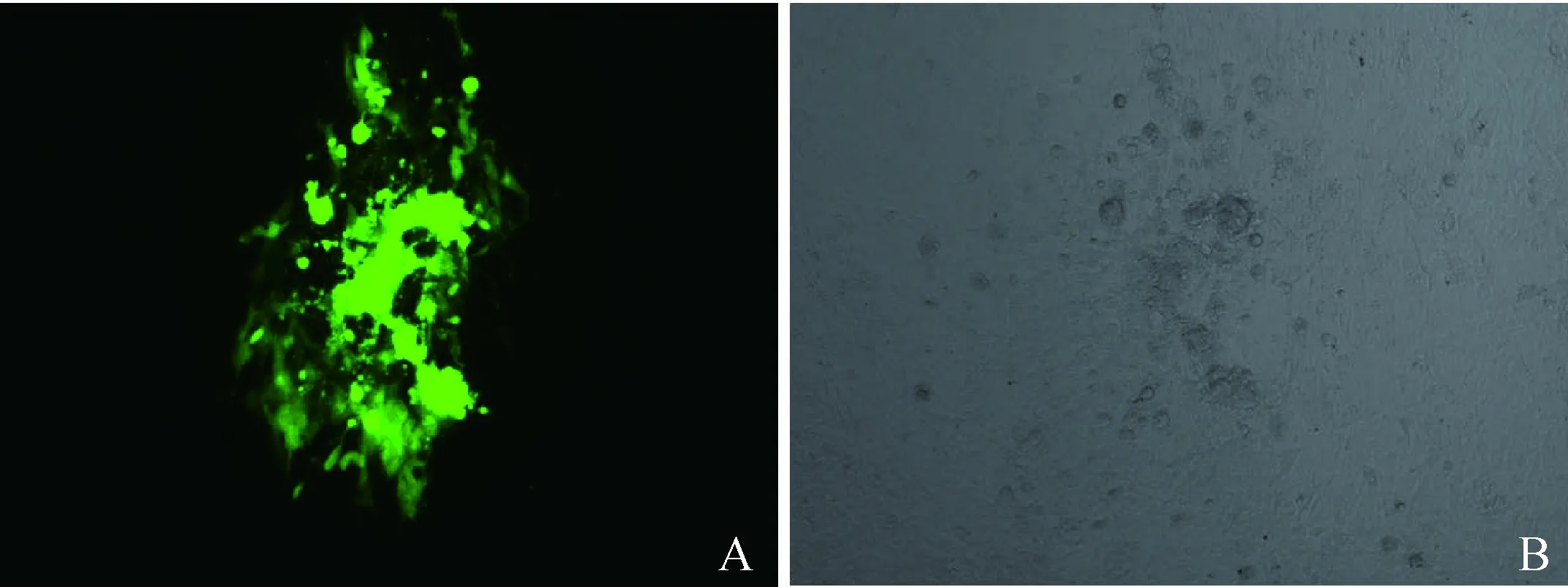
A.波长为488 nm紫外光下观察到的发出绿色荧光的病毒蚀斑;B.在白光下观察到的蚀斑A.Green plaques observed under UV excitation of 488 nm wavelength;B.Plaques of phase control图2 Mini-F重组HVT病毒蚀斑Fig.2 Plaque formation by mini-F recombinant HVT
2.3HVT BAC阳性克隆的获得与验证
取提纯的 mini-F重组HVT的DNA电转化到E.coilDH10B 感受态细胞中,获得10个克隆(C1~C10),取其中一个克隆(BACHVT-C1),用碱裂解法提取BACHVT-C1质粒DNA后用限制性内切酶EcoRⅠ和BamHⅠ酶切,进行RFLP分析,结果表明,酶切图谱是典型的BAC谱型,条带分布与软件分析结果基本吻合,但并不完全一致,这可能是由于本研究中所用HVT FC126株与参考序列毒株的来源不同,其基因组序列不完全相同所致(图3)。然后,再提取BACHVT-C1的DNA电转化自制的E.coliGS1783感受态细胞,获得了15个阳性克隆,取其中一个命名为BACHVT-G,经RFLP验证与BACHVT-C1完全一致,表明成功获得了HVT FC126株的细菌人工染色体。

图3 BACHVT-C1 DNA RFLP图谱Fig.3 RFLP map of BACHVT-C1
2.4HVT BAC的病毒拯救及gC恢复毒株的获得
将BACHVT-G的DNA转染CEF后,72 h传代一次,再培养48 h后,在波长为488 nm紫外光激发下观察到发出绿色荧光的病毒蚀斑,挑取其中一个蚀斑,进行纯化,获得了HVT BAC拯救的重组毒株,命名为HVTBAC-ΔgC。
以HVT DNA为模板,用引物HVT-B H1 F和HVT-B H2 R 进行PCR扩增,获得含有两侧同源臂和gC基因的片段,将此片段DNA与BACHVT-G的 DNA共转染到CEF,转染96 h后盲传1代,继续培养48 h后,在波长为488 nm紫外光激发下观察到不发出绿色荧光的病毒蚀斑,经数轮挑斑纯化获得一株纯化病毒,命名为HVTBAC-gC-R,分别以HVTBAC-ΔgC、HVTBAC-gC-R和HVT FC126株的DNA为模板,用一对引物(HVT-gC F和HVT-gC R)进行PCR扩增,其中HVTBAC-gC-R和HVT FC126株均扩增出1 600~1 700 bp大小的片段,而HVTBAC-gC-R未扩增出条带 (图4),所扩增出的片段经序列测定证明与HVT FC-126株gC基因序列完全一致,表明gC基因成功恢复。

图4 HVT gC片段的PCR条带Fig.4 PCR fragments of HVT gC sequences
2.5HVT FC126、HVTBAC-ΔgC和HVTBAC-gC-R生长特性的比较
测定和比较了HVT FC126、HVTBAC-ΔgC、HVTBAC-gC-R感染 CEF的多步生长动力学,结果显示HVT和HVT BACΔgCR接种 CEF后,无论是经胰酶消化成单个细胞的病毒滴度(图5A),还是经裂解的细胞结合性病毒的滴度(图5B),两株病毒的滴度都无显著差异。而gC缺失株HVTBAC-ΔgC病毒滴度明显下降,其经胰酶消化成单个细胞的病毒滴度了下降了约3倍,而经裂解的细胞结合性病毒的滴度则下降了约100倍。表明HVT的gC基因虽然不是一个必需基因,但对病毒的增殖有重要作用。
2.6HVT FC126、HVTBAC-ΔgC和HVTBAC-gC-R对MD保护效力的比较
空白对照组鸡均健康,无马立克病病变。3种HVT病毒接种1日龄雏鸡后未出现任何不良反应。攻毒后剖检病死鸡和存活鸡观察马立克病的典型病变,结果表明,攻毒对照组85%(17/20)MD阳性,HVT和HVTBAC-gC-R免疫组的MD阳性率分别为15%(3/20)和10%(2/20),MD的阳性率分别减少了70%和75%,达到了免疫保护合格的标准,表明作者所构建的HVT BAC是HVT全基因组克隆,可以应用于重组载体活疫苗的构建。而HVTBACΔgC免疫组的MD阳性率为35%(7/20),较攻毒对照组仅减少了50%(表2),不能达到合格的标准,表明gC基因缺失后对HVT的免疫原性产生较大影响。
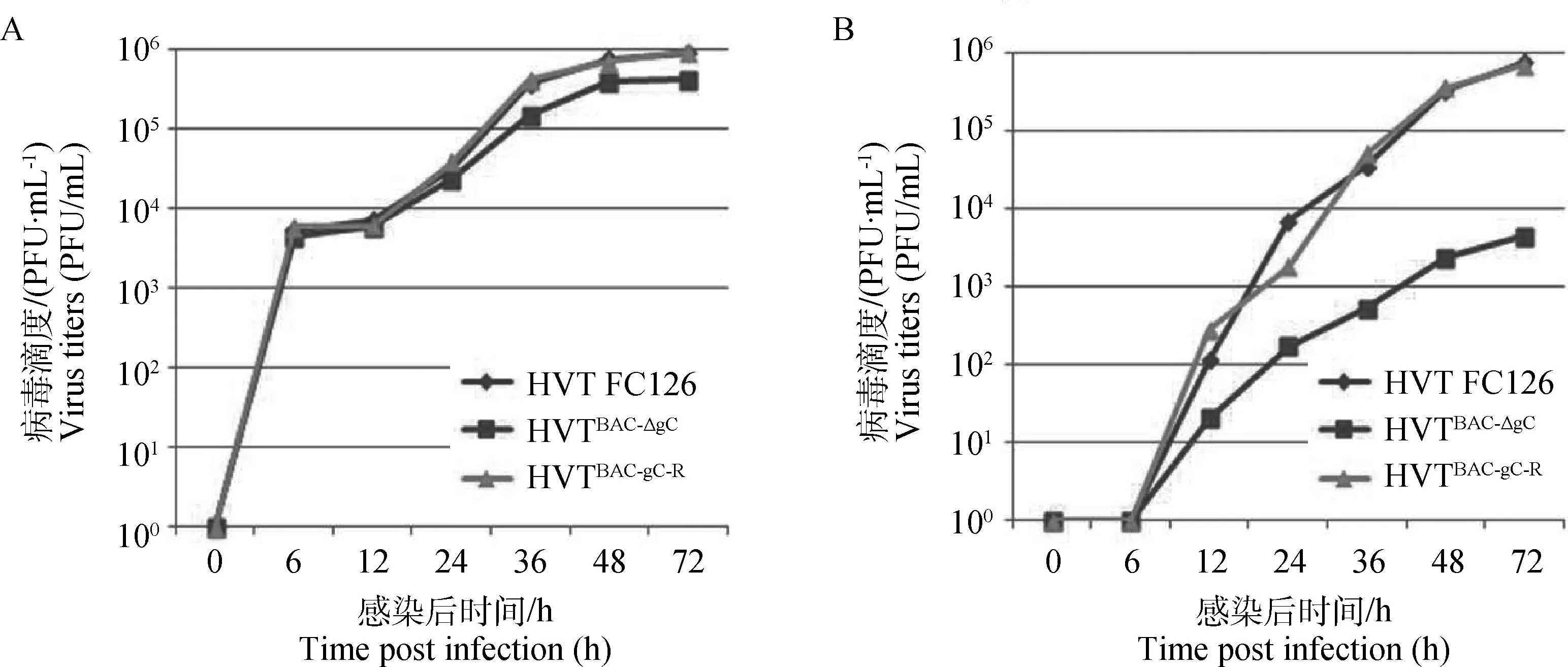
A.经胰酶消化成单个细胞的病毒滴度;B.经裂解的细胞结合性病毒的滴度A.Titers of trypsinized single cells after infection;B.Titer of cell-associated viruses released from infection cells图5 HVT FC126、HVTBAC-ΔgC和HVTBAC-gC-R在CEF上的生长动力学曲线Fig.5 Growth kinetics of HVT FC126,HVTBAC-ΔgC and HVTBAC-gC-R on CEF
表2MDV强毒株攻击保护率
Table 2Protection against virulent MDV challenge
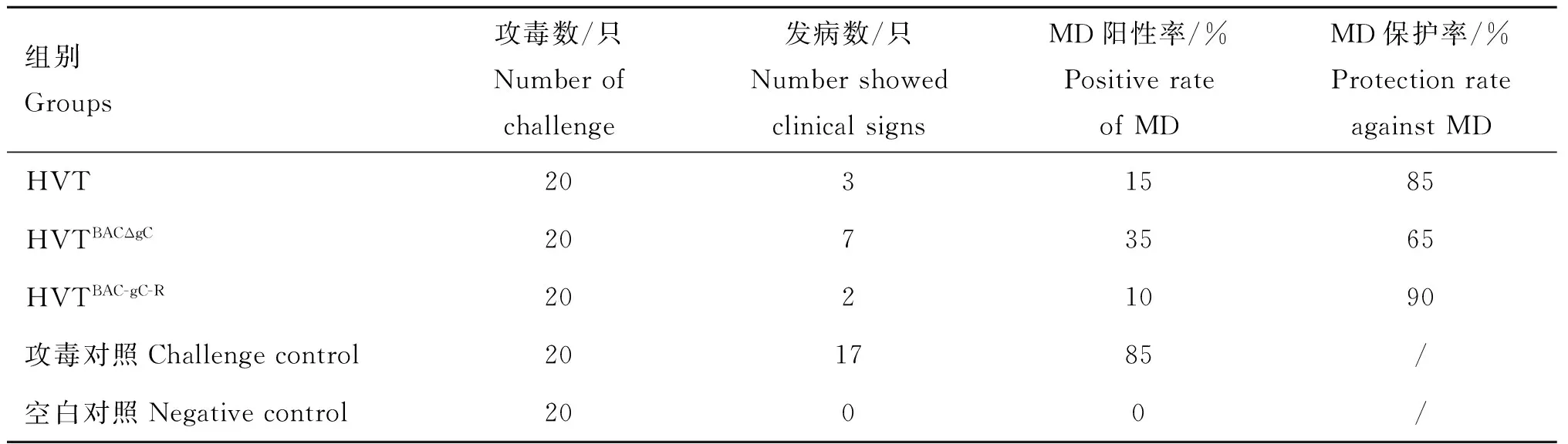
组别Groups攻毒数/只Numberofchallenge发病数/只NumbershowedclinicalsignsMD阳性率/%PositiverateofMDMD保护率/%ProtectionrateagainstMDHVT2031585HVTBACΔgC2073565HVTBAC-gC-R2021090攻毒对照Challengecontrol201785/空白对照Negativecontrol2000/
3 讨 论
火鸡疱疹病毒被广泛用于鸡马立克病的预防,HVT的基因组较大,有多个非必需基因和非编码区序列,能够容纳大片段外源基因的插入[27],因此,被成功用作禽类疫病重组病毒活载体疫苗的载体。早在20世纪90年代以来,国外研究者就已经开始用HVT为载体表达NDV的 F蛋白、IBDV的 VP2蛋白和禽流感病毒(avian influenza virus,AIV)的HA和NA蛋白等外源抗原,显示了优良的保护效果[12,28-30]。国内不少研究者也开展了HVT活载体相关方面的研究,通常采用传统的同源重组方法插入外源基因,然后选用LacZ或GFP作为遗传标记基因,采用有限稀释法和蚀斑挑斑以纯化重组毒株,结果表明采用这种传统的方法,难于获得真正纯化的HVT重组病毒,这可能与HVT有较强的细胞结合性有关。自M.Messerle等报道成功构建首个鼠巨细胞病毒(mouse cytomegalovirus,MCMV)全基因组的细菌人工染色体以来[19],越来越多的疱疹病毒相继构建成功细菌人工染色体(BAC)感染性克隆,BAC技术实现了在大肠杆菌内进行疱疹病毒基因组的修饰,尤其是Red/ET克隆修饰系统和Cre/loxP 克隆修饰系统在BAC 遗传修饰上的广泛应用,使得对BAC 分子克隆化病毒基因组上任何位点的插入、缺失、替换和点突变等遗传修饰变得非常简便、快速和准确,大大提高了相关病毒致病机制和病毒活载体研究的进展[16]。
构建HVT全基因组感染性细菌人工染色体成功的关键有以下几个方面:第一,筛选标记基因的选择。本课题组在筛选标记上曾使用过EGFP作为标记基因,但在重组病毒的纯化上遇到了很大的困难,因为HVT具有一定的细胞结合特性,因而在重组病毒挑斑纯化过程中,完全去除野毒株非常困难。本研究中最终使用了mini-F载体中的Eco-gpt作为HVT重组病毒的筛选基因,在鸟嘌呤从头合成途径中,催化IMP到XMP反应的是IMP脱氢酶,而MPA是该酶的不可逆阻断剂,在恰当浓度的MPA存在下,鸟嘌呤只能通过替代途径,在补充适当浓度的黄嘌呤和GPT的参与下合成,动物细胞本身不能合成GPT,但重组的病毒可以提供GPT从而使病毒完成核酸代谢,而野毒株感染细胞则不能进行核酸代谢,经过几轮加压筛选后,在显微镜下已观察不到野毒株感染细胞,大大提高了重组病毒的纯化程度。第二,mini-F载体的插入位点也是构建稳定的HVT BAC的关键之一,本研究也曾在US2位点插入mini-F 载体序列,但获得的重组病毒很不稳定,随着纯化过程中传代次数的增加,重组病毒的复制能力明显变弱(未报道)。而在将mini-F载体插入gC等位位点后获得的重组病毒则很稳定,才能保证传代纯化的正常进行。第三,在mini-F重组HVT纯化的过程中,除挑斑纯化之外,还将扩繁的含重组病毒和亲本病毒的混合样品经超声波裂解释放出游离状态的病毒,再经倍比稀释后接种96孔新鲜制备的CEF,培养后选取仅出现单个绿斑的细胞孔中的培养物进行扩繁,此处理对重组病毒的纯化也发挥了重要作用。
然而,虽然将mini-F重组HVT病毒从亲本病毒中纯化出来非常困难,但是在共转染拯救gC恢复株病毒时,将gC恢复的病毒从mini-F重组病毒中纯化则效率很高,仅经过2~3轮的挑斑即获得了纯净的恢复毒株。这可能是因为HVT在插入外源基因后其细胞结合性增强,还可能是插入外源序列后影响了重组病毒的复制,使得重组毒株在与亲本毒株在混合培养过程中处于明显劣势,难于将重组毒株分离纯化,而gC恢复毒株则具有亲本毒株的优势,易于纯化。
截止目前,研究表明所有甲型疱疹病毒的gC都是非必需基因,但对病毒粒子侵入细胞,以及从细胞中释出都有重要作用,而且gC能激发中和抗体,是疱疹病毒的重要抗原之一,gC基因缺失后对病毒的复制和免疫效力会产生重要影响[31-32]。本研究中gC缺失的HVT重组病毒虽然仍能有效地在细胞与细胞之间传播,但对病毒侵入细胞的能力损伤严重,且导致了病毒的免疫效力大大降低,与其他甲型疱疹病毒gC的功能相似。
4 结 论
作者首次将mini-F序列插入HVT基因组的gC基因等位位点成功构建了HVT全基因组的细菌人工染色体,并证明该细菌人工染色体是一个稳定的感染性克隆,可以用于重组HVT活载体疫苗的研制;HVT的gC基因是一个非必需基因,但对病毒的增殖能力和免疫效力有重要影响。
[1]MELCHIOR F J,FREDRICKSON T,LUGINBUHL R.Neutralization studies with Marek’s disease virus and turkey herpesvirus[J].ApplMicrobiol,1973,26(6):925-933.
[2]RAHAUS M,AUGUSTINSKI K,CASTELLS M,et al.Application of a new bivalent Marek’s disease vaccine does not interfere with infectious bronchitis or Newcastle disease vaccinations and proves efficacious[J].AvianDis,2013,57(2 Suppl):498-502.
[3]AFONSO C,TULMAN E,LU Z,et al.The genome of turkey herpesvirus[J].JVirol,2001,75(2):971-978.
[4]SONDERMEIJER P,CLAESSENS J,JENNISKENS P,et al.Avian herpesvirus as a live viral vector for the expression of heterologous antigens[J].Vaccine,1993,11(3):349-358.
[5]TSUKAMOTO K,SAITO S,SAEKI S,et al.Complete,long-lasting protection against lethal infectious bursal disease virus challenge by a single vaccination with an avian herpesvirus vector expressing VP2 antigens[J].JVirol,2002,76(11):5637-5645.
[6]DARTEIL R,BUBLOT M,LAPLACE E,et al.Herpesvirus of turkey recombinant viruses expressing infectious bursal disease virus (IBDV) VP2 immunogen induce protection against an IBDV virulent challenge in chickens[J].Virology,1995,211(2):481-490.
[7]ESAKI M,GODOY A,ROSENBERGER J,et al.Protection and antibody response caused by turkey herpesvirus vector Newcastle disease vaccine[J].AvianDis,2013,57(4),750-755.
[8]PALYA V,KISS I,TATR-KIS T,et al.Advancement in vaccination against Newcastle disease:recombinant HVT NDV provides high clinical protection and reduces challenge virus shedding with the absence of vaccine reactions[J].AvianDis,2012,56(2):282-287.
[9]RAUW F,PALYA V,GARDIN Y,et al.Efficacy of rHVT-AI vector vaccine in broilers with passive immunity against challenge with two antigenically divergent Egyptian clade 2.2.1 HPAI H5N1 strains[J].AvianDis,2012,56(4 Suppl):913-922.
[10]PALYA V,TATR-KIS T,MATT,et al.Onset and long-term duration of immunity provided by a single vaccination with a turkey herpesvirus vector ND vaccine in commercial layers[J].VetImmunolImmunopathol,2014,158(1-2):105-115.
[11]LIU S,SUN W,CHU J,et al.Construction of recombinant HVT expressing PmpD,and immunological evaluation against chlamydia psittaci and Marek’s disease virus[J].PLoSOne,2015,10(4):e0124992.
[12]PANTIN-JACKWOOD M,KAPCZYNSKI D,DEJESUS E,et al.Efficacy of a recombinant turkey herpesvirus h5 vaccine against challenge With H5N1 clades 1.1.2 and 2.3.2.1 highly pathogenic avian influenza viruses in domestic ducks (Anasplatyrhynchosdomesticus)[J].AvianDis,2016,60(1):22-32.
[13]LIU J,CHEN P,JIANG Y,et al.A duck enteritis virus-vectored bivalent live vaccine provides fast and complete protection against H5N1 avian influenza virus in ducks[J].JVirol,2011,85(21):10989-10998.
[14]CHEN Y,GUO W,XU Z,et al.A novel recombinant pseudorabies virus expressing parvovirus VP2 gene:Immunogenicity and protective efficacy in swine[J].VirolJ,2011,8:307.
[15]兰德松,石星明,王云峰,等. 火鸡疱疹病毒细菌人工染色体的构建[J].微生物学报,2008,48(6):811-817.
LAN D S,SHI X M,WANG Y F,et al.Reconstituting turkey herpesvirus with bacterial artificial chromosome clones[J].ActaMicrobiologicaSinica,2008,48(6):811-817.(in Chinese)
[16]WARDEN C,TANG Q,ZHU H.Herpesvirus BACs:past,present,and future[J].JBiomedBiotechnol,2011:124595.
[17]TISCHER B,SMITH G,OSTERRIEDER N.En passant mutagenesis:a two step markerless red recombination system[J].MethodsMolBiol,2010,634:421-430.
[18]OSTERRIEDER N,SCHUMACHER D,TRAPP S,et al.Establishment and use of infectious bacterial artificial chromosome (BAC) DNA clones of animal herpesviruses[J].BerlMunchTierarztlWochenschr,2003,116:373-380.
[19]MESSERLE M,CRNKOVIC I,HAMMERSCHMIDT W,et al.Cloning and mutagenesis of a herpesvirus genome as an infectious bacterial artificial chromosome[J].ProcNatlAcadSciUSA,1997,94:14759-14763.
[20]OSTERRIEDER N.Construction and characterization of an equine herpesvirus 1 glycoprotein C negative mutant[J].VirusRes,1999,59:165-77.
[21]WANG J,OSTERRIEDER N.Generation of an infectious clone of duck enteritis virus and generation of a vectored DEV expressing hemagglutinin of H5N1 avian influenza virus[J].VirusRes,2011,159(1):23-31.
[22]TISCHER B,VON EINEM J,KAUFER B,et al.Two-step red-mediated recombination for versatile high-efficiency markerless DNA manipulation inEscherichiacoli[J].Biotechniques,2006,40:191-197.
[23]REDDY S,SUN A,KHAN O,et al.Cloning of a very virulent plus,686 strain of Marek’s disease virus as a bacterial artificial chromosome[J].AvianDis,2013,57(2 Suppl):469-473.
[24]WANG J,GE A,XU M,et al.Construction of a recombinant duck enteritis virus (DEV) expressing hemagglutinin of H5N1 avian influenza virus based on an infectious clone of DEV vaccine strain and evaluation of its efficacy in ducks and chickens[J].VirolJ,2015,12:126.
[25]MA C,ZHANG Z,ZHAO P,et al.Comparative transcriptional activity of five promoters in BAC-cloned MDV for the expression of the hemagglutinin gene of H9N2 avian influenza virus[J].JVirolMethods,2014,206:119-127.
[26]BAIGENT S,PETHERBRIDGE L,SMITH L,et al.Herpesvirus of turkey reconstituted from bacterial artificial chromosome clones induces protection against Marek’s disease[J].JGenVirol,2006,87(Pt 4):769-776.
[27]HALL R,MEERS J,FOWLER E,et al.Identification of non-essential loci within the Meleagrid herpesvirus 1 genome[J].VirolJ,2015,12:130.
[28]RAUW F,GARDIN Y,PALYA V,et al.The combination of attenuated Newcastle disease (ND) vaccine with rHVT-ND vaccine at 1 day old is more protective against ND virus challenge than when combined with inactivated ND vaccine[J].AvianPathol,2014,43(1):26-36.
[29]PRANDINI F,SIMON B,JUNG A,et al.Comparison of infectious bursal disease live vaccines and a HVT-IBD vector vaccine and their effects on the immune system of commercial layer pullets[J].AvianPathol,2016,45(1):114-125.
[30]KAPCZYNSKI D,ESAKI M,DORSEY K,et al.Vaccine protection of chickens against antigenically diverse H5 highly pathogenic avian influenza isolates with a live HVT vector vaccine expressing the influenza hemagglutinin gene derived from a clade 2.2 avian influenza virus[J].Vaccine,2015,33(9):1197-1205.
[31]ADAMIAK B,TRYBALA E,MARDBERG K,et al.Human antibodies to herpes simplex virus type 1 glycoprotein C are neutralizing and target the heparan sulfate-binding domain[J].Virology,2010,400:197-206.
[32]JAROSINSKI K,OSTERRIEDER N.Further analysis of Marek’s disease virus horizontal transmission confirms that U(L)44 (gC) and U(L)13 protein kinase activity are essential,while U(S)2 is nonessential[J].JVirol,2010,84:7911-7916.
(编辑白永平)
Construction and Identification of a Novel Bacterial Artificial Chromosome of Herpesvirus of Turkey
WANG Zhi-sheng1,3,LIU Fang1,2,XU Meng-wei1,2,QIAO Yong-feng1,3,HOU Ji-bo1,3,WANG Ji-chun1,3*
(1.NationalResearchCenterofEngineeringandTechnologyforVeterinaryBiologicals,JiangsuAcademyofAgriculturalSciences,Nanjing210014,China;2.CollegeofVeterinaryMedicine,NanjingAgriculturalUniversity,Nanjing210095,China;3.JiangsuCo-innovationCenterforPreventionandControlofImportantAnimalInfectiousDiseasesandZoonoses,Yangzhou225009,China)
This study was conducted to construct a novel bacterial artificial chromosome (BAC) of herpevirus of turkey (HVT) as a technical platform for generation of recombinant HVT live vectored vaccine.The mini-F sequences were inserted into the genome of HVT in lieu of glycoprotein C (gC) gene through homologous recombination.The mini-F recombinant HVT were selected by GFP and gpt labeling.Then the DNA of mini-F recombinant HVT was transferred intoE.coliDH10B cells to construct the HVT BAC.Following identification of correct construction of HVT whole genome BAC through RFLP method,HVT BAC DNA was transferred intoE.coliGS1783 cells for further study after checking again.Then the HVT BAC was transfected into chicken embryo fibroblasts (CEF) for rescuing of virus.And also thegCrecovered virus was generated by replacement of mini-F sequences withgCgene through homologous recombination again.Finally,the growth characteristics and protective efficacy against Marek’s disease of the gC recovered HVT,mini-F recombinant HVT and the parental virus (HVT FC126) were investigated.Five strains of mini-F recombinant HVT was obtained.One of the five recombinants (HVTmini-F/ΔgC) was selected for isolation of DNA to transfer intoE.coliDH10B cells to construct HVT BAC which was identified successfully through RFLP.Following up,DNA of HVT BAC was transferred intoE.coliGS1783 cells successfully to obtain several positive clones and one of these clones was selected and named BACHVT-G.The recombinant HVT was rescued successfully from BACHVT-G,named HVTBAC-ΔgC.And thegCrecovered virus(HVTBAC-gC-R) was successfully obtained through homologous recombination.The HVTBAC-gC-Rand HVT FC126 showed no significant difference for growth kinetics or immunity.However,the propagation ability of HVTBAC-ΔgCwas significantly decreased compared to HVT and the immunity against MD of HVTBAC-ΔgCwas also decreased.This study successfully constructed a novel HVT bacterial artificial chromosome,which was an infectious clone of the whole genome of HVT.ThegCgene of HVT is a non-essential gene,but plays an important role for propagation of virus.The deletion ofgCgene will reduce the immunity of HVT against Marek’s disease.
herpesvirus of turkey;bacterial artificial chromosome;glycoprotein C;growth kinetics;immune efficiency
10.11843/j.issn.0366-6964.2016.10.016
2016-04-11
公益性行业(农业)科研专项(201303046);江苏省农业科技自主创新基金项目[CX(12)3061];江苏省自然科学基金项目(BK20131334)
王志胜(1982-),男,山东济南人,助理研究员,博士,主要从事畜禽病毒活载体疫苗的研究,E-mail:zhisheng.wang@163.com
王继春,研究员,E-mail:jcwang@263.net,Tel:025-84392068
S852.659.1
A
0366-6964(2016)10-2071-10
