基于恒温指数扩增反应高灵敏度检测端粒酶活性
2016-11-07周晓毓张佳玉周曼贾红霞
周晓毓,张佳玉,周曼,贾红霞
(河北大学 化学与环境科学学院,河北 保定 071002)
基于恒温指数扩增反应高灵敏度检测端粒酶活性
周晓毓,张佳玉,周曼,贾红霞
(河北大学 化学与环境科学学院,河北 保定071002)
端粒酶延伸产物是具有(ggttag)n重复序列的DNA.设计1条与2个重复序列相匹配的特异性的DNA探针-(ctaacc)2使其与端粒酶延伸产物杂交,形成双链DNA.过量的DNA探针被磁性石墨烯吸附,通过磁分离去除.利用恒温指数扩增反应(IEXPAR)对端粒酶延伸产物捕捉的DNA探针进行快速的扩增.用与双链DNA特异性结合的SYBR Green I染料对扩增产物进行实时荧光检测.在优化条件下,可以检测到低至50个癌细胞中的端粒酶活性.实现了恒温扩增条件下端粒酶活性的高灵敏度检测.
端粒酶活性;恒温指数扩增反应;磁性石墨烯;实时荧光检测
端粒酶是由RNA和蛋白质组成的一种核糖核蛋白酶,具有反转录活性.端粒DNA是位于染色体DNA末端特殊的具有重复序列的DNA,对染色体DNA起到保护作用.端粒酶中RNA序列与端粒DNA序列互补.端粒酶与端粒DNA结合后,会以自身的RNA序列为模板,使端粒DNA不断复制[1,2].端粒酶活性在正常细胞(除了永生细胞,像造血细胞、干细胞、生殖细胞等)中很难被检测到,它一般在肿瘤细胞中被激活.肿瘤细胞的强大活力与端粒酶密切相关.通过检测端粒酶的活性,可以实现对肿瘤、癌症的早期诊断.同时以端粒酶为靶标分子,研究有效的端粒酶抑制剂,对开发抗肿瘤药物具有重要意义.即使在癌细胞中,端粒酶的活性也很低,所以对端粒酶活性的检测需要高灵敏度的分析方法.目前广泛应用的方法是基于PCR扩增的端粒重复序列放大技术(TRAP)[3-5],即先用端粒酶底物(telomerase substrate,TS)的DNA序列与端粒酶和dNTPs反应,生成长链端粒重复序列的DNA,该DNA经PCR扩增后进行电泳分离和检测.由于端粒酶延伸产物的3′ 端是大量的重复序列,所以PCR扩增产物是一系列不同长度的DNA,这给电泳分离后的定量检测造成困难,由此给操作带来很大不便.之后,Szatmari[6-7]等对TRAP方法进行了改进,最后可得到长度一致的PCR产物,但是PCR扩增本身的一些缺点,如过程比较复杂,需要准确的控温,且反应时间较长等仍然存在.
近年来人们一直努力研究建立不需要PCR扩增反应的端粒酶活性分析方法,如表面等离子体共振[8]、电化学分析[9-10]、量子点共振能量转移[11]、端粒酶诱导生成金属纳米线[12]、具有催化性能的分子信标[13]等.但由于缺乏有效的DNA放大步骤,这些方法的灵敏度都达不到TRAP的水平.恒温指数扩增反应[14](isothermal exponential amplification reaction,IEXPAR)是一种基于聚合酶和切口酶共同作用的快速的核酸扩增方法.IEXPAR可以在恒温条件下对短链DNA(10~20个碱基)进行有效、快速的指数扩增.一般IEXPAR在十几分钟内可对目标分子放大106~109倍,在十几分钟内能够达到PCR过程几个小时的扩增效果.
磁性石墨烯对单链DNA具有较强的吸附能力,而对双链DNA吸附较弱[15].本方法利用这一性质,在端粒酶延伸产物与其特异性DNA探针杂交之后,在溶液中加入磁性石墨烯,通过磁分离,将过量的DNA探针去除.然后利用IEXPAR反应对端粒酶延伸产物捕捉的DNA探针进行快速扩增,弥补了端粒酶活性检测方法中恒温检测缺乏有效的扩增手段,检测灵敏度低的缺陷.
1 实验部分
1.1仪器与试剂
StepOne实时定量PCR仪(Applied Biosystems,美国)用于IEXPAR反应的实时荧光测量.2720热循环仪(Applied Biosystems,美国)用于控制端粒酶延伸反应和杂交反应温度.
DNA(聚丙烯酰胺电泳纯化)和PBS 购于上海生物工程公司.磁性石墨烯购于Nanoinnova Technologies 公司.Vent (exo-) DNA聚合酶和Nt.BstNBI切口酶购于New England Biolabs(美国).SYBR Green Ⅰ 荧光染料(20×,DMSO溶剂)购于厦门生物技术公司.CHAPS细胞裂解缓冲溶液购于Millipore Co.Ltd.(美国).实验中所用的水均为二次去离子水.
1×PBS:137 mmol/L NaCl,10 mmol/L 磷酸盐缓冲,2.7 mmol/L KCl,pH 7.4.
端粒酶延伸反应缓冲溶液(自己配制):20 mmol/L Tris-HCl,1.5 mmol/L MgCl2,70 mmol/L KCl,1 mmol/L EGTA,体积分数为0.05% Tween-20.
1×Nt.BstNBI切口酶缓冲溶液:50 mmol/L Tris-HCl,100 mmol/L NaCl,10 mmol/L MgCl2,100 μg/mL BSA,pH 7.9.
1×Vent (exo-) DNA聚合酶缓冲溶液:20 mmol/L Tris-HCl,pH 8.8,10 mmol/L KCl,10 mmol/L (NH4)2SO4,2 mmol/L MgSO4,体积分数为0.1%的Triton X-100,pH 8.8.
1.2实验步骤
1.2.1端粒酶提取过程
Hela细胞从培养基中分离,以冷的1×PBS缓冲溶液洗涤3次,然后以2 000 r/min在4 ℃离心10 min.分离出的细胞加入冷的CHAPS细胞裂解缓冲溶液,调节细胞浓度为1×104/μL,在冰上放置30 min,然后于4 ℃,12 000 r/min离心30 min.含有端粒酶的上层溶液放置在 -80 ℃的超低温冰箱中保存备用.
1.2.2端粒酶延伸过程
一定量的端粒酶提取液,0.16 μmol/L端粒酶延伸反应引物(TS primer),200 μmol/L 的dNTPs在端粒酶延伸反应缓冲溶液中混合均匀,反应体积为20 μL.将此混合液置于2720热循环仪中,37 ℃ 孵育1 h进行端粒酶延伸反应,90 ℃ 10 min使端粒酶变性失活,终止延伸.
1.2.3端粒酶延伸产物与特异性DNA探针杂交及杂交产物的分离
取端粒酶延伸后的反应溶液5 μL,加入5 μmol/L DNA 探针,在1×PBS缓冲溶液中进行杂交.杂交体系为10 μL.在2720热循环仪中95 ℃高温变性10 min,45 ℃复性杂交20 min,降至室温待用.向杂交反应溶液中加入10 μL 12 mg/mL 磁性石墨烯(1×PBS悬浮)不断振荡,反应20 min.溶液中过量未杂交的单链DNA探针,而端粒酶延伸产物与特异性DNA探针形成的双链DNA,不易被磁性石墨烯吸附,仍然存在于溶液中.磁分离,将过量未杂交的DNA探针除去.取上清液(含有端粒酶延伸产物与特异性DNA探针形成的双链DNA)用于恒温指数扩增反应(IEXPAR).
1.2.4恒温指数扩增反应检测端粒酶活性
将含有端粒酶延伸产物与特异性DNA探针形成的双链DNA的上清液稀释10倍,取1 μL稀释液与扩增模板DNA X′-Y′、Y′-Y′、dNTPs在Nt.BstNBI切口酶缓冲溶液中混合,作为Part A.Vent (exo-) DNA聚合酶、Nt.BstNBI切口酶及SYBR Green Ⅰ荧光染料在Vent (exo-) DNA聚合酶缓冲溶液中混合,作为Part B.将Part A和Part B混合后立即放入实时荧光定量PCR仪进行反应.IEXPAR反应温度为55 ℃,并实时测量其荧光强度随时间的变化曲线.IEXPAR反应溶液最终体积为10 μL,含有0.1 μmol/L扩增模板DNA X′-Y′,0.4 μmol/L 扩增模板DNA Y′-Y′,400 μmol/L dNTPs,1.6 U/μL Nt.BstNBI切口酶,0.44 U/μL Vent (exo-) DNA聚合酶,0.5×Nt.BstNBI切口酶缓冲溶液,0.5×Vent (exo-) DNA聚合酶缓冲溶液和0.4× SYBR GreenⅠ荧光染料.
2 结果与讨论
2.1端粒酶活性检测原理
基于恒温指数扩增反应(IEXPAR)的放大作用和磁性石墨烯的分离作用检测端粒酶活性的原理如图1所示.将端粒酶延伸反应引物(TS primer)与从Hela细胞提取的人端粒酶(human telomerase)在dNTPs存在条件下进行端粒酶延伸反应.端粒酶延伸产物中含有大量的端粒重复序列-(ggttag)n.在延伸后的反应溶液中加入过量的与端粒重复序列匹配的DNA探针(DNA probe)进行杂交.然后,在杂交溶液中加入磁性石墨烯(magnetic graphene).由于石墨烯对单链DNA具有强烈的吸附作用,而对双链DNA的吸附作用很弱,所以未杂交的DNA探针均被石墨烯吸附,而与端粒酶延伸产物杂交形成双链的DNA探针仍留在溶液中.磁分离后,取上清溶液用于IEXPAR反应.控制IEXPAR反应的温度大于DNA探针双链的解链温度,所以杂交的DNA探针被释放出来,可以引发IEXPAR反应.
该IEXPAR反应采用了2个DNA扩增模板和2步扩增反应.DNA探针与模板X′-Y′的3′-端相结合,在DNA聚合酶(DNA polymerase)和dNTPs存在时,DNA探针将沿扩增模板X′-Y′(amplified template X′-Y′)进行延伸反应形成双链DNA.X′-Y′中的3′-CTCAG-5′是切口酶(nicking enzyme)特异性识别的序列,Nt.BstNbⅠ切口酶将识别它对应的双链结构并从其后4个碱基处将引物延伸DNA链切断,释放出一个短链DNA Y.剩余的引物DNA链将继续不断的延伸并被切除,释放出更多的Y,形成线性放大的机制.另一方面,DNA Y的序列与第2个扩增模板DNA Y′-Y′(amplified template Y′-Y′)的3′-端序列匹配,所以Y将与Y′-Y′的3′-端杂交并产生沿Y′-Y′的延伸反应,最后形成双链DNA.Y′-Y′ 的中间具有与X′-Y′相同的切口酶识别位点,且Y′-Y′ 3′-端与5′-端的序列相同,所以形成的双链DNA中引物延伸DNA链将被切口酶切断并不断释放出短链DNA Y,Y继续与其他的Y′-Y′杂交、延伸、被切断,再释放出Y,由此形成指数放大机制.以SYBR GreenⅠ作为荧光染料,实时测量该IEXPAR反应产物的荧光强度变化.
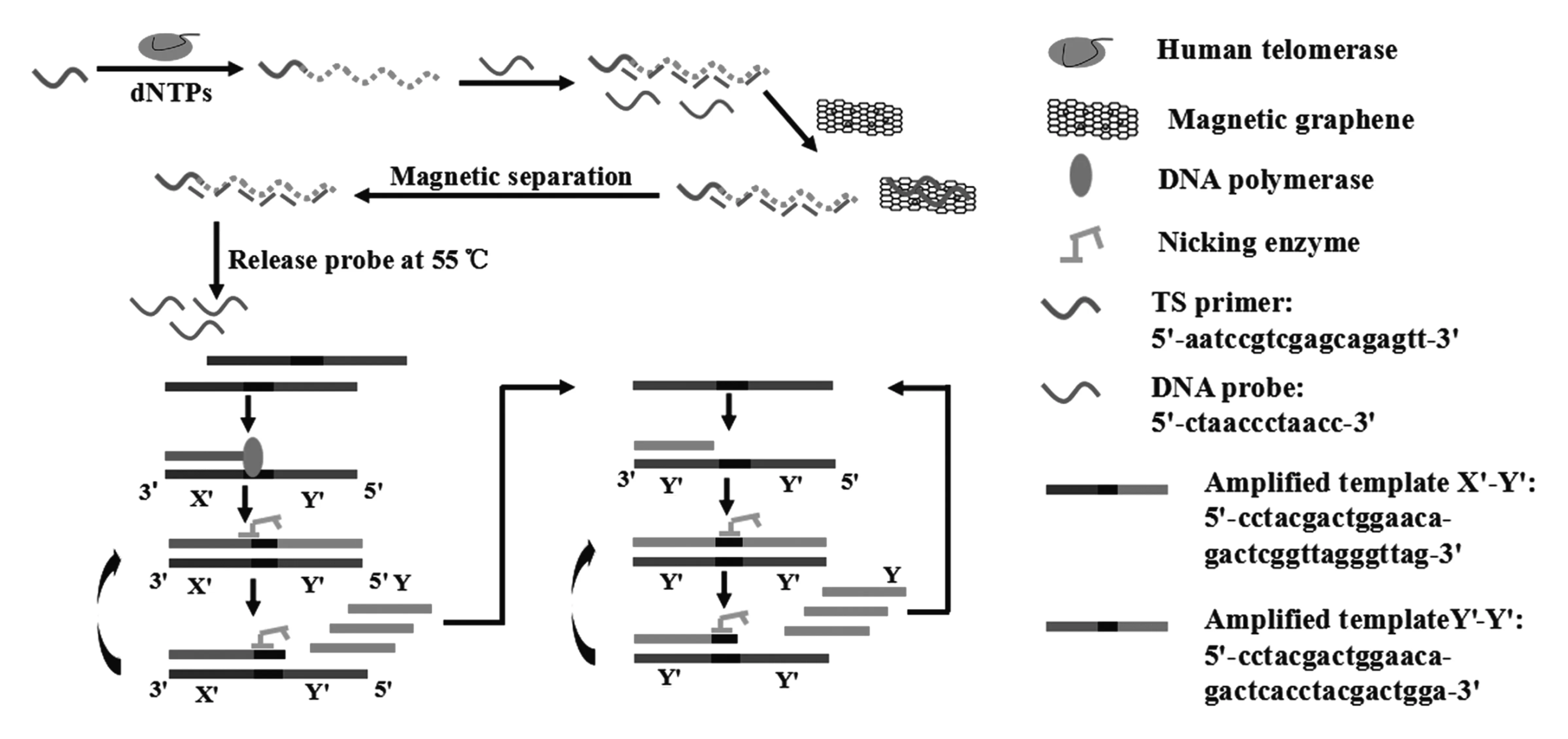
图1 端粒酶活性检测原理Fig.1 Schematic representation of telomerase activity assay
2.2实验条件的优化
首先利用合成的含有10个端粒重复序列的端粒酶延伸产物(synthetic telomerase elongated product,STEP:5'-aatccgtcgagcagagtt-(agggtt)10)作为检测样品对该方法中的实验条件,如聚合酶用量、切口酶用量和磁性石墨烯用量进行了优化.
2.2.1DNA聚合酶用量的优化
STEP用量为0.4 μmol/L,石墨烯用量为12 mg/mL,切口酶用量为1.6 U/μL,改变DNA聚合酶的用量,其他实验条件如实验步骤所述,对空白和样品进行实时荧光强度的测定.图2所示,DNA聚合酶用量越多,空白和样品出现荧光信号的时间越短.但样品和空白的POI值(point of inflection,对应于荧光强度曲线斜率最大点的反应时间)在DNA聚合酶为0.44 U/μL时差别达到最大,所以选择DNA聚合酶用量为0.44 U/μL.

a.样品;b.空白.聚合酶用量:A.0.36 U/μL;B.0.40 U/μL;C.0.44 U/μL;D.0.48 U/μL.图2 DNA聚合酶的用量对实时荧光信号的影响Fig.2 Influence of the amount of Vent (exo-) DNA polymerase on the real-time fluorescence curve
2.2.2切口酶用量的优化
STEP用量为0.40 μmol/L,石墨烯用量为12 mg/mL,DNA聚合酶的用量为0.44 U/μL,改变切口酶用量,其他实验条件如实验步骤所述,对空白和样品进行实时荧光强度的测定.图3所示,切口酶用量越多,空白和样品出现荧光信号的时间逐渐增加,但样品和空白的POI值在切口酶为1.6 U/μL时差别达到最大,所以选择切口酶用量为1.6 U/μL.

a.样品;b.空白.切口酶的用量:A.1.2 U/μL;B.1.4 U/μL;C.1.6 U/μL;D.1.8 U/μL.图3 切口酶用量对实时荧光信号的影响Fig.3 Influence of the amount of Nt.BstNBI nicking enzyme on the real-time fluorescence curve
2.2.3磁性石墨烯用量的优化
STEP用量为0.4 μmol/L,DNA聚合酶的用量为0.44 U/μL,切口酶用量为1.6 U/μL,改变磁性石墨烯的用量,其他实验条件如实验步骤所述,对空白和样品进行实时荧光强度的测定.图4所示,当时磁性石墨烯使用12 mg/mL时样品和空白的POI值达到最大,所以选择磁性石墨烯用量为12 mg/mL.

a.样品;b.空白.磁性石墨烯的用量:A.6 mg/mL;B.12 mg/mL;C.18 mg/mL;D.24 mg/mL.图4 磁性石墨烯用量对实时荧光信号的影响Fig.4 Influence of the amount of magnetic graphene on the real-time fluorescence curve
2.3线性范围与检出限
根据以上确立的最佳实验条件,研究了不同浓度合成的端粒酶延伸产物-STEP的实时荧光强度曲线(图5).结果表明实时荧光强度曲线的POI值与STEP浓度在2×10-11~ 4×10-9mol/L内具有良好的线性关系(图6),其线性回归方程为POI = -126.8-21.11 lgcSTEP,线性相关系数R为0.998 3.

STEP的浓度(mol/L)a.0;b.2×10-11;c.4×10-11;d.2×10-10;e.4×10-10;f.2×10-9;g.4×10-9.图5 不同浓度STEP的实时荧光强度曲线Fig.5 Real-time fluorescence curves produced by STEP with different concentrations

图6 STEP引发的实时荧光强度曲线的 POI值与STEP浓度负对数值之间的线性关系Fig.6 Relationship between the POI value of the real-time fluorescence curves produced by STEP and the negative logarithm of the concentration of STEP
2.4实际样品检测
按实验过程所述,从Hela细胞中提取端粒酶.使用不同数量的端粒酶(以细胞个数计数)进行端粒酶延伸反应,得到实际样品的端粒酶延伸产物,按照建立的方法进行实时荧光测量.图7所示,该方法可以检测到50个Hela细胞中端粒酶的活性.控制实验(图7b)是将从2 000个Hela细胞中提取的端粒酶加热到90 ℃失活后按测定端粒酶活性的相同步骤进行实验.控制实验溶液与空白溶液(图7a:无端粒酶加入)产生的实时荧光曲线非常相近,与样品溶液(图7f:2 000个Hela 细胞提取的端粒酶)产生的实时荧光曲线具有显著差别,证明该端粒酶活性检测方法的可靠性.而且实时荧光强度曲线的POI值与相应的癌细胞个数(amount of Hela cells)有较好的线性关系(图8),其线性回归方程为POI = 49.66-0.0098A,线性相关系数R为-0.995 8.

图7 从不同数量Hela细胞中提取的端粒酶引发的 图8 端粒酶引发的实时荧光强度曲线的 POI值与癌细实时荧光强度曲线 胞个数之间的线性关系Fig.7 Real-time fluorescence curves produced by telomerase Fig.8 Relationship between the POI value of the real-timeextracted from different amount of Hela cellsfluorescence curves produced by telomerase and the amount of Hela cells
3 结论
利用恒温指数扩增反应(IEXPAR)对端粒酶延伸产物特异性的DNA探针进行放大,研究建立了灵敏的端粒酶活性检测的方法.该方法可检测到低至50个Hela细胞中的端粒酶活性,且通过控制实验证明了该端粒酶活性检测方法的可靠性.该方法不需要热循环,无需任何标记,反应时间短,分析成本低,检测效率高,为端粒酶在恒温条件下的高灵敏度检测开辟了新的途径.
[1]FENG J,FUNK W D,WANG S S,et al.The RNA component of human telomerase [J].Science,1995,269:1236-1240.
[2]COHEN S B,GRAHAM M E,LOVRECZ G O,et al,Protein composition of catalytically active human telomerase from immortal cells [J].Science,2007,315:1850-1853.DOI:10.1126/science.1138596.
[3]KIM N W,WU F.Advances in quantification and characterization of telomerase activity by the telomeric repeat amplification protocol (TRAP) [J].Nucleic Acids Res,1997,25:2595-2597.
[4]HOU M,XU D W,BJORKHOLM M,et al.Real-time quantitative telomeric repeat amplification protocol assay for the detection of telomerase activity [J].Clinical Chemistry,2001,47:519-524.
[5]WEGE H,CHUI M S,LE H T,et al.SYBR Green real-time telomeric repeat amplification protocol for the rapid quantification of telomerase activity [J].Nucleic Acids Res,2003,31:e3.DOI:10.1093/nar/gng003.
[6]SZATMARI I,ARADI J.Telomeric repeat amplification,without shortening or lengthening of the telomerase products:a method to analyze the processivity of telomerase enzyme [J].Nucleic Acids Res,2001,29:e3.
[7]SZATMARI I,TOKES S,DUNN C B,et al.Modified telomeric repeat amplification protocol:a quantitative radioactive assay for telomerase without using electrophoresis [J].Anal Biochem,2000,282:80-88.DOI:10.1006/abio.2000.4589.
[8]MAESAWA C,INABA T,SATO H,et al.A rapid biosensor chip assay for measuring of telomerase activity using surface Plasmon resonance [J].Nucleic Acids Res,2003,31:e4.DOI:10.1093/nar/gng004.
[9]SATO S,KONDO H,NOJIMA T,et al.Electrochemical telomerase assay with ferrocenylnaphthalene diimide as a tetraplex DNA-specific binder [J].Anal Chem,2005,77:7304-7309.DOI:10.1021/ac0510235.
[10]ESKIOCAK U,OZKAN A D,OZSOZ M,et al.Label-free detection of telomerase activity using guanine electrochemical oxidation signal [J].Anal Chem,2007,79:8807-8811.DOI:10.1021/ac071014r.
[11]PATOLSKY F,GILL R,WEIZMANN Y,et al.Lighting-up the dynamics of telomerization and DNA replication by CdSe-ZnS quantum dots [J].J Am Chem Soc,2003,125:13918-13919.DOI:10.1021/ja035848c.
[12]WEIZMANN Y,PATOLSKY F,POPOV I,et al.Telomerase-generated templates for the growing of metal nanowires [J].Nano Lett,2004,4:787-792.DOI:10.1021/nl049939z.
[13]XIAO Y,PAVLOV V,NIAZOV T,et al.Catalytic beacons for the detection of DNA and telomerase activity [J].J Am Chem Soc,2004,126:7430-7431.DOI:10.1021/ja031875r.
[14]VAN NESS J,VAN NESS L K,GALAS D J,Isothermal reactions for the amplification of oligonucleotides [J].Proc Natl Acad Sci USA,2003,100:4504-4509.DOI:10.1073/pnas.0730811100.
[15]LEE J,PARK II-S,JUNG E,et al.Direct,sequence-specific detection of dsDNA based on peptide nucleic acid and graphene oxide without requiring denaturation [J].Biosensors And Bioelectronics,2014,62:140-144.DOI:10.1016/j.bios.2014.06.028.
(责任编辑:梁俊红)
Sensitive detection of telomerase activity based on isothermal exponetial amplification reaction
ZHOU Xiaoyu,ZHANG Jiayu,ZHOU Man,JIA Hongxia
(College of Chemistry and Environmental Science,Hebei University,Baoding 071002,China)
Telomerase elongated product has many repeat sequences-(ggttag)n.A specific DNA probe-(ctaacc)2which is matched with two repeat sequences is used to hybridize with telomerase elongated product.Excess DNA probes are attached to magnetic graphene and removed by magnetic separation.The DNA probes hybridized with telomerase elongated product is rapidly amplified by isothermal exponential amplification reaction (IEXPAR).SYBR Green I is utilized for real-time fluorescent detection of IEXPAR products.Under the optimal conditions,the telomerase activity in only 50 cancer cells can be easily detected.Sensitive detection of telomerase activity under isothermal condition is achieved.
telomerase activity;isothermal exponential amplification reaction;magnetic graphene;real-time fluorescence detection
10.3969/j.issn.1000-1565.2016.02.008
2015-11-25
国家自然科学基金青年基金资助项目(21405032);教育部博士点基金资助项目(20121301120006)
周晓毓(1990—),女,河北阜城人,河北大学在读研究生.E-mail: love_zhouxy@126.com
贾红霞(1980—),女,河北宣化人,河北大学讲师,博士,主要从事生化分析及光谱分析研究.
E-mail: jia123renren@126.com
O65
A
1000-1565(2016)02-0155-07
