柱后碘衍生法荧光检测黄曲霉毒素的方法探讨
2016-11-07吴高芬李慧敏
吴高芬,李慧敏
(湖南省岳阳市食品药品检验所,湖南岳阳414000)
柱后碘衍生法荧光检测黄曲霉毒素的方法探讨
吴高芬,李慧敏
(湖南省岳阳市食品药品检验所,湖南岳阳414000)
目的优化柱后碘衍生法检测中药材中黄曲霉毒素G2,G1,B2,B1的含量。方法样品经甲醇-水(70∶30)提取后,通过免疫亲和柱净化、柱后碘衍生高效液相色谱-荧光检测器测定。结果在优化条件下,黄曲霉毒素G2、G1、B2、Bl的检出限分别为0.20,0.05,0.15,0.02 g/kg,回收率分别为78.63%,81.75%,79.47%,80.70%。结论该方法简便快速,灵敏度高,重复性好,可满足中药材中黄曲霉毒素含量检测的需要。
黄曲霉毒素G2,G1,B2,B1;免疫亲和柱;柱后碘衍生法;高效液相色谱法;荧光检测器
黄曲霉毒素是真菌毒素重要代表之一,为至今发现的毒性最大的真菌毒素,被世界卫生组织(WHO)的癌症研究机构认定为ⅠA级危险物,是世界公认的3大强致癌物质之一[1],对肝脏有剧毒,并有致畸、致突变、致癌的作用。中药材在储存加工中易滋生黄曲霉毒素及受黄曲霉毒素污染,随着老百姓对食品、药品安全性要求的不断提高,国家食品药品监督管理总局(CFDA)对食品、药品中安全性指标的限量检测越来越重视,提高中药材质量,保证中药产品质量安全变得尤为重要。目前,黄曲霉毒素的检测方法主要有GB/T 18979-2003食品中黄曲霉毒素的测定方法,另外,2010年版《中国药典(一部)》收载了黄曲霉毒素的测定方法。笔者曾尝试使用多种品牌的色谱柱,发现其检测线性范围均较窄,峰变形严重,导致检验结果不可靠,经改变流动相的组成,并用流动相稀释对照品溶液及样品,可扩大线性范围,改善峰形,适用于陈皮、酸枣仁等中药材中黄曲霉毒素测定。现报道如下。
1 仪器与试药
1.1仪器
Agilent 1260 Infinity型高效液相色谱仪(荧光检测器G1314F,1260VWD);Mettler Toledo XS-105型电子天平(d=0.01 mg/0.1 mg);上海FLUKO JJ-2型组织捣碎匀浆机。
1.2试药
黄曲霉毒菌B1,B2,G1,G2混标(上海安谱科学仪器有限公司,批号为212127,含量为98%,黄曲霉毒素B1和G1分别为0.996 3 mg/L和0.998 0 mg/L,黄曲霉毒素B2和G2分别为0.301 3 mg/L和0.300 2 mg/L;规格为每支1 mL);黄曲霉菌G2,G1,B2,B1单标(上海安谱科学仪器有限公司,批号分别为207386,188627,213099,216773,3 mg/L,含量98%,规格为每支1 mL);免疫亲和柱(AflaStarTMR,Romer Labs公司);甲醇为色谱纯(Tedia公司);水为超纯水;碘为分析纯;样品来源于本检验所抽验品。
2 方法与结果
2.1色谱条件
色谱柱:Agilent XDB-C18柱(250 mm×4.6 mm,5 μm);流动相:甲醇-水(45∶55)[2-3];激发波长:360 nm;发射波长:450 nm;流量:0.8 mL/min;柱温:30℃;进样量:对照品5~30 μL,样品20 μL;衍生溶液流速:每分钟0.3 mL;衍生反应管温度:70℃。
2.2溶液制备
对照品溶液:精密量取上述混标溶液0.5 mL置10 mL容量瓶中,用甲醇稀释至刻度,作为贮备液;精密量取贮备液1 mL置25 mL容量瓶中,用流动相稀释至刻度,即得对照品溶液。
衍生溶液[4]:取碘0.50 g,加入甲醇100 mL使溶解,用水稀释至1 000 mL,制成0.05%的碘溶液。
供试品溶液:取样品粉末(过2号筛)15 g,加入氯化钠3 g,置均质瓶中,精密加入70%甲醇溶液75 mL,高速搅拌2 min,离心5 min,精密量取上清液15 mL,置50 mL容量瓶中,用水稀释至刻度,摇匀,用微孔滤膜(0.45 μm)滤过,量取续滤液20.0 mL,通过免疫亲和柱,流速为3 mL/min,用水20 mL洗脱,将洗脱液弃去,使空气进入柱内,将水挤出柱子,再用甲醇1.5 mL洗脱,收集洗脱液,置2 mL容量瓶中,并用水稀释至刻度[5],摇匀,即得供试品溶液。
2.3方法学考察
专属性试验:采用陈皮代替试验样品,按供试品溶液制备方法制备不含黄曲霉毒素的空白溶液。按拟订色谱条件,取空白溶液、2.2项下对照品溶液及供试品溶液依法进样测定。结果见图1。黄曲霉毒素峰形受溶剂效应影响,建议用流动相溶解,或纯甲醇溶解后缩小进样体积(5~15 μL),分别采用纯甲醇及流动相溶解后不同进样体积峰型的比较见图2。用纯甲醇溶解,当进样量为15 μL时,黄曲霉毒素G2,G1,B2,B1开始向右倾斜,其中G2和G1变形较严重,当进样量为20 μL时,G2,G1,B2,B1严重变形;改用流动相溶解,当进样量为30 μL时,峰形依然符合《中国药典(一部)》的要求。
线性关系考察:吸取2.2项下对照品溶液5,10,15,20,25,30 μL注入液相色谱仪,依法测定峰面积。以对照品进样量(X,μg)为横坐标、峰面积(Y)为纵坐标进行线性回归,回归方程见表1。
重复性试验:吸取2.2项下对照品溶液,精密称取,连续进样6次,进样量为20 μL,测定峰面积。结果黄曲霉毒素G2,G1,B2,B1峰面积的RSD分别为0.6%,0.9%,0.8%,1.0%(n=6),表明方法重复性较好。
稳定性试验:吸取2.2项下对照品溶液,精密称取,分别于0,2,4,6,8 h时进样20 μL,测定峰面积。结果黄曲霉毒素G2,G1,B2,B1峰面积的RSD分别为0.8%,1.2%,0.6%,1.1%(n=5),表明黄曲霉毒素在8 h内稳定。

图1 黄曲霉毒素高效液相色谱图
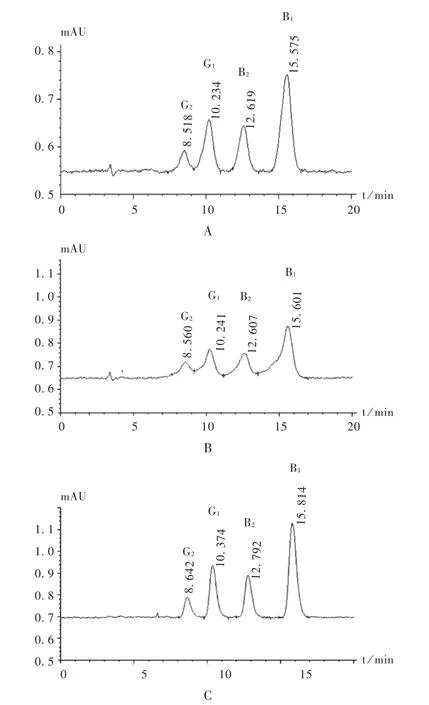
图2 溶剂影响高效液相色谱图

表1 黄曲霉毒素的线性回归方程、相关系数及线性范围(n=6)
加样回收试验(陈皮):取供试品5 g(含黄曲霉毒素B10.5 μg/kg,黄曲霉毒素G2,G1,B2均未检出),共6份,分别精密加入贮备液(3 ng/mL)。配制方法:分别精密量取黄曲霉菌单标100 μL置100 mL容量瓶中,用甲醇稀释至刻度,适量,按2.2项下方法制备供试品溶液。依法测定,计算回收率。结果见表2。
2.4检测限考察
吸取2.2项下对照品溶液2 μL,依法进样测定。黄曲霉毒素G2,G1,B2,B1方法检出限(S/N=3)分别为0.2,0.05,0.15,0.02 μg/kg。结果见图3。

表2 陈皮加样回收试验结果(n=6)
3 讨论
曾按照2010年版《中国药典(一部)》附录ⅨⅤ黄曲霉毒素测定法,即高效液相色谱柱后碘衍生化法测定样品,采用Phenomenex Luna C18柱(200 mm×4.6 mm,5 μm)、Waters SymmetryC18柱(250 mm×4.6 mm,5 μm)、Agilent Zorbax SB-C18柱(250 mm×4.6 mm,5 μm)等不同品牌的色谱柱测定桃仁、酸枣仁、陈皮、胖大海等黄曲霉毒素的含量,进样量在5~15 μL较正常,20 μL开始严重变形,分离度及对称性已达不到检测要求。但改用流动相稀释至刻度,25 μL峰形均符合检测要求,30 μL峰形依然符合检测要求,甚至50 μL也能达检测要求。

图3 检测限高效液相色谱图
采用2010年版《中国药典(一部)》收载流动相与本文流动相稀释最终进样的供试品溶液与对照品溶液,均可达文中图谱效果,但本研究所载流动相配制简单,重复性较好。
[1]曲秋颖,鲍蕾,石媛螈,等.黄曲霉毒素的检测技术及预防措施[J].农产品加工·学刊,2011(8):87.
[2]GB/T 18979-2003,食品中黄曲霉毒素的测定免疫亲和层析净化高效液相色谱法和荧光光度法[S].
[3]国家药典委员会.中华人民共和国药典(四部)[M].北京:中国医药科技出版社,2015:401.
[4]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2010:附录ⅥB.
[5]许勇,王少敏,毛丹,等.HPLC-MS/MS测定绿豆中黄曲霉毒素G2、G1、B2、B1[J].齐鲁药事,2011,30(7):381.
Detection of Aflatoxins in Chinese Medicinal Herbs by Post-Column Derivatization and HPLC-FLD
Wu Gaofen,Li Huimin
(Yueyang Institute for Food and Drug Control,Yueyang,Hunan,China414000)
ObjectiveTo optimize a method for the content determination of aflatoxin G2,G1,B2,B1.MethodsThe samples were extracted with 70%methanol,and cleaned up by immunoafinity columns.The separation of aflatoxin G2,G1,B2,B1were conducted by HPLC-FLD.ResultsUnder optimum conditions,the limits of detection of aflatoxin G2,G1,B2,B1were 0.20,0.05,0.15,0.02 μg/kg respectively and the recoveries of aflatoxin G2,G1,B2,B1were 78.63%,81.75%,79.47%,80.70%.ConclusionThe method is simple,high sensitive and good repeatability,which is suitable for the determination of aflatoxins in Chinese medicinal herbs.
aflatoxin G2,G1,B2,B1;imnmnoafinity column;post-column derivatization;HPLC;fluorescence detector
R284.1;R286.0;R282.71
A
1006-4931(2016)18-0064-04
(2016-04-20)
