人GJB6基因Tet-on HaCaT细胞稳定株的构建与鉴定
2016-11-06路雨婷王震英宋亚丽姬灿灿张莉
路雨婷 王震英 宋亚丽 姬灿灿 张莉
250021济南,山东大学附属省立医院皮肤科
人GJB6基因Tet-on HaCaT细胞稳定株的构建与鉴定
路雨婷 王震英 宋亚丽 姬灿灿 张莉
250021济南,山东大学附属省立医院皮肤科
目的 以Tet-on慢病毒为载体建立稳定表达GJB6基因及其突变体的HaCaT细胞株,为后续研究有汗性外胚层发育不良的发病机制奠定实验基础。方法 利用PCR技术扩增人GJB6基因野生型与突变型(A88V)基因,重组Tet-on慢病毒质粒,经基因测序及酶切技术对其鉴定,再将重组慢病毒转染入HaCaT细胞,经嘌呤霉素筛选出稳定表达编码缝隙连接蛋白Cx30的GJB6基因的细胞株。细胞株加四环素诱导后,通过RTPCR检测GJB6基因的mRNA表达量,同时通过Western印迹检测Cx30与FLAG标签肽的表达,从而对稳定表达GJB6基因的HaCaT细胞株进行鉴定。用CCK8法检测GJB6基因野生型与突变型经四环素诱导表达后对细胞增殖的影响。结果 经酶切、测序鉴定,重组慢病毒质粒构建成功。RT-PCR检测到稳定转染的HaCaT细胞中GJB6基因mRNA表达量明显增加,感染野生型Tet-on慢病毒的HaCaT细胞组(WT组)加四环素GJB6基因表达丰度是WT组不加四环素的113.369倍(P<0.05),感染突变型(A88V)Tet-on慢病毒的HaCaT细胞组(MU组)加四环素GJB6基因表达丰度是MU组不加四环素的3.249倍(P<0.05);Western印迹可检测到经四环素处理的WT组和MU组稳定表达Cx30与FLAG,而未经四环素处理的细胞和感染阴性对照病毒的HaCaT细胞组(NC组)未检测到Cx30与FLAG目的条带。NC组加与不加入四环素在4、8、12、24、36、48 h时的A值差异均无统计学意义(P>0.05);WT组加与不加入四环素在4、8、12、24、36 h时的A值差异均有统计学意义(P<0.05);MU组加与不加入四环素在4、8、12、24、36、48 h时的A值差异均有统计学意义(P<0.05)。结论 成功构建出稳定表达GJB6基因野生型及其突变体A88V的HaCaT细胞株。
外胚层发育不良症;连接蛋白类;GJB6基因;HaCaT细胞;Tet-on
Cx30是缝隙连接蛋白中的一员。2000年Lamartine 等[1]已证实,编码 Cx30 蛋白的 GJB6 基因为有汗性外胚层发育不良的致病基因。迄今为止,在有汗性外胚层发育不良(hidrotic ectodermal dysplasia,HED)患者中已发现该基因的5种突变,它们均为错义突变,分别为G11R、A88V、V37E、D50N和N14S[1-5]。目前的研究虽然已识别出该病的致病基因,但对其发病机制还了解甚少。我们曾通过过表达慢病毒的方法进行细胞转染,欲对Cx30蛋白的功能进行进一步研究,但在实验过程中4种突变型的过表达慢病毒分别转染HaCaT细胞后,细胞死亡现象均较明显,荧光表达弱,导致后续研究不能正常进行[6]。因此,改用Ten-on基因表达系统再次尝试转染HaCaT细胞并构建为稳定株。
材料与方法
一、实验材料
1.实验细胞与慢病毒:HaCaT细胞购自中国科学院基础研究所细胞中心;阴性对照组慢病毒、Tet-on野生型及突变型(A88V)慢病毒均为本院中心实验室保存。
2.主要试剂:胎牛血清(澳大利亚Ausbian公司),二甲基亚砜(DMSO,北京索莱宝科技有限公司),DMEM(美国Corning公司),胰酶[生工生物工程(上海)股份有限公司],嘌呤霉素(美国Clontech公司),Trizol试剂、逆转录试剂盒(日本Takara公司),BCA Protein Assay Kit(美国HyClone-Pierce公司),预染的蛋白参照(上海中晶公司),ECL-PLUS/Kit(美国 Amersham公司),Cx30抗体(美国Inventrogen公司),FLAG抗体(美国Sigma公司),辣根过氧化物酶标记的山羊抗兔IgG以及山羊抗鼠IgG(北京中杉金桥公司),ECL+plusTMWestern印迹试剂盒(美国Amersham公司)。
二、方法
1.重组慢病毒质粒载体的鉴定:以GJB6基因野生型及野生型A88V引物为模板扩增其对应的GJB6基因的cDNA序列。再克隆到GV308质粒上,经生工生物工程(上海)股份有限公司测序分析证实其正确性。
2.HaCaT细胞的培养:从液氮罐中取出细胞冻存管,迅速放入37℃水浴中,并不时摇动使其尽快解冻。完全解冻后,150×g,离心3 min,75%乙醇擦拭冻存管消毒后,移至生物安全柜。吸去冻存液上清液,将细胞悬液接种至含有10%胎牛血清和DMEM培养基的培养瓶中,轻轻晃匀后置于37℃、5%CO2培养箱。24 h后更换1次培养液继续培养,保持细胞良好的生长状态。
实验分组:感染阴性对照病毒的HaCaT细胞组(NC组)、感染野生型Tet-on慢病毒的HaCaT细胞组(WT组)、感染突变型(A88V)Tet-on慢病毒的HaCaT细胞组(MU组)。
3.Tet-on慢病毒感染HaCaT细胞:将处于对数生长期的细胞用胰酶消化,完全培养基制成3×104~5×104个/ml细胞悬液,接种相应的细胞数到培养板中进行预实验,继续培养保证感染时铺板量达到15%~30%左右。按照预实验结果,将完全培养基制成3×104~5×104个/ml细胞悬液接种至6孔板中,感染时每孔细胞融合度为20%,MOI值为20,16 h左右更换为常规培养基继续培养。
4.观察感染后细胞状态及感染效率并筛选细胞:细胞状态良好,未出现大量死亡,感染效率达到80%左右。于感染96 h后,换用含嘌呤霉素的培养基筛选细胞,处理时间为120 h。待细胞融合至70%~80%时,以终浓度2.00 mg/L的嘌呤霉素进行筛选,根据培养基的颜色和细胞生长情况每3~5 d更换1次筛选培养基,最终以1.00 mg/L的嘌呤霉素维持。5 mg/L四环素处理48 h后送样RT-PCR检测和Western印迹检测。
5.RT-PCR检测目的基因GJB6:用Trizol法提取细胞总RNA,用分光光度仪测得A260nm/A280nm为1.8~2.1。按照试剂盒说明书,取1 μg RNA为模板逆转录合成cDNA,然后PCR扩增。GJB6基因引物序列上游为5′-GTGGCCTACTACAGGCACGAA-3′,下游 5′-AGCGACCCCTCTATCCGAAC-3′,扩增长度为113 bp。GAPDH为内参照,引物序列上游为5′-TGACTTCAACAGCGACACCCA-3′,下游 5′-CA CCCTGTTGCTGTAGCCAAA-3′,扩增长度为 121 bp。
6.Western印迹检测HaCaT细胞中Cx30与FLAG的表达:收集生长状态良好的目的细胞,提取蛋白。以GAPDH、β肌动蛋白作为内参,每个样品蛋白上样量均为30 μg。采用10%分离胶进行SDSPAGE电泳,在4℃、300mA恒流条件下湿转150 min,将蛋白转移到PVDF膜上。用封闭液室温封闭PVDF膜1 h,一抗4℃孵育过夜。洗膜后二抗室温孵育2 h,次日显影。
7.CCK8法检测加四环素诱导GJB6基因表达后对细胞增殖的影响:将对数生长期HaCaT细胞分组:①对照组:不加四环素的NC组、WT组、MU组HaCaT细胞;②实验组:加四环素的NC组、WT组、MU组HaCaT细胞。在96孔板中接种密度为6×103个/ml的细胞悬液,每组设3个复孔,每孔培养基为100 μl,同时设置空白组,即培养基+CCK8试剂,上述方法种4块96孔板分别用于各个时间点的检测。将培养板放在培养箱预培养24 h后,实验组换含有5 mg/L四环素的培养基100 μl。培养箱中分别培养 4、8、12、24、36、48 h,取出培养板,加入10 μl CCK8溶液。在细胞培养箱内继续孵育1 h,选择450 nm波长,在酶标仪上测定各孔吸光度(A值),实验重复3次,取平均值。
8.采用SPSS 19.0统计软件对实验结果进行分析,差异可信区间为95%,以P<0.05为差异有统计学意义。所有数据以±s表示。两组间比较采用t检验。
结 果
一、PCR扩增GJB6基因的野生型和突变型A88V并克隆到载体进行测序
PCR试剂盒扩增突变型和野生型GJB6基因cDNA全长序列,PCR产物交换人线性化表达载体,将该片段克隆至GV308载体(12.4 kb)中进行转化,挑选单克隆菌落。PCR鉴定结果,野生型与突变型A88V的阳性转化子PCR产物大小分别是829 bp和1128bp,阴性转化子PCR产物大小分别是363bp和377 bp,经测序,结果与已报道的GJB6基因序列一致,表明重组质粒构建成功(图1)。
二、Tet-on过表达慢病毒转染HaCaT细胞结果
阴性对照组慢病毒、Tet-on野生型及突变型(A88V)慢病毒分别感染HaCaT细胞后(图2),细胞状态良好,为多角形,呈簇集生长。感染96 h后,经嘌呤霉素处理120 h后的细胞形态未见明显异常,生长状态亦良好(图3)。HaCaT细胞为有嘌呤霉素抗性的细胞,转染较为成功。
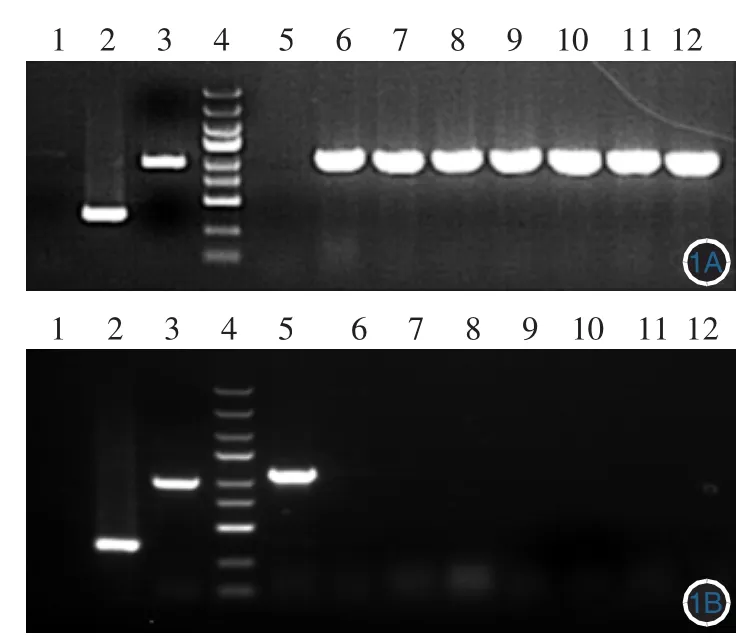
图1 酶切鉴定重组质粒结果 1:阴性对照(ddH20);2:空载自连对照组;3:GAPDH;4:标准参照物:自上而下依次为5 kb、3 kb、2 kb、1.5 kb、1 kb、750 bp、500 bp、250 bp、100 bp;5 ~ 12:1A 为 GJB6基因野生型1~8号重组质粒,1B为GJB6基因突变型A88V 1~8号重组质粒
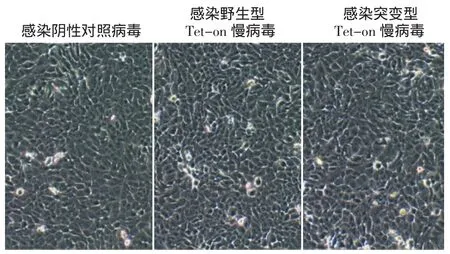
图2 Tet-on过表达慢病毒感染HaCaT细胞 细胞状态良好,为多角形,呈簇集生长
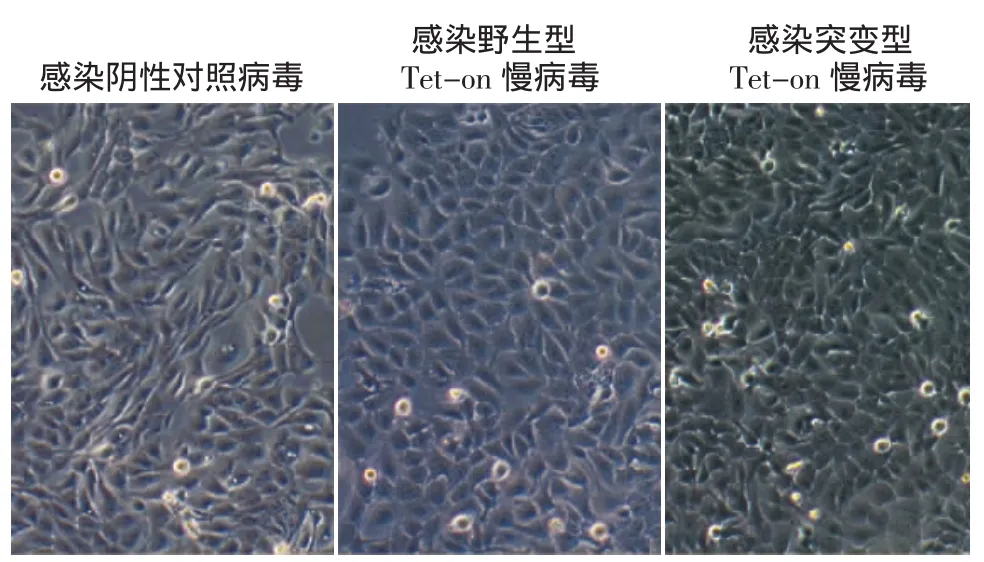
图3 Tet-on过表达慢病毒感染HaCaT细胞96 h、经嘌呤霉素处理120 h后的生长状态 HaCaT细胞生长良好,细胞无明显分化、老化现象
三、四环素诱导后细胞状态的变化
MU组加四环素诱导,24 h后细胞形态发生变化,48 h后大部分细胞死亡,残存的细胞老化,细胞核固缩(图4),而NC组与WT组细胞形态未有明显变化,且细胞无明显死亡。
四、RT-PCR检测目的基因GJB6 mRNA水平
WT加四环素组GJB6基因表达丰度(113.369±6.494) 是 WT不加四环素组(1.001±0.067)的113.369倍(P<0.05);MU加四环素组GJB6基因表达丰度(3.249±0.273)是MU不加四环素组(1.001±0.067)的3.249倍(P<0.05)。稳定转染的HaCaT细胞加四环素诱导后表达量增高,说明目的基因的表达是可调控的。
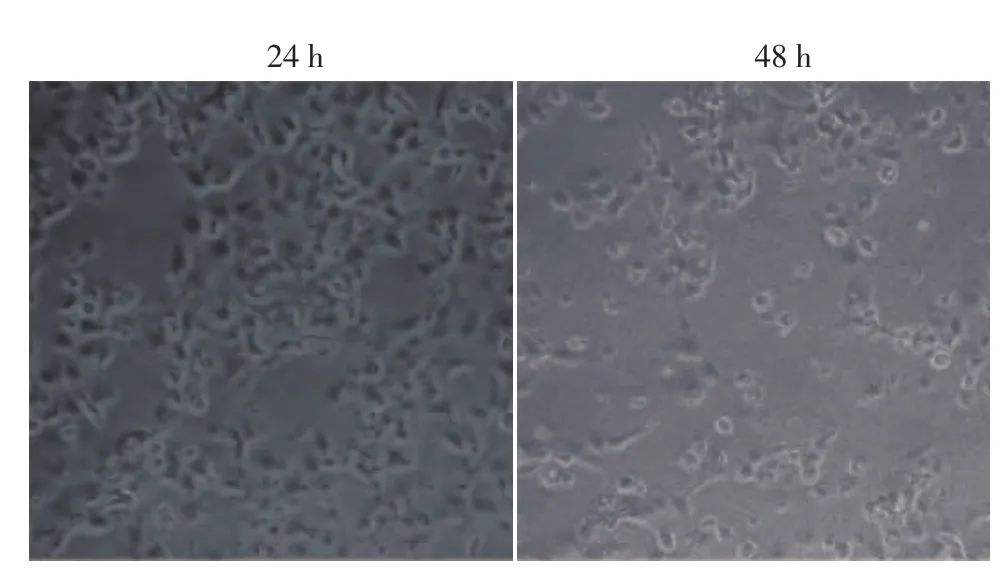
图4 Tet-on过表达慢病毒感染HaCaT细胞经四环素诱导24、48 h后的细胞形态 24 h后的细胞形态发生变化,48 h后的细胞老化,细胞核固缩
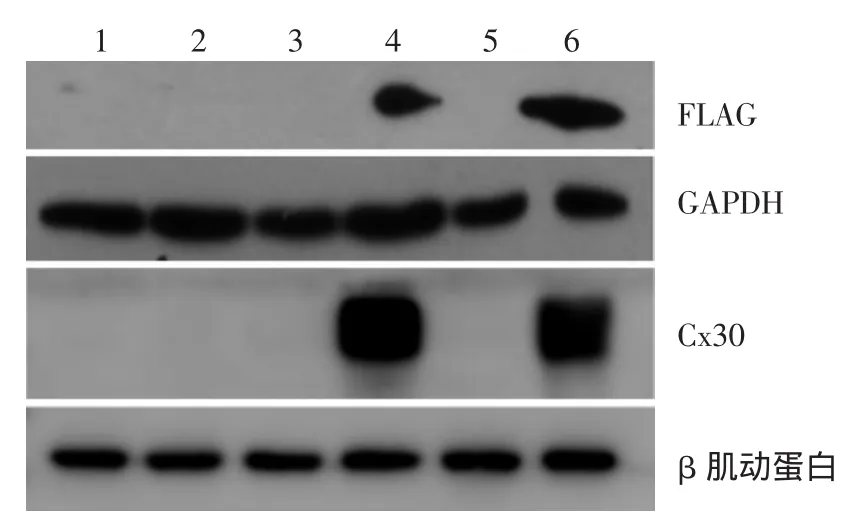
图5 Western印迹检测各组蛋白的表达 经四环素处理的感染野生型Tet-on慢病毒组(WT组)和感染突变型(A88V)Tet-on慢病毒组(MU组)检测到Cx30与FLAG目的条带。1:感染阴性对照病毒的HaCaT细胞组(NC组)不加四环素;2:NC组加四环素;3:WT组不加四环素;4:WT组加四环素;5:MU组不加四环素;6:MU组加四环素
五、HaCaT细胞中Cx30与FLAG的检测
将各实验组细胞裂解并提取蛋白行Western印迹检测,经四环素处理的WT组和MU组检测到Cx30与FLAG目的条带,而未经四环素处理的细胞和NC组细胞未检测到Cx30与FLAG目的条带(图5)。说明稳定株转染成功,且表达受四环素调控。
六、加四环素诱导基因表达后对HaCaT细胞增殖的影响
各组细胞分别培养4、8、12、24、36、48h后测A值(表1)。结果发现,NC组加与不加四环素在各个时间节点的A值差异均无统计学意义(P>0.05);WT组加与不加四环素在 4、8、12、24、36 h 时的A值差异均有统计学意义(P<0.05);MU组加与不加四环素在各时间点差异均有统计学意义(P<0.05)。加入四环素后不同组别间各时段的多重比较采用单向方差分析,LSD法结果提示,加入四环素后NC组与WT组、NC组与MU组、MU组与WT组之间差异均有统计学意义(P<0.05)。

表1 加四环素诱导基因表达后不同时间对HaCaT细胞增殖的影响(A450值)
讨 论
Tet-on基因表达系统是一个由Gossen和Bujard[7]建立的比较成熟的四环素正向诱导的真核生物外源基因诱导表达系统,具有高效、无毒、开关严密等优点。当四环素的衍生物存在时,目的基因高效表达;而撤走药物时,基因一般不被转录[8]。该基因表达系统目前被广泛运用在基因功能研究中。Schrier等[9]使用该表达系统稳定转染了携带FMRP野生型和突变型的PC12细胞株,并研究了FMRP突变体的功能,为该蛋白的功能研究开辟了一个新的途径。Tet-on基因表达系统的这些优势弥补了之前本课题组在构建传统慢病毒载体过程中所遇到的基因表达和终止调控性差等问题,成功稳定构建GJB6野生型与突变型(A88V)HaCaT细胞株。
缝隙连接蛋白(Connexin)是在细胞间通讯中起重要作用的一个蛋白质家族,它们是完整的膜蛋白,形成含水的缝隙连接通道,允许细胞间离子和小代谢分子的扩散交换,协调多细胞组织的新陈代谢活动[10]。间隙连接是介导多细胞生物相邻细胞之间直接进行小分子物质交换的通道,其介导的信息交流在细胞增殖、分化、胚胎发育过程中起到了十分重要的作用。缝隙连接蛋白是组成间隙连接通道的亚单位。目前已发现许多遗传性疾病的发生与缝隙连接蛋白的突变有关[11-13]。
有研究显示,大鼠表皮角质形成细胞(REKs)被表达了A88V突变体后会进入细胞死亡途径,细胞核发生固缩、碎裂,并且可引起细胞膜的破坏,从而导致细胞在突变体表达后的 24 h内死亡[14]。Essenfelder等[15]研究发现,A88V 突变体通过形成异常的间隙连接半通道,导致ATP外流和细胞死亡。我们曾构建过带有绿色荧光的过表达慢病毒载体转染HaCaT细胞,G11R和A88V突变体过表达慢病毒载体转染细胞后,可观察到弱的荧光;V37E突变型未观察到荧光或仅有较弱荧光,且48 h内3种HaCaT细胞均出现大量死亡,细胞无法传代[6]。以至于不能对转染后的HaCaT细胞进行筛选,未得到稳定表达的细胞株,无法确保实验的同步性和统一性。改用Tet-on基因表达系统后,将携带GJB6基因野生型和突变型的过表达慢病毒载体转染到HaCaT细胞,因病毒载体具有抗嘌呤霉素的特性,被成功转染该病毒载体的HaCaT细胞也具备嘌呤霉素抗性,未被转染的细胞没有上述特点,故经过嘌呤霉素筛选后的HaCaT细胞即为转染成功后稳定表达的细胞株。然后,通过四环素的诱导使它们在同一时间点表达该基因的野生型和突变型A88V。实验过程中观察到,四环素诱导突变体A88V在HaCaT细胞内表达后,经过24 h细胞形态即发生变化,部分细胞出现漂浮;48 h后贴壁细胞中部分细胞胞核固缩,细胞出现老化,大部分细胞漂浮。为了进一步了解GJB6基因野生型与突变型A88V经四环素诱导表达后对细胞增殖的影响,我们采用CCK8法进行检测。实验结果发现,WT组和MU组加入四环素的A值与WT组和MU组不加四环素的A值相比差异有统计学意义,说明四环素对感染野生型和突变型(A88V)Tet-on慢病毒的HaCaT细胞的增殖有显著影响;加入四环素后WT组在各时间段的A值比NC组略小,MU组在各时间段的A值明显小于NC组,且加入四环素的WT组与MU组比较后在各时间段的A值具有统计学差异,说明GJB6基因野生型与突变型(A88V)经四环素诱导表达后会不同程度地影响上述两组HaCaT细胞的增殖。
本实验成功构建了突变体A88V和野生型Tet-on慢病毒表达载体,我们将用该方法构建G11R等其他突变体的载体。通过该载体稳定转染HaCaT细胞株后探讨野生型和多种突变型GJB6基因对角蛋白、兜甲蛋白、内披蛋白和丝聚蛋白的作用,从而为阐明GJB6基因突变体引起皮肤角化异常等表型的可能机制奠定基础。该模型不仅有助于揭示有汗性外胚层发育不良的发病机制,还可以探讨与缝隙连接蛋白基因突变相关的其他多种综合征的发病机制,为今后的基因治疗提供实验研究依据。
[1]Lamartine J,Munhoz Essenfelder G,Kibar Z,et al.Mutations in GJB6 cause hidrotic ectodermal dysplasia[J].Nat Genet,2000,26(2):142-144.DOI:10.1038/79851.
[2]Smith FJ,Morley SM,McLean WH.A novel connexin 30 mutation in Clouston syndrome[J].J Invest Dermatol,2002,118(3):530-532.DOI:10.1046/j.0022-202x.2001.01689.x.
[3]Baris HN,Zlotogorski A,Peretz-Amit G,et al.A novel GJB6 missense mutation in hidrotic ectodermal dysplasia 2(Clouston syndrome)broadens its genotypic basis [J].Br J Dermatol,2008,159(6):1373-1376.DOI:10.1111/j.1365-2133.2008.08796.x.
[4]Liu YT,Guo K,Li J,et al.Novel mutations in GJB6 and GJB2 in Clouston syndrome[J].Clin Exp Dermatol,2015,40(7):770-773.DOI:10.1111/ced.12654.
[5]Chen N,Xu C,Han B,et al.G11R mutation in GJB6 gene causes hidrotic ectodermal dysplasia involving only hair and nails in a Chinese family [J].J Dermatol,2010,37 (6):559-561.DOI:10.1111/j.1346-8138.2009.00768.x.
[6]姬灿灿,王震英,燕鹏荣,等.GJB6基因突变体过表达慢病毒载体的构建及其在HaCaT细胞中的表达[J].中国麻风皮肤病杂志,2015,31(1):11-14.Ji CC,Wang ZY,Yan PR,et al.Construction of the over-expression lentivirus vector of the GJB6 gene and the expression in HaCaT cells[J].Chin J Lepr Skin Dis,2015,31(1):11-14.
[7]Gossen M,Bujard H.Tight control of gene expression in mammalian cells by tetracycline-responsive promoters[J].Proc Natl Acad Sci USA,1992,89(12):5547-5551.
[8]Schmeisser F,Donohue M,Weir JP.Tetracycline-regulated gene expression in replication-incompetent herpes simplex virus vectors[J].Hum Gene Ther,2002,13 (18):2113-2124.DOI:10.1089/104303402320987815.
[9]Schrier M,Severijnen LA,Reis S,et al.Transport kinetics of FMRP containing the I304N mutation of severe fragile X syndrome in neurites of living rat PC12 cells[J].Exp Neurol,2004,189(2):343-353.DOI:10.1016/j.expneurol.2004.05.039.
[10]Nakagawa S,Maeda S,Tsukihara T.Structural and functional studies of gap junction channels[J].Curr Opin Struct Biol,2010,20(4):423-430.DOI:10.1016/j.sbi.2010.05.003.
[11]Shiels A,Mackay D,Ionides A,et al.A missense mutation in the human connexin50 gene(GJA8)underlies autosomal dominant"zonular pulverulent"cataract,on chromosome 1q [J].Am J Hum Genet,1998,62(3):526-532.DOI:10.1086/301762.
[12]Li J,Wang Q,Fu Q,et al.A novel connexin 50 gene(gap junction protein,alpha 8)mutation associated with congenital nuclear and zonular pulverulent cataract[J].Mol Vis,2013,19:767-774.
[13]Ghosh S,Kumar A,Chandna S.Connexin-43 downregulation in G2/M phase enriched tumour cells causes extensive low-dose hyper-radiosensitivity (HRS) associated with mitochondrial apoptotic events[J].Cancer Lett,2015,363 (1):46-59.DOI:10.1016/j.canlet.2015.03.046.
[14]Berger AC,Kelly JJ,Lajoie P,et al.Mutations in Cx30 that are linked to skin disease and non-syndromic hearing loss exhibit several distinct cellular pathologies[J].J Cell Sci,2014,127(Pt 8):1751-1764.DOI:10.1242/jcs.138230.
[15]Essenfelder GM,Bruzzone R,Lamartine J,et al.Connexin30 mutations responsible for hidrotic ectodermal dysplasia cause abnormal hemichannel activity[J].Hum Mol Genet,2004,13(16):1703-1714.DOI:10.1093/hmg/ddh191.
Construction of HaCaT cell lines stably expressing the human GJB6 gene by using a Tet-On lentiviral vector and their identification
Lu Yuting,Wang Zhenying,Song Yali,Ji Cancan,Zhang Li
Department of Dermatology,Shandong Provincial Hospital Affiliated to Shandong University,Jinan 250021,China
ObjectiveTo construct HaCaT cell lines stably expressing the wild type human GJB6 gene or its mutant by using a Tet-On lentiviral vector,and to lay an experimental foundation for studies on pathogenesis of hidrotic ectodermal dysplasia.MethodsThe wild-type human GJB6 gene and its mutant(A88V)were amplified by PCR,and then inserted into the Tet-on lentivirus plasmid to construct recombinant lentivirus vectors.The recombinants were identified by gene sequencing and enzymatic digestion.Cultured HaCaT cells were classified into three groups to be transfected with a negative control lentiviral vector (NC group),the lentivirus vector expressing the wild-type human GJB6 gene (WT group),or the lentivirus vector expressing the mutant human GJB6 gene (MU group).Puromycin was used to select HaCaT cell clones stably expressing the GJB6 gene which encodes the connexin 30 (Cx30)protein.The selected HaCaT cell clones were cultured with or without tetracycline for 48 hours,thereafter,real-time PCR(RT-PCR)was performed to detect GJB6 gene mRNA expression,Western-blot analysis to measure expressions of Cx30 and FLAG-tag proteins,and cell counting kit 8 (CCK8)assay to evaluate cellular proliferative activity.ResultsEnzymatic digestion and gene sequencing showed that recombinant lentivirus plasmids were successfully constructed.RT-PCR showed evidently increased mRNA expression of the GJB6 gene in stably transfected HaCaT cells.Moreover,the expression abundance of the GJB6 gene was 112.369 times higher in the WT group induced by tetracycline than in that without tetracycline treatment(P<0.05),and 2.249 times higher in the MU group induced by tetracycline than in that without tetracycline treatment(P< 0.05).Western-blot analysis showed that Cx30 and FLAG-tag proteins were stably expressed in the WT group and MU group after induction with tetracycline,while neither of them was observed in the WT group or MU group without tetracycline treatment,or in the NC group.Significant differences were noted in cellular proliferative activity(expressed as the absorbance value at 450 nm)between the MU group with and without tetracycline treatment and between the WT group with and without tetracycline treatment at 4,8,12,24,36 and 48 hours(allP<0.05),but not between the NC group with and without tetracycline treatment at any of the above time points (allP>0.05).ConclusionHaCaT cell lines which stably express the wild-type GJB6 gene or its mutant(A88V)are successfully constructed.
Ectodermal dysplasia;Connexins;GJB6 gene;HaCaT cells;Tet-on
Zhang Li,Email:zhangliwenzhe@medmail.com.cn
张莉,Email:zhangliwenzhe@medmail.com.cn
10.3760/cma.j.issn.0412-4030.2016.04.009
国家自然科学基金(81171492);山东省自然科学基金(ZR2011HQ056);山东省科技发展计划项目(2010GSF10812、2011GSF11847)
Fund programs:National Natural Science Foundation of China (81171492);Natural Science Foundation of Shandong Province of China (ZR2011HQ056);Shandong Province Science and Technology Development Program(2010GSF10812,2011GSF11847)
2015-08-18)
(本文编辑:颜艳)
