阿维A与干扰素对人皮肤T细胞淋巴瘤细胞株Hut78细胞增殖及白细胞介素15表达的影响
2016-11-02于凯王一宇金仙花李雪朱文静夏建新
于凯王一宇 金仙花 李雪 朱文静 夏建新
252000山东,聊城市人民医院皮肤科(于凯);吉林大学第二医院皮肤科(王一宇、金仙花、李雪、朱文静、夏建新)
阿维A与干扰素对人皮肤T细胞淋巴瘤细胞株Hut78细胞增殖及白细胞介素15表达的影响
于凯王一宇 金仙花 李雪 朱文静 夏建新
252000山东,聊城市人民医院皮肤科(于凯);吉林大学第二医院皮肤科(王一宇、金仙花、李雪、朱文静、夏建新)
目的检测不同浓度阿维A、干扰素α(IFN⁃α)单独或联合应用对人皮肤T细胞淋巴瘤Hut78细胞株的增殖抑制作用及白细胞介素15(IL⁃15)表达的影响。方法将Hut78细胞分为空白对照组、阴性对照组、二甲基亚砜组(DMSO)和实验组,其中实验组分别用0.1~10μmol/L阿维A和5 000~20 000 IU/ml IFN⁃α单独或1.0μmol/L阿维A联合5 000~20 000 IU/m l IFN⁃α作用Hut78细胞,培养24、48、72 h后分别进行测定。CCK8法检测细胞增殖情况,ELISA检测药物处理后细胞的白细胞介素15(IL⁃15)表达情况。结果各浓度阿维A或联合作用组与DMSO组相比及IFN⁃α组与阴性对照组相比,Hut78细胞增殖和IL⁃15表达均受到明显抑制,抑制作用随浓度增加和时间延长而增强。重复测量方差分析显示,阿维A、IFN⁃α单独或联合作用不同时间,细胞增殖抑制率和IL⁃15表达差异均有统计学意义(P<0.05),不同作用浓度之间差异亦有统计学意义(均P<0.05),作用时间与药物浓度之间存在交互作用(均P<0.05)。1.0μmol/L阿维A+10 000或20 000 IU/ml IFN⁃α组与相应浓度药物单独作用组比较,细胞抑制率差异在24、48、72 h时均有统计学意义(P<0.05)。1.0μmol/L阿维A+5 000 IU/m l IFN⁃α组在24、48、72 h时与5 000 IU/m l IFN⁃α组相比,IL⁃15表达差异均有统计学意义(P<0.05);1.0μmol/L阿维A+10 000或20 000 IU/ml IFN⁃α组与相应浓度药物单独作用组之间IL⁃15表达差异在24、48、72 h时均有统计学意义(P<0.05)。结论阿维A和IFN⁃α均对Hut78细胞的增殖有抑制作用,均可下调Hut78细胞IL⁃15的表达,这种作用随着浓度的增加和时间的延长而增强,且两者联合用药优于单独用药。
淋巴瘤,T细胞,皮肤;阿维A;干扰素α;白介素15;细胞增殖;细胞系,肿瘤;Hut78细胞
维A酸类药物是一组与天然维生素A结构类似的化合物,可调节上皮细胞等的生长和分化,对恶性细胞生长有抑制作用,还可调节免疫和炎症过程等。干扰素(IFN)是病毒或其诱导剂诱导人体细胞产生的一种糖蛋白,有病毒抑制、抗肿瘤及免疫调节作用。IFN⁃α⁃2b被广泛用于皮肤T细胞淋巴瘤(CTCL)的治疗,可以有效控制早期蕈样肉芽肿,对肿瘤期患者及Sézary综合征患者也是一线治疗药物[1]。我们通过体外培养人T细胞淋巴瘤细胞株Hut78,观察阿维A和IFN⁃α对细胞生长的影响,初步探讨其作用机制,为临床治疗皮肤T细胞淋巴瘤提供新的思路。
一、材料和方法
1.细胞、试剂和仪器:人T细胞淋巴瘤细胞株Hut78来自中国科学院上海细胞库。培养基为含20%胎牛血清的IMDM(Iscove′smodified Dulbeccomedium,美国Gibco公司),并添加100 U/m l青霉素和100 g/L链霉素(上海谱振生物科技有限公司)。阿维A胶囊(重庆华邦公司惠赠,规格:10mg,产品批号:2012034),重组人IFN⁃α⁃2b注射液(天津华立达生物工程有限公司惠赠,规格:300万IU/ml,批号:sa120601),CCK8细胞增殖及细胞毒性检测试剂盒、人白细胞介素15(IL⁃15)ELISA试剂盒(武汉博士德生物有限公司),二甲基亚砜(DMSO)来自北京化学试剂公司。
2.药物配制:避光条件下称取阿维A粉末(纯度>99.0%),用DMSO配制成10mmol/L,吹打混匀,过滤除菌,分装于1.5ml Eppendorf管中,置于-20℃冰箱避光储存。使用前用IMDM培养液稀释成3个浓度:0.1、1.0、10μmol/L,即配即用。用IMDM培养基稀释IFN⁃α至终浓度5 000、10 000、20 000 IU/ml,即用即配。
3.细胞分组及处理:设空白对照组(只加入培养基)、阴性对照组(只加入单细胞悬液)、DMSO组(加入单细胞悬液,DMSO体积分数为0.1%)和实验组,实验组又分为阿维A组、IFN⁃α组、联合组,阿维A组细胞分别用0.1、1.0、10μmol/L阿维A处理[2],IFN⁃α组分别用5 000、10 000、20 000 IU/ml IFN⁃α处理[3];预实验中10μmol/L阿维A对细胞增殖抑制作用极其明显,为避免其掩盖不同浓度IFN⁃α所产生的影响,故联合组细胞分别用1.0μmol/L阿维A+5 000 IU/ml IFN⁃α、1.0μmol/L阿维A+10 000 IU/m l IFN⁃α、1.0μmol/L阿维A+20 000 IU/ml IFN⁃α处理。各组每个药物浓度分别设3个复孔,各孔最终体积均为100μl,细胞浓度为4×104个/ml。将细胞置于96孔板上,在37℃、5%CO2的培养箱中培养,直到细胞胞质饱满、均匀悬浮于视野方可加药,联合组两种药物同时加入。加药后于培养箱中培养24、48、72 h后分别进行测定。
4.电镜下观察细胞形态:于药物干预后24、48、72 h在电镜下观察各组细胞形态,并拍照。
5.CCK8法检测细胞增殖:在细胞培养结束前1 h,每孔加入10μlCCK⁃8溶液,继续孵育1 h。用全自动酶标仪于波长450 nm处测定吸光度(A值),根据以下公式计算细胞增殖抑制率,抑制率(%)=(1-试验组A值/阴性对照组A值)×100%。
6.ELISA测定阿维A及IFN⁃α作用前后人Hut78细胞IL⁃15表达情况:将药物干预后的细胞悬液吸出、离心,按原分组将90μl上清液置于已包被抗体的酶标板孔中,并增加1孔作为空白显色孔,同时设不同浓度标准品对照孔和调零孔,按照试剂盒说明书操作,最后用酶标仪在450 nm波长处测定A值。根据标准曲线确定样品IL⁃15表达水平。
二、结果
1.阿维A、IFN⁃α对Hut78细胞增殖的影响:见表1。
(1)阿维A组:与DMSO组相比,阿维A组Hut78细胞增殖受到明显抑制,随着浓度的增加和时间的延长,抑制作用逐渐增强,以10.0μmol/L阿维A作用72 h的抑制率最高。不同作用时间之间增殖抑制率差异有统计学意义(F=1 261.413,P<0.05),作用时间与药物浓度之间存在交互作用(F=16.879,P<0.05),不同药物浓度之间增殖抑制率差异有统计学意义(F=92.503,P<0.05)。
(2)IFN⁃α组:与阴性对照组相比,IFN⁃α组Hut78细胞增殖受到明显抑制,随着浓度的增加和时间的延长,抑制作用逐渐增强,且以20 000 IU/m l IFN⁃α组作用72 h的抑制率最高。不同作用时间之间及不同药物浓度之间增殖抑制率差异均有统计学意义(F=744.426、165.536,P<0.05),作用时间与药物浓度之间存在交互作用(F=21.300,P<0.05)。
(3)阿维A和IFN⁃α联合组:与DMSO组相比,1.0μmol/L阿维A联合不同浓度IFN⁃α对Hut78细胞有明显的增殖抑制作用,随着IFN⁃α浓度增加和药物作用时间延长,抑制作用逐渐增强,且以阿维A+20 000 IU/ml IFN⁃α组作用72 h的抑制率最高。不同作用时间之间及不同药物浓度之间增殖抑制率差异均有统计学意义(F=2 927.877、417.025,P<0.05),作用时间与药物浓度之间存在交互作用(F=66.586,P<0.05)。
1.0 μmol/L阿维A+5 000 IU/ml IFN⁃α组与1.0μmol/L阿维A组及5 000 IU/ml IFN⁃α组之间细胞抑制率差异在24、48、72 h时均无统计学意义(P>0.05);1.0μmol/L阿维A+10 000 IU/ml IFN⁃α组与1.0μmol/L阿维A组及10 000 IU/ml IFN⁃α组之间、1.0μmol/L阿维A+20 000 IU/m l IFN⁃α组与1.0μmol/L阿维A组及20 000 IU/m l IFN⁃α组之间细胞抑制率差异在24、48、72 h时均有统计学意义(P<0.05)。
2.倒置显微镜观察细胞形态变化:阴性对照组细胞生长良好,大小较一致,部分抱团生长,呈圆形或椭圆形,胞质饱满,细胞膜完整,折光性好,圆形胞核居胞质中央;经阿维A和IFN⁃α作用后,细胞生长慢,细胞形态发生显著变化,细胞皱缩、破碎,部分形成细胞碎片,失去原有的形态,折光性差,随着作用时间的延长,细胞数明显减少。见图1。
表1 阿维A和干扰素(IFN)⁃α单独或联合作用不同时间对Hut78细胞增殖以及白细胞介素15(IL⁃15)蛋白表达的影响(±s)
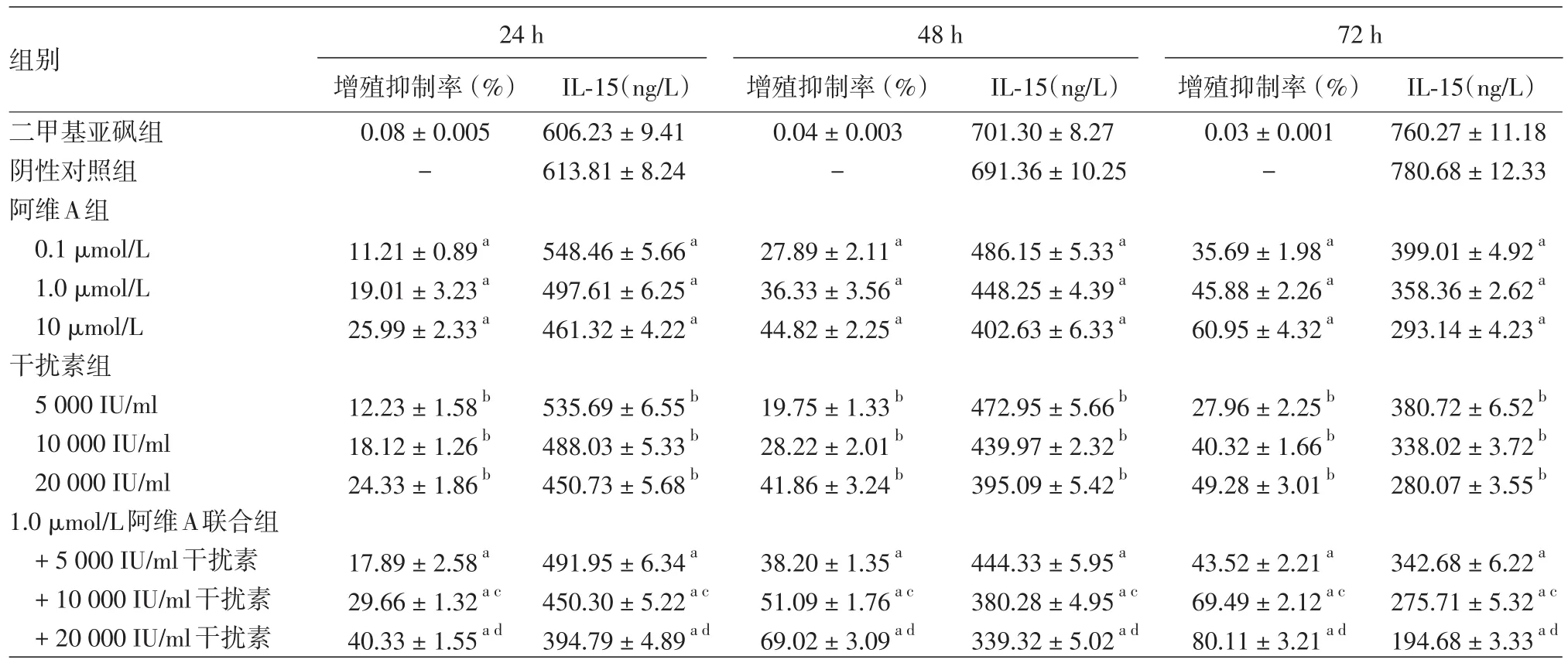
表1 阿维A和干扰素(IFN)⁃α单独或联合作用不同时间对Hut78细胞增殖以及白细胞介素15(IL⁃15)蛋白表达的影响(±s)
注:n=3。a:与二甲基亚砜组相比,P<0.05;b:与阴性对照组相比,P<0.05;c:与1.0μmol/L阿维A组及10 000 IU/ml干扰素组相比,P<0.05;d:与1.0μmol/L阿维A组及20 000 IU/m l干扰素组相比,P<0.05
组别二甲基亚砜组阴性对照组阿维A组0.1μmol/L 1.0μmol/L 10μmol/L干扰素组5 000 IU/m l 10 000 IU/m l 20 000 IU/m l 1.0μmol/L阿维A联合组+5 000 IU/m l干扰素+10 000 IU/ml干扰素+20 000 IU/m l干扰素24 h增殖抑制率(%)0.08±0.005-11.21±0.89a 19.01±3.23a 25.99±2.33a 12.23±1.58b 18.12±1.26b 24.33±1.86b 17.89±2.58a 29.66±1.32ac 40.33±1.55ad IL⁃15(ng/L)606.23±9.41 613.81±8.24 548.46±5.66a 497.61±6.25a 461.32±4.22a 535.69±6.55b 488.03±5.33b 450.73±5.68b 491.95±6.34a 450.30±5.22ac 394.79±4.89ad 48 h增殖抑制率(%)0.04±0.003-27.89±2.11a 36.33±3.56a 44.82±2.25a 19.75±1.33b 28.22±2.01b 41.86±3.24b 38.20±1.35a 51.09±1.76ac 69.02±3.09ad IL⁃15(ng/L)701.30±8.27 691.36±10.25 486.15±5.33a 448.25±4.39a 402.63±6.33a 472.95±5.66b 439.97±2.32b 395.09±5.42b 444.33±5.95a 380.28±4.95ac 339.32±5.02ad 72 h增殖抑制率(%)0.03±0.001-35.69±1.98a 45.88±2.26a 60.95±4.32a 27.96±2.25b 40.32±1.66b 49.28±3.01b 43.52±2.21a 69.49±2.12ac 80.11±3.21ad IL⁃15(ng/L)760.27±11.18 780.68±12.33 399.01±4.92a 358.36±2.62a 293.14±4.23a 380.72±6.52b 338.02±3.72b 280.07±3.55b 342.68±6.22a 275.71±5.32ac 194.68±3.33ad
3.Hut78细胞IL⁃15表达情况:见表1。
(1)阿维A组:与DMSO组相比,阿维A在0.1~10.0μmol/L浓度范围内对Hut78细胞IL⁃15的表达有明显抑制作用,随着浓度增加和时间延长,抑制作用逐渐增强,且以10.0μmol/L浓度组作用72 h的抑制率最高。不同作用时间之间及不同药物浓度之间IL⁃15表达水平差异均有统计学意义(F=24 269.350、260.245,P<0.05),作用时间与药物浓度之间存在交互作用(F=87.572,P<0.05)。

图1不同组Hut78细胞培养48 h后生长情况(×100)1A:阴性对照组细胞生长良好,大小较一致,部分抱团生长,呈圆形或椭圆形,胞质饱满,胞膜完整,折光性好,圆形胞核居胞质中央;1B~1D:分别为1.0μmol/L阿维A组、10 000 IU/m l干扰素α组、1.0μmol/L阿维A+10 000 IU/m l干扰素α组,细胞形态发生显著变化,细胞皱缩、破碎,部分形成细胞碎片,失去原有的形态,折光性差。联合组细胞皱缩、破碎的程度更加明显
(2)IFN⁃α组:与阴性对照组相比,IFN⁃α对Hut78细胞IL⁃15的表达有明显抑制作用,随着浓度增加和时间延长,抑制作用逐渐增强,且以20 000 IU/ml浓度组作用72 h的抑制率最高。不同作用时间之间及不同药物浓度之间IL⁃15表达水平差异均有统计学意义(F=3 524.983、390.785,P<0.05),作用时间与药物浓度之间存在交互作用(F=9.553,P<0.05)。
(3)阿维A和IFN⁃α联合组:与DMSO组相比,阿维A联合IFN⁃α对Hut78细胞IL⁃15的表达有明显的抑制作用,随着浓度增加和时间延长,抑制作用逐渐增强,且以1.0μmol/L阿维A和20 000 IU/ml IFN⁃α联合作用72 h的抑制率最高。不同作用时间之间及不同药物浓度之间IL⁃15表达水平差异均有统计学意义(F=133 039.386、336.793,P<0.05),作用时间与药物浓度之间存在交互作用(F=1 158.045,P<0.05)。
1.0 μmol/L阿维A+5 000 IU/m l IFN⁃α组在24、48 h时与1.0μmol/L阿维A组相比IL⁃15表达差异均无统计学意义(P>0.05),在24、48、72 h时与5 000 IU/ml IFN⁃α组相比IL⁃15表达差异均有统计学意义(P<0.05);1.0μmol/L阿维A+10 000 IU/ml IFN⁃α组与1.0μmol/L阿维A组及10 000 IU/ml IFN⁃α组之间、1.0μmol/L阿维A+20 000 IU/ml IFN⁃α组与1.0μmol/L阿维A组及20 000 IU/m l IFN⁃α组之间IL⁃15表达在24、48、72 h时差异均有统计学意义(P<0.05)。
三、讨论
阿维A临床上主要用于治疗各型银屑病和角化性皮肤病等[4⁃5]。近年来,其抗肿瘤作用日益受到重视[6]。某些类型肿瘤对维A酸的敏感性低,探索其他药物与维A酸的联合应用是必要的。IFN⁃α通过介导抗血管生成作用和激活免疫反应,发挥抗增殖和诱导凋亡的作用[7⁃8],IFN⁃α⁃2b已被广泛用于治疗CTCL,但其具体治疗机制尚未明确。我们体外评估阿维A和IFN⁃α单独或联合应用对Hut78细胞增殖的影响,并初步探讨其作用机制。
我们发现,阿维A和IFN⁃α均可抑制Hut78细胞增殖,并且呈浓度依赖性。随着作用时间延长,阿维A和IFN⁃α对Hut78细胞的增殖抑制作用逐渐增强,表现出时间依赖性。而且,阿维A联合IFN⁃α的抑制率高于二者单独用药,表明两药联合应用有协同作用,可有效抑制CTCL的生长。
有文献报道,人急性T淋巴细胞白血病、CTCL肿瘤细胞表达IL⁃15Rα,IL⁃15能够和其受体结合,促进肿瘤细胞增殖[9]。研究发现,CTCL中IL⁃15和IL⁃16过度表达[10]。但也有文献报道,IFN通过上调IL⁃15发挥抗肿瘤作用[11]。本研究结果显示,阿维A、IFN⁃α均可抑制Hut78细胞表达IL⁃15,并呈剂量依赖性。随着作用时间延长,不同浓度阿维A和IFN对Hut78细胞IL⁃15表达的抑制作用逐渐增强。并且阿维A与IFN⁃α联合应用有协同作用。本研究结论与IFN可作用于多种细胞产生IL⁃15的结论[11]相反,推测原因可能是:①阿维A与IFN⁃α诱导Hut78细胞的凋亡作用大于促进IL⁃15表达的作用,从而间接导致Hut78细胞表达IL⁃15的总量减少;②体内外环境不同导致IFN抗肿瘤的机制产生变化。
本研究表明,阿维A可协同IFN⁃α对人皮肤T细胞淋巴瘤Hut78的增殖产生抑制作用,为皮肤T细胞淋巴瘤的临床治疗提供了新的思路和理论依据。
[1]Criscione VD,Weinstock MA.Incidence of cutaneous T⁃cell lymphoma in the United States,1973⁃2002[J].Arch Dermatol,2007,143(7):854⁃859.DOI:10.1001/archderm.143.7.854.
[2]刘雁.阿维A酸联合干扰素对小鼠黑色素瘤细胞株B16作用的研究[D].石家庄,河北医科大学,2009.DOI:10.7666/d.y1636541.Liu Y.The mechanism of acitretin combined INF on malignant melanoma B16 cells[D].Shijiazhuang,HebeiMedical University,2009.DOI:10.7666/d.y1636541.
[3]谷晓广,汪旸,张高磊.IFN⁃α对人皮肤淋巴瘤细胞系Hut78的影响[J].中国皮肤性病学杂志,2012,26(10):871⁃874,879.Gu XG,Wang Y,Zhang GL.The effects of IFN⁃αon human cutaneous T⁃cell lymphoma cell line Hut78[J].Chin J Dermatovenereol,2012,26(10):871⁃879.
[4]Lee CS,Koo J.A review of acitretin,a systemic retinoid for the treatment of psoriasis[J].Expert Opin Pharmacother,2005,6(10):1725⁃1734.
[5]罗权,张锡宝.阿维A治疗儿童角化性疾病的研究现状[J].国际皮肤性病学杂志,2006,32(3):136⁃138.DOI:10.3760/cma.j.issn.1673⁃4173.2006.03.002.Luo Q,Zhang XB.Acitretin in the treatment of cutaneous disorders of keratinization in children[J].Int JDermatol Venereol,2006,32(3):136⁃138.DOI:10.3760/cma.j.issn.1673⁃4173.2006.03.002.
[6]Otley CC,Stasko T,Tope WD,et al.Chemoprevention of nonmelanoma skin cancer with systemic retinoids:practical dosing and management of adverse effects[J].Dermatol Surg,2006,32(4):562⁃568.DOI:10.1111/j.1524⁃4725.2006.32115.x.
[7]Ahtiainen L,Mirantes C,Jahkola T,et al.Defects in innate immunity render breast cancer initiating cells permissive to oncolytic adenovirus[J/OL].PLoS One,2010,5(11):e13859[2014⁃01⁃03].http://journals.plos.org/plosone/article?id=10.1371/journal.pone.0013859.DOI:10.1371/journal.pone.0013859.
[8]Williams RF,Sims TL,Tracey L,et al.Maturation of tumor vasculature by interferon⁃beta disrupts the vascular niche of glioma stem cells[J].Anticancer Res,2010,30(9):3301⁃3308.
[9]Kukita T,Arima N,Matsushita K,etal.Autocrineand/or paracrine growth of adult T⁃cell leukaemia tumour cells by interleukin 15[J].Br JHaematol,2002,119(2):467⁃474.
[10]Leroy S,Dubois S,Tenaud I,et al.Interleukin⁃15 expression in cutaneous T⁃cell lymphoma(mycosis fungoides and Sézary syndrome)[J].Br JDermatol,2001,144(5):1016⁃1023.
[11]Fuertes MB,Woo SR,Burnett B,etal.Type I interferon response and innate immune sensing of cancer[J].Trends Immunol,2013,34(2):67⁃73.DOI:10.1016/j.it.2012.10.004.
Effects of acitretin and interferon on the proliferative activity of and interleukin⁃15 expression in a human cutaneous T⁃cell lymphoma cell lineHut78
Yu Kai,Wang Yiyu,Jin Xianhua,LiXue,ZhuWenjing,Xia Jianxin
Department ofDermatology,Liaocheng People′s Hospital,Liaocheng 252000,Shandong,China(Yu K);Department of Dermatology,The Second Hospital ofJilin University,Changchun 130041,China(Wang YY,Jin XH,LiX,ZhuWJ,Xia JX)
Xia Jianxin,Email:911469806@qq.com
Objective To evaluate effects of acitretin and interferon⁃α(INF⁃α)alone or in combination on the proliferative activity of and interleukin⁃15 expression in human cutaneous T⁃cell lymphoma Hut78 cells.M ethods Cultured Hut78 cellswere divided into severalgroups,including blank controlgroup,negative control group,dimethyl sulphoxide(DMSO)group and experimental groups.Cells in experimental groups were additionally classified into severalsubgroups tobe treatedwith acitretin(0.1-10μmol/L,acitretin groups)or INF⁃α(5 000-20 000 IU/ml,INF⁃α groups)alone,or the combination of 1.0μmol/L acitretin and IFN⁃αat concentrations of 5 000-20 000 IU/m l(combination groups),for24,48 and 72 hours.Subsequently,cell counting kit8(CCK8)assaywasperformed toassess the proliferative activity ofHut78 cells,and enzyme⁃linked immunosorbentassay(ELISA)tomeasure the expression of IL⁃15 in these cells.Results The proliferative activity of and IL⁃15 expression in Hut78 cellswere both obviously suppressed in the acitretin groups and combination groups compared with the DMSO group,aswell as in the INF⁃α groups compared with the negative control group,and the inhibitory effects gradually increased with the increase in acitretin or INF⁃αconcentrations and treatment durations.As repeatedmeasures analysis of variance revealed,there wasasignificantdifference in both proliferation inhibition ratesand IL⁃15 expression amongdifferent treatmentdurations and among different concentrations of acitretin or INF⁃α(allP<0.05),and there was an interaction effect between treatment durations and drug concentrations(allP<0.05).A significant differencewas observed in both proliferation inhibition rates and IL⁃15 expression at 24,48 and 72 hourswhen the 1.0⁃μmol/L acitretin+10 000/20 000⁃IU/ml IFN⁃αgroup was compared with the 1.0⁃μmol/L acitretin group and 10 000/20 000 IU/ml IFN⁃αgroup(allP<0.05).There was also a significantdifference in IL⁃15 expression at24,48 and 72 hours between the 1.0⁃μmol/L acitretin+50 000⁃IU/ml IFN⁃αgroup and 5 000⁃IU/ml IFN⁃αgroup(allP<0.05).Conclusions Acitretin and IFN⁃αboth can inhibit the proliferation ofand IL⁃15 expression in Hut78 cells,the inhibitory effects are enhanced with the increase in drug concentrations and treatment durations,and the combination of acitretin and IFN⁃αappears to have stronger inhibitory effects than acitretin or IFN⁃αalone.
Lymphoma,T⁃cell,cutaneous;Acitretin;Interferon⁃alpha;Interleukin⁃15;Cell proliferation;Cell line,tumor;Hut78 cells
夏建新,Email:911469806@qq.com
10.3760/cma.j.issn.0412⁃4030.2016.11.013
吉林省科技发展项目(20130413015GH)
Fund program:Science and Technology DevelopmentProjectof Jilin Province(20130413015GH)
2015⁃09⁃11)
(本文编辑:尚淑贤)
