药疹患者血清Th22细胞相关细胞因子和补体蛋白水平变化研究
2016-11-02臧丹丹张家祥叶良平杨鹏黄健朱启星
臧丹丹 张家祥 叶良平 杨鹏 黄健 朱启星
230032合肥,安徽医科大学公共卫生学院职业卫生与环境卫生学系(臧丹丹、张家祥、杨鹏、黄健);安徽医科大学第一附属医院皮肤病研究所(叶良平、朱启星)
药疹患者血清Th22细胞相关细胞因子和补体蛋白水平变化研究
臧丹丹 张家祥 叶良平 杨鹏 黄健 朱启星
230032合肥,安徽医科大学公共卫生学院职业卫生与环境卫生学系(臧丹丹、张家祥、杨鹏、黄健);安徽医科大学第一附属医院皮肤病研究所(叶良平、朱启星)
目的了解药疹患者治疗前后血清中Th22细胞相关因子及补体相关指标表达水平的变化,探索其在药疹发生发展中的可能作用。方法35例药疹患者,以1∶1的比例匹配性别、年龄一致的健康对照者,分别采集药疹患者治疗前后及对照组外周血5m l。采用酶联免疫吸附试验(ELISA)和流式液相多重蛋白定量技术(CBA)检测血清中白细胞介素22(IL⁃22)、IL⁃13、肿瘤坏死因子α(TNF⁃α)及补体蛋白C3a、C4a、C5a。结果治疗前,药疹患者血清中IL⁃22[(40.85±14.56)ng/L]、IL⁃13[(869.94±463.39)ng/L]、TNF⁃α[(1.03±0.64)ng/L]及补体C3a[(55.21±32.98)ng/L]、C4a[(285.11±123.91)ng/L]、C5a表达水平[(279.68±127.72)ng/L]明显高于对照组(分别为29.09±8.66、372.92±151.75、0.44±0.31、42.44±14.26、237.00±63.57和215.98±65.38 ng/L),差异均有统计学意义(t值分别为5.549、6.071、4.321、2.832、2.257、2.495,均P<0.05)。治疗后,药疹患者血清IL⁃22[(32.72±11.77)ng/L]、IL⁃13[(456.21±123.22)ng/L]、TNF⁃α[(0.64±0.39)ng/L]、C3a[(45.47±21.11)ng/L]、C4a[(241.86±84.12)ng/L]、C5a表达水平[(239.61±103.51)ng/L]均低于治疗前,差异均有统计学意义(t值分别为4.443、5.197、3.572、3.213、2.728、4.772,均P≤0.01),且除IL⁃22、IL⁃13水平仍高于对照组外(P<0.05),TNF⁃α及补体C3a、C4a、C5a水平与对照组差异无统计学意义(均P>0.05)。相关性分析显示,药疹患者治疗前血清补体C3a与C4a(r=0.660)、C5a(r=0.404),C4a与C5a(r=0.501)表达水平呈正相关,均P<0.05,IL⁃22表达水平与补体C3a水平呈负相关(r=-0.490,P=0.005),与TNF⁃α表达水平呈正相关(r=0.573,P=0.005)。结论Th22细胞相关细胞因子及补体活化在药疹发生发展过程中可能起重要作用,且IL⁃22可能参与补体蛋白的调控。
药疹;白细胞介素13;肿瘤坏死因子α;补体C3a;补体C4a;补体C5a;Th22细胞;白细胞介素22
目前药疹的发病机制尚不清楚,研究发现,T细胞的活化和功能发挥在重症药疹发病中发挥重要作用[1]。Th22细胞是近年发现的新型辅助性T细胞亚群,表型特征为CCR4+CCR6+CCR10+,分泌白细胞介素22(interleukin⁃22,IL⁃22)、IL⁃13、肿瘤坏死因子α(tumor necrosis factor⁃α,TNF⁃α)等细胞因子[2]。由于CCR4和CCR10是皮肤归巢受体,因此被认为与皮肤的病理生理及稳态有着密不可分的联系[3]。本研究收集药疹患者血清,检测其Th22细胞分泌相关细胞因子(IL⁃22、IL⁃13、TNF⁃α)及部分补体活化指标(C3a、C4a、C5a)变化情况,探讨Th22细胞及补体激活在药疹发病过程中的可能作用机制。
材料与方法
一、病例资料
收集2014年9月至2016年3月安徽医科大学第一附属医院皮肤科收治的住院药疹患者35例,按照性别、年龄匹配健康对照组35例,为安徽医科大学第一附属医院健康体检中心的健康体检者。药疹患者年龄26~80(50.14±13.87)岁,对照组24~77(49.45±12.79)岁,两组年龄差异无统计学意义(t=1.441,P=0.159)。两组性别比例一致,均为男18例、女17例。药疹患者潜伏期4~21 d,其中有明确过敏史12例。
致敏药物根据《实用药物指南》[4]进行分类。药疹的诊断及分类依据文献[5]:明确的用药史、潜伏期及各型药疹的典型临床皮损,同时排除有类似皮损的其他皮肤疾病和发疹型传染病。
35例药疹患者分别诊断为麻疹样或猩红热样药疹,致病药物主要为青霉素类、头孢菌素类和解热镇痛类药物。停用致敏及可能致敏的药物,慎用结构相近似的药物,多饮水或静脉输液。同时可予以抗组胺药物、维生素C及钙剂等,必要时给予小剂量泼尼松。局部以红斑、丘疹为主者外用炉甘石洗剂或糖皮质激素制剂,以糜烂渗出为主者可用0.1%依沙吖啶或3%硼酸溶液等间歇湿敷。35例药疹患者中12例治愈后出院,23例好转后出院。
分别收集药疹住院患者治疗前(入院第1天)和治疗后出院当天的静脉血5m l,对照组取体检当天静脉血5m l。
本研究经过安徽医科大学生物医学伦理委员会审批,所有受检者均签署知情同意书。
二、试剂及仪器
IL⁃22、IL⁃13酶联免疫吸附试验(ELISA)试剂盒(武汉优尔生公司),流式液相多重蛋白定量(CBA)人过敏毒素试剂盒、CBA人Th1/Th2/Th17细胞因子试剂盒(美国BD公司);Universal 320/320R型低温高速离心机(德国Hettich公司),μQuant酶标仪(美国BioTek公司),FACSVerse三激光八色流式细胞仪(美国BD公司)。
三、检测方法
抽取空腹静脉血5ml,静置1 h后,3 000 r/min离心15min(离心半径87mm),取上层血清。ELISA法检测IL⁃22和IL⁃13表达水平,CBA法检测TNF⁃α、C3a、C4a和C5a表达水平,操作步骤按试剂盒说明书进行。
四、统计学处理
采用SPSS 16.0软件分析患者的年龄、性别、过敏史、潜伏期、致敏药物等临床资料,计量数据以±s表示,采用正态性检验、配对t检验和相关性分析。
表1 药疹患者血清Th22细胞相关细胞因子和补体蛋白水平检测结果(±s,ng/L)
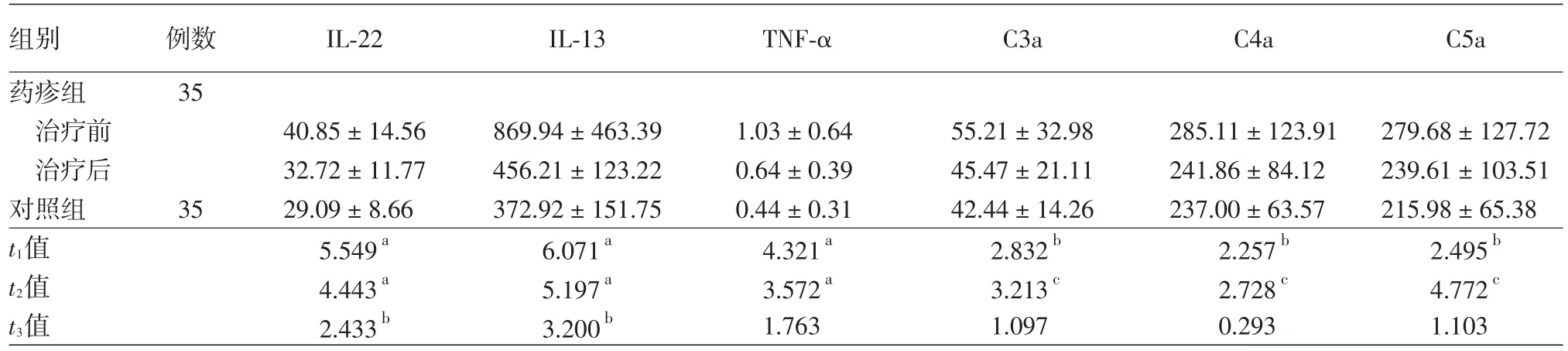
表1 药疹患者血清Th22细胞相关细胞因子和补体蛋白水平检测结果(±s,ng/L)
注:t1值:药疹患者组治疗前与对照组比较;t2值:药疹患者组治疗前后比较;t3值:药疹患者组治疗后与对照组比较。a:P<0.001;b:P<0.05;c:P≤0.01;IL:白细胞介素;TNF⁃α:肿瘤坏死因子α
组别药疹组治疗前治疗后对照组t1值t2值t3值例数35 35 IL⁃22 40.85±14.56 32.72±11.77 29.09±8.66 5.549a 4.443a 2.433b IL⁃13 869.94±463.39 456.21±123.22 372.92±151.75 6.071a 5.197a 3.200b TNF⁃α 1.03±0.64 0.64±0.39 0.44±0.31 4.321a 3.572a 1.763 C3a 55.21±32.98 45.47±21.11 42.44±14.26 2.832b 3.213c 1.097 C4a 285.11±123.91 241.86±84.12 237.00±63.57 2.257b 2.728c 0.293 C5a 279.68±127.72 239.61±103.51 215.98±65.38 2.495b 4.772 c 1.103
结果
一、Th22细胞相关细胞因子检测结果
检测结果见表1。药疹患者治疗前血清中IL⁃22、IL⁃13、TNF⁃α表达水平均高于对照组,差异均有统计学意义(P<0.001);治疗后均显著低于治疗前水平(P<0.001),但IL⁃22、IL⁃13水平仍高于对照组(均P<0.05),而TNF⁃α水平与对照组差异无统计学意义(P=0.089)。
二、血清补体相关指标检测结果
检测结果见表1。药疹患者治疗前血清补体C3a、C4a、C5a水平高于对照组,差异均有统计学意义(P<0.05);治疗后均显著低于治疗前水平,差异均有统计学意义(P≤0.01),但与对照组比较差异均无统计学意义(P>0.05)。
三、相关性分析
经相关分析,治疗前药疹患者血清补体蛋白C3a的表达水平与C4a(r=0.660)、C5a(r=0.404)表达水平呈正相关,均P<0.05;补体蛋白C4a与C5a表达水平亦呈正相关(r=0.501,P=0.004);血清IL⁃22的表达水平与C3a表达水平呈负相关(r=-0.490,P=0.005),与TNF⁃α表达水平呈正相关(r=0.573,P=0.005)。其他指标分析尚未发现相关性。
讨论
Th22细胞是近年来发现的一种不同于Th1、Th2、Th17的新型CD4+T细胞亚群,可以分泌IL⁃22、TNF⁃α、IL⁃13等细胞因子[2,6]。IL⁃22可由Th1、Th17和Th22等细胞产生,但主要由Th22细胞产生[7]。IL⁃13是由活化T细胞产生的多效应性因子,可通过由IL⁃4Rα、IL⁃13Rα1、IL⁃13α2组成的复杂受体系统发挥效应,激活Janus蛋白激酶/信号转导分子及转录激活子(JAK/STAT)信号通路发挥功能[8]。TNF⁃α作为一种前炎性因子,可由Th1、Th17、Th22等细胞分泌[9]。初始T细胞经单一IL⁃6刺激后即可分化为Th22细胞,TNF⁃α及维生素D可增强IL⁃6的刺激诱导效应[10]。Th22细胞的功能主要通过IL⁃22实现,IL⁃22可以通过与相应受体IL⁃22R结合进而激活STAT信号通路发挥作用。由于IL⁃22R主要存在于皮肤、胃肠道、呼吸道等身体屏障部位的上皮细胞中,尤其在角质形成细胞高表达,因此被认为是参与炎症性皮肤病发生发展的重要因素[11]。
Th22细胞在炎症性疾病的发病过程中作用复杂,具体发挥促炎还是抑炎作用还存在争议。其主要效应因子IL-22在皮肤中的作用具有两面性,主要体现在对角质形成细胞的作用,既可以是保护性的,也可以是有害的。在药疹患者血清中TNF⁃α表达升高[12]。Caproni等[13]发现,与健康对照相比,药疹患者血清中IL⁃13、TNF⁃α表达升高,且重症药疹患者血清IL⁃13、TNF⁃α水平明显高于轻症药疹患者。本研究中药疹患者治疗前血清中IL⁃22、IL⁃13、TNF⁃α表达水平均显著高于对照组,治疗后较治疗前显著降低,其中TNF⁃α表达水平恢复到正常水平,而IL⁃22、IL⁃13水平仍高于对照组。提示Th22细胞相关细胞因子在药疹的发生发展过程中可能起到重要作用。
Eyerich等[14]发现,IL⁃22和TNF⁃α可促进补体因子C1r和C1q的表达,提示高表达的IL⁃22和TNF⁃α可能促进补体的激活。也有研究[15⁃16]发现,在产气梭状芽孢杆菌引起的肠道损伤模型中,IL⁃22可以通过调节补体系统进而调控病原微生物的清除。补体系统是体内重要的免疫效应系统和效应放大系统,包括30余种可溶性蛋白和膜蛋白。补体的各种成分可循经典途径、甘露糖结合凝集素活化(MBL)途径或旁路途径依次被激活,激活C3后通过共同的末端通路,最终形成具有溶解细胞作用的膜攻击复合物(MAC)C5b-9参与机体免疫效应机制[17⁃18]。正常情况下,机体补体的激活处于严格的调控之下,从而有效地维持机体免疫系统的自稳状态;但当某些机体内外环境发生变化,引起补体被过度激活时,可导致其功能紊乱,造成机体多种组织和器官的损伤[19⁃20]。Navi等[21]通过组织活检发现,药物引起的大疱性皮炎病灶周围表皮下有中性粒细胞浸润,直接免疫荧光法检查显示,真皮表皮结合处有补体C3的沉积。以上研究提示,补体C3在药疹发生发展中起到重要作用。
补体在活化过程中产生多种具有炎症介质作用的活性片段,如C3a、C4a、C5a。其中C3a和C5a不仅具有强大的趋化作用,参与炎性细胞的招募,还具有过敏毒素作用,可使肥大细胞和嗜碱性粒细胞脱颗粒,释放活性介质,介导局部炎症反应。除参与炎症反应外,C3a和C5a还可与多种免疫细胞相互作用,调节免疫细胞增殖、分化和功能发挥,从而参与机体特异性免疫应答的调节。本研究发现,药疹患者治疗前血清补体成分C3a、C4a、C5a显著高于健康对照,治疗后显著降低,且低于其治疗前水平,表明药疹患者体内存在补体过度激活。相关性分析发现,IL⁃22的表达水平与TNF⁃α表达水平呈正相关,与C3a表达水平呈负相关,这与部分其他疾病的研究结果[14]不一致,可能是由于IL⁃22在不同疾病中的多样性作用,在药疹患者中IL⁃22可能通过某些信号通路参与补体调节,但具体调节机制尚不清楚,有待进一步研究。
综上所述,基于本次研究我们发现,药疹患者体内存在补体过度激活的现象,结合Th22细胞的相关因子水平在药疹患者治疗过程中发生的变化,推测Th22细胞因子及补体可能在药疹发生发展中起到一定的作用。
[1]Adam J,Pichler WJ,Yerly D.Delayed drug hypersensitivity:models of T⁃cell stimulation[J].Br JClin Pharmacol,2011,71(5):701⁃707.DOI:10.1111/j.1365⁃2125.2010.03764.x.
[2]Trifari S,Kaplan CD,Tran EH,et al.Identification of a human helper T cell population that has abundant production of interleukin 22 and is distinct from T(h)⁃17,T(h)1 and T(h)2 cells[J].Nat Immunol,2009,10(8):864⁃871.DOI:10.1038/ni.1770.
[3]Fujita H.The role of IL⁃22 and Th22 cells in human skin diseases[J].JDermatol Sci,2013,72(1):3⁃8.DOI:10.1016/j.jdermsci.2013.04.028.
[4]刘锡钧.实用药物指南[M].北京:人民军医出版社,2000:771⁃772.Liu XJ.Practical drug guide[M].Beijing:people′s military medicalpress,2000:771⁃772.
[5]张学军.皮肤性病学[M].8版.北京:人民卫生出版社,2008:120⁃126.Zhang XJ.Dermatovenereology[M].Bei Jing:People′smedical publishinghouse,2008:120⁃126.
[6]Fujita H,Nograles KE,Kikuchi T,etal.Human Langerhans cells induce distinct IL⁃22⁃producing CD4+T cells lacking IL⁃17 production[J].Proc Natl Acad SciU SA,2009,106(51):21795⁃21800.DOI:10.1073/pnas.0911472106.
[7]Wolk K,Witte E,Witte K,et al.Biology of interleukin⁃22[J].Semin Immunopathol,2010,32(1):17⁃31.DOI:10.1007/s00281⁃009⁃0188⁃x.
[8]金旗,熊丽霞.IL⁃13Rα2作为功能受体介导信号转导的研究进展[J].中国病理生理杂志,2014,30(8):1513⁃1518.DOI:10.3969/j.issn.1000⁃4718.2014.08.031.Jin Q,Xiong LX.IL⁃13Rα2 as a functional receptor mediates signal transduction[J].Chin JPathophysiol,2014,30(8):1513⁃1518.DOI:10.3969/j.issn.1000⁃4718.2014.08.031.
[9]Eyerich K,Eyerich S.Th22 cells in allergic disease[J].Allergo J Int,2015,24(1):1⁃7.DOI:10.1007/s40629⁃015⁃0039⁃3.
[10]Duhen T,Geiger R,Jarrossay D,et al.Production of interleukin 22 but not interleukin 17 by a subset of human skin⁃homing memory T cells[J].Nat Immunol,2009,10(8):857⁃863.DOI:10.1038/ni.1767.
[11]Pan HF,Li XP,Zheng SG,et al.Emerging role of interleukin⁃22 in autoimmune diseases[J].Cytokine Growth Factor Rev,2013,24(1):51⁃57.DOI:10.1016/j.cytogfr.2012.07.002.
[12]吴少宾,林岑珊,蔡壬辛,等.药疹患者血清CCL17、CCL27、TNF⁃α和IL⁃10的测定[J].中山大学学报(医学科学版),2015,36(2):241⁃244,256.Wu SB,Lin CS,CaiRX,etal.Serum levelsand functionsofCCL⁃17,CCL⁃27,TNF⁃αand IL⁃10 in patientswith drug hypersensi⁃tivity reaction[J].JSun Yat⁃Sen Uni(Medical Sciences),2015,36(2):241⁃244,256.
[13]CaproniM,TorchiaD,Schincaglia E,etal.Expression ofcytokines and chemokine receptors in the cutaneous lesions of erythema multiforme and Stevens⁃Johnson syndrome/toxic epidermal necrolysis[J].Br J Dermatol,2006,155(4):722⁃728.DOI:10.1111/j.1365⁃2133.2006.07398.x.
[14]Eyerich S,Wagener J,Wenzel V,et al.IL⁃22 and TNF⁃α represent a key cytokine combination for epidermal integrity during infection withCandida albicans[J].Eur JImmunol,2011,41(7):1894⁃1901.DOI:10.1002/eji.201041197.
[15]Hasegawa M,Yada S,Liu MZ,etal.Interleukin⁃22 regulates the complement system to promote resistance against pathobionts after pathogen⁃induced intestinal damage[J].Immunity,2014,41(4):620⁃632.DOI:10.1016/j.immuni.2014.09.010.
[16]Yamamoto H,Kemper C.Complement and IL⁃22:partnering up for border patrol[J].Immunity,2014,41(4):511⁃513.DOI:10.1016/j.immuni.2014.10.002.
[17]Carroll MV,Sim RB.Complement in health and disease[J].Adv Drug Deliv Rev,2011,63(12):965⁃975.DOI:10.1016/j.addr.2011.06.005.
[18]Trouw LA,DahaMR.Role of complement in innate immunity and hostdefense[J].Immunol Lett,2011,138(1):35⁃37.DOI:10.1016/j.im let.2011.02.014.
[19]Sun S,Guo Y,Zhao G,et al.Complement and the alternative pathway play an important role in LPS/D⁃GalN⁃induced fulminant hepatic failure[J/OL].PLoSOne,2011,6(11):e26838.http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3206060/.DOI:10.1371/journal.pone.0026838.
[20]Pickering M,Cook HT.Complement and glomerular disease:new insights[J].Curr Opin Nephrol Hypertens,2011,20(3):271⁃277.DOI:10.1097/MNH.0b013e328345848b.
[21]Navi D,Michael DJ,Fazel N.Drug⁃induced linear IgA bullous dermatosis[J].DermatolOnline J,2006,12(5):12.
Changes in serum levelsof Th22 cell⁃related cytokines and com p lements in patientsw ith drug eruption before and after treatment
Zang Dandan,Zhang Jiaxiang,Ye Liangping,Yang Peng,Huang Jian,Zhu Qixing
Department of Occupational and Environmental Health,School of Public Health,Anhui Medical University,Hefei 230032,China(Zang DD,Zhang JX,Yang P,Huang J);Institute ofDermatology,First Affiliated Hospital,Anhui MedicalUniversity,Hefei230022,China(Ye LP,Zhu QX)
Zhu Qixing,Email:zqxing@yeah.net
Objective To investigate changes in serum levels of Th22 cell⁃related cytokines and complements in patients with drug eruption before and after treatment,and to explore their possible roles in the occurrence and developmentof drug eruption.M ethods This study included 35 patientswith drug eruption,and 35 sex⁃and age⁃matched healthy controls.Fivemillilitersofperipheralblood sampleswere collected from the controls and patients before and after treatment.Enzyme⁃linked immunosorbent assay(ELISA)was performed tomeasure serum levels of interleukin 22(IL⁃22)and IL⁃13,and the cytometric bead array(CBA)system was used to determine serum levels of tumor necrosis factor⁃α(TNF⁃α)and complement components C3a,C4a and C5a.Results Before treatment,the patientswith drug eruption showed significantly higher serum levels of IL⁃22(40.85±14.56vs.29.09±8.66 ng/L,t=5.549,P<0.05),IL⁃13(869.94±463.39vs.372.92±151.75 ng/L,t=6.071,P<0.05),TNF⁃α(1.03±0.64vs.0.44±0.31 ng/L,t=4.321,P<0.05),complementC3a(55.21±32.98vs.42.44±14.26 ng/L,t=2.832,P<0.05),C4a(285.11±123.91vs.237.00±63.57 ng/L,t=2.257,P<0.05),and C5a(279.68±127.72vs.215.98±65.38 ng/L,t=2.495,P<0.05)compared with the controls.After treatment,the serum levelsof IL⁃22,IL⁃13,TNF⁃α,complement C3a,C4a and C5a in patients decreased to(32.72±11.77)ng/L,(456.21±123.22)ng/L,(0.64±0.39)ng/L,(45.47±21.11)ng/L,(241.86±84.12)ng/L and(239.61±103.51)ng/L respectively,with a significant difference between the pretreatment and posttreatment values of these proteins(t=4.443,5.197,3.572,3.213,2.728 and 4.772,respectively,allP≤0.01).Additionally,the serum levelsof IL⁃22 and IL⁃13 were still significantly higher in the patients than in the controls(bothP<0.05),while therewere no significant differences in the serum levels of TNF⁃α,complement C3a,C4a or C5a between the patients and controls after treatment(allP>0.05).Correlation analysis showed positive correlations between complement C3a and C4a serum levels(r=0.660,P<0.05),between C3a and C5a serum levels(r=0.404,P<0.05),between C4a and C5a serum levels(r=0.501,P<0.05),and between IL⁃22 and TNF⁃αserum levels(r=0.573,P=0.005),but negative correlations between IL⁃22 and complement C3a serum levels(r=-0.490,P=0.005),in patients before treatment.Conclusion The activation of Th22 cell⁃related cytokines and complementsmay play important roles in the occurrence and development of drug eruption,and IL⁃22may participate in the regulation of complements.
Drug eruptions;Interleukin⁃13;Tumor necrosis factor⁃alpha;ComplementC3a;ComplementC4a;ComplementC5a;Th22 cells;Interleukin⁃22
朱启星,Email:zqxing@yeah.net
10.3760/cma.j.issn.0412⁃4030.2016.11.05
国家自然科学基金(81371730、81502791);高等学校博士学科点专项科研基金(20133420110001)
Fund programs:National Natural Science Foundation of China(81371730,81502791);Research Fund for the Doctoral Program ofHigher Education ofChina(20133420110001)
2016⁃02⁃01)
(本文编辑:周良佳颜艳)
