硅胶表面阪崎克罗诺杆菌生物膜的形态观察
2016-11-01景春娥李萍杜欣军王硕
景春娥,李萍,杜欣军,王硕
(天津科技大学食品营养与安全教育部重点实验室,天津300457)
硅胶表面阪崎克罗诺杆菌生物膜的形态观察
景春娥,李萍,杜欣军,王硕*
(天津科技大学食品营养与安全教育部重点实验室,天津300457)
阪崎克罗诺杆菌是一种食源性条件致病菌,它能导致婴幼儿罹患坏死性小肠结肠炎、菌血症、脑膜炎等疾病。在硅胶表面形成生物膜,可能是导致阪崎克罗诺杆菌感染的重要途径。使用结晶紫法测定阪崎克罗诺杆菌ATCC BAA-894在食品级硅胶表面的静态生物膜成熟曲线,并且采用扫描电子显微镜对其在食品级硅胶表面的静态生物膜的形成过程进行形态学观察。观察到阪崎克罗诺杆菌在硅胶表面形成了具有三维结构的成熟生物膜形态。在3 h能粘附到硅胶表面,并且在12h~24h已经形成了比较成熟的生物膜。
阪崎克罗诺杆菌;生物膜;硅胶;粘附;成熟
细菌生物膜是指细菌在生长过程中附着于物体表面而形成的由细菌细胞及其分泌的细胞外多聚物基质等所组成的膜样多细菌复合体,胞外多聚物主要成分包括多糖基质、纤维蛋白、脂蛋白、胞外DNA等[1]。生物膜能够增强细菌对外界环境的耐受性[2]。细菌生物膜的形成是一种高度依赖环境信号的动态过程,即由多细胞参与不同阶段组成的一个过渡性过程,主要包括粘附、微菌落形成、成熟生物膜以及游离菌的播散与再次定植[2-3]。在食品加工环境中,食品加工器械以及餐饮器具表面的污染是病原菌传播到食品中的主要原因之一[4]。在生物膜的保护作用下,即使通过消毒液或常规的清洗后,这些菌可能仍然存活[5],产生持续的交叉污染,不但会降低食品的保质期而且会给消费者带来很大的危险[6-7]。阪崎克罗诺杆菌具有生存温度范围广[8]、抗渗透压能力强[9]的特征,并且具有高效的生物膜形成能力[10-12],这些特征是其在食品加工环节成功传播并且成为潜在污染源的重要原因。硅胶因其具有化学性质稳定、吸附性能强、热稳定性好、安全性等特点已被广泛应用于食品行业,如采用食品级硅胶为原料制成的奶嘴、奶瓶以及食品蛋糕模具等[13]。
阪崎克罗诺杆菌能够在硅胶表面形成生物膜[8,14],并且会随着生物膜的成熟,生物膜微菌落或游离细菌发生播散,交叉污染准备配方奶粉的器具。随后,这些成功播散的细菌生物膜团块会随着食物进入胃,并且保护其免受胃酸的伤害[10-11,15]。因此,这些细菌可能粘附到婴幼儿的肠上皮细胞,成为易感婴幼儿的潜在危险因素。已经有研究表明,婴幼儿配方奶粉的人工喂养与其罹患坏死性结肠炎疾病具有正相关性[16-17]。由于阪崎克罗诺杆菌感染所导致的新生儿坏死性小肠结肠炎,其特征为肠黏膜甚至为肠深层的坏死,本症是新生儿消化系统极为严重的疾病[16,18],但是,目前对于阪崎克罗诺杆菌在食品级硅胶表面的生物膜形成过程及其形成机制的研究报道很少。
由于阪崎克罗诺杆菌ATCC BAA-894是从与新生儿重症监护室疾病爆发有关的配方奶粉中分离的菌株[19],也是克罗诺杆菌属中第一个通过全基因组测序的菌株[20]。本研究利用食品级硅胶材质来研究阪崎克罗诺杆菌ATCC BAA-894在材料表面静态生物膜的形成过程,以便模拟研究食品加工环境中阪崎克罗诺杆菌生物膜的形成特点。采用扫描电子显微镜对阪崎克罗诺杆菌在食品级硅胶片表面的生物膜的形成过程进行了形态学观察。因此,对于阪崎克罗诺杆菌ATCC BAA-894在硅胶表面生物膜形成过程的研究对于防止婴儿配方奶粉调制过程中的交叉污染的发生具有现实指导意义。
1 材料与方法
1.1 试验材料
菌株(C.sakazakii ATCC BAA-894):购自美国菌种保藏中心,是已经测序菌株;细菌粘附材料(食品级硅胶):东莞市鸿凯橡胶制品有限公司。
1.2 仪器与试剂
SU-1510扫描式电子显微镜:购自日本日立公司;96孔细胞培养板与24孔细胞培养板:购自美国Corning公司;结晶紫:购自天津市北方天医化学试剂厂;LB培养基:购自北京陆桥技术有限公司。
1.3 方法
1.3.1 细菌悬液的制备
平板划线挑取单菌落于盛有5 mL液体LB培养基的试管中,37℃、150 r/min恒温振荡培养12 h得到种子液,4℃,3 000 r/min,离心5 min弃上清,收集菌体沉淀;然后用无菌的PBS缓冲液重悬菌体,4℃,3 000 r/min,离心5 min,重复3次,收集菌体沉淀,用无菌新鲜的液体LB培养基重悬菌液;按照比例,菌液 ∶甘油(4∶1)加入到1.5 mL Eppendorf管中混匀,用封口膜封口,-20℃保存备用。培养均采用以下条件:按1∶100(体积比)的比例将休止细菌悬液接种于液体LB培养基中,于37℃恒温振荡培养(150 r/min)过夜;按1%的接种量转接后同样条件培养2 h,菌液在600 nm处测OD值,并用无菌新鲜的液体LB培养基将菌液OD值调至0.1,取1.0 mL菌液离心3 000 r/min,5 min,弃上清,加入1mL液体LB培养基用于后续试验。
1.3.2 阪崎克罗诺杆菌生物膜形成能力测定方法
在96孔细胞培养板上测定阪崎克罗诺杆菌生物膜形成能力,具体方法步骤如下[21-23]:在96孔细胞培养板中分别加入40 μL菌液和160 μL的LB培养基,在恒温培养箱中37℃培养24 h,以未接种菌体的LB培养基为对照;用酶标仪在600 nm读数,测菌体吸光度;用PBS洗3次,剧烈摇动去除未黏附细菌,在室温下干燥固定生物膜15 min;加入200 μL 0.1%的结晶紫染料染色30 min;用无菌水冲洗至对照孔为无色;用200 μL 95%乙醇溶解生物膜中的染料,室温静置10 min;将溶解的液体转入新的96孔细胞培养板用酶标仪在波长595 nm处测定吸光值。
1.3.3 阪崎克罗诺杆菌在硅胶表面生物膜形成过程
硅胶的准备和清洗:参照文献[14-15]方法,将食品级硅胶(1 cm×1 cm)样片浸泡在含有15%磷酸溶液(phosphoric acid solution)烧杯中进行超声波处理20 min,用蒸馏水冲洗,用中性洗涤剂洗1 min后用蒸馏水洗涤。将清洗干净的样片置于55℃干燥2 h,置于封闭的离心管中(用50 mL离心管),高压蒸汽灭菌121℃,15 min。
在硅胶表面阪崎克罗诺杆菌生物膜培养:参照文献[11,24],将无菌的样片浸泡在含有菌悬液2.0 mL的24 孔细胞培养板中,37℃培养,0、3、5、7、12、18、24、48h,在每个时间点取出培养好的样片,进行后续的试验。
1.3.4 阪崎克罗诺杆菌生物膜的扫描电镜观察
参照文献[25]的方法,用无菌水洗去硅胶样片表面未粘附的细菌,用2%戊二醛固定液4℃固定过夜,用0.1 mol/L的PBS(pH 7.2)冲洗 2次,再用1%的锇酸(室温)固定2h,用 0.1 mol/L PBS(pH 7.2)洗 2次,用25%、50%、70%、80%、90%系列浓度乙醇脱水各10 min,100%乙醇脱水两次,每次15 min,通风橱干燥,喷金,扫描电镜观察。
2 结果与分析
2.1 阪崎克罗诺杆菌在食品级硅胶表面生物膜的形成过程
阪崎克罗诺杆菌ATCC BAA-894在食品级硅胶片表面生物膜形成的变化过程,如图1。

图1 硅胶表面阪崎克罗诺杆菌生物膜形成Fig.1 C.sakazakii biofilm formation on silicone surfaces
食品级硅胶片对照组与在含有菌液的培养液中培养了 3、5、7、12、18、24、48 h 的硅胶片之间的 OD595值都具有显著性差异。结果表明,从3 h开始,在硅胶表面已经有菌体粘附,具体分析如下:3 h与5 h之间的OD595值有显著性差异,5 h与7 h之间的OD595值有显著性差异,生物膜曲线呈现上升趋势,这个阶段浮游菌粘附于硅胶表面并且菌体数量剧增。7 h与12 h之间的OD595值无显著性差异,12 h与18 h之间的OD595值无显著性差异。7 h与18 h之间的OD595值具有显著性差异,从菌株ATCC BAA-894的生物膜形成曲线的趋势可以看到,这是个逐渐递增的过程,生物膜的产量在不断的增加,并且比较平稳。18 h与24 h之间的OD595值有显著性差异,从曲线可以看出,培养时间达到24 h时菌株ATCC BAA-894的生物膜达到了最大生长量。24 h与48 h之间,生物膜形成量呈现明显下降的趋势。
2.2 阪崎克罗诺杆菌在食品级硅胶片表面生物膜形成的形态学观察
阪崎克罗诺杆菌ATCC BAA-894在LB液体培养基中于食品级硅胶片表面的生物膜形成的过程中几个关键阶段的扫描电镜形态图片,如图2。
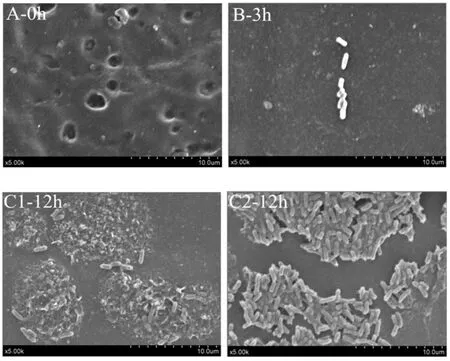

图2 阪崎克罗诺杆菌ATCC BAA-894在食品级硅胶片表面生物膜发育不同阶段的扫描电镜图片Fig.2 Scanning microscope imaging of C.sakazakii ATCC BAA-894 biofilm developmental stages on silicone
0 h(图A)时为无菌生长的硅胶表面结构。3 h(图B)时硅胶表面有少量菌体粘附在了硅胶表面,菌体零散分布,形态正常。12 h(图C)时硅胶表面的部分区域以“微菌落(microcolony)”形态存在,菌体簇状聚集,菌体之间有多根鞭毛或菌毛样结构相互连接,菌体分泌的胞外多聚物质(extracellular polymeric substances,EPS)包绕在微菌落周围,并与硅胶表面牢固结合,使黏附更加牢靠。18 h时(图D)硅胶表面的大部分区域生物膜微菌落更加密集,形成了大片的生物膜,并且厚度增加,出现了大量胞外聚合物将部分菌体以及微菌落包裹其中,并且从菌体的形态可以得知,菌体长度大多数在2 μm左右,细菌生长旺盛,菌体之间鞭毛或菌毛样结构相互交错,便于菌体之间的“交流”,基本形成了成熟的生物膜体系。24 h(图E)时生物膜系统中微菌落之间的连接变得松散,并且生物膜表面有一些菌体形态发生了变化,菌体开始固缩,从杆状变成了球状。48 h(图F)时硅胶表面菌体形态发生了很大的变化,部分菌体从杆状变成了球状,此外,在生物膜整个体系中由于菌体的死亡以及胞外聚合物的瓦解,瓦解后的生物膜系统骨架呈现出来,其上面粘附了大量死亡的菌体,“隔板”状的结构纵横交错。
3 结论与讨论
细菌生物膜的形成过程主要包括粘附、微菌落形成、成熟生物膜以及游离菌的播散与再次定植,这些阶段贯穿了细菌生物膜生态系统的整个动态平衡过程[2-3]。根据扫描电子显微镜的观察,我们发现阪崎克罗诺杆菌ATCC BAA-894在硅胶表面的静态生物膜的形成过程。在3 h,我们认为阪崎克罗诺杆菌处在起始粘附阶段(attachement)。在 5 h~12 h期间,可以界定为微菌落形成(microcolony)阶段,菌体数量剧增并且定植于材质表面,菌体菌毛或鞭毛样结构变得更多,菌体之间连接更紧密,并且开始分泌胞外多粘物质,相互吸引而聚集形成小菌落,并与材料表面牢固结合,使黏附更加牢靠。在12 h~24 h期间,可以界定为成熟生物膜(mature biofilm)阶段,在硅胶的表面已经具有了成熟生物膜的雏形,从比较独立的小菌落连成了成片的相互交错的大菌落,在体系中出现了“隔板”样的结构,这些“隔板”或许就是生物膜系统中的“水通道”,能够运输营养排泄代谢废物,并且能够保持湿润的生物膜生态系统的正常运。从理论上来说,播散期(dispersal)是成熟生物膜可由活跃生长的细胞子代脱落、胞外聚合物或密度感应系统的自身程序化过程解聚,或者其他因素导致生物膜微菌落的分离,游离的细胞寻找新的定植环境[2-3],但是这个动态的播散过程,无法在电镜下面看到,我们的电镜图片观察到,在24 h~48 h菌体形态发生了变化,在硅胶表面从杆状固缩成了球状,附着在隔板结构表面,我们推测,这可能与实验室构建的生物膜培养环境有关,在这个时间段,由于培养基中营养物质耗尽,代谢废物大量积累,环境pH值变化等等因素,导致了菌体的死亡与溶解。
在生物膜形成的整个动态过程中,菌体的粘附能力可能决定着生物膜不断扩张的命运。菌体粘附能力的大小与被粘附材料的表面性质、菌体表面性质以及周围生长环境的一些参数有关。通常,粘附可能发生在5 s~30 s,主要可以界定为可逆与不可逆粘附[26]。可逆粘附可能与范德华力和静电力和疏水作用有关,在此阶段,细菌容易被外界剪切力从表面清除。细菌的不可逆粘附发生在细菌表面附属结构的锚定和细胞外多聚物质的产生[27],如脂多糖的结构,粘附素和其他蛋白以及脂磷壁酸[3,28]。这些结构可能会有助于细菌粘附到非生物材料的表面[29-30]。一些研究表明,不可逆粘附在4℃~20℃时通常发生在20 min到4 h内[31-32]。要清除不可逆粘附的细胞是比较困难,需要借助于更强剪切力(擦洗或刮)和化学类清除剂,如酶,洗涤剂,表面活性剂,杀菌剂以及加热作用[33-34]。硅胶具有较大的表面积及空容[15],通常具有很大的吸附性。这种吸附性使得细菌更容易粘附在上面,并且形成成熟的生物膜。
由于食品加工环境的复杂性,本研究无法从静态的电镜图片来说明生物膜的形成过程,但是,从形态的变化上,为生物膜的形成过程的研究提供了一点资料。通过以上分析,阪崎克罗诺杆菌ATCC BAA-894在3 h已经能粘附到硅胶表面,因此,在食品加工环境以及日常的食品制备结束后,要尽快清洗加工器械,以免产生食品污染的隐患。此外,应该结合其他更先进的生物膜培养技术和检测技术,实时观察或模拟食品加工环境中生物膜的动态形成过程,为能够更好的控制食品加工环境中的生物膜寻找更好的策略。
[1] Hall-Stoodley L,Costerton J W,Stoodley P.Bacterial biofilms:from the natural environment to infectious diseases[J].Nature Reviews Microbiology,2004,2(2):95-108
[2] Monds R D,O’Toole G A.The developmental model of microbial biofilms:ten years of a paradigm up for review[J].Trends in Microbiology,2009,17(2):73-87
[3] Davey M E,O'toole G A.Microbial biofilms:from ecology to molecular genetics[J].Microbiology and Molecular Biology Reviews,2000,64(4):847-867
[4] Kusumaningrum H,Riboldi G,Hazeleger W,et al.Survival of foodborne pathogens on stainless steel surfaces and cross-contamination to foods[J].International Journal of Food Microbiology,2003,85(3):227-236
[5]Reij M,Den Aantrekker E,ILSI Europe Risk Analysis in Microbiology Task Force.Recontamination as a source of pathogens in processed foods[J].International Journal of Food Microbiology,2004,91(1):1-11
[6] Bagge-Ravn D,Gardshodn K,Gram L,et al.Comparison of sodium hypochlorite-based foam and peroxyacetic acid-based fog sanitizing procedures in a salmon smokehouse:survival of the general microflora and Listeria monocytogenes[J].Journal of Food Protection,2003,66(4):592-598
[7]Carpentier B,Cerf O.Biofilms and their consequences,with particular reference to hygiene in the food industry[J].Journal of Applied Bacteriology,1993,75(6):499-511
[8] Iversen C,Lane M,Forsythe S.The growth profile,thermotolerance and biofilm formation of Enterobacter sakazakii grown in infant formula milk[J].Letters in Applied Microbiology,2004,38(5):378-382
[9]Breeuwer P,Lardeau A,Peterz M,et al.Desiccation and heat tolerance of Enterobacter sakazakii[J].Journal of Applied Microbiology,2003,95(5):967-973
[10]Hurrell E,Kucerova E,Loughlin M,et al.Biofilm formation on enteral feeding tubes by Cronobacter sakazakii,Salmonella serovars andother Enterobacteriaceae[J].InternationalJournal of Food Microbiology,2009,136(2):227-231
[11]Hurrell E,Kucerova E,Loughlin M,et al.Neonatal enteral feeding tubes as loci for colonisation by members of the Enterobacteriaceae[J].BMC Infectious Diseases,2009,9(1):146
[12]Lehner A,Riedel K,Eberl L,et al.Biofilm formation,extracellular polysaccharide production,and cell-to-cell signaling in various Enterobacter sakazakii strains:aspects promoting environmental persistence[J].Journal of Food Protection,2005,68(11):2287-2294
[13]周土芬,林静.硅胶在食品工业中应用现状[J].福建轻纺,2013(10):38-42
[14]Jo S H,Baek S B,Ha J H,et al.Maturation and survival of Cronobacter biofilms on silicone,polycarbonate,and stainless steel after UV light and ethanol immersion treatments[J].Journal of Food Protection,2010,73(5):952-956
[15]Kim H,Ryu J H,Beuchat L R.Attachment of and biofilm formation by Enterobacter sakazakii on stainless steel and enteral feeding tubes[J].Applied and Environmental Microbiology,2006,72(9):5846-5856
[16]Van Acker J,De Smet F,Muyldermans G,et al.Outbreak of necrotizing enterocolitis associated with Enterobacter sakazakii in powdered milk formula[J].Journal of Clinical Microbiology,2001,39(1):293-297
[17]Iversen C,Forsythe S.Risk profile of Enterobacter sakazakii,an emergent pathogen associated with infant milk formula[J].Trends in Food Science Technology,2003,14(11):443-454
[18]Lin P W,Stoll B J.Necrotising enterocolitis[J].The Lancet,2006,368(9543):1271-1283
[19]Himelright I,Harris E,Lorch V,et al.Enterobacter sakazakii infections associated with the use of powdered infant formula-Tennessee,2001[J].Journal of the American Medical Association,2002,287(5):2204-2205
[20]Kucerova E,Clifton S W,Xia X Q,et al.Genome sequence of Cronobacter sakazakii BAA-894 and comparative genomic hybridizationanalysiswithotherCronobacterspecies[J].PLoSOne,2010,5(3):e9556
[21]O'Toole G A,Kolter R.Initiation of biofilm formation in Pseudomonas fluorescens WCS365 proceeds via multiple,convergent signalling pathways:a genetic analysis[J].Molecular Microbiology,1998,28(3):449-461
[22]Stepanovic S,Vukovic D,Dakic I,et al.A modified microtiter-plate test for quantification of Staphylococcal biofilm formation[J].Journal of Microbiological Methods,2000,40(2):175-179
[23]Konto-Ghiorghi Y,Mairey E,Mallet A,et al.Dual role for pilus in adherence to epithelial cells and biofilm formation in Streptococcus agalactiae[J].PLoS pathogens,2009,5(5):e1000422
[24]Smith K,Hunter I S.Efficacy of common hospital biocides with biofilms of multi-drug resistant clinical isolates[J].Journal of Medical Microbiology,2008,57(8):966-973
[25]Lu X,Samuelson D R,Rasco B A,et al.Antimicrobial effect of diallyl sulphide on Campylobacter jejuni biofilms[J].Journal of Antimicrobial Chemotherapy,2012,67(8):1915-1926
[26]Mittelman M W.Structure and functional characteristics of bacterial biofilms in fluid processing operations[J].Journal of Dairy Science,1998,81(10):2760-2764
[27]Sutherland I.Microbial exopolysaccharides-their role in microbial adhesion in aqueous systems[J].CRC Critical Reviews in Microbiology,1982,10(2):173-201
[28]Vatanyoopaisarn S,Nazli A,Dodd C E,et al.Effect of flagella on initial attachment of Listeria monocytogenes to stainless steel[J].Applied and Environmental Microbiology,2000,66(2):860-863
[29]Gilbert P,Evans D,Evans E,et al.Surface characteristics and adhesion of Escherichia coli and Staphylococcus epidermidis[J].Journal of Applied Bacteriology,1991,71(1):72-77
[30]Heilmann C,Gerke C,Perdreau-Remington F,et al.Characterization of Tn917 insertion mutants of Staphylococcus epidermidis affected in biofilm formation[J].Infection and Immunity,1996,64(1):277-282
[31]Briandet R,Meylheuc T,Maher C,et al.Listeria monocytogenes Scott A:cell surface charge,hydrophobicity,and electron donor and acceptor characteristics under different environmental growth conditions[J].Applied and Environmental Microbiology,1999,65(12):5328-5333
[32]Lundén J M,Miettinen M K,Autio T J,et al.Persistent Listeria monocytogenes strains show enhanced adherence to food contact surface after short contact times[J].Journal of Food Protection,2000,63(9):1204-1207
[33]Gelinas P,Goulet J,Tastayre G,et al.Effect of temperature and contact time on the activity of eight disinfectants-a classification[J].Journal of Food Protection,1984,47(11):841-852
[34]Sinde E,Carballo J.Attachment of Salmonella spp.and Listeria monocytogenes to stainless steel,rubber and polytetrafluorethylene:the influence of free energy and the effect of commercial sanitizers[J].Food Microbiology,2000,17(4):439-447
Morphological Observation of Cronobacter sakazakii Biofilm on the Surfaces of Silicone
JING Chun-e,LI Ping,DU Xin-jun,WANG Shuo*
(Key Laboratory of Food Nutrition and Safety,Ministry of Education,Tianjin University of Science and Technology,Tianjin 300457,China)
Cronobacter sakazakii is an emerging pathogen which causes a life-threatening syndrome of meningitis,necrotizing colitis and meningoencephalitis in neonates and infants.Biofilm formed on the surface of silicone is an important possible source of clinical infections caused by this pathogen.Crystal violet staining method was employed to determine biofilm maturation curves of C.sakazakii ATCC BAA-894 on silicone.The processes of static biofilm formation on the silicone were investigated using the scanning electron microscope(SEM).The bacteria on the surface had been observed to aggregate and grow into microcolonies,form 3-dimensional structures and communal relationships,resulting in a complex biofilm.In addition,the SEM revealed biofilm morphologies with variable amounts of extracellular polymeric substances,the presence of microcolonies and the mature biofilm formed between 12 h and 24 h.
Cronobacter sakazakii;biofilm;silicone;attachment;maturation
10.3969/j.issn.1005-6521.2016.14.037
“十二五”农村领域国家科技计划课题(2014BAD04B03)作者简介:景春娥(1985—),女(汉),博士研究生,研究方向:食品安全与检测技术。
*通信作者:王硕(1969—),男(汉),教授,博士,研究方向:食品安全和免疫学检测。
2015-07-28
