米糠多糖铁的制备及其与ctDNA的相互作用
2016-11-01刘梁余熙前陈彬胡小贞陈新
刘梁,余熙前,陈彬,胡小贞,陈新
(1.武汉轻工大学生物与制药工程学院,湖北武汉430023;2.农产品加工湖北省协同创新中心,湖北武汉430023)
米糠多糖铁的制备及其与ctDNA的相互作用
刘梁1,2,余熙前1,陈彬1,胡小贞1,陈新1,2
(1.武汉轻工大学生物与制药工程学院,湖北武汉430023;2.农产品加工湖北省协同创新中心,湖北武汉430023)
在碱性条件下用米糠多糖与三氯化铁制备米糠多糖铁(RBPIC)。理化试验表明米糠多糖与三氯化铁生成了稳定的RBPIC,RBPIC在pH4.1~12.6的条件下可以稳定存在,RBPIC中铁含量为18.41%;通过紫外-可见吸收光谱研究了RBPIC与ctDNA的相互作用,结果表明RBPIC与ctDNA存在明显的相互作用,结合常数为7.27×106L/mol;琼脂糖凝胶电泳实验表明BRPIC/DNA可以有效促进DNA凝聚。
米糠;多糖铁;ctDNA;紫外-可见吸收光谱
基因治疗被认为有希望治愈如血友病、囊性纤维化等遗传和传染类疾病的一种新型技术[1]。基因治疗的成功关键取决于核酸高效传递进入细胞核内并能有效表达[2]。为此,已经开发了若干基因传递技术,如通过细胞电穿孔技术,显微注射技术,利用病毒或合成载体的基因转运技术等。虽然非病毒载体在体内的基因转运效率较病毒类载体较低,但非病毒载体具有如低安全性,低免疫原性,低特异性等缺点[3]。
由于多糖具有天然、无毒、生物相容性和可生物降解的独特优点,并很易被修饰以改善其物理化学性质,因此在众多的非病毒载体中,多糖一直被认为是最具发展潜力的载体之一[4]。目前,此类载体主要以阳离子型多糖-壳聚糖为代表,研究结果表明壳聚糖或其衍生物具有较高的基因转运效率。此外,其他类型的中性多糖通过修饰连接带电分子如PEI后也具有良好的基因转运功能。但现有多糖类载体除壳聚糖外都必须经结构修饰连接其他阳离子结构片段后,才具备促进核酸凝聚并将其转运到细胞内的功能。需要注意的是,多糖分子良好的生物兼容性也被引入的阳离子支链破坏导致安全性下降。因此研究更安全的多糖类载体意义重大。
多糖铁具备化合物促进DNA凝聚的所需必要条件-正电性,由于多糖铁与其他有机阳离子修饰的多糖载体相比,分子中只引入了细胞毒性极低的Fe3+,未引入其他高细胞毒性的分子片段,且多糖铁配合物具有更简单的结构,更好地保证了天然多糖分子的自身结构,最大程度保持了多糖分子良好的生物兼容性,这一特性充分保证了多糖铁作为DNA释放载体的安全性[7-8]。本研究利用米糠多糖与三氯化铁在碱性条件下络合形成米糠多糖铁配合物(Rice Bran Polysaccharide-Fe(Ⅲ)Complex,RBPIC),对其理化性质及其与DNA的相互作用进行研究,为将多糖铁类化合物开发为基因转运载体做探索。
1 材料与方法
1.1 仪器与试剂
仪器:Lambda 25型紫外分光光度计(美国PerkinElmer公司);STARTER 3100型pH计(美国A-haus);DK-II型万用电炉(天津泰斯特仪器有限公司);HH-S1数显恒温水浴锅(金坛医疗仪器厂);TGL-16c型离心机(上海安亭仪器厂);FA2004电子天平;干燥箱。
试剂:米糠多糖为本实验自制并纯化;三氯化铁、氢氧化钠、柠檬酸三钠、无水乙醇、抗坏血酸、邻菲啰啉、硫酸亚铁胺、硫氰酸钾、亚铁氰化钾等试剂均为分析纯;小牛胸腺 DNA;Tris-HCl缓冲液(pH7.4)。
铁(II)标准储备液:称取0.702 3 g硫酸亚铁铵[Fe(NH4)2(SO2)2·6H2O]溶于蒸馏水并转入1 000 mL容量瓶中,加3 mL盐酸,用蒸馏水定容;铁(Ⅱ)标准液(现配):吸取10.00 mL铁(Ⅱ)标准储备液,转入100 mL容量瓶中,用蒸馏水定容;0.1%邻菲啰啉显色液:称取邻菲啰啉1.0 g溶解于加有2 mL盐酸的蒸馏水中,转入1 000 mL容量瓶中,用蒸馏水定容;10%抗坏血酸:称取抗坏血酸50.0 g,溶于适量蒸馏水,转入50 mL容量瓶中,用蒸馏水定容。
1.2 方法
1.2.1 米糠多糖铁的制备
参照文献,称取米糠多糖1.0 g,柠檬酸三钠0.5 g,溶于40 mL水中,置80℃水浴中搅拌。在搅拌下滴加2 mol/L的FeCl3溶液和20%NaOH溶液,控制两者的滴加速度以调节反应液pH8~9。当反应液中产生的红棕色沉淀不再溶解时,停止滴加FeCl3溶液和NaOH溶液,继续在水浴中反应1.5 h。反应冷却后,8 000 r/min离心10 min,收集上层红棕色离心液。离心液中加入约1倍体积的无水乙醇醇沉,静置过夜,倾去上清液,沉淀继续用适量无水乙醇洗涤3次,8 000 r/min离心5 min,将沉淀干燥,即为产品,保存备用[9]。
1.2.2 米糠多糖铁的理化性质
米糠多糖铁与氢氧化铁的定性比较。取干燥的RBPIC粉末0.05 g,溶于适量蒸馏水中,转移至50 mL容量瓶中定容至刻度,制得RBPIC溶液。在50 mL沸水中滴加饱和FeCl3溶液知道溶液变成红褐色,得氢氧化铁溶胶。分别取RBPIC溶液和氢氧化铁溶胶2 mL,对二者进行定性比较。①观察二者颜色。②加入乙醇或乙醚观察现象。③加入氢氧化钠溶液,观察溶液变化。④加入硫氰酸钾,观察溶液变化。⑤加入亚铁氰化钾,观察溶液变化。
米糠多糖铁的破坏试验。取RBPIC溶液约3 mL于锥形瓶中,加入蒸馏水30 mL、盐酸2 mL,加热煮沸3 min,定性检验。
米糠多糖铁的水解试验。配置3.2 mg/mL的RBPIC溶液,用 0.01 mol/L 的盐酸调节 pH,用 K4[Fe(CN)6]检验其水溶液,并用酸度计测定溶液pH;用0.01 mol/L的NaOH调节pH,观察溶液是否产生沉淀,并用酸度计测定溶液pH。
米糠多糖铁的还原试验。取RBPIC溶液1.0mL,置于50mL容量瓶内,加入10%抗坏血酸溶液2.5mL,0.1%的邻菲啰啉溶液5.0 mL,定容,37℃下反应,以不加RBPIC的溶液为空白样,每隔0.5小时在510 nm处测定一次吸光度,直到吸光度值基本不变。
1.2.3 米糠多糖铁的铁含量测定
采用邻菲啰啉比色法,原理是抗坏血酸在酸性条件下把Fe3+还原成Fe2+,Fe2+与邻菲啰啉结合生成橙红色的螯合物,由紫外分光光度计测得其吸光度值,计算铁的含量。
1.2.3.1 绘制铁的标准曲线
取8个25 mL的容量瓶,分别加入铁的标准溶液0、1、2、3、4、5、6、7 mL,再分别加入 10%的抗坏血酸1.75 mL、0.1%的邻菲啰啉2.5 mL,蒸馏水定容摇匀,放置10 min,在510 nm处测定吸光度,以铁的浓度为横坐标,吸光度为纵坐标绘制铁的标准曲线。
1.2.3.2 米糠多糖铁含量的测定
取RBPIC溶液1.0 mL,置于50 mL容量瓶内,加入10%抗坏血酸溶液2.5 mL,0.1%的邻菲啰啉溶液5.0 mL,用蒸馏水定容,摇匀,在37℃下反应若干时间,测定吸光度值,计算铁的含量。
1.2.4 米糠多糖铁的结构表征
紫外光谱测定:蒸馏水做对照,在200 nm~400 nm范围内扫描其紫外吸收光谱。
红外光谱测定:KBr压片,在400 cm-1~4 000 cm-1范围内扫描其红外光谱。
1.2.5 米糠多糖铁与DNA的相互作用
在一批比色管中准确加入500 μL pH7.4的Tris-HCl缓冲溶液,50 μL DNA 溶液,2 050 μL 蒸馏水,不同量RBPIC溶液,混合均匀,放置0.5 h,以相应浓度未加DNA的RBPIC溶液作参比,在200 nm~400 nm扫描吸收光谱。
1.2.6 米糠多糖铁促进DNA凝聚
在总体水平上,物质追求维度得分最高,这可能和学生的生源地来源及其家庭经济水平低有紧密的联系。黄星、刘霞等人的研究也证实了这一点 [5,6]。
20 mmol/L Na2HPO4-柠檬酸缓冲液(最适反应体系 pH)中加入 75 μmol/L pBR322 DNA(碱基对浓度),然后分别加入一定浓度梯度的RBPIC,反应体系的总体积为10 μL,37℃反应4 h。反应结束后,向体系中加入 2 μL 6×DNA loading buffer(溴酚蓝),混匀后上样于1%琼脂糖凝胶中,室温下,在1×的TAE电泳缓冲液中以80 V的电压电泳65 min。电泳结束后,将凝胶在1.0 μg/mL的溴化乙锭(EtBr)染色液中浸泡30 min进行染色,最后在Bio-Rad凝胶成像仪上观察并成像分析。
2 结果与讨论
2.1 米糠多糖铁的理化性质
2.1.1 米糠多糖铁的物理性质
米糠多糖铁的产量为1.177 g。米糠多糖铁为棕色无定形粉末,无臭无味,易溶于水,其水溶液呈弱碱性,不溶于乙醇、乙醚等有机溶剂。用亚铁氰化钾检验其水溶液,不显示Fe3+的特殊效应,证明其水溶液中无游离的三价铁离子(Fe3+),铁与米糠多糖络合形成稳定的复合物。米糠多糖铁粉末在空气中放置24 h后性状未发生改变,其水溶液在空气中敞口放置24 h,未发生聚沉,且保持均一透明,进一步说明米糠多糖铁及其溶液的稳定性。
2.1.2 米糠多糖铁与氢氧化铁的定性比较
米糠多糖铁与氢氧化铁的定性比较见表1。

表1 米糠多糖铁与氢氧化铁的定性比较Table 1 Qualitative comparison of RBPIC and iron hydroxide
RBPIC溶液与氢氧化铁溶胶性质比较的结果表明,两者在理化性质方面有显著区别;同时还说明,RBPIC中的三价铁并未以游离的形式存在,而是与米糠多糖配合生成了稳定的复合物。
2.1.3 米糠多糖铁的破坏试验
2.1.4 米糠多糖铁的水解试验
滴加HCl溶液调节RBPIC溶液pH到4.1时,用K4[Fe(CN)6]检验其水溶液不显示 Fe3+特殊效应。Fe3+和Fe2+在pH 6~7的水溶液中均会生成氢氧化物沉淀,用NaOH溶液调节RBPIC溶液pH值到12.6时,仍无浑浊现象。说明米糠多糖铁在pH4.1~12.6稳定,复合物中的三价铁不会被水解成游离的Fe3+。
2.1.5 米糠多糖铁的还原性试验
吸光度与反应时间的关系见表2。

表2 吸光度与反应时间的关系Table 2 Relationship between absorbance and reaction time
由表2可知,RBPIC中的铁在3.5 h内基本被抗坏血酸还原。
2.2 米糠多糖铁的铁含量测定
铁的标准曲线绘制数据见表3,曲线见图1。
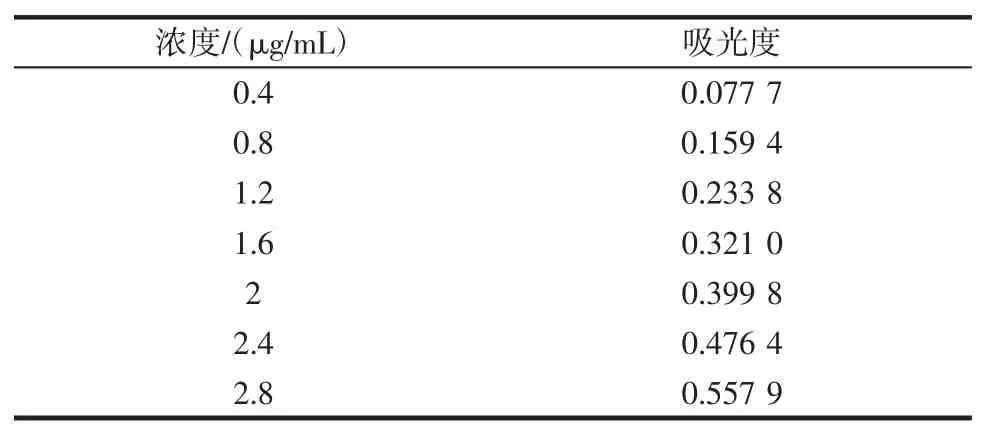
表3 铁离子标准曲线数据Table 3 Data of iron solution standard curve

图1 铁标准曲线Fig.1 Standard curve of iron standard solution
37℃下米糠多糖铁与抗坏血酸反应3.5 h,在紫外可见吸收光谱仪上测得样品在510 nm处的吸光度为0.734 8,将此结果代入回归方程计算得铁含量为18.41%。
2.3 米糠多糖铁的结构表征
2.3.1 米糠多糖铁的紫外光谱分析
紫外图谱如图2。

图2 紫外光谱分析Fig.2 Ultraviolet spectrum of RBPIC solution
由图2米糠多糖与米糠多糖铁的紫外扫描曲线对比可以看出,米糠多糖铁在紫外区的吸收强度明显增加,说明米糠多糖与铁反应生成了复合物。米糠多糖铁中的生色基有羰基、羧基、酯基,助色基是-OH,在米糠多糖与铁发生反应后紫外吸收变强推测助色基发生了改变,从而使得紫外吸收强度发生了变化,说明助色基-OH发生了络合反应。
2.3.2 米糠多糖铁的红外光谱分析
米糠多糖铁的红外光谱分析见图3。
图3红外光谱图显示,米糠多糖铁特征吸收与文献报道的β-FeOOH的特征吸收一致,表明米糠多糖铁中的铁核是聚合的β-FeOOH结构。在3 500 cm-1~3 400 cm-1附近有一强吸收峰,这是由于米糠多糖分子中有多个-OH,且分子中有较强的氢键作用,它们属于米糠多糖中羟基伸缩振动的吸收峰,此外,由米糠多糖与米糠多糖铁的红外光谱对照可见,金属离子的络合没有使米糠多糖的结构发生改变。

图3 红外光谱分析Fig.3 IR spectrum of RBPIC
2.4 米糠多糖铁与DNA的相互作用
米糠多糖铁与DNA作用的紫外吸收光谱图见图4。

图4 米糠多糖铁与DNA作用的紫外吸收光谱图Fig.4 UV-Vis absorption spectrum of rice bran polysaccharide iron and DNA
从图4中看出,随着米糠多糖铁浓度的增加,DNA 260 nm处的特征吸收峰无明显位移,但有明显的减色效应,表明复合物可能以嵌插方式与DNA结合。减色效应可认为是米糠多糖铁的π*共轭体系与DNA碱基的大π共轭体系之间发生强烈作用,产生π电子堆积,使复合物π*空轨道与碱基的π电子轨道发生偶合,偶合后的复合物π*轨道因部分填充电子使π-π*跃迁几率减小,从而产生减色效应。减色效应的强弱与分子的嵌插作用能力有关,减色效应越明显,插嵌作用能力越强[1]。可以根据双倒数公式求得米糠多糖铁与DNA相互作用的结合常数K。小分子化合物与DNA相互作用的结合常数与其紫外吸光度值有以下关系[2]:
1/(A0-A)=1/A0+1/(K×A0×CRBPIC)
式中:A0和A分别为加入米糠多糖铁前后的吸光度;K为结合常数;CRBPIC为米糠多糖铁的浓度。以1/(A0-A)对1/CRBPIC作双倒数图(如图5),得到直线的斜率与截距之比即为K。计算得结合常数K为7.27×106L/mol,说明米糠多糖铁与DNA的作用较强。

图5 RBPIC-DNA体系双倒数图Fig.5 The double reciprocal diagram of RBPIC-DNA system
2.5 琼脂糖凝胶电泳试验
我们利用琼脂糖分子塞阻滞作用来观察BRPIC诱导DNA凝聚,并分析了BRPIC浓度对DNA的凝聚程度影响。当DNA分子被BRPIC诱导凝聚后在琼脂糖凝聚中会受到更大的阻滞作用,其迁移率显著降低,形成凝聚体的DNA分子都聚集于加样孔中而未发生迁移,试验结果如图6所示。

图6 BRPIC/DNA比对DNA凝聚的影响Fig.6 The effect of Ratio of RBPIC and DNA on DNA condensation
由图6可知,BRPIC与DNA浓度比为0.5时只有部分DNA被凝聚,而B当BRPIC/DNA大于0.5时,化合物均能促进DNA凝聚。
3 结论
通过三氯化铁与米糠多糖在碱性条件下反应合成了米糠多糖铁复合物,对其理化性质进行了研究,并对复合物的结构进行了表征,确定复合物中的铁(III)不是以游离的形式存在,而是与米糠多糖形成了稳定的配合物,其在生理条件下不被水解,可作为新型的口服补铁剂。运用紫外吸收光谱的方法研究了复合物与DNA的作用机理,试验结果表明米糠多糖铁与DNA以嵌插模式结合,计算得结合常数为7.27×106L/mol。琼脂糖凝胶电泳试验表明米糠多糖铁在BRPIC/DNA值大于等于1.0时,可以有效促进DNA凝聚,具有作为DNA释放载体的可能。
[1] M A Mintzer,E C Simanek.Nonviral vectors for gene delivery[J].Chem Rev,2008,109(2):259-302
[2]J J Green, R Langer, D G Anderson. A combinatorial polymer library approach yields insight into nonviral gene delivery, Acc[J].ChemRev,2008, 41(6): 749-759
[3]IMVerma,NSomia.Gene therapy-promises,problems and prospects[J].Nature,1997,389(6648):239-242
[4] Koen Raemdonck,Thomas F Martens,Kevin Braeckmans,et al.Polysaccharide-based nucleic acid Nanoformulations[J].Advanced Drug Delivery Rev,2013,65(9):1123-1147
[5]Praneet Opanasopit,Auayporn Apirakaram wong,Tanasait Ngawhirunpat,et al.Development and characterization of pectinate micro/nanoparticles for gene delivery[J].AAPS Pharm Sci Tech,2008,9(1):67-74
[6] YanfangZhou,BinYang,XianyueRen,et al.Hyperbranched cationic amylopectin derivatives for gene Delivery[J].Biomaterials,2012,33(18):4731-4740
[7] Celine Valeria Liew,Lai Wah Chan,Ai Ling Ching,et al.Evaluation of sodium alginate as drug release modifier in matrix tablets[J].Int.J.Pharm,2005,309(1):25-37
[8] 王凯平,张玉,戴立泉.当归多糖铁理化性质的初步研究[J].中国中药杂志,2006,31(9):747-750
The Interaction of Rice Bran Polysaccharide Iron Complex and ctDNA
LIU Liang1,2,YU Xi-qian1,CHEN Bin1,HU Xiao-zhen1,CHEN Xin1,2
(1.School of Biological and Pharmaceutical Engineering,Wuhan Polytechnic University,Wuhan 430023,Hubei,China;2.Hubei Collaborative Innovation Center for Processing of Agricultural Products,Wuhan 430023,Hubei,China)
Rice bran polysaccharide iron complex (RBPIC)was prepared with rice bran polysaccharides and ferric iron at alkaline conditions.RBPIC was stable at pH 4.1-12.6 and the iron content in RBPIC was 18.41%.The interaction between ctDNA and RBPIC was studied by UV-vis absorption spectra.The results showed that the interaction between ctDNA and RBPIC was obvious,and the binding constant was 7.27×106L/mol.
rice bran;polysaccharide iron complex(PIC);ctDNA;UV-vis spectrum
10.3969/j.issn.1005-6521.2016.14.038
湖北省教育厅科学研究计划项目(B2016077);武汉轻工大学大学生科研项目(xsky2015008);武汉轻工大学2015校立科研项目(2015d5)
刘梁(1981—),男(汉),讲师,博士,研究方向:食品功能因子研究。
2015-07-01
