尼莫地平对帕金森病模型小鼠黑质iNOS和COX-2表达的抑制作用
2016-10-31李雅鑫秦丽娟张宇新周洪霞
李雅鑫, 徐 帆, 秦丽娟, 张宇新, 周洪霞, 耿 菲, 张 田
尼莫地平对帕金森病模型小鼠黑质iNOS和COX-2表达的抑制作用
李雅鑫1,徐帆1,秦丽娟2,张宇新3,周洪霞3,耿菲3,张田2
目的研究尼莫地平对1-甲基-4-苯基-1、2、3、6四氢吡啶(MPTP)所诱导的帕金森病(PD)模型小鼠黑质多巴胺能神经元的保护作用。方法雄性健康C57BL/6N小鼠随机分为对照组,腹腔注射生理盐水;模型组,腹腔注射MPTP(25 mg/kg);尼莫地平治疗组,每次注射MPTP前3 h灌胃给予尼莫地平(15 mg/kg)。观察各组小鼠行为学变化,免疫组织化学和免疫蛋白印迹法观察中脑黑质酪氨酸羟化酶(TH)、诱导型一氧化氮合酶(induciblenitricoxidesynthase,iNOS)和环氧化酶-2(Cyclooxygenase,COX-2)的表达变化。结果与对照组小鼠比较,MPTP模型组小鼠出现典型的PD症状,中脑黑质TH阳性神经元大量丢失,iNOS和COX-2阳性细胞显著增多,蛋白水平明显升高;经尼莫地平处理后,上述情况得到明显改善。结论在此PD小鼠模型中,尼莫地平通过抑制炎症因子iNOS和COX-2的表达,可对多巴胺能神经元起到一定的保护作用。
帕金森病;酪氨酸羟化酶;诱导型一氧化氮合酶;环氧化酶-2;尼莫地平;小鼠
帕金森病(Parkinson’sdisease,PD)是仅次于阿尔茨海默病(Alzheimer’sdisease,AD)的第二常见神经变性疾病。中脑黑质多巴胺能神经元的退行性变是PD的关键病理学特征。目前,PD病因和发病机制尚不十分清楚,因而临床上缺乏有效的标本兼治方法。随着我国老龄化社会的到来,PD发病率将呈逐年上升趋势,必然会给家庭和社会带来沉重负担。因此,阐明PD发病机制以及如何防治已成为PD研究的核心与焦点问题。目前认为,炎症反应可能是PD的重要发病机制之一[1],尼莫地平(Nimodipine,NIM)是1,4-二氢吡啶类钙通道拮抗剂,易透过血脑屏障。近年研究显示,尼莫地平对AD动物模型所致的神经元损伤有一定的保护作用[2];尼莫地平能通过其抗炎作用,从而有效的保护多巴胺能神经元[3]。有证据表明,iNOS和COX-2作为非常重要的炎症因子,参与了PD的发病过程[4]。那么,尼莫地平是否能够通过抑制iNOS和COX-2的表达,从而对多巴胺神经元起到保护作用呢?为此,本实验主要观察尼莫地平对MPTP诱导的PD小鼠黑质多巴胺能神经元的保护作用,从而为PD的预防、治疗、延缓疾病的发展提供一条新的思路。
1 材料与方法
1.1动物及试剂雄性健康C57BL/6N小鼠45只,12~14周龄,体质量25~30 g,清洁级,购于北京维通利华公司,自由进食,饮水,室温25±2 ℃,单笼喂养。MPTP(Sigma,USA);兔抗人iNOS单克隆抗体(CANYAN,USA);兔抗鼠COX-2多克隆抗体,预染蛋白Marker(天津灏洋生物公司);大鼠抗TH单克隆抗体(Chemicon,USA);尼莫地平(德国拜耳医药);UltraSensitiveSP超敏试剂盒(福州迈新公司)。
1.2动物分组和模型制备实验动物随机分为3组,每组15只。模型组:腹腔注射MPTP(25 mg/kg,生理盐水溶解),每天1次,连续7 d;尼莫地平治疗组:在MPTP注射前3 h灌胃给予尼莫地平预处理(15 mg/kg),每天1次,连续7 d;对照组:注射与模型组等量生理盐水。
1.3行为学检测采用悬挂实验衡量小鼠的力量及肢体运动协调情况。每次注射后1 h将受试小鼠双前爪悬挂于一条张紧的水平电线上,观察其后爪抓握电线的情况并评分,评测时间是1 min。如小鼠用两后爪抓住电线,记3分;如用一后爪抓住电线,记2分;如果小鼠两后爪均抓不住电线,记1分;最后计算总得分。
1.4组织固定、取材MPTP第7次注射后12 h每组随机取9只C57BL/6N小鼠。腹腔麻醉后,经左心室插管用生理盐水(室温)灌注,再用4%的多聚甲醛磷酸盐缓冲液缓慢灌注固定,迅速切取中脑黑质部位脑块,放于4%多聚甲醛后固定48 h(4 ℃),固定好的脑组织经蒸馏水冲洗、梯度酒精脱水、二甲苯透明、浸蜡、包埋,包埋后,石蜡切片机做连续冠状切片,片厚5 m,4 ℃保存备用。每组15只小鼠中随机取6只进行Westernblot分析。小鼠麻醉后,迅速断头取脑,分离中脑黑质部分,置入细胞裂解液中,低温匀浆,4 ℃震荡30 min后,12000 r/min,4 ℃离心15 min,取上清液,-80 ℃保存备用。
1.5免疫组织化学免疫组织化学染色采用SP法,步骤如下:切片经二甲苯脱蜡、梯度酒精脱水后,用TBS(pH7.4±0.2)洗3次,每次5 min;组织切片进行水浴法抗原修复;降至室温;TBS洗3次,每次5 min;每张切片加入过氧化氢(25l)阻断内源性过氧化物酶,TBS洗3次,每次5 min;每张切片滴加10%正常山羊血清(25 μl)室温孵育15 min,同一组织相邻切片分别加入兔抗人iNOS单克隆抗体(1∶150),兔抗鼠COX-2多克隆抗体(1∶150),大鼠抗TH单克隆抗体(1∶300),4 ℃过夜,TBS洗3次,每次5 min;加入二抗(生物素标记羊抗兔IgG,1∶150)室温孵育20 min;TBS洗3次,每次5 min;加入链霉菌抗生物素蛋白-过氧化酶溶液(25l)室温孵育20 min,DAB显色,自来水冲洗,苏木素复染,梯度酒精脱水,二甲苯透明,中性树胶封片,光镜下观察。
1.6Western blot检测蛋白定量后取4倍体积样品缓冲液,95 ℃变性10 min。蛋白上样量为30 g/lane,10% SDS-PAGE电泳,将蛋白电转移至硝酸纤维膜上,依分子量大小切取条带,加入封闭液室温下震荡2 h后,取相应条带分别加入兔抗人iNOS单克隆抗体(1∶300),兔抗鼠COX-2多克隆抗体(1∶200),大鼠抗TH单克隆抗体(1∶400),4 ℃过夜。室温孵育1 h后,TBST洗5次,每次3 min;分别加入二抗(生物素标记羊抗兔IgG,1∶500)室温孵育1 h,TBST洗5次,每次3 min;加入链霉菌抗生物素蛋白-过氧化酶溶液室温下孵育0.5 h,TBST洗5次,每次3 min;DAB显色,扫描蛋白印迹条带,作定量分析。
1.7统计学处理免疫组织化学染色数据,采用CMIAS真彩医学图像自动分析系统进行阳性细胞记数。各组每只动物的3张脑片数值相加后取平均值。实验结果使用SPSS 17.0统计软件进行单因素方差分析,q检验,以P<0.05差异具有统计学意义;免疫印迹法统计分析同上。
2 结 果
2.1行为学检测注射MPTP后,模型组小鼠出现典型PD样症状,表现为竖毛、翘尾、震颤和运动变缓等特征。悬挂实验中,与对照组小鼠比较,抓电线的能力明显下降。罗格列酮处理后,抓握电线的能力有所提高(P<0.05,见表1)。
2.2免疫组织化学检测对照组小鼠中脑黑质区偶见iNOS和COX-2阳性细胞;与对照组比较,模型组iNOS和COX-2阳性细胞显著增多,呈棕黄色;对照组小鼠中脑黑质区可见大量TH阳性神经元,排列整齐,神经纤维密集;模型组TH阳性神经元大量丢失;经尼莫地平治疗后,TH阳性神经元丢失程度明显减轻,iNOS和COX-2阳性细胞较模型组显著减少。图像分析结果显示差异具有统计学意义(P<0.05,见表2)。
2.3Westernblot检测结果显示,对照组小鼠中仅有微量iNOS、COX-2蛋白表达;模型组小鼠中iNOS、COX-2表达水平显著升高;经尼莫地平处理后,iNOS、COX-2蛋白表达水平较模型组明显下降(P<0.05,见表3);模型组TH表达较对照组降低,治疗后出现明显升高,模型组和尼莫地平处理组比较差异具有统计学意义(P<0.05,见表3)。
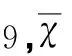
表1 小鼠悬挂实验的评分结果(n﹦±s)
*P<0.05 vs 对照组;**P<0.05 vs 模型组
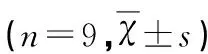
表2 各组小鼠中脑黑质iNOS、COX-2和TH阳性细胞数
*P<0.05 vs 对照组;**P<0.05 vs 模型组
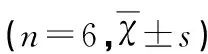
表3 各组小鼠黑质iNOS、COX-2和TH蛋白表达水平
*P<0.05 vs 对照组;**P<0.05 vs 模型组
3 讨 论
PD是中老年人常见的神经退行性疾病之一,诸多机制参与了其发病过程,如中脑黑质区氧化应激、慢性炎症反应等。大量证据表明,炎症反应与PD发生密不可分[5]。COX-2和iNOS作为重要的炎症介质,在多种PD模型中表达明显增高,同时伴有多巴胺神经元的大量丢失[6,7],说明其可能参与了多巴胺神经元变性丢失的过程。本实验结果显示,MPTP注射7 d后,与对照组比较,模型组小鼠黑质区TH阳性神经元显著丢失,而iNOS和COX-2显著表达,Westernblot结果显示了同样的趋势。以上这些证据表明,炎症因子iNOS和COX-2可能与多巴胺能神经元丢失密切相关。
目前左旋多巴类药物仍是治疗该病的主要药物,但长期应用会引起一系列严重的并发症。抗炎治疗已成为近年PD治疗的研究热点。尼莫地平属于临床上常用的L型钙通道拮抗剂,有报道显示,在体外细胞培养中尼莫地平能通过减轻炎症反应,从而起到保护多巴胺能神经元的作用[8]。另有研究认为[9],尼莫地平能显著减轻PD大鼠模型所诱发的炎症反应,从而对多巴胺神经元起到保护作用。为进一步证实尼莫地平的抗炎作用,本实验用其作为药物干预,观察了它对iNOS和COX-2表达的影响。结果显示,与模型组比较,尼莫地平治疗组中脑黑质区iNOS和COX-2阳性细胞大幅减少,蛋白水平显著下降,而TH阳性神经元丢失程度明显减轻。为进一步证实尼莫地平的神经保护作用,本实验采用悬挂试验[10]衡量小鼠的力量及肢体运动协调情况,评估小鼠的运动功能,结果显示模型组小鼠产生PD样体征,肢体协调能力差,与对照组小鼠比较,运动能力明显下降,尼莫地平处理后运动能力有很大改善。
综上所述,在本实验条件下,MPTP可诱导模型小鼠中脑黑质iNOS和COX-2的高表达,最终参与多巴胺神经元的变性丢失过程;尼莫地平可在一定程度上抑制iNOS和COX-2的表达,推测其可能通过影响炎症的发展进程而对多巴胺神经元起到一定的保护作用。
[1]Yeh NC,Tien KJ,Yang CM,et al. Increased Risk of Parkinson’s Disease in Patients With Obstructive Sleep Apnea:A Population-Based,Propensity Score-Matched,Longitudinal Follow-Up Study[J]. Medicine (Baltimore),2016,95(2):e2293.
[2]Gholamipour-Badie H,Naderi N,Khodagholi F,et al. L-type calcium channel blockade alleviates molecular and reversal spatial learning and memory alterations induced by entorhinal amyloid pathology in rats[J]. Behav Brain Res,2013,237:190-199.
[3]Hopp SC,Royer SE,D’Angelo HM,et al. Differential neuroprotective and anti-inflammatory effects of L-type voltage dependent calcium channel and ryanodine receptor antagonists in the substantia nigra and locus coeruleus[J]. J Neuroimmune Pharmacol,2015,10(1):35-44.
[4]Neves KR,Nobre HV Jr,Leal LK,et al. Pentoxifylline Neuroprotective Effects Are Possibly Related to Its Anti-Inflammatory and TNF-Alpha Inhibitory Properties,in the 6-OHDA Model of Parkinson’s Disease[J]. Parkinsons Dis,2015,2015(2):108179.
[5]Machado V,Haas SJ,von Bohlen Und Halbach O,et al. Growth/differentiation factor-15 deficiency compromises dopaminergic neuron survival and microglial response in the 6-hydroxydopamine mouse model of Parkinson’s disease[J]. Neurobiol Dis,2015,88:1-15.
[6]Ramalingam M,Kim SJ. The Neuroprotective Role of Insulin Against MPP+-Induced Parkinson’s Disease in Differentiated SH-SY5Y Cells[J]. J Cell Biochem,2016,117(4):917-926.
[7]Mounsey RB,Mustafa S,Robinson L,et al. Increasing levels of the endocannabinoid 2-AG is neuroprotective in the 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine mouse model of Parkinson’s disease[J]. Exp Neurol,2015,273:36-44.
[8]Li Y,Hu X,Liu Y,et al. Nimodipine protects dopaminergic neurons against inflammation-mediated degeneration through inhibition of microglial activation[J]. Neuropharmacology,2009,56(3):580-589.
[9]Daschil N,Humpel C. Nifedipine and nimodipine protect dopaminergic substantia nigra neurons against axotomy-induced cell death in rat vibrosections via modulating inflammatory responses[J]. Brain Res,2014,1581(1):1-11.
[10]Luo FC,Wang SD,Qi L,et al. Protective effect of panaxatriol saponins extracted from Panax notoginseng against MPTP-induced neurotoxicity in vivo[J]. J Ethnopharmacol,2011,133(2):448-453.
Inhibitory effects of nimodipine on expressions of iNOS and COX-2 in substantia nigra of mice with Parkinson’s disease
LIYaxin,XUFan,QINLijuan,etal.
(SchoolofBasicmedicalSciences,NorthChinaUniversityofScienceandTechnology,Tangshan063000,China)
ObjectiveTo investigate the protective effect of nimodipine on the dopaminergic neurons in the substantia nigra(SN)of MPTP-induced mouse model of Parkinson’s disease(PD). MethodsHealthy male C57BL/6N mice were randomly divided into three groups:control group which was treated with saline;model group which was injected with MPTP intraperitoneally;nimodipine group which was treated with nimodipine before injection of MPTP. The behavioral changes of different groups were observed,immunohistochemistry and Western blot methods were used to investigate the positive cell numbers and the protein expression of COX-2,iNOS and TH. ResultsCompared with control group,the MPTP model group showed PD-like symptoms with marked loss of Tyrosine hydroxylase(TH)-positive neurons,however,the expression level of COX-2 and iNOS increased significantly. After treating with nimodipine,the above changes were alleviated obviously. ConclusionIn the mouse model of Parkinson’s disease induced by MPTP,nimodipine may play a protective role on the dopaminergic neurons by inhibiting the expression of inflammatory mediators COX-2 and iNOS.
Parkinson’s disease;Tyrosine hydroxylase;Inducible nitric oxide synthase;Cyclooxygenase-2;Nimodipine;Mouse
1003-2754(2016)09-0799-03
2016-03-20;
2016-07-20
国家自然科学基金资助项目(No 81101912);华北理工大学大学生创新创业训练计划项目(No X2016243)
(1.华北理工大学基础医学院麻醉专业,河北 唐山 063000;2.华北理工大学基础医学院生理学系,河北 唐山 063000;3.华北理工大学基础医学院解剖学系,河北 唐山 063000)
张田,E-mail:zhangtian791229@126.com
R742.5
A
