超声检查与超声造影对肝脏占位性病变的诊断价值
2016-10-28何俊俊
何俊俊
(池州市第二人民医院,安徽 池州 247000)
超声检查与超声造影对肝脏占位性病变的诊断价值
何俊俊
(池州市第二人民医院,安徽 池州247000)
目的探讨常规超声(US)检查与超声造影(CEUS)检查在肝脏占位性病变临床诊断中的应用价值。方法2013年1月至2014年12月对78例经肝细胞穿刺活检或术后病理组织检查确诊为肝占位性病变患者分别行US检查及CEUS检查,分析两种诊断方法准确率、病灶大小数目及患者在US及CEUS中的影像学特征。结果US在诊断肝脏良性病变中的符合率与CEUS相当(P>0.05),而在恶性肿瘤诊断中CEUS组诊断准确率显著高于US组(P<0.05)。CEUS组在直径≤1 cm微小肿瘤诊断中的符合率大于US组(P<0.05)。与肝炎型假瘤、肝局灶性增生结节、肝血管瘤患者相比,原发性肝癌、转移性肝癌患者CEUS始消时间及持续时间更长(P<0.05)。结论与US相比,CEUS对肝占位性病变的诊断率更加准确,更尽早分辨出恶性病灶及微小病灶。且不同性质的肝占位性病变在CEUS中表现出不同的增强方式,能有效鉴别不同种类的肝脏占位性病变。
常规超声;超声造影;肝脏占位性病变;临床价值
肝脏占位性病变是消化内科常见的疾病,其病变种类较多,部分病变早期缺乏典型的影像学特征,因此不容易分辨及鉴定,容易导致误诊或漏诊[1]。超声是诊断肝脏占位性病变常用的检测方法,但其图像分辨率较低,敏感性及特异性容易受众多因素限制,从而影响患者诊断结果[2]。近年随着超声造影术在临床诊断中的应用,通过利用CEUS造影剂谐波信号可进行灰阶成像,从而有利于对病灶的早期诊断[3]。本研究将对肝占位性病变患者分别行US及CEUS检查,并对比分析两种检查方法在肝脏占位性病变中的诊断价值,旨在为肝脏占位性病变早期诊断及鉴别提供依据。
1 资料及方法
1.1临床资料2013年1月至2014年12月选取78例(共88个病灶)经增强CT或MRI和肝细胞穿刺活检确诊的肝占位性病患者为研究对象,所有患者均签署知情同意书,术前均愿意接受US及CEUS检查。其中男性 38例,女性40例,年龄26~78岁,平均年龄(62.2±5.8)岁。其中经病理学确诊为原发性肝癌 24例,转移性肝癌 20例,肝血管瘤 14例,肝炎型假瘤 12例,肝局灶性增生结节 8例。病灶大小:<1 cm 38个,1~3 cm 28个,3~5 cm 14个,>5 cm。
1.2方法
1.2.1仪器及试剂飞利浦HDⅡ,配备脉冲序列超声造影成像软件,频率为2.5~3.5 MHz,机械指数0.10~0.15,宽频凸形探头。造影剂采用博莱科有限公司提供的SonoVue。使用前注射生理盐水,同时配制六氟化硫微泡悬浮液,充分摇匀震荡,直至微气泡平均直径为2.5 μm。
1.2.2常规性超声检查采用常规性超声扫查肝脏,并记录肝脏病灶大小、位置、数目,同时采用彩色多普勒观察局部病灶血流频谱信号。对于多个病灶患者,可选择1~2个重点病灶进行超声造影扫描。
1.2.3超声造影患者取合并的体位,使得肝脏内病变处于最佳的现象位置后,采用专用成像技术模式,并根据患者胖瘦及病灶深浅调整超声探头输出频率及焦点位置,使得机械指数状态在0.07~0.11,此时几乎看不到肝脏灰阶图像,只能接收来自造影剂的谐波信号。采用20G套管穿刺针进行静脉穿刺,并注入2.4 ml造影剂剂,然后以5 ml生理盐水冲洗套管针。在推注造影剂同时按压超声内针并实时观察回声强度变化及造影过程,并收集造影图像。
1.2.4超声造影对肝脏占位性病变各时期的判断:超声造影可清晰观察到患者注射造影剂后门静脉、肝动脉及肝实质增强情况,其造影效果与增强螺旋CT相相同,能实时对肝脏肿瘤继续努力分析。本研究参照2005年全国超声造影学术会议中的标准,将造影剂注射后10~30 s定义为动脉期,将造影剂注射后31~120 s定义为门脉期;将造影剂注射后120 s定义为延迟期。

2 结 果
2.1US组与CEUS组在肝占位性病变良恶性肿瘤中的诊断对比经病理组织学确诊44例为恶性肿瘤,34例为良性肿瘤。US在诊断肝脏良性病变中的符合率与CEUS组相当(P>0.05),而在恶性肿瘤诊断中CEUS组诊断准确率显著高于US组(P<0.05),见表1。

表1 US组与与CEUS组在肝占位性病变良恶性肿瘤中的诊断对比
2.2CEUS组与US组在不同病灶诊断中的价值对比CEUS组在直径≤1 cm微小肿瘤诊断中的符合率大于US组,差异有统计学意义(P<0.05),见表2。

表2 CEUS组与US组在不同病灶诊断中的价值对比(个,%)
2.3不同肝脏肿瘤患者超声造影增强时间对比与肝炎型假瘤、肝局灶性增生结节、肝血管瘤患者相比,原发性肝癌、转移性肝癌患者CEUS始消时间及持续时间更长(P<0.05),见表3,图1,2。
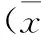
表3 不同肝脏肿瘤患者超声造影增强时间对比±s,s)
注:与原发性肝癌相比,aP<0.05;与转移性肝癌相比,bP<0.05;与肝炎型假瘤相比,cP<0.05;与肝局灶性增生结节相比,dP<0.05.

图1男,48岁,原发性肝癌,A:超声造影显示肿瘤周边实体部分为环形增强,中心液化区域未见增强;B:造影剂消退后中心液化区域坏死,并抽出黄色浑浊浓状液体。

图2男,58岁,A图:原发性肝癌,乙肝病史8年,超声下显示肝右前叶呈低回声病灶形态缺佳,为可疑恶性。B图:超声造影下可观察动脉期不均匀增强,内可见坏死病灶
3 讨 论
肝占位性病变是消化内科中常见的疾病,常规性超声可有效鉴别肝囊肿,在常规超声基础上结合彩色多普勒超声能有效显示组织内血流信号,但对于低速血流敏感性较差,容易误诊或漏诊[4]。超声造影剂由于含有微气泡,可增加血流信号强度,使得血流信息能清晰显示。SonoVue为新型造影剂,有助于分辨病灶与肝实质间的声学差异,并能有效了解肿瘤灌注时间及血管形态情况,从而有效判断肿瘤血管类型[5]。SonoVue造影剂外膜柔软,韧性适中,不容易破坏,因此在低机械指数灰质阶段成像状态下可获得二次谐波散射信号并能有效被接收,从而获得连续完整的回声变化信号[6]。由于不同肝占位性病变组织血供丰富程度、血供来源、分布方式、血流特征等在超声造影后呈现不同的增强方式,因此有助于鉴别不同肝占位性病变[7]。
本研究发现,CEUS在诊断恶性肿瘤及微小病灶中的准确率高于US诊断,这可能由于恶性肿瘤常表现为肿瘤内部液化、坏死,在超声诊断中常表现为无信号增强或回声,容易导致误诊[8]。微小病灶在常规超声下由于信号增强微弱,图像分辨率低,因此容易出现漏诊。超声造影可以实施跟踪微气泡,并在灌注过程对肿瘤灰质阶段实现实时动态观察,提高了对微小病灶及恶性肿瘤的诊断,因此使得肝占位性病变的诊断准确性得到较大的提高[9]。本研究对肝占位性病变患者行超声造影时发现,不同肝脏肿瘤病变患者超声造影增强时间存在差异,与其他类型肿瘤相比,原发性肝癌、转移性肝癌患者CEUS始消时间及持续时间更长。这可能由于原发性性肝癌患者血供丰富,主要由供血动脉扩张迂曲、肝动脉供血及肿瘤中心血管异常增生及动脉吻合有关,使得造影剂在肿瘤内循环时间缩短,使得肝实质主要由静脉供血,导致肝癌病灶与肝组织周围实质造影存在一定差异[10]。转移性肝癌由于原发病灶不同,因此患者血供及超声造影后病理基础也存在较大的差异。本研究中周边环状区可观察到造影剂在肿瘤内存在早于肝实质,所有延迟时间回声低于正常肝组织,因此通过观察延迟期来判断肿瘤是否发生恶性转移。肝血管瘤表现我疏松纤维弹性基质间隔,且这些血管表现为纤维机化或血栓,因此血流缓慢,在彩色多普勒超声下血流信号表现不显著。注射造影剂后血管周围环状增强并向心性填充,使得病变时间延长[11]。肝局灶性增生结节由于血管丰富,由于放射状分支供血,超声造影下动脉轮辐状增强,导致患者门静脉及延迟期回声延长。肝炎性假瘤动脉期增强不显著,且与肝实质同步增强,使得门静脉及延迟期回声消退,时间延长[12]。因此通过测定不同病灶不同事期增强时间将有助于鉴别不同类型的肝占位性病变。
综上所述,与US相比,CEUS对肝占位性病变的诊断率更加准确,更尽早分辨出恶性病灶及微小病灶。且不同性质的肝占位性病变在CEUS中表现出不同的增强方式,能有效鉴别不同种类的肝脏占位性病变。
[1]张立平,杨斌.实时超声造影在肝脏占位性病变鉴别诊断中的应用[J].安徽医学,2012,33(10):1353-1355.
[2]杨先.超声造影与增强CT对肝脏占位性病变的研究进展[J].实用肿瘤学杂志,2012,26(6):569-572.
[3]岳湘竹,李亚珂,王玲,等.超声造影对肝脏局灶性病灶的诊断价值[J].中华全科医学,2012,10(11):1781-1783.
[4]Wu W,Chen M,Yan K,et al.Evaluation of contrast-enhanced ultrasound for diagnosis of dysplastic nodules with a focus of hepatocellular carcinoma in liver cirrhosis patients[J].Chin J Cancer Res,2015,27(1):83-89.
[5]Echtenacher B, Wege AK, Schardt K,et al.High-Resolution Ultrasound Including Contrast-Enhanced Ultrasound (CEUS) for the Detection of Gas Formation during Aspergillus Fumigatus Infection in Mice[J].Ultraschall Med, 2015,9(4):78-79.
[6]Park HS, Kim YJ, Yu MH,et al.Real-time Contrast-Enhanced Sonographically Guided Biopsy or Radiofrequency Ablation of Focal Liver Lesions Using Perflurobutane Microbubbles (Sonazoid): Value of Kupffer-Phase Imaging[J].J Ultrasound Med,2015,34(3):411-421.
[7]王晓东,梁群兴,赵萍,等.超声造影和彩色多普勒超声在原发性肝细胞肝癌诊断中的应用[J].广东医学,2013,34(12):1869-1871.
[8]Kong WT, Wang WP, Huang BJ,et al.Contrast-Enhanced Ultrasound in Combination with Color Doppler Ultrasound Can Improve the Diagnostic Performance of Focal Nodular Hyperplasia and Hepatocellular Adenoma[J].Ultrasound Med Biol,2015,41(4):944-951.
[9]Corvino A, Catalano O, Setola SV,et al.Contrast-Enhanced Ultrasound in the Characterization of Complex Cystic Focal Liver Lesions[J].Ultrasound Med Biol,2015,9(4):42-46.
[10]柯振华,郑玉美,杨培俊,等.彩色多普勒超声在肝脏占位性病变中的诊断价值[J].实用临床医学,2012,13(11):92-93.
[11]马继斌,明丽,徐细明,等.声触诊组织量化技术对肝脏占位性病变的鉴别诊断价值[J].中国医师杂志,2013,15(3):352-353.
[12]钱建民,乔英立.肝脏良性占位性病变的诊断与治疗[J].中华肝脏外科手术学电子杂志,2014,(2):127-130.
何俊俊(1985—),女,安徽池州人,医师,主要从事超声诊断工作。
R445.1
B
1004-7115(2016)09-1038-03
10.3969/j.issn.1004-7115.2016.09.026
2016-05-06)
