4-氧代-3(4H)-喹唑啉-5-羧酸的合成
2016-10-25郑培根刘益州杜培娟康从民
郑培根, 刘益州, 杜培娟, 康从民
(青岛科技大学 化工学院, 山东 青岛 266042)
4-氧代-3(4H)-喹唑啉-5-羧酸的合成
郑培根, 刘益州, 杜培娟, 康从民*
(青岛科技大学 化工学院, 山东 青岛266042)
以2-氨基-6-甲基苯甲酸为起始原料,通过合环反应生成两种4-氧代-3(4H)-喹唑啉-5-羧酸衍生物(1a, 1b), 1a, 1b分别经高锰酸钾氧化合成了4-氧代-3(4H)-喹唑啉-5-羧酸(2a, 2b),其结构经1H NMR,13C NMR和MS表征。研究了投料比{r[n(高锰酸钾) ∶n(5-甲基-3(4H)-喹唑啉-4-酮)]}和反应温度等对收率的影响。结果表明:在最佳反应条件(r=7 ∶1,中性高锰酸钾氧化,于90 ℃反应)下合成2,总收率可达66%。
2-氨基-6-甲基苯甲酸; 合成; 高锰酸钾氧化; 4-氧代-3(4H)-喹唑啉-5-羧酸
喹唑啉-5-羧酸及其衍生物是重要的精细化工原料和化工产品[1-2],在工业、农业及医药等领域中有着十分广泛的用途,如抗癌、杀菌、杀虫及抗病毒等[3-5]。2-取代-4-氧代-3(4H)-喹唑啉-5-羧酸也是一种重要的有机中间体,可以被广泛地应用于医药和农药的合成[6-8],近年来,深受广大科研人员的青睐。
本文以2-氨基-6-甲基苯甲酸分别与甲酰胺和硫代乙酰胺经闭环反应生成5-甲基-3(4H)-喹唑啉-4-酮(1a)和2,5-二甲基-3(4H)-喹唑啉-4-酮(1b);用中性高锰酸钾将1a和1b氧化分别得到4-氧代-3(4H)-喹唑啉-5-羧酸(2a)和2-甲基-4-氧代-3(4H)-喹唑啉-5-羧酸(2b)(Scheme 1),其结构经1H NMR,13C NMR和MS表征。并研究了投料比{r[n(高锰酸钾) ∶n(5-甲基-3(4H)-喹唑啉-4-酮)]}、反应温度等对收率的影响。
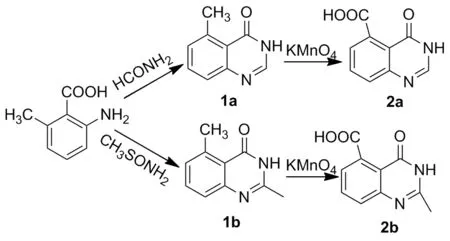
Scheme 1
1 实验部分
1.1仪器与试剂
XT-4型显微熔点仪(温度未校正);Brucker 500 MHz型核磁共振仪(DMSO-d6为溶剂,TMS为内标);XEVO G2-XS型质谱仪。
2-氨基-6-甲基苯甲酸,上海市彤源化工有限责任公司;其余所用试剂均为分析纯。
1.2合成
(1) 1a的合成
在三口瓶中加入2-氨基-6-甲基苯甲酸1.00 g(6.62 mmol)和甲酰胺10 mL,搅拌下于140 ℃反应至终点(TLC监测)。加冰10 g,抽滤,滤饼用水洗涤,干燥得暗红色固体1a 0.95 g,收率89.2%, m.p.214~215 ℃(215~216 ℃[9]);1H NMR(CDCl3)δ: 2.92(s, 3H, CH3), 7.08(s, 1H, CH), 7.28(d,J=9.5 Hz, 1H, ArH), 7.63(m, 2H, ArH), 10.82(s, 1H, NH);13C NMR (125 MHz)δ: 19.1, 118.9, 124.7, 130.1, 134.5, 140.7, 145.6, 146.8, 159.1; MSm/z: 161.1 {[M+H]+}。
(2) 1b的合成
在三口瓶中加入2-氨基-6-甲基苯甲酸1.00 g(6.62 mmol)和硫代乙酰胺1.00 g(13.3 mmol),缓慢升温至125 ℃,搅拌使其完全熔化后保温反应30 min(生成固体)。冷却至室温,加入1% NaHCO3溶液7 mL,于室温反应30 min,抽滤,滤饼依次用水洗涤,乙醇重结晶得白色针状晶体1b 1.03 g,收率89.4%, m.p.251~253 ℃(248~251℃[10]);1H NMR(CDCl3)δ: 2.54(s, 3H, CH3), 2.90(s, 3H, CH3), 7.23(d,J=7.0 Hz, 1H, ArH), 7.53(d,J=8.5 Hz, 1H, ArH), 7.60(t,J=7.5 Hz, 1H, ArH), 11.22(s, 1H, NH);13C NMRδ: 19.1, 21.4, 120.9, 126.8, 132.0, 139.6, 140.9, 144.3, 150.7, 161.5; MSm/z: 175.1 {[M+H]+}。
(3) 2a的合成
在三口瓶中加入1a 0.40 g(2.5 mmol)和水15 mL,搅拌下于80 ℃保温反应10~15 min(原料完全溶解),将中性高锰酸钾溶液(2.50 g高锰酸钾加入20 mL水中,加热溶解,冷却至室温)缓慢滴入反应液中,滴毕,于90 ℃反应至终点(TLC检测)。趁热抽滤,冷却,滤液用浓盐酸调至pH 4~5,抽滤,滤饼用水洗涤,干燥得淡黄色固体2a 0.35 g。
用类似方法合成2b。
2a: 淡黄色固体,收率73.8%, m.p.280~281 ℃;1H NMRδ: 7.43(d,J=7.25 Hz, 1H, ArH), 7.71(d,J=8.1 Hz, 1H, ArH), 7.82(m, 1H, ArH), 12.41(s, 1H, NH), 13.00(s, 1H, COOH);13C NMRδ: 126.3, 130.1, 131.2, 132.6, 134.7, 145.8, 155.3, 162.7, 170.1; MSm/z: 191.0 {[M+H]+}。
2b: 黄色固体,收率67.8%,m.p.>300 ℃;1H NMRδ: 2.35(s, 3H, CH3), 7.34(d,J=7.2 Hz, 1H, ArH), 7.59(d,J=8.2 Hz, 1H, ArH), 7.76(m, 1H, ArH), 12.32(s, 1H, COOH);13C NMRδ: 23.5, 128.3, 131.6, 135.3, 137.6, 143.7, 150.8, 161.4, 167.7, 174.1; MSm/z: 205.1 {[M+H]+}。
2 结果与讨论
2.11a的合成条件优化
为进一步优化1a的合成条件,分别研究了反应时间和反应温度对1a收率的影响。
(1) 反应温度(T)和反应时间(t)
2-氨基-6-甲基苯甲酸6.62 mmol, 其余反应条件同1.2(1),考察T和t对1a收率的影响,结果见表1。由表1可知,温度越高,反应速率越快。超过140 ℃时收率趋于稳定。且在此温度下,延长反应时间至8 h,收率未发生变化,因此最佳反应温度为140 ℃。
2.22a的合成条件优化
进一步优化2a的合成方法,分别研究了pH,反应时间,投料比{r[n(高锰酸钾) ∶n(5-甲基-3(4H)-喹唑啉-4-酮)]}和反应温度对2a收率的影响。

表1 反应温度和时间对1a收率的影响*
*2-氨基-6-甲基苯甲酸6.62 mmol, 其余反应条件同1.2(1)。
(1) 高锰酸钾和反应时间(t)
探究了高锰酸钾和反应时间对收率的影响,结果见表2。由表2可见,酸性高锰酸钾氧化能力较强,故用时较少,但由于氧化能力较强的原因,可能会将反应物中的双键氧化断开,以至于收率降低。综合反应时间和收率,本文采用中性高锰酸钾法合成2a。
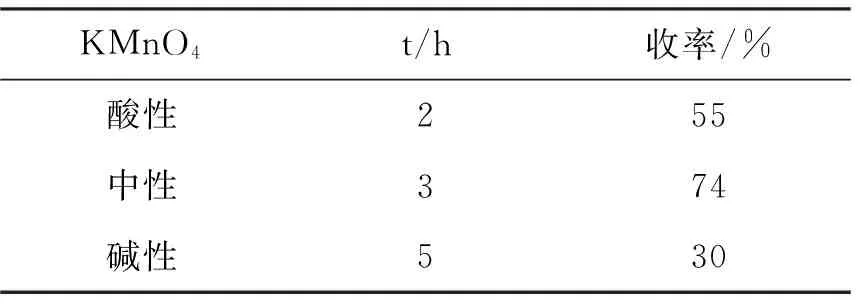
表2 高锰酸钾和反应时间对2a收率的影响*
*1a 2.5mmol, 其余条件同1.2(3)。
(2)r
考察了r对2a收率的影响,结果见表3。结果表明,随着高锰酸钾用量的增加,起初收率增加很多,当r=7 ∶1时收率趋近于稳定,增加幅度减小。为了获得较高的收率和节省原料,最佳投料比r应控制为7 ∶1。

表3 r对2a收率的影响*
*1a 2.5mmol, 中性高锰酸钾方法氧化,其余反应条件同1.2(3)。
(3) 反应温度(T)
考察了反应温度对2a收率的影响,结果见表4。结果表明:反应温度的高低对产物的收率以及产品的质量都有很大的影响,随着反应温度的升高,产物收率提高,但是当温度超过90 ℃时,收率开始下降,说明90 ℃是最佳反应温度,温度越高,可能会有少量的高锰酸钾受热分解导致收率降低。所以,为了保证产品收率,应该控制反应温度在90 ℃左右。
*1a 2.5 mmol, 中性高锰酸钾法氧化,r=7 ∶1, 其余条件同1.2(3)。
以2-氨基-6-甲基苯甲酸为原料,通过合环和氧化两步反应合成4-氧代-3(4H)-喹唑啉-5-羧酸(2a)和2-甲基-4-氧代-3(4H)-喹唑啉-5-羧酸(2b)。在三种氧化方法中,中性高锰酸钾氧化法优于酸性和碱性方法。以合成2a为例,分别从投料比、反应温度方面进行了探究,结果表明:反应物投料比r[n(高锰酸钾) ∶n(5-甲基-3(4H)-喹唑啉-4-酮)]=7 ∶1,反应温度为90 ℃时,2a收率最高(66%)。
[1]高元磊,林选福,韩菲菲,等.N-[3-(4-喹唑啉基) 氨基-1H-吡唑-4-甲酰基]醛腙类衍生物的合成及抗菌活性研究[J].有机化学,2011,31(10):1648-1652.
[2]Yadav M R, Shirude S T, Parmar A,etal. Synthesis and anti-inflammatory activity of 2,3-diaryl-4(3H)-quinazolinones[J].Chemistry of Heterocyclic compounds,2006,42(8):1038-1045.
[3]马耀,刘芳,严凯,等. 6-溴-4-烃硫基喹唑啉类化合物的合成及抑菌活性研究[J].有机化学,2008,28(7):1268-1272.
[4]王敏,宋志国,张婷婷. 氯化锌催化合成3-取代-4(3H)-喹唑啉酮衍生物[J].化学通报,2010,(4):381-384.
[5]陈舒忆,吕同杰,严和平,等. 喹唑啉类衍生物的合成及其抗肿瘤活性[J].合成化学,2013,21(1):92-95.
[6]Lu T, Mao Y, Yao K. Metal free:A novel and efficient aerobic oxidation of toluene derivatives catalyzed byN′,N″,N,-trihydroxyisocyanuric acid and dimethylglyoxime in PEG-1000-based dicationic acidic ionic liquid[J].Catalyst Communication,2012,27:124-128.
[7]Sugai T, Itoh A. Aerobic oxidation under visible light irradiation of a fluorescent lamp with a combination of carbon tetrabromide and triphenyl phosphine[J].Tetrahedron Letters,2007,48(52):9096-9099.
[8]Chen L, Tang R, Li Z,etal. An efficient and mild oxidation ofα-Isophorone to ketoisophorone catalyzed byN-Hydroxyphthalimide and copper chloride[J].Bulletin Korean Chemical Society,2012,33(2):459-463.
[9]Nepomuceno G M, Chan K M, Huynh V,etal. Synthesis and evaluation of quinazolines as inhibitors of the bacterial cell division protein ftsZ[J].ACS Medical Chemistry Letters,2015,6(3):308-312.
[10]Kulkarni S S. Synthesis and SAR optimization of quinazolin-4(3H)-ones as poly(ADP-ribose)polymer-ase-1 inhibitors[J].Euroupen Journal of Medical Chemistry,2012,50(6):264-273.
Syntheses of 4-Oxo-3(4H)-Quinazolin-5-Carboxylic Acid
ZHENG Pei-gen,LIU Yi-zhou,DU Pei-juan,KANG Cong-min*
(College of Chemical Engineering, Qingdao University of Science and Technology, Qingdao 266042, China)
Two different 4-oxo-3(4H)-quinazolin-5-carboxylic acid derivatives(1a, 1b) were synthesized by ring-closing reaction of 2-amino-6-methyl-benzoic acid. 4-Oxo-3(4H)-5-carboxylic acid(2a, 2b) were synthesized by the oxidation of 1a and 1b with potassium permanganate, respectively. The structures were characterizd by1H NMR,13C NMR and MS. Effects of the molar ratio {r[n(potassium permanganate) ∶n(5-methyl-3(4H)-4- methyl ketone)]} and reaction temperature on yield of 2 were investigated. The results indicated that the yield of 2 was 66% under the optimum condition(r=7 ∶1, neutral potassium permanganate oxidation, reacted at 90 ℃) .
2-amino-6-methyl-benzoic acid; synthesis; potassium permanganate oxidation; 4-oxo-3(4H)-quinazolin-5-carboxylic acid
2015-12-04;
2016-06-22
国家自然科学基金资助项目(2107211)
郑培根(1989-),男,汉族,山东临沂人,硕士,主要从事药物合成研究。E-mail: 847831443@qq.com
康从民,教授, Tel. 0532-84023290, E-mail: lvyingtao@qust.edu.cn
O626.4; O625.6
ADOI: 10.15952/j.cnki.cjsc.1005-1511.2016.09.15378
